陈皮精准煮散饮片与市售饮片的质量
2017-12-20莫结丽丘小惠肖水明李西文黄志海
莫结丽 张 靖 宫 璐 丘小惠 肖水明 李西文 徐 江 黄志海
(1 广州中医药大学第二附属医院,广东省中医药科学院中国中医科学院广东分院,广州,510006; 2 广东省药检所,广州,510120; 3 中国中医科学院中药研究所,北京,100700)
陈皮精准煮散饮片与市售饮片的质量
莫结丽2张 靖1宫 璐1丘小惠1肖水明3李西文3徐 江3黄志海1
(1 广州中医药大学第二附属医院,广东省中医药科学院中国中医科学院广东分院,广州,510006; 2 广东省药检所,广州,510120; 3 中国中医科学院中药研究所,北京,100700)
目的:临床疗效与中药饮片规格及质量是否均一密切相关,本文采用化学指纹图谱法结合DNA分子鉴定技术,考察陈皮精准煮散饮片与市售原饮片质量差异。方法:比较原饮片及精准煮散饮片的干膏收率;采用HPLC-DAD法进行3批次饮片混合粉碎前后质量均一性、指纹图谱与相似度评价。应用ITS2序列作为DNA条形码对陈皮饮片进行鉴定;比较市售原饮片及精准煮散饮片的干膏收率;采用HPLC-DAD法进行3批次饮片混合粉碎前后质量均一性、指纹图谱与相似度评价。结果:陈皮煮散饮片出膏率略高于市售饮片出膏率;精准煮散饮片提取液中橙皮苷溶出较原饮片高,市售原饮片批间溶出量有明显的差异性RSD为18.93%,混合制成煮散饮片后差异较小RSD为6.28%。指纹图谱相似度评价结果显示,混合粉碎后指纹图谱相似度提高,标定共有峰16个,峰面积均有提高。结论:陈皮精准煮散饮片与市售饮片基本属性相一致,并提高中药的浸出率、成分溶出率及质量均一性,表明煮散饮片有较好的临床应用优势。
陈皮;精准煮散饮片;DNA条形码;指纹图谱
陈皮为芸香科植物橘CitrusreticulataBlanco及其栽培变种的干燥成熟果皮,在现行版《中华人民共和国药典》中分为“广陈皮”和“陈皮”[1],两者在外观形状上差异有统计学意义。其中广陈皮主产于广东,其他陈皮产于福建、浙江、四川、江西等地。陈皮作为我国的一种传统中药,有着悠久的历史,《本草纲目》记载:“今天下多以广中者来胜。”广东是陈皮主产区,来源主要有茶枝柑、行柑、甜柑、蕉柑、八月橘等,产量大,销全国并供出口,其中广陈皮(茶枝柑)是陈皮道地药材,质量最优[2]。现代医学研究表明,陈皮具有抗炎、抗氧化、抗病原微生物、抗肿瘤、改善心脑血管疾病等药理作用[3-5]。陈皮中含有多种化学成分,主要含有黄酮类和挥发油两大类活性成分,一般以橙皮苷的含量来评价陈皮的质量[6-7]。
由于橘的栽培变种品种繁多,造成陈皮商品来源复杂混乱,特别是切制成丝状饮片后大多有混杂,人为添加多种不能入药品种的柑皮。长期以来,产地与生长的差异化、货源的不确定性、不稳定性、中药饮片的外观形态差异大等因素,导致陈皮饮片批间、批内质量不均一,直接影响临床用药疗效的稳定。此外,饮片的商业等级盲目追求大规格为优,人为增加饮片加工和调剂的难度,也制约了中药饮片工业化生产和应用的自动化进程。因此,迫切需要一种易于鉴定和检测,可经标准化工艺制备、规模化生产、质量均一、可实现自动化分装,以提高临床用药精准性的新型饮片。
实际上,传统中药药用形式并非一成不变。唐宋时期盛行“药力尽出”的中药煮散,将中药粉碎成一定粒度与水共煎,在粉碎加工过程中破坏了药材原有形态,丧失了品质鉴别的性状特征,导致“辨药之难”,后逐步被中药饮片所取代[8-9]。中药DNA条形码鉴定体系的应用与发展[10-12],提供准确的中药识别与溯源,可有效解决传统煮散的“辨药之难”问题,并与现有中药饮片质量评价标准、中药指纹图谱技术构成质量控制体系,实现煮散的精准化鉴定和检测。基于传统中药煮散,本课题组提出“精准煮散饮片”的概念与思路方法,将中药饮片的形状规格微小化、均匀化处理,使饮片批量规模稳定化,批内质量均一化,实现准确、高效的自动化分装、调剂、煎煮流程,提高临床汤剂用药的精准性。现以陈皮为例,以饮片规格、含量均匀度、指纹图谱与相似度评价、DNA序列比对为考查重点,对陈皮精准煮散饮片的质量开展系统评价,以期揭示精准煮散饮片应用的优势,为中药饮片的质量均一化处理,使之实现生产和配给的标准化、自动化,从而提高中医临床疗效的稳定性和临床评价的可靠性提供参考实例。
1 仪器与试药
1.1 仪器 美国Agilent 1260型高效液相色谱仪(配备四元泵,柱温箱、自动进样器及DAD检测器),BT 125 D十万分之一分析天平(赛多利斯,德国)、BS 224 S万分之一分析天平(赛多利斯,德国)、HTP-312电子天平、DK-S26电热水浴锅、Centrifuge 5430R高速台式冷冻离心机,台湾荣聪铁工厂粉碎机。
1.2 试剂 乙腈、甲酸均为色谱纯,购自Fisher公司;液相用水为Millipore制备纯水。
1.3 分析样品 橙皮苷(含量≥98%,批号B20182),购于上海源叶生物科技有限公司。陈皮购自康美药业有限公司,均产至广东(批号为160303611、160903391、160809231),经本实验室黄志海中药师鉴定均为现行版《中华人民共和国药典》(一部)收载品种。
2 方法与结果
2.1 色谱条件 含量测定采用高效液相方法测定,色谱柱为Kinetex C18柱(2.6 μm,100 mm×4.6 mm)。检测方法按照中华人民共和国药典2015年版一部陈皮项下含量测定方法测定市售饮片及煮散饮片提取液中橙皮苷的含量。
指纹图谱色谱条件为:色谱柱同上;流动相为乙腈(B)—水(A),梯度洗脱(5%→75%);流速:1 mL/min,检测波长:283 nm;柱温:25 ℃;洗脱时间:30 min;进样体积:5 μL。
2.2 对照品溶液的制备 精密称取橙皮苷对照品适量,加甲醇配制成含橙皮苷0.50 mg/mL的对照品溶液,至于冰箱中4 ℃保存,备用。
2.3 供试品溶液的制备
2.3.1 不同规格陈皮煮散饮片制备 取陈皮市售原饮片(批号:160303611)用粉碎机粉碎均匀,过筛,分别得5~10目(2~4 mm)、10~24目(0.8~2 mm)、24~65目(0.25~0.8 mm)等不同规格的煮散饮片。分别称取原饮片及不同规格煮散饮片100 g,分别加8倍水,先浸泡30 min,煮沸30 min,过滤分离出煎煮液,再加6倍水煎煮30 min。合并煎煮液,浓缩成100 mL溶液,即浓缩为1 g/mL的原药材溶液。

图1 陈皮原饮片及煮散饮片形态
2.3.2 质量均一性实验陈皮煮散饮片制备 分别取3个批次市售饮片各200 g(S1:160303611,S2:160903391,S3:160809231),充分混合后,用粉碎机粉碎均匀,过筛取10~65目粒径范围的煮散饮片。传统饮片及煮散饮片形态见图1。不同批次原饮片各取20 g;混合后10~65目陈皮煮散饮片取300 g,均匀摊平,画格分为9份,随机选取3份(S4~S6),从每份中分别称取20 g。上述6份样品按上述方法煎煮。合并煎煮液,浓缩成100 mL溶液,即浓缩为0.2 g/mL的原药材溶液。
取上述制备的0.2 g/mL的原药材溶液,为供试品溶液,进样前用0.22 μm滤膜过滤。
2.4 DNA条形码检测 选取各批次及混合后煮散饮片样本各约40 mg,用组织研磨仪磨碎,采用植物DNA提取试剂盒(Tiangen Biotech Co.,中国)提取基因组总DNA。ITS2序列扩增采用正向引物ITS2F:5′-ATGCGATACTTGGTGTGAAT-3′,反向引物:ITS3R:5′-GACGCTTCTCCAGACTACAAT-3′,进行扩增。PCR反应体系为25 μL,包括2×Taq PCR Mix酶(北京艾德莱生物科技有限公司)12.5 μL,正向、反向引物各1 μL(2.5 μmol/L),模板DNA 2.0 μL(30~100 ng),加ddH2O补足至25 μL。扩增程序:94 ℃变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s(40个循环);72 ℃延伸10 min。PCR扩增产物采用1.2%琼脂糖凝胶电泳进行检测,将电泳条带清晰、明亮、单一的PCR产物送测序公司进行双向测序。所得序列采用CodonCode Alinger 6.02软件进行校对拼接,去除低质量区并采用基于隐马尔可夫模型的HMMer注释方法去除两端5.8S和28S区段,获得完整的ITS2序列。利用软件MEGA 6.06分析比对,分析ITS2序列特点[13]。
2.5 样品测定结果
2.5.1 出膏率考察 分别精密量取25 mL原饮片及不同规格煮散饮片1 g/mL的原药材溶液于蒸发皿中,60 ℃真空干燥至恒重,称量重量,根据出膏率公式[14]计算出膏率。与原饮片比较,粉碎后不同粒径煮散饮片的出膏率略有增加;不同粒径的出膏率有差异,其中5~10目出膏率较高。见表1。
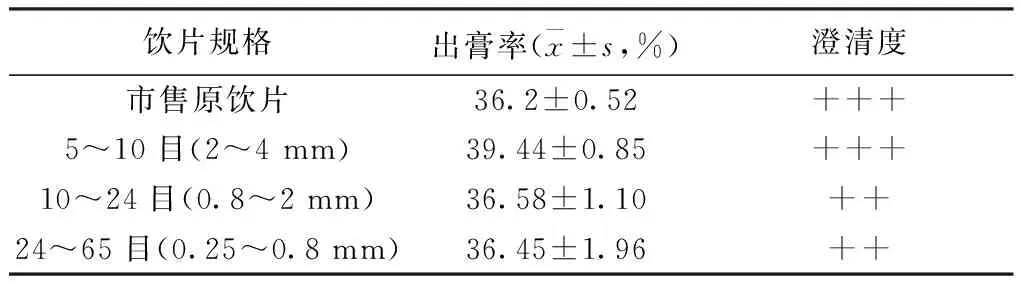
表1 陈皮市售原饮片与精准煮散饮片出膏率(n=3)
2.5.2 饮片提取液中橙皮苷含量 采用高效液相方法测定,按照中华人民共和国药典2015年版一部陈皮项下含量测定方法测定市售饮片及煮散饮片提取液中橙皮苷的含量。对照品及样品溶液HPLC-DAD色谱图分别见图2、图3。结果显示,对照品及样品中橙皮苷的色谱峰分离效果佳,杂峰较少,峰形良好,适合陈皮饮片中橙皮苷含量测定分析。

图2 对照品HPLC-DAD色谱图(1:橙皮苷)
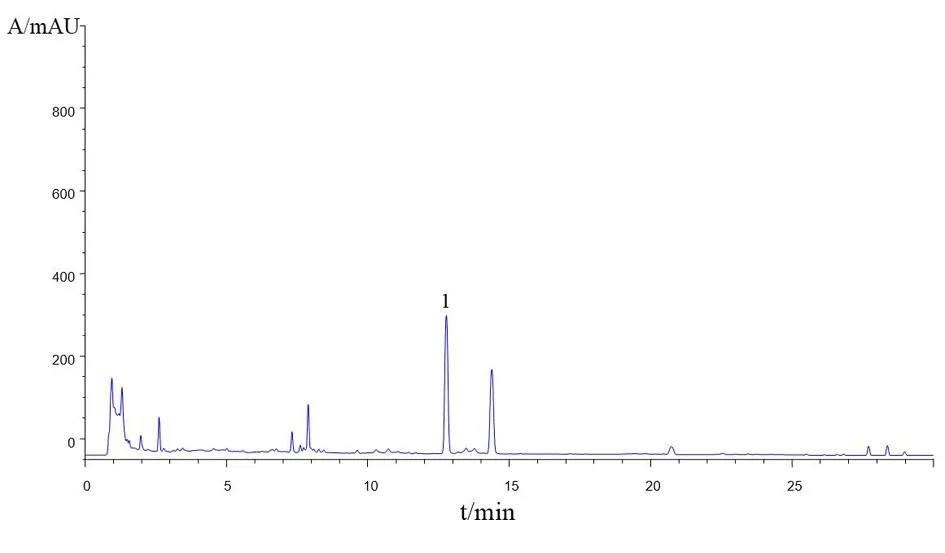
图3 陈皮饮片HPLC-DAD色谱图(1:橙皮苷)
混合煮散前,各批次陈皮饮片药材中橙皮苷成分的溶出差异较大,波动范围在2.51~3.54 mg/g,RSD18.93%。混合并制成煮散饮片后,其橙皮苷溶出量略有增加,且RSD值显著下降。见表2。
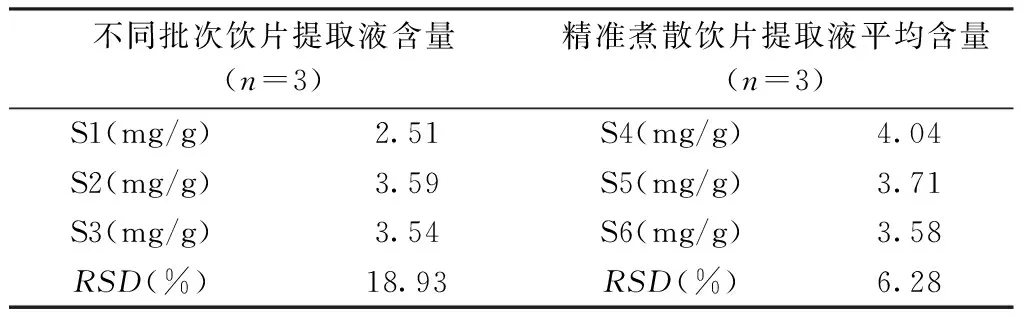
表2 陈皮原饮片与精准煮散饮片提取液中橙皮苷含量
2.5.3 饮片指纹图谱比较 取上述药材,按指纹图谱检测方法检测,检测波长为283 nm的陈皮饮片提取液主要色谱峰指纹图谱如图4所示。采用国家药典委员会2014年版指纹图谱相似度评价软件,比较市售原饮片与煮散饮片指纹图谱相似度。见表3。结果显示,精准煮散饮片与市售饮片的指纹图谱相似度基本一致,在成分的种类上未有明显改变,不同批次样品经粉碎、混合后的指纹图谱相似度更好,相似度可达0.997以上,采用指纹图谱相识度分析方法可以用于陈皮煮散饮片的真伪鉴别及质量优劣的判定。以原饮片中橙皮苷的平均峰面积为基准,计算制得精准煮散饮片前后各共有峰的相对峰面积见表4。不同批次药材经混合制成精准煮散饮片后,部分共有峰溶出率有不同程度的升高。其中峰11为橙皮苷。
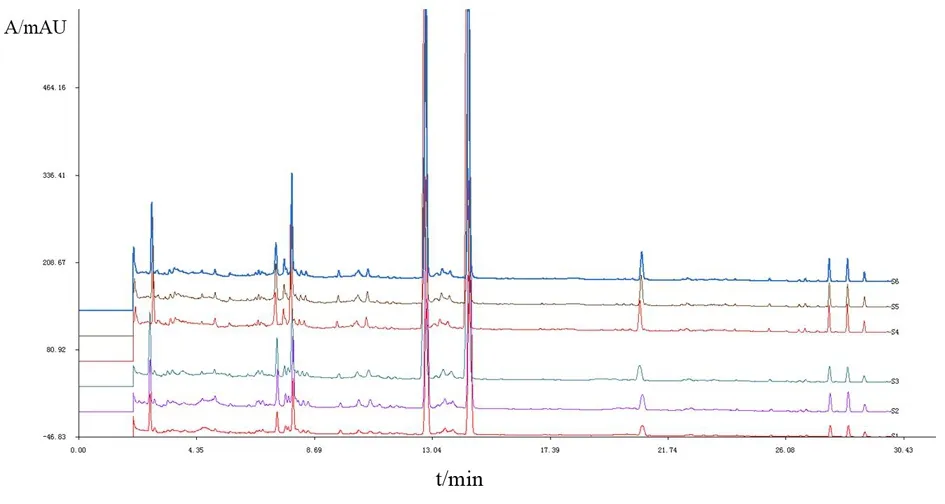
图4 市售原饮片及混合后精准煮散饮片HPLC指纹图谱

样品S1S2S3S4S5S6对照指纹图谱S11.0000.9950.9760.9730.9710.9710.985S20.9951.0000.9850.9790.9790.9770.990S30.9760.9851.0000.9900.9890.9880.994S40.9730.9790.9901.0000.9990.9990.998S50.9710.9790.9890.9991.0001.0000.997S60.9710.9770.9880.9991.0001.0000.997对照指纹图谱0.9850.9900.9940.9980.9970.9971.000
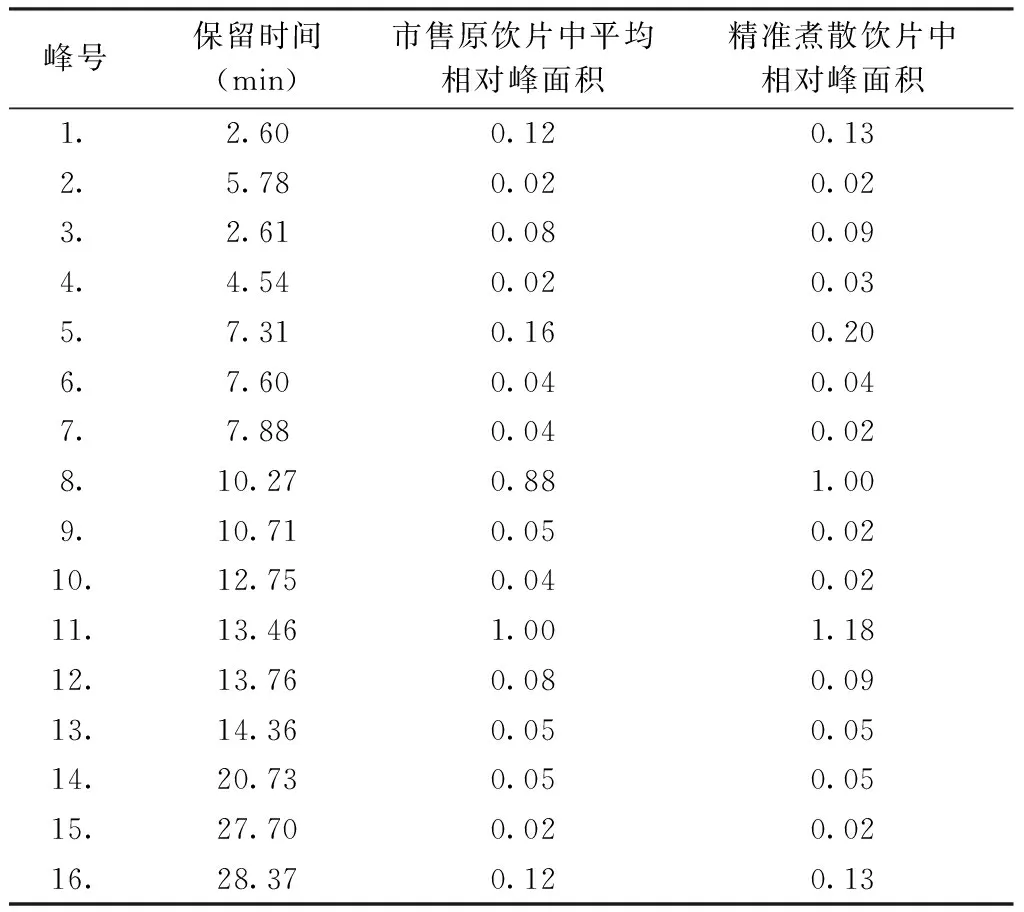
表4 共有峰相对峰面积比较(n=3)
3.5.4 DNA条形码检测结果 应用MEGA6.06分析陈皮3条ITS2序列特征,发现种内无变异位点,3条陈皮序列长度均为232 bp,A、C、G、T的碱基含量分别为14.66%、38.36%、33.19%、13.79%,GC含量达71.55%。3条psbA-trnH序列比对后长度为413 bp,无变异位点。2种序列BLAST搜索结果均显示相似性最高的为橘Citrus reticulata,相似度为100%。主导单倍型序列特征见图5,6。
3 讨论
橙皮苷是《中华人民共和国药典》规定的陈皮饮片测量指标成分,含橙皮苷不得少于2.5%,且能够被水提取出来,因而我们以橙皮苷作为测定饮片溶出的指标成分,其余成分以橙皮苷的平均峰面积为基准,比较煮散饮片制备前后共有峰的相对峰面积。我们收集了3批次陈皮市售饮片,饮片均匀混合粉碎后制成煮散饮片,采用HPLC-DAD法进行饮片混合粉碎前后橙皮苷成分的浸出率质量均一性,指纹图谱分析,以及DNA序列比对研究。比较陈皮煮散饮片与市售饮片指纹图谱,其成分的种类上未有明显改变,但各共有峰的溶出有不同程度的升高,混合粉碎后的精准煮散饮片指纹图谱相似度更好。
陈皮的ITS2和psbA-trnH条形码在NCBI数据库和中药材DNA条形码鉴定系统中进行BLAST搜索时,尚能比对到除橘及其变种外的同属物种,包括甜橙Citrussinensis、酸橙Citrusaurantium等。由于该属植物自身特点,如易发生芽变、种属间易杂交、体细胞突变率高、人工栽培品种繁多,以及研究者采用的分类标准的不同等,导致该属在种的划分上一直存在较大分歧[15]。罗焜等[16]对包括橘属7个品种在内的芸香科72属300个样本进行DNA条形码筛选比较研究时发现,ITS2和psbA-trnH序列在属水平上的鉴定成功率为100%,但目前暂未发现可用于柑橘属种间鉴定的DNA条形码序列[17-19]。因此,对于陈皮的物种鉴定,在DNA条形码鉴定到属的基础上,应辅以其他手段如指纹图谱技术进一步明确种属。

图5 陈皮ITS2序列

图6 陈皮psbA-trnH序列
精准煮散饮片基于传统中药煮散用药方式,仅是改变了中药饮片的形状规格,使其微小化、均匀化,可实现饮片质量均一化,饮片分装、调剂、煎煮自动化,使中药剂量和汤剂质量更加精准。发展精准煮散饮片不仅能提高中医临床用药质量的稳定性,也能提高中药资源的合理利用,在药量更少的情况下煮散仍可达到常规饮片同样的临床治疗效果。此外,它采用中药DNA条形码鉴定体系,与现有中药饮片质量评价标准、中药指纹图谱技术结合,解决了中药饮片因切制及粉碎处理导致某些性状特征丧失产生的“辨药之难”问题,实现了煮散饮片的精准化鉴定和检测。基于多种现代技术体系为支撑的现代新型饮片,精准煮散饮片体系将成为现阶段常规饮片向“精准化”转型升级的适宜模式。
[1]国家药典委员会.中华人民共和国药典一部[M].北京:中国医药科技出版社,2015:191-192.
[2]刘文集,王玫馨,黄爱东,等.广陈皮挥发油成分[J].中山医科大学学报,1991,12(2):136-138.
[3]Tao N,Jia L,Zhou H.Anti-fungal activity of Citrus reticulata Blanco essential oil against Penicillium italicum and Penicillium digitatum[J].Food Chem,2014,153:265-271.
[4]俞静静,苏洁,吕圭源.陈皮抗心脑血管疾病相关药理研究进展[J].中草药,2016,47(17):3127-3132.
[5]张海丽.陈皮提取物的抗氧化活性研究[J].黑龙江医药,2014,24(2):306-309.
[6]Aasim KM,Ali M,Alam P.Phytochemical investigation of the fruit peels of Citrus reticulata Blanco[J].Nat Prod Res,2010,24(7):610-620.
[7]吴愫青,叶莹,张俊.HPLC测定不同产地陈皮橙皮苷的含量[J].中国现代中药,2008,10(8):20-22.
[8]徐海波.中药煮散源流考[J].河北中医药学报,1999,41(4):11-13.
[9]刘起华,文谨,章军,等.根及根茎类中药煮散与传统饮片有效成分煎出量对比研究[J].中国新药杂志,2014,23(5):591-595,605.
[10]Wang M,Zhao HX,Wang L,et al.Potential use of DNA barcoding for the identification of Salvia,based on cpDNA and nrDNA sequences[J].Gene,2013,528(2):206-215.
[11]Chen S,Pang X,Song J,et al.A renaissance in herbal medicine identification:from morphology to DNA[J].Biotechnol Adv,2014,32(7),1237-1244.
[12]陈士林.中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015:5-7.
[13]陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志,2013,38(2):54-61.
[14]陈士林,刘安,李琦,等.中药饮片标准汤剂研究策略[J].中国中药杂志,2016,41(8):1367-1375.
[15]于杰.柑橘及其近缘属植物DNA条形码研制及其物种的鉴定研究[D].重庆:西南大学,2011.
[16]罗焜,陈士林,陈科力,等.基于芸香科的植物通用DNA条形码研究[J].中国科学:生命科学,2010,40(4):342-358.
[17]于杰,闫化学,鲁振华,等.基于柑橘及其近缘属植物DNA条形码的叶绿体编码序列筛选[J].中国农业科学,2011,44(2):341-348.
[18]于杰,闫化学,鲁振华,等.基于matK和rbcLDNA序列条形码鉴定柑橘及其近缘属植物[J].园艺学报,2011,38(9):1733-1740.
[19]闫化学.柑橘及其近缘属植物DNA条形码研究[D].重庆:西南大学,2010.
ComparativeStudyonQualityofPrecisePowderDecoctionPiecesofCitriRetilulataePericarpiumwithitsCrudeSlices
Mo Jieli2,Zhang Jin1,Gong Lu1,Qiu Xiaohui1,Xiao Shuiming3,Li Xiwen3,Xu Jiang3,Huang Zhihai1
(1SecondAffiliatedHospitalofGuangzhouUniversityofChineseMedicine,GuangdongProvincialAcademyofChineseMedicalSciences,ChinaAcademyofChineseMedicalSciencesGuangdongBranch,Guangzhou510006,China;2GuangdongInstituteforDrugControl,Guangzhou,510120,China; 3InstituteofChineseMateriaMedica,ChinaAcademyofChineseMedicalSciences,Beijing100700,China)
Objective:To evaluate the quality difference of precise powder decoction pieces (PPDP) of Citri Retilulatae Pericarpium (CRP) and traditional commercial crude slices.MethodsDifferent specifications of PPDP were prepared,their dry extract contents were compared with those of commercial slices.Three batches of commercial slices were collected,and the content uniformity,fingerprint and similarity were evaluated before and after mixing and preparation by HPLC-DAD and DNA sequence alignment.ResultsPaste rate of PPDP was slightly higher than that of the traditional commercial slices,among which paste rate of 5-10 mesh were the highest.The dissolution rate of hesperidin of PPDP was higher than that of traditional commercial slices.RSDof inter-assay dissolution of commercial slices was 18.93%,which could be reduced to 6.28 % after being mixed and prepared into PPDP.ConclusionPPDP and traditional commercial slices of CRP shared consistent properties,while PPDP could apparently improve the extraction rate,the dissolution rate and the quality uniformity,which demonstrates boiled powder of CRP is more suitable in clinical practice.
Citri Retilulatae Pericarpium; Precise powder decoction pieces; DNA; Fingerprint
广东省药品检验所专项(2016KT1014);广东省中医院专项(2015KT1817);国家自然基金项目(81402887);中国中医科学院中医药健康服务专项(ZZ0908067)
莫结丽(1974.12—),女,硕士研究生,主任药师,副主任,研究方向:中药质量控制,E-mail:13925104132@139.com
徐江(1984.04—),男,博士研究生,助理研究员,研究方向:药用植物基因组学研究,E-mail:jxu@icmm.ac.cn;黄志海(1974.08—),男,硕士研究生,主任药师,团队负责人,研究方向:中药资源与中药炮制,Tel:(020)39318571,E-mail:1925196926@qq.com
R917
A
10.3969/j.issn.1673-7202.2017.11.056
(2017-01-05收稿 责任编辑:杨觉雄)
