附子品种的抗病性及根表真菌多样性研究
2017-12-20高继海谢晓芳曹小玉
高继海 王 伟 谢晓芳 曹小玉 彭 成
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
附子品种的抗病性及根表真菌多样性研究
高继海 王 伟 谢晓芳 曹小玉 彭 成
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
目的:在系统中药思想指导下,研究附子品种的抗病能力及与外界真菌系统多样性的关系。方法:使用高通量技术构建附子品种的根表真菌文库,分析其多样性指数与附子抗病品质形成的关系。结果:小花叶与瓜叶子型附子之间,以及健康与病害附子之间,其根表土壤的优势真菌种类、群落多样性均存在差异,附子根系影响了土壤真菌的结构组成,阿太菌、总状毛霉等是附子根腐病的致病菌群,而被孢霉属、青霉菌属等又组成病害菌的拮抗菌群。结论:本结果为附子农业的良好品质管理提供理论指导,也丰富了附子品种品质形成的系统学理论与分析方法。
系统中药学;附子;根腐病;土壤真菌;高通量测序
附子是毛茛科植物乌头(AconitumCarmichaelii)的子根加工品,一种典型的道地性中药材,具有回阳救逆,助阳补火,散寒止痛之功效[1]。附子又是乌头植物、生药材等的统称,其野生资源生长于川藏高原东缘起,向东遍历长江中、下游以及珠江流域上游各省区的丘陵、高山地区,还分布于江苏向北经过山东达到辽宁南部的广阔区域[2];而作为中药农业作物,其栽培历史逾1 300多年,主产于四川、陕西、云南、贵州、重庆等地区,近年于四川地区的人工种植规模在2~3万亩,产量占全国70%以上,“江油附子”“布拖附子”均获得国家地理标志产品保护[3-4]。
系统中药理论认为,品种是中药品质形成的物质基础和内部系统要素,而生境又与中药品种相互影响,环境生态系统与生物内部系统的相互作用是决定中药品质的主要结构因素[5]。附子的品种按叶形区分为南瓜叶、大花叶、小花叶、鹅掌叶、莓叶子、油叶子和冒氏苗等。目前,附子栽培品种又以瓜叶子为主,混杂少量小花叶型。瓜叶附子以单产量高的优势,受到附农偏爱,所谓“江油附子个大质优”即指瓜叶子品种[3],但瓜叶附子对植物系统外界的真菌更为敏感,极易受到根腐病等的侵染,以四川江油为例,2014—2016年有农田根腐病感染面积比例达50%之多,附农减收严重,经济损失巨大。相较于瓜叶子品种,小花叶附子虽然产量小,其对外界系统根腐菌类的抗性能力较高,农田感染比例也较小。我国目前针对附子品种与根腐病抗性关系的科学研究与学术报道不多,甚至附子根腐病的致病原因尚未清楚,这种现状使得根腐病的预防以及附子农业管理无所适从,影响了附农增产增收,也制约了附子产业的现代化、标准化、规范化发展。
本研究从品种内在系统与外部生境系统2个角度,在整理附子主要栽培品种抗病能力的基础上,使用HiSeq 2500高通量测序技术检测其根表真菌群落的生物多样性,以期从外部系统阐释附子品种的抗病性差异以及致病原因,为附子良好农业品质的管理提供理论指导,同时也丰富了附子品种品质形成的系统学理论与分析方法。
1 材料与方法
1.1 样品采集
1.1.1 附子植株样品采集 本研究所涉附子主要栽培品种有南瓜叶、大花叶、小花叶,于2016年06月中旬采集于四川省江油市河西乡普照村GAP基地(N31°44′′,E104°42′)。按照叶形,对附子品种分别进行拍照,根系带土采挖,并编号。
1.1.2 根表土样品采集 附子植株样品采挖后,小心刮取每株附子根系的根表土约100 g,多个实验重复附子植株的土壤样品混合后烘干,通过四号筛过滤掉木屑、石块等杂质,取约10 g样品用于总DNA提取和高通量测序。采集样品包括正常附子根表土壤(编号T1、T2、T3、T4、T5,统称G1)、大花叶型附子根表土壤(编号D1、D2、D3、D4,统称G2)、患病大花叶型附子根表土壤(编号DV1、DV2、DV4,统称G3)、小花叶型附子根表土壤(编号X1、X2、X3、X4、X5,统称G4)。
1.2 土壤DNA提取与PCR扩增 采用SDS-CTAB法[7]提取土壤样品总DNA,利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度。以稀释后的基因组DNA为模板,使用带Barcode的ITS特异引物进行PCR,其反应体系为30 μL:Phusion® High-Fidelity PCR Master Mix(New England Biolabs,2×)15 μL,Primer(2 μM)3 μL(6 μM),gDNA(1 ng/μL)10 μL(5~10 ng),ddH2O 2 μL。ITS引物为:(ITS5-1737F)5′-GGA AGT AAA AGT CGT AAC AAG G-3′、(ITS2-2043R)5′-GCT GCG TTC TTC ATC GAT GC-3′。PCR反应程序为:98 ℃预变性1 min,30个循环(98 ℃,10 sec;50 ℃,30 sec;72 ℃,30 sec),72 ℃延伸5 min。
1.3 真菌cDNA文库构建与物种注释分析 根据PCR产物浓度进行等浓度混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物,选择主带大小在400~450 bp之间的序列,割胶回收目标条带。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用HiSeq2500 PE250进行测序。高通量测序结果参照Qiime(Version 1.7.0)的Tags质量控制流程[8],进行Tags截取和长度过滤。Tags序列通过UCHIME Algorithm[9]与数据库Unite database进行比对检测嵌合体序列,去除嵌合体序列得到最终有效数据[10]。利用Uparse对所有样品的有效数据在97%水平上进行聚类成为OTUs(Operational Taxonomic Units)[12],并对OTUs代表序列进行物种注释,并分别在各个分类水平(界,门,纲,目,科,属,种)统计各样本的群落组成。使用MUSCLE进行快速多序列比对[12],得到所有OTUs代表序列的系统发生关系。将OTU数值生成相对丰富度(%)进行物种分类树统计,并使用SPSS(v 19)统计结果。
1.4 群落多样性与结构分析 利用α多样性分析土壤样品内真菌的丰富度[13],用β多样性指数分析土壤样品组间差异。本文重点研究了病态土壤与健康土壤真菌多样性的差异,用Qiime软件以Weighted Unifrac距离矩阵做UPGMA聚类分析,并将聚类结果与各样品在门、属、种水平上的物种相对丰度整合展示。
2 结果与分析
2.1 附子主要栽培品种及根腐病抗性 在四川江油、布拖等主产地,附子栽培品种主要有南瓜叶、大花叶与小花叶3种。同等苗龄的这3种附子,南瓜叶型的附子叶形似南瓜叶般宽厚、油亮,叶齿平缓,茎杆粗壮;小花叶型附子茎杆细弱易,有较多分蘖出于叶腋中,叶面小、叶基狭长、叶尖尖锐,其形状如菊科植物艾,故又称艾叶型(图1A);大花叶型附子的茎杆也较粗,叶片规格介于南瓜叶与小花叶之间,叶尖端也较尖锐,附农将之与南瓜叶型附子统称瓜叶子或花叶子(图1B)。
瓜叶附子容易感染根腐病,其发病从根外至根内、自地下而地上,根表皮初为水浸状病斑,逐渐扩大至根组织内部,附子块根最后完全腐烂(图1F、H),而整个植株受害初期叶片萎蔫、下垂,似水烫状,严重时患病植株叶片自下而上变黄褐色或红紫色枯焦,甚至根茎结合处土面可见白色菌丝体与黑褐色似油菜籽大小的菌核(图1D)。瓜叶附子生病后,其病菌蔓延速度迅速,极难控制。相对于瓜叶子型品种,小花叶附子对根腐病的抵抗能力强,大田栽培时其植株少有生病(图1A、C、E、G)。瓜叶子与小花叶型附子对根腐病的明显抗性差异,为其优良品质的培育提供了筛选材料,而根腐病的致病真菌群落也是附子土壤生境系统的较佳研究对象。

图1 小花叶附子(左)与瓜叶子附子(右)
注:A、B,正常植株叶形;C、D,小花叶附子茎基与染病瓜叶附子茎基;E、F,小花叶附子与染病瓜叶附子;G、H,小花叶附子与染病瓜叶附子横切
2.2 土壤真菌数据库的构建与测序注释 本研究通过分析土壤真菌ITS高通量测序技术,成功构建了4组数据库,分别为对照正常土壤G1、大花叶附子根表土壤G2、患病大花叶附子根表土壤G3和小花叶附子根表土壤G4,共17个土壤样品。4组数据库包含996 653条序列,去除条形码引物后获得975 213条序列。根据QC和Nochime分析,最终获得总有效序列948 843条(95.25%),核苷酸195 583 495个,平均每个片段含核苷酸206个。Q30值达到99.36%,说明测序质量良好。
所有土壤样品共获得12266个OTUs,各样品平均OTUs数722个,表明附子生境系统中存在复杂的共生真菌群落。经过注释分析,99.03%的真菌序列可以注释到界、门、纲、目、科、属、种7个分类等级,如在门水平上(图2A),土壤真菌主要分布在接合菌门(Zygomycota)、子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和壶菌门(Chytridiomycota)等,而在属水平上(图2B,表1),土壤真菌主要为被孢霉属(Mortierella)、踝节菌属(Talaromyces)、青霉菌属(Penicillium)、阿太菌属(Athelia)和毛霉属(Mucor)等。
2.3 土壤真菌的多样性差异分析 对附子根表真菌做物种丰富度、多样性分析,并构建聚类树,图2结果显示,瓜叶子与小花叶型附子品种的根表土壤系统中,真菌群落结构存在较明显的差异。由图2A可见,在门的水平上,正常健康土壤(G1)中接合菌门、子囊菌门和担子菌门等分布比较均衡,而附子根表的真菌群落结构发生了变化,如小花叶品种(G4)以接合菌门为显著的根表优势菌群,瓜叶子品种(G2、G3)以担子菌门为主,其次为接合菌门(或子囊菌门)。同样为瓜叶子品种,健康附子与生病附子的根表真菌系统也发生较显著的变化(P<0.05),表现为接合菌门和担子菌门在染病土壤系统中含量增加,而子囊菌门的丰度减小。可见,附子各品种的根系均影响了周围正常土壤的真菌群落结构组成。
由图2B和表1可见,在属的水平上,对照土壤组的真菌群落也最为均衡,物种丰富度也最高(shannon指数=5.32)。瓜叶子品种的根表真菌丰富度有所降低,shannon指数分别为4.91、4.76,在小花叶附子土壤中,被孢霉属真菌含量显著升高,达到36.4%,这导致其真菌系统的丰富度最低。同样为瓜叶子品种,生病土壤(G3)中阿太菌属真菌含量达到10.3%,约为健康组(G2)的2.6倍,而且G3组含有更多毛霉属、被孢霉属类真菌,所占比例分别约为G2组的1.6和5.4倍,表明生病附子的土壤生境中存在更大的真菌群落结构失衡情况。
在物种水平上,本研究依据附子根表真菌序列构建了UPGMA树(图2),并将物种相对丰度、各附子品种的该物种占比进行标注,图3和表2显示,除了分类级别属水平上的群落结构差异,各附子品种、健康与染病附子根表系统之间,其真菌的物种水平也发生了较大的变化。如患病瓜叶子(G3)土壤中,阿太菌(A.rolfsii)、总状毛霉(Mucorracemosus)、被孢霉属的M.chlamydospora、青霉菌属的P.simplicissimum等含量,相较于对照土壤与小花叶土壤均显著增加,并且成为G3组的优势真菌。阿太菌又称白绢病菌(Sclerotiumrolfsii),主要分布于温暖潮湿地区,是导致土豆、向日葵、大豆和一些观赏花卉植物根部腐烂的主要病菌[14-15],江油地区夏季平均温度为30~33 ℃,雨水充沛,恰好适宜该菌生长。有研究表明,总状毛霉可以导致小番茄根部软化,是根腐疾病的致病菌之一[16]。此外,某些丰度较小的真菌,其在染病土壤系统中也明显改变。如茎点霉属Phomaadonidicola的含量在G3组中升高到G2组的4倍,研究表明该属许多真菌可以造成苜蓿、大豆感染严重根腐病[17]。
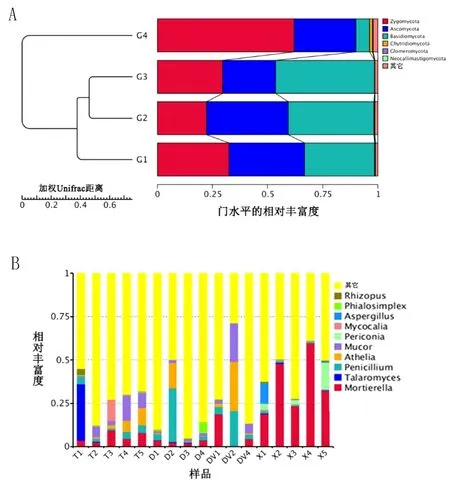
图2 4组土壤真菌的UPGMA聚类树及其在不同水平的相对丰富度
注:A,左侧是UPGMA聚类树结构,右侧的是各样品真菌在门水平上的相对丰度分布;B,各样品中真菌在属水平的相对丰富度

表1 附子根表土壤真菌在属水平分布的相对丰富度
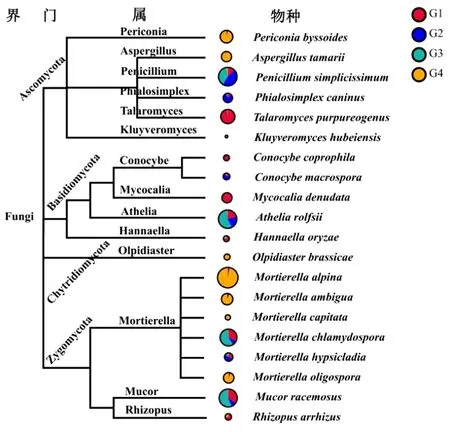
图3 附子根表土壤真菌的系统分类树及其在不同土壤的分布比例
注:分类树绘制选择使用附子根表真菌数据库中含量丰度最高的20种真菌物种,以圆圈表示,其圆圈直径与其在真菌群落中的相对丰度成正比,期在4组样品的相对比例又以圆圈中不同颜色标示

表2 附子根表土壤部分真菌在种水平的相对丰富度
有意思的是,在染病附子根表真菌群落(G3)中,被孢霉属的丰度也有较大的提高,该属是一类广泛存在于热带雨林和温带农业地区的真菌,主要分布于植物根表土壤,它们能够适应不同温度,可以拮抗(抑制)阿太菌这类利用土壤传播的真菌[18]。同时,小花叶附子根表真菌群落(G4)中,被孢霉属含量超过36%,可见其对小花叶附子的抗根腐菌能力起到重要作用。另外,P.simplicissimum于抗病品种小花叶附子土壤中含量相对较高,研究发现其是一种促进植物生长,提高植物抗性的真菌[19],因此它也应与该附子品种的抗病性状有关联。G4样品中红酵母属的Rhodotorulaingeniosa,也高于其他品种,该属真菌可以帮助甜菜抵御土壤立枯丝核菌(Rhizoctoniasolani)等的侵害[20-21],也是小花叶附子品种抵抗根腐病的因素之一。
3 讨论
系统中药理论是研究中药材种质资源的理想理论,它认为品种是中药品质形成的物质基础和内部要素,土壤、微生物等生境条件是其外界系统要素,而多维评价、自组织分析方法又兼顾到内外要素的相互协同、突变与有序演化过程,而本文针对中药材附子的实验研究及数据分析,从实践上阐释了该理论。研究所涉的小花叶、瓜叶子等多品种抗病性状,是其优良品质形成的客观内在要素,而附子自身及该农业性状品质又与外在的土壤真菌系统存在相互作用,一方面附子植物改变了对照土壤中平衡的接合菌门、子囊菌门和担子菌门比例组成,致使小花叶、瓜叶子根表土壤系统中出现了明显的优势菌群(图2,表1)。另一方面,这些外在的真菌系统又影响着附子品质变化,阿太菌等优势菌群导致G3组附子发生根腐病害,被孢霉属菌类保护小花叶附子免受致病菌感染(图3,表2)。此外,本研究结果还显示附子外界生境的真菌系统中也存在着协同与拮抗作用,如阿太菌外的其他致病菌也参与植物根腐病的发生,而青霉菌属“有益菌”物种随着G3组附子根腐病的发生也有所增加,可能在附子抗病性方面发挥着重要的外部作用。
本文主要外部系统入手,使用HiSeq 2 500高通量测序技术检测附子根表真菌群落的多样性,以期阐释附子品种的抗病性差异以及致病原因,为附子良好农业品质的管理提供理论指导,发现阿太菌等可能为附子根腐病的主要致病菌之一,课题组后期已从病害材料中纯化获得该菌株,侵染实验也验证了其致病性,这为附子根腐病的预防以及农业良好品质管理工作奠定了坚实基础,同时也丰富了附子品种品质形成的系统学理论于分析方法。然而,附子内在品质的遗传物质与药效物质成分,在与外界系统的相互关系中发挥着怎样的主导作用,以及附子生命系统内部存在哪些协同、拮抗与演化因素,还需要后续进一步研究。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:191-193.
[2]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979:264.
[3]杜路,曾加.论道地药材的地理标志保护[J].西北大学学报:哲学社会科学版,2012,42(5):137-141.
[4]薛荣娟.论道地药材的地理标志保护[D].重庆:西南政法大学,2013.
[5]彭成.论系统中药学的科学内涵[J].中药与临床,2016,7(3):1-4,8.
[6]黄勤挽,周子渝,王瑾,等.附子道地性形成模式的梳理与考证研究[J].中国中药杂志,2011,36(18):2599-2601.
[7]蔡刘体,胡重怡,罗正友.SDS-CTAB法提取烟草病圃土壤微生物总DNA[J].江西农业学报,2011,23(2):119-121.
[8]Caporaso JG,Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Methods,2010,7(5):335-336.
[9]Edgar RC,Haas BJ,Clemente JC,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[10]Haas BJ,Gevers D,Earl AM,et al.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].Genome Res,2011,21(3):494-504.
[11]Edgar RC.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Methods,2013,10(10):996-998.
[12]Edgar RC.MUSCLE:multiple sequence alignment with high accuracy and high throughput[J].Nucleic Acids Res,2004,32(5):1792-1797.
[13]Li B,Zhang X,Guo F,et al.Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J].Water Res,2013,47(13):4207-4216.
[14]Wunsch MJ,Bergstrom GC.Genetic and morphological evidence that Phoma sclerotioides,causal agent of brown root rot of alfalfa,is composed of a species complex[J].Phytopathology,2011,101(5):594-610.
[15]Pastor N,Carlier E,Andrés J,et al.Characterization of rhizosphere bacteria for control of phytopathogenic fungi of tomato[J].J Environ Manage,2012,95 Suppl:S332-337.
[16]Kwon JH,Hong SB.Soft Rot of Tomato Caused by Mucor racemosus in Korea[J].Mycobiology,2005,33(4):240-242.
[17]Wunsch MJ,Bergstrom GC.Genetic and morphological evidence that Phoma sclerotioides,causal agent of brown root rot of alfalfa,is composed of a species complex[J].Phytopathology,2011,101(5):594-610.
[18]Miao CP,Mi QL,Qiao XG,et al.Rhizospheric fungi of Panax notoginseng:diversity and antagonism to host phytopathogens[J].J Ginseng Res,2016,40(2):127-134.
[19]Hossain MM,Sultana F,Kubota M,et al.The plant growth-promoting fungus Penicillium simplicissimum GP17-2 induces resistance in Arabidopsis thaliana by activation of multiple defense signals[J].Plant Cell Physiol,2007,48(12):1724-1736.
[20]El-Tarabily KA.Suppression of Rhizoctonia solani diseases of sugar beet by antagonistic and plant growth-promoting yeasts[J].J Appl Microbiol,2004,96(1):69-75.
[21]Hilber-Bodmer M,Schmid M,Ahrens CH,et al.Competition assays and physiological experiments of soil and phyllosphere yeasts identify Candida subhashii as a novel antagonist of filamentous fungi[J].BMC Microbiol,2017,17(1):4.
StudyonDiseaseResistanceofRadixAconitiLateralisPraeparataVarietiesandtheirRhizoplaneFungalDiversities
Gao Jihai, Wang Wei, Xie Xiaofang, Cao Xiaoyu, Peng Cheng
(CollegeofPharmacy,ChengduUniversityofTraditionalChineseMedicine;KeyLaboratoryofChineseHerbsStandardizationofMinistryofEducation;Co-constructKeyLaboratoryofSystematicResearch,DevelopmentandUtilizationofChineseMedicinalResources,Chengdu611137,China)
Objective:To study the relationship between the disease resistance of Radix Aconiti Lateralis Praeparata and the diversity of fungi system under the guidance of systematic theory of Chinese herbal medicine.MethodsHigh-throughput technology was used to build the rhizoplane fungus library of different types of Radix Aconiti Lateralis Praeparata, and then the relationship between the diversity index and the anti-disease capacity was analyzed.ResultsThere were differences in the dominant strains and the diversity of fungi community for the rhizoplane soils between the Xiao-Hua Radix Aconiti Lateralis Praeparata and the Gua-Ye Radix Aconiti Lateralis Praeparata, the healthy and pathogenic Radix Aconiti Lateralis Praeparata; The root system of Radix Aconiti Lateralis Praeparata affect the structure of soil fungi. Atheli arolfsii,Mucor racemosus were the pathogenic fungi, while the Mortierella, Penicillium are antagonistic fungi to root rot pathogens.ConclusionThe results provide theoretical guidance for good quality management of Radix Aconiti Lateralis Praeparata agriculture, and enrich the theory and analysis methods for the system science of Chinese herbal medicine.
System science of Chinese herbal medicine; Radix Aconiti Lateralis Praeparata; Root rot; Soil fungus; High-throughput sequencing
国家自然科学基金重点项目(81630101);国家发改委标准化项目(ZYBZH-C-SC-51);国家自然科学基金国家基础科学人才培养基金(J1310034);四川省中医药管理局“川产道地药材综合开发与区域发展”项目(2016ZY008);四川省科技厅应用基础计划(2016JY0089)
高继海(1983.11—),男,博士,讲师,研究方向:分子生药学研究,E-mail:gaojihaiwuwei@163.com
彭成(1964.03—),男,博士,教授,博士研究生导师,研究方向:中药毒效的系统评价与整合研究,E-mail:pengchengchengdu@126.com
R282.5
A
10.3969/j.issn.1673-7202.2017.11.004
(2017-10-09收稿 责任编辑:王明)
