有毒乌头类中药的毒效网络整合分析:思路与方法
2017-12-20韩波黄维谢欣彭成
韩 波 黄 维 谢 欣 彭 成
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
有毒乌头类中药的毒效网络整合分析:思路与方法
韩 波 黄 维 谢 欣 彭 成
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
中药的有效性和安全性不仅是中医药传承和发展的坚实基础,也是中医药服务于世界人民健康事业的根本前提。因此多学科交叉融合、整合分析中药毒效的物质基础、作用原理、毒效关系,揭示“有故无殒、中病即止”的科学内涵,是中药进入国际医药市场亟待解决的关键问题。利用复杂生物网络研究中药系统药理学和系统毒理学,构建可靠的中药药效物质作用靶标相关的分子效应和毒理学性质网络,反映特定疾病状态的相关生物实体的分子网络及毒性机制,整合效应物质作用靶标网络与疾病生物网络,通过网络拓扑学和动力学等方法分析“药物-靶点-疾病”网络和“药物-靶点-活性/毒性”网络中有效物质与疾病、成分与毒性的相互作用关系,检识出复杂网络模型中的靶点组合、通路组合、子网组合、药物组合等,大大提高了中药复杂药效物质的研究效率。作者主要基于其研究团队近年来开展的乌头类中药研究工作,重点介绍开展有毒中药的毒效网络整合分析研究的思路和方法。
有毒中药;乌头类中药;毒效网络;系统毒理学;网络药理学
安全性和有效性是药物必备的核心要素,换言之即药品的“毒”与“效”是药品发现、研发和应用的根本。中医药对中药“毒”与“效”的认识源远流长,是中华民族在长期与疾病作斗争的医疗实践和现代药理毒理研究过程中,逐渐形成的知识和技术体系。继《吴普本草》最早于药品下标注“毒性”后,历代本草著作在其各药物条目下,通常有“有毒”或“无毒”的记载,或按大毒、有毒、小毒或微毒以标注其毒性的大小,以保证用药安全。目前,有毒中药是指药性峻猛,对机体有毒性或不良反应,安全剂量小,用之不当或药量稍超,即可对机体产生危害的一类中药。虽然中医药对有毒中药的安全应用有独到的认识,中医古籍和中药主流本草中记载了许多“毒药”“毒性”、有毒中药毒性分级、药材品种、药材品质、炮制制剂、剂量大小、给药途径、服药方法、对证用药、合理配伍、患者个体差异等方面的理论知识和临床应用实践,已形成中药毒性理论和有效控制有毒中药毒性的方法体系。但继比利时中药减肥事件、新加坡黄连事件、日本柴胡事件、英国千柏鼻炎片和复方芦荟胶囊事件、马兜铃酸事件、鱼腥草注射液事件、何首乌事件之后,中药材熏硫、汉森制药“槟榔入药”、云南白药与“乌头碱”、同仁堂多种中成药含重金属等成为国内外公众关注的热点,中药的安全性和有效性备受质疑[1]。
自古有云:“药以治病,因毒为能”,“药未有不偏者也,以偏救偏,故名曰药”。砒霜、附子毒药救人,人参虽补也能伤身。由此可见效与毒是辨证统一。有毒中药在治疗某些疑难疾病方面,效力强,取效甚捷,为历代医家所习用。现代中医师也常将其用于肿瘤、风湿病等疑难重症及杂症的治疗,疗效奇特。随着精准医学时代的到来,以及基础生命科学新技术在中药学科中不断渗透融合,基于系统毒理学和网络药理学的研究思路及手段,融合组学技术,从而系统阐释中药的毒效关系,科学总结有毒中药的作用规律,整合分析有毒中药的物质基础和作用机制,阐明有毒性中药治疗疑难重症的毒效机制,对于实现中药现代化具有重要意义。
1 基于系统毒理学和网络药理学开展乌头类中药毒效网络的整合分析的思路
系统毒理学是伴随着系统生物学和高通量分子检测技术而发展起来的学科,是通过整合分子、细胞、组织等不同研究层次的高通量信息,系统研究外源性化学物和环境应激等与机体相互作用的科学[2]。系统毒理学主要包括毒理组学技术及计算系统毒理学两部分,而计算系统毒理学旨在整合毒理组学实验数据,构建多水平、多尺度的预测模型,定量评估化合物的安全性。计算系统毒理学虽然起步不久,但建立的静态网络分析预测、动态网络模拟和有害结局路径等研究方法,在全面解析毒理学机制、发现新的生物标志物及化合物安全性综合评估等方面已表现出良好的应用前景[3]。其研究思路与方法,特别适合“毒性物质基础多样-毒作用机制复杂-增效减毒方法多种”的有毒性中药的系统研究。
网络药理学是以药物、靶点与疾病间相互作用的整体性和系统性为出发点,利用复杂网络模型表达和分析研究药物-靶点-疾病的网络关系。网络药理学在方法学上整体性、系统性的特点与中医药整体观、辨证论治的原则不谋而合,且能够从分子水平和系统层次解析中药药效的科学内涵。中药网络药理学主要是评价中药的多个靶点的协同作用对疾病相关分子网络的综合影响。基于生物分子网络的中药药理学研究路线通常包括:1)探索活性成分的作用靶标;2)明确中药所治疗疾病的相关基因,并构建疾病网络;3)整合并完善药物-靶点-疾病,阐释中药多成分、多靶点、多途径、多层次的协同作用规律。
通过构建的药物“成分-靶点-活性”网络和“成分-靶点-毒性”网络的整合分析,系统阐述有毒乌头类中药在临床上“治疗心力衰竭与心脏毒性”“治疗风湿痹痛与神经毒性”“治疗妊娠疾病与胚胎毒性”3个层面上的系统作用规律,揭示毒效整合作用的科学内涵。
2 毒效网络的整合分析的研究方法及关键技术
利用复杂生物网络研究中药系统药理学和系统毒理学,构建可靠的中药药效物质作用靶标相关的分子效应和毒理学性质网络,反映特定疾病状态的相关生物实体的分子网络及毒性机制,整合效应物质作用靶标网络与疾病生物网络,通过网络拓扑学和动力学等方法分析“药物-靶点-疾病”网络和“药物-靶点-活性/毒性”网络中有效物质与疾病、成分与毒性的相互作用关系,检识出复杂网络模型中的靶点组合、通路组合、子网组合、药物组合等,最终对预测的结果进行实验验证。其基础技术包括网络数据库检索、药效物质的研究、计算机虚拟计算及高通量组学数据分析等。
2.1 乌头类中药的药效物质基础研究 毛茛科(Ranuculaceae)乌头属(Aconitum L.)植物全世界约有300余种。乌头属植物虽然具有很强地毒性,但由于其显著的药理作用,越来越受到国内外的广泛关注。《中华人民共和国药典》所收录的乌头属中药主要有川乌、草乌及附子,具有止痛、抗炎、局部麻醉、强心、退热等作用,临床上可用于治疗风湿性关节炎、跌打损伤、神经性疼痛、休克等[4-6]。

图2 乌头类生物碱
乌头属药材中含有多种化学成分,主要成分为二萜生物碱,是乌头属药材的有效成分,又是最主要的毒性成分,包括C18型二萜生物碱、C19型二萜生物碱、C20型二萜生物碱及双二萜生物碱(图2)。在C19二萜类生物碱中的乌头碱-牛扁碱型研究较多,其母核按C3、C8及C14位取代基结构的不同,又分为三酯型生物碱、双酯型生物碱、单酯型生物碱和醇胺型生物碱。目前,对于乌头属构效关系的研究主要集中在C18及C19型二萜生物碱。
2.1.1 乌头属有效成分与镇痛活性的构效关系 自1981年起,就有学者开始研究乌头属植物的C18及C19二萜型生物碱的镇痛活性。在所研究的化合物中,3-乙酰乌头碱(3-acetylaconitine)、拉普乌头碱(Lappaconitine)、粗颈乌头碱 A(CrassicaulineA)、草乌甲素 A(Bulleyaconitine A)已经表现出显著的镇痛活性,并且以应用于临床[7-11]。二萜类生物碱的镇痛机制与中枢神经系统细胞膜Na+通道有关。根据对电压依赖Na+通道的作用方式不同,具镇痛作用的二萜生物碱分为3类:双酯型(如乌头碱、中乌头碱、3-乙酰乌头碱)对Na+通道结合位点2具有高亲和力,激活电压依赖性Na+通道导致去极化最终抑制疼痛传导;单酯型(如高乌甲素,N-去乙酰高乌甲素)能抑制Na+通道,具有镇痛和抗癫痫作用;胺醇类由于失去了与Na+通道结合位点的苯甲酰酯基,镇痛作用较弱。唐希灿等[12]通过对乌头碱、3-乙酰乌头碱和草乌甲素的镇痛活性和毒性比较发现,3位羟基的引入使镇痛活性增大,毒性也增大;而羟基乙酰化可降低毒性和镇痛活性,但后者的下降幅度较小而加大了治疗指数。同时发现,8位、14位酯基的改变对活性和毒性的影响也很大,具有8、14位双酯的乌头碱毒性最大,而水解掉一个酯基变成单酯基化合物则毒性大大降低而镇痛活性下降较小。Jutta Friese等[13]通过对一些高亲和性生物碱和低亲和性生物碱镇痛活性以及毒性比较发现,双酯型二萜生物碱使神经突触钠离子流以及钙离子流增加(EC50,3 μM),镇痛活性较强(ED50,25 μM),并可导致心率失常,有较大毒性(LD50,70 μg/kg)。单酯型和醇胺型二萜生物碱则减少钙离子流,使心率降低且镇痛活性较低(ED50,20 mg/kg),毒性也较低(LD50,30 mg/kg)。这也表明C-8位的乙氧基取代及C14位的芳香酯基取代对于镇痛作用是重要的。Angélica M.Bello-Ramírez等[14]运用了QSAR分析了乌头属植物根中已证明具有镇痛活性的生物碱的结构与活性之间的构效关系。认为在C-14位连接芳酯基或芳酰基的镇痛活性强于在C-4位连接芳酯基的活性。其次,在芳香环上的C-5位的反应活性系数对于镇痛活性来说是一个最重要的因子。通过对3种二萜类乌头属生物碱高乌甲素(Lappaconitine)、滇乌头碱(Yunaconitine)和粗颈乌头碱(Crassicauline)的镇痛活性进行比较,Jianli Wang等认为A环三价氮离子、8位碳连接的乙酰氧基或羟乙基、14位碳的芳香酯基以及D环的饱和度为影响该类生物碱镇痛活性的重要因素[15]。
2.1.2 乌头属中药成分与抗炎活性的构效关系 目前,关于乌头属中药成分的抗炎构效关系的研究很少,只能通过已证明有明显抗炎活性的化合物的结构来推测与疗效相对应的必须结构。由于煎煮,使得乌头碱、中乌头碱、次乌头碱含量降低。然而,它们的水解产物,如苯甲酰乌头碱、苯甲酰中乌头碱、苯甲酰次乌头碱含量相对较高,且实验表明具有显著的抗炎活性[16-20],说明水解产物的抗炎活性强于原形乌头型生物碱,即乌头属有效成分的抗炎活性可能与C-8位的乙酰氧基以及酯基的碳链长度以及不饱和度有关。
2.1.3 乌头属中药成分与局部麻醉活性的构效关系 Angélica M.Bello-Ramírez等[21]应用QSAR探讨了乌头型生物碱与局部麻醉之间的关系。研究认为,乌头型生物碱的局部麻醉作用的构效不同于镇痛作用的结构特征,在C-14位上连接芳酯基最具有局部麻醉活性,而C-4位连接此基团则活性相对较弱。此外,乌头型生物碱的局部麻醉活性的ED50与分子量、核-核之间的排斥能量、空间的能量等具有显著的联系。其中,分子量是最重要的结构参数,与其正相关;其次是芳香环上C-5′及C-2′的反应活性指数,与其负相关。
2.1.4 乌头属中药成分与毒性的构效关系 研究表明,双酯型乌头碱类成分经水解转变为单酯型乌头碱类,毒性减为双酯型乌头碱的1/200,继续水解为胺醇类碱,毒性为双酯型乌头碱的1/2 000,毒性与其结构关系极为密切,且疗效也存在巨大差异,与其结构密切相关也密切相关,故研究效应与结构的关系对减毒增效具有十分重要的价值[22]。Angélica M等[23]对乌头型生物碱的结构特征及毒性(LD50)之间的关系进行了QSAR分析,他们把这些生物碱分成2组(图3),组一为在C-14为连接芳酰基或芳酯基,如滇乌头碱(Yunaconitine)、乌头碱(Aconitine)、3-乙酰基乌头碱(3-acetyl aconitine)等;组二为在C-4位连有芳酯基,如高乌甲素(Lappaconitine)、N-去乙酰高乌头碱(N-deacetyllappaconitine)等。发现组一的LD50显著低于组二,即在C-14位连有芳酰基或芳酯基毒性强于在C-4位连有芳酯基的乌头型生物碱(表1)。表明C-14上连有的芳酰基或芳酯基对毒性来说是很重要的。

图3 Angélica M研究中被分为两类的乌头类生物碱
周远鹏的研究显示,不含14位芳酯基的Pseudaconine和Pentaacetylaconine不会引起心律失常,且苯甲酰乌头碱(benzoylaconine)毒性低于乌头碱(aconitine)200倍[24]。进一步说明了14位碳的芳酯基为乌头类生物碱的重要毒性基团。唐希灿等对乌头碱、3-乙酰乌头碱和草乌甲素的毒性进行比较,发现引入3位羟基可增加毒性,而对此羟基进行乙酰化可降低毒性,且下降幅度较镇痛活性下降大,因而增加了治疗指数[25]。8位、14位酯基的改变对活性和毒性的影响也很大,具有8、14位双酯的乌头碱毒性最大,而水解掉一个酯基变成单酯基化合物则毒性大大降低而镇痛活性下降较小[26]。
Malakhat A.Turabekova等[27]运用GA-MLRA技术对19种乌头属和翠雀属生物碱进行了QSAR分析,结果显示,化合物特征结构中羰基的数量在生物碱活性中起着决定性的作用,同时决定着氢键形成能力。毒性的增加由参与氢键的原子数量决定,而不是大型基团的增加。这一研究表明分子量越大、疏水性越强、氮原子形成分子内氢键能力越强,该乌头类生物碱毒性越低,同时也进一步证实了乌头类生物碱是在Na+通道与受体结合,氢键在结合过程中发挥着重要作用。洪波等[28]采用密度泛函理论B3LYP/6-31G方法,对附子中的9种生物碱类成分进行了量子化学理论研究,讨论了该类生物碱的结构和毒的关系。研究认为,C-8位及C-14位上的酯基,特别是C-14上的Ph COO-在水解的过程中所发生的变化,影响了分子的构型、电荷分布、前线分子轨道等性质,使分子与受体的作用减弱,从而使毒性降低。

表1 两类乌头类生物碱的毒性及其特征结构的关系
本课题组采用微量热法,研究3种乌头类双酯型生物碱对嗜热四膜虫生长的毒性效应。在不同给药条件下,以表达功率-时间曲线(热谱曲线)的特征参数生长速率常数(k)、半数抑制浓度(IC50)、最大输出功率(Pmax)及达峰时间(tp)和总产热量(Qt)为指标,对嗜热四膜虫生长代谢程度进行客观地量化评价。由半抑制浓度IC50得到3种乌头类双酯型生物碱毒性的大小顺序:乌头碱>新乌头碱>次乌头碱。构效关系研究表明,在乌头类双酯型生物碱C(3)上引入羟基(OH)以及N原子上引入乙基(CH2CH3)更有助于增加双酯型生物碱的毒性作用[29]。
2.2 基于系统毒理学研究中药的毒性作用网络 系统毒理学旨在采用人源细胞系、细胞组分进行体外高通量筛选实验,整合计算预测模型,直接测试和模拟人体环境。其中主要的研究方法:通过生物信息学和计算毒理学技术,结合传统毒理学的研究参数,建立“药物-靶点-毒性”网络模型推测各要素之间相互关系,并对预测的结果进行实验验证,从而研究中药的毒理学性质及致毒机制等,为药物的安全性评价提供理论依据。
2.2.1 利用系统毒理学开展中药的毒性作用网络的技术 构建毒性作用网络的现有网络工具主要包含数据库、毒性预测工具和网络可视化及分析软件。
目前,可用于毒性作用网络研究的相关数据库主要有CTD,TOXNET,NTP,RTECS等。CTD(comparativetoxicogenomics database)[30]提供了环境化合物影响人类健康的数据信息,首次为全世界研究人员提供了多种毒理学信息,包括不同类型分子的毒理学数据以及来自各种生物体的毒理学数据等。TOXNET提供了一组毒性有关的数据库,包括HSDB,IRIS,GENE-TOX,CCRIS等。其中,HSDB(hazardoussubstances data bank)主要提供人和动物相关的毒性方面的数据等;IRIS(integrated risk information system)主要提供人类健康风险评估相关数据,如危害辩识、药物剂量反应评估等;GENE-TOX主要提供生化诱变测试相关数据;CCRIS(chemical carcinogenesis research information system)主要提供化合物致癌性、诱变性等数据信息。NTP(national toxicology program)是由美国DHHS(Department of Health and HumanServices)于1978年创建,已为诸多化学品或药物提供了系统的短期毒性、器官毒和三致等基础科学数据。RTECS(theregistry of toxic effects of chemical substances)是一个大型数据库,涵盖了大量(超过130 000种)化合物的毒性信息,包括急性毒性、多剂量毒性、遗传毒性、致癌性、生殖毒性、皮肤和眼睛刺激等[31]。
可用于毒性预测的工具主要有TOPKAT,HazardExpert,DEREK,M-CASE,ToxSYS等。TOPKAT(www.accelrys.com)由Accelrys公司开发,主要预测外源物质的致突变性、致癌性、敏感性、刺激性等。HazardExpert(www.compudrug.com)由Compudrug公司开发,主要预测外源物质的致突变性、致癌性、致畸性、皮肤敏感性、刺激性、免疫毒性、神经毒性等。DEREK(www.chem.leeds.ac.uk)由Lhasa Limited公司开发,主要预测外源物质的致突变性、致癌性、致畸性、刺激性、神经毒性、甲状腺毒性、呼吸敏感性和皮肤敏感性等。M-CASE(www.multicase.com)由Multicase公司开发,主要预测外源物质的致癌性、致畸性、刺激性、短期毒性等。ToxSYS(www.scivision.com)由SciVision公司开发,主要预测外源物质的致突变性、急性毒性等。
网络可视化工具可以把难以理解的关系表变得容易观察和分析的网络图,网络分析工具则用于对已建成的网络进行拓扑学等分析,以挖掘出隐含的知识、规律和新的知识。一般而言,网络可视化和网络分析工具大多集成在同一软件中,以方便研究。该技术是指应用可视化工具,将联系表反映成一张相互联系的可视网络的过程。一般分为2个阶段:①丰富网络属性,通过增添网络本身、节点及连接的属性,使节点联系表扩展为包含丰富信息的网络;②网络描述,通过丰富的特征描述手段,使网络表现更加直观。目前,应用较为广泛的网络可视化及分析软件有Cytoscape,GUESS,Pajek等[32]。
2.2.1.1 基于CTD的药-靶-毒性网络的构建 美国比较毒理基因组学数据库(Comparative Toxicogenomics Database,CTD)(http://ctdbase.org/)是一个由环境科学家和毒理学家手工创建的与毒理基因组学密切相关的数据库,目前数据库中包含超过百万条化合物基因疾病关联性数据,包括文献报道的试验数据和计算推理的数据。CTD中收集了目前成熟的3个2部网络数据,包括化合物-基因相互作用(Chemical-Gene Interactions,CGI)、化合物-疾病关联性(Chemical-Disease Associations,CDA)和基因-疾病关联性(Gene-Disease Associations,GDA)用于计算系统毒理学方法的发展和模型构建。Davis等[33]运用CTD的导出和批量处理工具下载砷类化合物和基因的交互作用,分析基因序列以获得分子间相互作用,KEGG通路注释,并推断疾病关系。CTD从文献中得到了21个不同砷类化合物和1456个基因和蛋白的2738种治疗关系,揭示了暴露在砷类化合物下时受影响的生理学功能和分子网络,包括应激反应、细胞凋亡、细胞周期和具体的蛋白信号通路。整合砷类化合物-基因数据和基因疾病数据得到了可能与砷暴露相关的疾病清单和可能解释这种关联的基因。结果表明CTD数据整合和管理策略能够揭示了环境化合物的作用机制,并为发展环境性疾病致病原下的分子机制假说奠定基础。针对有关砷类化合物分子响应的文献报道,CTD将其与能够帮助建立“化合物-基因-疾病”网络的附加策划数据集相整合,为考察砷相关疾病和毒性的分子基础提供证据。
此外,CTD通过收集化合物和基因,基因和疾病,疾病和化合物之间相互关系的数据,建立起化合物-基因-疾病的网络系统。研究者不仅可以在数据库中找到数据,而且还可以从中推导出新的信息[34]。Allan等[35]还继续开发了新的工具来帮助研究者更好地使用CTD数据库。不仅如此,如果从细胞信号通路的角度入手,撇开单个基因的表达变化差异,而关注与信号通路的整体变化的比较分析,在某些研究中取得了更好的效果。这些成果使得毒理基因组学的研究向系统化前进了一大步。此类分析适用于任何环境性化合物或治疗性药物的毒性网络研究,中药毒性成分也不例外。
2.2.1.2 基于MetaADEDB的药-靶-毒性网络的构建 药物不良反应的预测和识别在发展个性化诊疗中十分重要。许多不良反应在临床试用阶段并未被发现,导致被批准进入临床应用时产生的不良发病率和死亡率在全世界都很常见。因此综合性计算可得的药物不良反应数据库(Comprehensive Computer-available ADEs Database,MetaADEDB)应运而生。MetaADEDB是由整合CTD、SIDER和OFFSIDES而得到的,能够将3 060个化合物(其中包含超过1 300个FDA批准的药物和试验药物)和13 256种药物不良反应联系起来。MetaADEDB中的所有药物和疾病都由医学主标题和统一医学语言系统词汇进行标注。目前已有527 216个药物-药物不良反应关联运用MetaADEDB建立,研究者可运用药物名称、药物不良反应名称、医学主题词以及统一医学语言系统标识符和相似性搜索在MetaADEDB搜索特定的药物-药物不良反应相关性。Tang等[36]以MetaADEDB为基础,发展了预测能力可与结构相似性推断(Structural Similarity Inference,DSSI)方法和药物治疗作用相似性推断(Drug Therapeutic Similarity Inference,DTSI)方法比较肩的药物不良反应相似性推断(Drug Side Effect Similarity Inference,DSESI)方法,在由621个批准药物和893个靶蛋白连接而成的已知“药物-靶点”相互作用(Drug Target Interaction,DTI)网络对7个批准药物进行药物-靶点的预测。发现了关于多巴酚丁胺、菲洛特罗、酮替芬、洛沙平、曲马多、匹莫齐特、舍曲林7种药物的共44对新预测的DTI组合,其中7组DTI组合在已报道的实验中得到了证实。
此外,“药物-靶点”和“靶点-不良反应”关联的网络可视化可以为市售药物提供新的作用机制(Mechanism-of-action,MOA)。在个案研究中,“药物-靶点”关联的网络可视化和脱靶的不良反应关联为3种抗精神病药物(菲洛特罗、匹莫齐特、洛沙平)提供了新的作用机制。
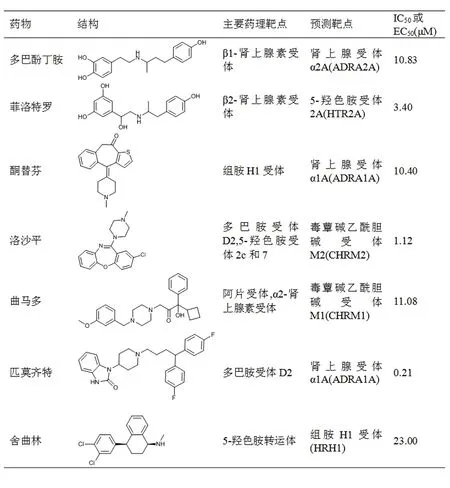
图4 7种批准药物的DTI组合

图5 利用Cytoscape软件包制作的3种药物脱靶不良反应网络
2.2.1.3 毒性作用网络技术在中药研究中的应用 毒性作用网络通过基因、蛋白、化合物和毒性反应之间的网络构建,可在复杂体系中寻找毒性物质、预测已知化合物的不良反应,为解释其致毒机制提供有价值的信息。毒性作用网络在中药研究中可以有以下几方面的应用[37]。1)寻找单味中药或方剂中的潜在致毒成分:随着中药临床应用的增加,其不良反应报道亦逐年增多。然而,受限于中药化学组成的复杂性,目前仍缺乏有效辨识其致毒组分或成分的方法。网络毒理学的提出为该问题的解决提供了新的思路。例如,根据某些毒性反应(或不良反应)相关的毒性化合物结构的相似性可构建化合物-化合物网络,再在所建网络中加入结构明确的中药成分,进行网络分析,与已知毒性化合物处于同一子簇的中药成分可能就是该药材的潜在毒性成分。对经体外及动物实验证实的毒性成分,应当在中药制剂中严格控制这些化合物的含量,并在临床上谨慎使用含有这些成分的中药。2)阐述有毒中药或方剂的致毒机制:古人对有毒中药的安全应用已有独特的见解,中医古籍中也记载了许多有关有毒中药(按其毒性强弱分为大毒、有毒以及小毒中药)方面的理论知识和临床应用经验,逐渐形成了中药毒性理论和有效控制有毒中药毒性相关的方法体系,但关于有毒中药的致毒机制尚未进行诠释。因此,揭示有毒中药的致毒机制可为合理使用有毒中药提供科学数据。有研究表明,中药的毒性作用很可能也是通过多途径、多靶点起作用,而解释这种复杂毒性机制正是网络毒理学的优势所在。如,可针对重要的毒性靶器官,从相关数据库和文献中抽取整理中药、蛋白、基因、毒性反应等相关信息,采用前述软件构建有毒中药-靶点网络,进而对所建网络进行系统分析,阐明有毒中药的可能致毒机制。3)诠释中药配伍禁忌理论科学内涵:“十八反”“十九畏”等配伍禁忌理论是中药临床使用的重要指导原则,但其科学内涵尚未得到完全诠释。如“甘草反甘遂”的研究实例表明[38],当甘草、甘遂2种药合用时,毒性的大小主要取决于甘草与甘遂的用量比例:当甘草的用量相等或大于甘遂的用量时,所产生的毒性相对2味药单用时所产生的毒性作用大;而“乌头反贝母与半夏”的研究实例表明,乌头配伍半夏、贝母后毒性增加并不大[39]。显然,“十八反”和“十九畏”的现象,还有待进一步深入研究,探讨相畏和相反现象产生的机制和规律。网络毒理学为“十八反”和“十九畏”等传统中医配伍禁忌理论现代研究提供了新的思路。以“甘草反甘遂”为例,可通过文献整理、数据库查找、实验研究甚至计算预测等方法收集由甘草或甘遂引起的毒性反应的相关蛋白、基因等,构建蛋白-蛋白网络、基因-基因网络或基因-蛋白网络;其次,收集2味中药(甘草和甘遂)所包含的尽可能全的成分;再者,通过网络的方法构建这2味中药相关成分的化合物-蛋白网络、化合物-基因网络或化合物-蛋白-基因网络;最后,通过网络分析推测2味中药“相反”的作用的致毒机制。4)解释中西药相互作用:目前,中西药结合治疗复杂疾病的现象越来越普遍。合理的配伍有益于疾病的治疗,而不合理的配伍,则会带来许多不良反应与配伍禁忌。有些中西药均具有较强的药理作用,合用后药理作用相互加强产生不良反应。如强心苷有较强的药理效应,过量会引起中毒。因此,蟾酥、夹竹桃等含强心苷成分的中药及其制剂不宜与强心苷类西药合用[40]。与前述中药配伍禁忌研究类似,同样可以使用毒性作用网络的研究方法,通过构建化合物-蛋白网络、化合物-基因网络或化合物-蛋白-基因网络,通过系统的网络分析对联合用药产生不良反应的原因进行科学的解释。
2.3 基于网络药理学研究中药的活性作用网络 中药网络药理学主要是评价中药的多个靶点的协同作用对疾病相关分子网络的综合影响问题。网络药理学的研究方法包括:1)凭借公共的开放数据库,模拟研究目标成分的分子网络模型,用于阐释和预测成分-靶标的相互作用规律;2)借助蛋白组学、基因组学及高内涵/高通量筛选手段,获得海量数据后运用生物信息学进行分析,构建拟研究目标成分-靶标-疾病的分子网络,进而解析目标药效物质的网络机制。基于生物分子网络的中药药理学研究路线通常包括:1)探索活性成分的作用靶标;2)明确中药所治疗疾病的相关基因,并构建疾病网络;3)整合并完善药物-靶点-疾病,阐释中药多成分、多靶点、多途径、多层次的协同作用规律。常用的分子网络归为3大类:1)药物组(drugome)网络,可用于预测脱靶效应、药物不良反应及药物作用机制的阐释等;2)疾病组(diseaseome)网络,用于预测疾病相关的基因和阐释疾病发病机制;3)相互作用组(interactome)网络,分析疾病相关基因和药物相关靶标在相互作用组中的关系,阐释疾病发病机制和评估药物的药效及不良反应,指导设计高疗效低毒性的新药物。三者的关系如图6所示。
2.3.1 利用网络药理学研究中药的活性作用机制的思路 1)探索活性成分的作用靶标:当前计算预测方法主要有反向分子对接(Inverse Docking)、化学相似性搜索(Chemical Similarity Searching)等。反向分子对接以小分子化合物为探针,在已知结构的候选靶点数据库内,搜寻可能与之结合的生物大分子,通过空间和能量匹配,识别可能形成的分子复合物,进而预测药物潜在的作用靶点。2013年《Nature》报道,纽约大学朗格医学中心的药理学家Timothy Cardozo开展了史上最大规模的药物对接计算机模拟工作[41]:从PubChem数据库和ChEMBL数据库中选择了大约60万种化合物分子,评价了这些分子与570种人类蛋白质的7 000多个结构“口袋”的结合能力的强弱,创建了名为Drugable的网站并对公众开放。对于靶标未知的化合物,通过搜索与其结构相似而靶标已知的化合物,来预测该化合物的靶标。Lin Na课题组[42]在研究乌头汤对类风湿关节炎的作用机制时,首先通过查询TCMDatabase@Taiwan数据库,获得乌头汤中化合物的化学结构,然后使用TTD(Therapeutic Targets Database)数据库所提供的药物相似性搜索工具,搜索到乌头汤中的化合物与153种药物有相似结构,预测了潜在作用靶点。李梢课题组[43]提出的靶标预测算法drugCIPHER将药物的化学相似性、治疗相似性相结合,预测了清络饮中235种活性成分对应的靶标。2)构建疾病网络:对于疾病网络的构建,相关研究小组设计了很多算法,在已知疾病基因的基础上预测更多的疾病相关基因。其中,基于蛋白网络的算法可用于疾病网络构建:从背景网络中将已知疾病基因、预测的疾病基因,以及这些基因间的相互作用全部提取出来,构建成疾病网络。近年来的算法主要包括随机漫步法、Page Rank法、k步马尔科夫法(k-step Markov method)、网络传播法、Katz-中心性法等。李梢课题组[44]提出的疾病基因预测算法CIPHER,将疾病间的相关性与网络结点的邻近性相结合,利用此算法,他们以OMIM中类风湿关节炎基因为种子,预测了更多类风湿关节炎相关的基因,从而构建了该疾病的网络。3)研究协同作用:复方中药中不同成分间通过多靶标协同作用发挥疗效,如何确定这种协同作用、量化评价药物作用于多靶标所达成的终极治疗效应,仍是中药药理学研究中的难题。李梢课题组[45]提出的基于网络靶标的多成分协同作用识别法NIMS,将不同成分的靶标在疾病网络上的位置关系、与靶标对应的疾病谱的关系结合起来,确定存在协同作用的成分组合。赵静和张卫东课题组[46]在研究黄连解毒汤抗类风湿作用机制时,应用随机漫步算法,分别计算了类风湿关节炎的疾病基因和黄连解毒汤的靶标蛋白对全基因组网络中各蛋白的影响分,获得疾病影响向量和药物影响向量。
2.3.2 利用网络药理学开展中药的活性作用网络的技术
2.3.2.1 数据的获取和验证 网络药理学研究中与实验相关的环节有2个:一是基于实验结果构建网络所需基本数据的获取,二是对所建立的网络预测模型进行实验验证,这2个环节涉及的技术均应具有高通量、可定量、灵敏、快速、简便、可靠地获取大量数据的特点。目前,网络药理学研究所涉及的相关技术除了组学(基因组、蛋白质组、代谢组和元基因组等)技术外,主要包括高通量和高内涵技术、双高通量基因表达检测技术和分子相互作用技术[47]。高通量/高内涵技术是指在保持细胞、组织或整体动物结构和功能完整性的前提下,一次性检测成百上千个处理且同时检测被筛样品对活细胞、组织或整体动物多个表型的作用,具有均质、多维表型检测、实时动态监测和可视化的特点。双高通量基因表达检测技术是指应用具有检测样品高通量、检测目标基因高通量的双高通量技术,具有对所需基础数据和网络模型进行验证的作用。Fakhari等[48]在2002年提出的聚合酶链式反应(PCR)芯片技术,具有操作流程简单、定量结果无需后期验证、特异性强、灵敏度高及重复性好等特点。分子相互作用技术是指从网络药理学角度揭示药物作用原理,或对所构建的药物作用网络或预测模型进行验证,用来揭示药物分子与机体生物大分子之间的相互作用关系。主要包括3种技术:基于表面等离子共振的检测技术、基于生物膜层干涉的检测技术、纳米液相层析一质谱分析技术。这3种技术均具有高通量、高精度、无标记且实时检测的特点[49-51]。
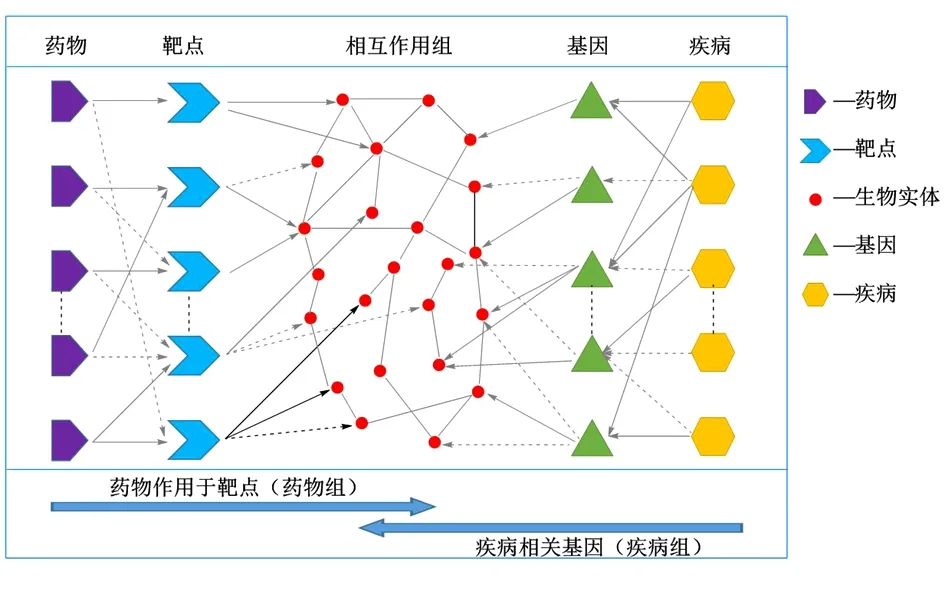
图6 网络药理学中的分子网络
2.3.2.2 网络可视化技术 同2.2.1项下利用系统毒理学开展中药的毒性作用网络的技术中的网络可视化技术。
2.3.2.3 网络分析技术 该技术是指采用相应技术对构建得到的网络进行分析,从中提取出有用信息。主要分为3类:1)网络拓扑学信息计算,可以得到网络本身的统计属性,反映网络中的隐藏信息;2)随机网络生成和比较,用来对现有网络进行可靠性验证;3)网络分层和聚类,简化网络复杂度的重要算法,也是寻找网络潜在信息的方法[52-54]。
2.3.2.4 网络药理学技术在中药研究中的应用 中医药的特色体现在中药复方对复杂疾病整体上的辨证论治。强调从整体把握病因、病机的传变规律及疾病的发展变化,同时方剂的配伍组方注重“君、臣、佐、使”,通过多味中药的协调配合实现对机体失衡紊乱状态的调节,这些理念充分体现了多成分、多靶点及系统调控的思想。借鉴并应用网络药理学技术和方法,通过挖掘网络中的关键节点和功能模块研发多分子、多靶点的复方制剂,有助于中医药整体和多途径系统调控的作用及其机制的研究。1)中药数据库的构建和应用:建立中药数据库是开展中药网络药理学研究的前提。Ye H等[55]通过文本挖掘技术结合严格的人工审核与注释,并从PubMed等海量文献中获取中草药有效成分蛋白靶点信息,建立了首个中草药有效成分蛋白靶点数据库(Herbal Ingredients′targets Database,HIT),该数据库提供了中草药一活性成分一蛋白靶点一站式综合信息,并且,提供了化合物结构式及蛋白序列相似性的分析平台。运用HIT发现中药成分经常作用于多个已知的西药靶点,而其药靶蛋白又具有明显的网络特征,如87%药靶参与的pathway不超过4条[56]。
LiS等[57]整合中医药数据库与基因芯片数据库,构建了具有全球网络特性的文献和基因芯片数据整合系统(LMMA),并运用LMMA重建血管生成网络。另外,疾病一药物数据库DrugBank和Therapeutic Target Database(TTD)等,也为我们研究中药成分的药物靶标等提供了研究工具[58-59]。2)中药靶点预测:中药靶点预测是通过网络药理学技术,虚拟筛选中药有效物质并发现其作用靶点,为发现中药及复方新的药理作用提供实验理论依据。吴氏等[60]根据1 401个美国FDA批准上市药物的分子结构及其相应靶点数据,采用随机森林法建立靶点预测模型,进而依据附子所含化学成分预测其作用靶点,并据此构建附子多成分一多靶点网络,研究发现附子的22个化学成分预测出多个作用靶点,预测结果得到文献数据印证,反映出中药“多成分、多靶点、多效应”的特点。朱氏等[61]对小柴胡汤中甘草酸、黄芩苷、柴胡皂苷A、人参皂苷Re等38种化学成分进行靶标预测和分析。研究表明,38种化学成分中有21种被发现有预测靶标,提示了小柴胡汤多效应的分子机制。张氏等[62]采用基因芯片检测的高通量组学数据,通过连通图(C Map)对扶正化瘀胶囊疗效的新药理作用进行了预测,发现扶正化瘀胶囊具有降血糖、降血脂和降血压的作用。3)中药网络药理学分析:为了分析中药及其复方复杂且多向的药理作用,朱氏等[63]运用分子对接和复杂网络分析技术研究调脾护心方所含化学成分和靶标之间的相互作用,结果发现,调脾护心方所含化学成分一靶标相互作用网络属于无尺度网络模型,网络的无尺度特性和网络节点的性质可以较好地阐释各化学成分的药理作用。郑氏等[64]利用生物网络特征参数,对透骨消痛胶囊中分子配体一靶作用网络和药物库中药物分子配体一靶作用网络对照研究透骨消痛胶囊的药理学机制,研究发现透骨消痛胶囊和药物分子配体一靶作用网络中存在“一对多、多对一”复杂的非线性调控模式,揭示了透骨消痛胶囊的多向药理学行为。4)中药文本挖掘的网络可视化:为了发掘文献信息,实现数据整合,发现中药新的功效,吴氏等运用网络药理学方法理念构建中药饮片网络,研究和诠释饮片的主治、功能与归经等属性间相互关系,以2010年版《中华人民共和国药典》所载646种中药饮片的相关信息,采用文本挖掘法将饮片主治信息梳理归类,以主治来关联各味饮片,建立饮片网络模型,再对网络进行分析和诠释。结果梳理归纳出3 016对饮片一主治关联,据此建立饮片网络[65]。5)中药多成分相互作用的网络药理学研究:为了发现中药多成分相互作用的方式和潜在药理作用,Yue QX等[66]研究发现,中药多成分协同机制主要以药效动力学为主,中药多成分同时作用于生物网络上的相同或不同靶点后,可以通过互补增强或拮抗抵消,网络交叉相互协调来产生整体增强效果。Li S等[67]将筛选具有协同作用复方制剂的网络靶标技术应用于传统中医药,并提出了以网络靶标为基础鉴别多成分协同作用(NlidS)的算法,运用NIMS算法发现中药成分汉防己碱能与木樨草素、槲皮素、厚朴酚、苦参碱和芍药苷5种成分产生增效协同作用。此外,Wu Z等[68]基于药物相互作用分子网络建立的多种药物作用预测方法也可以用于中药多成分相互作用的疗效预测研究。6)基于中医“病—证一效”结合的网络药理学研究:辨证论治是中医的特色所在,强调病证结合、方证合一。网络药理学整合了“疾病-表型-基因-药物”信息,建立了“疾病表型-生物分子”网络,能为具有中医特色的“病-证-效”结合治疗模式服务[69]。牛氏等[70]以热证类风湿性关节炎(RA)为切入点,通过构建、分析其对应的分子网络及药物靶标网络,运用定向文本挖掘等技术探讨“药-证对应”的机制,结果发现,RA热证的分子网络和对证中药靶点的分子网络所涉及的共同的生物学通路可能就是对证中药治疗RA热证“药-证对应”的分子生物学机制之一。
2.4 基于复杂网络系统研究乌头类中药毒-效整体作用规律 通过构建的“成分-靶点-活性”网络和“成分-靶点-毒性”网络的整合分析,系统阐述乌头类中药在临床上“治疗心力衰竭与心脏毒性”“治疗风湿痹痛与神经毒性”“治疗妊娠疾病与胚胎毒性”3个层面上的系统作用规律,揭示乌头类中药毒效整合作用的科学内涵。
3 开展有毒中药毒效网络整合分析的问题和展望
有毒中药的毒效网络研究已在方法与技术上取得了较大进展,这类研究正逐步围绕更多的有毒中药开展,并对中药的安全合理应用提供坚实的理论依据。在此基础上,进一步开展方法学研究,让基于有毒中药的毒效网络研究从“探索”走向“规范化”。此外,围绕有毒中药的有效性和安全性研究,应重视以下几个方面,以取得更大的研究进展。
3.1 重视有毒中药毒/药效物质基础和毒效相关性的研究 首先,毒性物质基础及其机制研究是有毒中药毒性研究的首要环节,也是基于有毒中药毒性成分开展中药创新药物研究的基础。有毒中药所含毒性成分的类型和含量决定毒性的大小,其使用剂量是决定有毒中药是否毒害人体的重要因素。每一种中药都有合理的使用剂量,有毒中药也是如此,所以要客观评价有毒中药毒性成分的毒性作用与治疗作用,充分认识有毒中药的毒性物质基础和药效物质基础,正确认识和充分了解含毒中药毒性成分的毒性作用机制,才能以此为依据采用化学、生物手段进行中药毒性成分的“存效减毒”或“增效减毒”。其次,中药及其复方在临床治疗中有着“多成分、多靶标”的优势,能多通路对疾病状态进行网络调控,而在有毒中药的运用中,也可能存在“多成分、多靶点”产生毒性反应的情况。因此,利用现代化学的提取、分离、纯化技术,分离出有毒中药的毒性成分,确定其化学结构,分别研究其毒/效作用机制,对于毒性成分和药效成分可通过分离手段一分为二的毒性中药,可以采取精简成分的方法达到“存效减毒”的目的;对于毒效同时存在的成分,可以此作为先导化合物进行结构修饰及构效关系研究,寻找创新药物,提高安全性和可控性。对于机制明确、靶点清楚的毒性成分,还可以借助现代计算机辅助药物设计手段进行创新药物设计,再结合不同的药理、毒理模型评价其有效性和安全性。最后,由于中药安全性事件的频发,当下对有毒中药的研究多集中在其毒性成分上,但之所以要对有毒中药进行研究,是因为其有良好药效。因此,只开展毒性物质基础及作用机制研究,一则容易让人误认为有毒中药只有毒性或毒性被放大而不敢应用,二则在应用中容易让人缺乏对其活性的认识和指导,用药安全性提高了反而活性得不到应有的保证。而在毒性/药效物质基础的研究基础上,开展毒效相关性研究,有利于确定毒性成分与活性成分的差异,为确定减毒保留药效的工艺或制定安全有效剂量范围的研究奠定基础。
3.2 重视中医药“整体观”科学理论对有毒中药研究的科学指导 随着生命科学的发展,很多疾病的分子机制得以阐明,基于这些机制的体外筛选方法或细胞系得以建立,特别是高通量筛选技术的推广应用,大大提高了围绕中药活性成结构修饰得到的新药先导化合物的筛选速度,但随之而来产生了过分重视或局限于体外筛选和计算机虚拟筛选的趋势,没有再从整体水平进一步证实其药理作用,所得到的研究结果难以保证其有效性[71]。基于中医“整体观”对于有毒中药药效物质代谢产物的研究有助于阐明中药活性成分的毒性机制和药理机制,如对乌头碱的代谢产物分析有利于认识其毒性发生机制及更好地利用其毒性与活性的双刃剑作用。一些在中药药效物质基础研究中具有很好临床疗效的中药活性成分,在科研工作中经常会出现提纯的化合物单体没有生物活性的问题,这说明这种单体可能需要体内转化激活才能具有生物活性;有些则是体外效果很好,但在被吸收之前就已被胃酸等破坏而失去作用。因此,在进行该活性成分衍生物的研究中,也应采用相应的生物转化过程进一步研究其药理活性和成药性。否则,基于中药的单体成分结构改造和构效关系研究的中药新药,与中药比没有特色,与化学药比更没有治疗优势,容易形成“中药单体成分开发热”的误区。对于普通中药成分来说,存在着有/无活性成分在进入体内代谢后的相互转化,而对于有毒中药毒效成分来说,也存在着药、毒效物质角色转换机制:毒效成分/药效成分进入体内代谢后可进行相互转化,如苦杏仁苷口服给药后在体内分解,产生为一种强烈的细胞毒性物质氢氰酸,可导致死亡。因此,在基于有毒中药毒效成分的新药研究时,也应该通过对有毒中药毒效成分衍生物在病理模型体内代谢的研究,清楚药物转化过程,分析代谢机制,全面、客观地进行临床前安全性评价,为临床上合理安全用药提供足够的理论依据,减少不必要的不良反应。
3.3 重视生理、病理模型在有毒中药研究中的应用 有毒中药药效与毒效成分之间存在着复杂的辨证关系,主要体现在以下几方面:1)生、病理状态对中药“毒性”反应存在差异:健康机体对药物的反应,在质或量上,往往与病理状态机体的反应不同;2)不同病理状态下药、毒效物质基础不同:有毒中药在临床上可治疗不同的病证,也可导致不同的中毒表现,其所含成分复杂是其原因之一,即在不同的病理状态下发挥药效(毒效)的成分可能不同;3)不同病理状态下药、毒效物质能发生角色转变:有毒中药的大多数成分并不是起单一作用的,药、毒效物质也会根据应用的状态不同而发生角色转换,应用于不同生理病理状态动物,特别是寒与热、虚与实之类互相对立的病理模型,可能显示完全不同的药物反应,如中药附子在用于寒证时发挥治疗作用,然而应用于热证时,则产生毒性作用;4)毒效成分成为药效成分发挥效应的辅佐:有毒中药的药效成分在发挥治疗作用时,一定毒效成分的存在可使其药用发挥更佳。基于有毒中药药效成分和毒性成分的辨证统一关系,提示在有毒中药研究的过程中也应该重视生理、病理以及不同病理状态下的药/毒理模型对毒效成分及其衍生物的反应。由于中药毒性成分具有毒效双重性的特点,其发挥效、毒作用存在生、病理状态的差异性,对毒性成分的评价也应建立起符合中医药特色的有毒中药的多项评价标准,这一评价体系既应体现对中药毒效成分的毒性控制,亦应注意到毒效成分药效的正常发挥。
4 结语
中药的毒性是客观存在的,但根据药物的毒性、机体的生理病理状态在临床上加以合理应用则能获得显著的疗效。如何通过有毒利用复杂生物网络研究中药网络药理学和系统毒理学,构建可靠的中药药效物质作用靶标相关的分子效应和毒性网络,反映特定疾病状态的相关生物实体的分子网络及毒性机制,整合效应物质作用靶标网络与疾病生物网络,通过网络拓扑学和动力学等方法分析“药物-靶点-疾病”网络和“药物-靶点-活性/毒性”网络中有效物质与疾病、成分与毒性的相互作用关系,检识出复杂网络模型中的靶点组合、通路组合、子网组合、药物组合等,并对预测的结果进行实验验证,是具有挑战性和原创性的基础研究工作,同时也为建立符合国际规范的有毒中药的安全评价模式开拓了新思路。
[1]彭成,王昌恩,林娜.有毒中药毒效相关性基础研究的意义与实践[J].中药药理与临床,2008,24(1):71-73.
[2]王先良,于云江,王红梅,等.毒理学发展的新方向——系统毒理学[J].环境与健康杂志,2007,24(6):456-458.
[3]李杰,李柯佳,张臣,彭邱鹏,唐赟.计算系统毒理学:形成、发展及应用[J].科学学报,2015,60(19):1751-1760.
[4]吴克红,唐力英,王祝举,徐义龙,周喜丹.附子的化学和生物活性研究进展[J].中国实验方剂学杂志,2014,20(2):212-220.
[5]夏烨,杨春华,刘静涵,等.乌头属药材特征成份二萜生物碱的电喷雾质谱研究进展[J].海峡药学,2009,21(3):1-5.
[6]李梦然,曲玮,梁敬钰.乌头属化学成分和药理作用研究进展[J].海峡药学,2010,22(4):1-6.
[7]Tang XC,Feng J.Analgesic actions and local anesthetic activity of 3-acetylaconitine hydrobromide(author′s transl)[J].Acta pharmacologica Sinica,1981,2(2):82-84.
[8]韦壁瑜,赵志远,朱任宏.中国乌头研究ⅩⅤⅢ——高乌头中的生物碱成分(一)[J].中药通报,1981,16(2):26-28.
[9]Tang X C,Liu X J,Lu W H,et al.Studies on the analgesic action and physical dependence of bullyaconitine A[J].1987,21(12):886-891.
[10]Chi Fei Wang,Peter Gerner,Birgitta Schmidt,et al.Use of Bulleya-conitine A as an Adjuvant for Prolonged Cutaneous Analgesia in the Rat[J].NIH Public Access Author Manuscript,2008,107(4):1397-1405.
[11]苏帆.高乌甲素的临床应用及研究进展[J].实用疼痛学杂志,2009,5(1):50-54.
[12]赵永堂.新乌头碱、乌头碱与次乌头碱在附子不同炮制法中含量变化的实验研究[J].中国医药导报,2012,9(14):27-28.
[13]Jutta Friese,Johannes Gleitz,Ulrike T.Gutser.Aconitum sp.1alkaloids:the modulation of voltage2 dependent Na+channels,toxicity andantinociceptive properties[J].European Journal of Pharmachology,1997,337(2-3):165-174.
[14]Bello-Ramírez AM,Buendía-Orozco J,Nava-Ocampo AA.A QSAR analysis to explain the analgesic properties of Aconitum alkaloids[J].Fundam Clin Pharmacol,2003,17(5):575-580.
[15]Jianlii Wang,Xiangli Shen,Qiaohong Chen,et al.Structure-Analgesic Activity Relationship Studies on the C18-and C19-Diterpenoid Alkaloids[J].Chem.Pharm.Bull,2009,57(8):801-807.
[16]Zhou H,Wong YF,Cai X,et al.Suppressive effects of JCICM-6,the extract of an anti-arthritic herbal formula,on the experimental inflammatory and nociceptive models in rodents[J].Biol Pharm Bull,2006,29(2):253-260.
[17]Tang XC,Lin ZG,Cai W,et al.Anti-inflammatory effect of 3-acetyla-conitine[J].Acta pharmacologica Sinica,1984,5(2):85-89.
[18]Shi H,Zhou C,Li Y,et al.Anti-inflammatory effect of aconitines[J].China Journal of Chinese Materia Medica,1990,15(3):174-177,192.
[19]Hikino H,Takata H,Fujiwara M,et al.Mechanism of inhibitory action of mesaconitine in acute inflammations[J].Eur J Pharmacol,1982,82(1-2):65-71.
[20]Hikino H,Konno C,Takata H,et al.Antiinflammatory principles of Aconitum roots[J].J Pharmacobiodyn,1980,3(10):514-525.
[21]Bello-Ramírez AM,Nava-Ocampo AA.The local anesthetic activity of Aconitum alkaloids can be explained by their structural properties:a QSAR analysis[J].Fundam Clin Pharmacol,2004,18(2):157-161.
[22]王宪楷,赵同芳,赖盛.中坝鹅掌叶附子的生物碱研究Ⅰ[J].中国药学杂志,1995,30(12):716-719.
[23]Bello-Ramírez AM,Nava-Ocampo AA.A QSAR analysis of toxicity of Aconitum alkaloids[J].Fundam Clin Pharmacol,2004,18(6):699-704.
[24]周远鹏,刘文化,曾贵元,等.乌头碱及其类似物的毒性和对心脏收缩功能的影响[J].药学学报,1984,19(9):641-646.
[25]俞昌喜,黄凌燕,唐希灿.滇乌碱及其类似物镇痛效应的构效关系[J].福建医学院学报,1996,30(1):10-12.
[26]刘建华,朱悦心,唐希灿.N-脱乙酰刺乌头碱和刺乌头碱的抗炎和镇痛作用[J].中国药理学报,1987,6(8):301-305.
[27]Turabekova MA,Rasulev BF,Dzhakhangirov FN,et al.Aconitum and Delphinium alkaloids of curare-like activity.QSAR analysis and molecular docking of alkaloids into AChBP[J].Eur J Med Chem,2010,45(9):3885-3894.
[28]洪波,仇永清.附子中双酯型乌头碱类成分水解减毒机制的密度泛函理论研究[J].分子科学学报,2008,24(3):216-219.
[29]唐慧英,韩玉梅,鄢丹,等.乌头类双酯型生物碱对嗜热四膜虫生长的毒性效应微量热学研究[J].化学学报,2010,68(3):205-210.
[30]Davis AP,Grondin CJ,Johnson RJ,et al.The Comparative Toxicogenomics Database:update 2017[J].Nucleic Acids Res,2017,45(D1):D972-D978.
[31]Wolfgang GH,Johnson DE.Web resources for drug toxicity[J].Toxicology,2002,173(1-2):67-74.
[32]吴磊宏,王毅,范骁辉.网络药理学技术工具:网络可视化及网络分析[J].中国中药杂志,2011,36(21):2923-2925.
[33]Davis AP,Murphy CG,Rosenstein MC,et al.The Comparative Toxicogenomics Database facilitates identification and understanding of chemical-gene-disease associations:arsenic as a case study[J].BMC Med Genomics,2008,1:48.
[34]Davis AP,Murphy CG,Saraceni-Richards CA,et al.Comparative Toxicogenomics Database:a knowledgebase and discovery tool for chemical-gene-disease networks[J].Nucleic Acids Res,2009,37(Database issue):D786-792.
[35]Davis AP,Murphy CG,Saraceni-Richards CA,et al.GeneComps and ChemComps:a new CTD metric to identify genes and chemicals with shared toxicogenomic profiles[J].Bioinformation,2009,4(4):173-174.
[36]Cheng F,Li W,Wu Z,et al.Prediction of polypharmacological profiles of drugs by the integration of chemical,side effect,and therapeutic space[J].J Chem Inf Model,2013,53(4):753-762.
[37]范骁辉,赵筱萍,金烨成,等.论建立网络毒理学及中药网络毒理学研究思路[J].中国中药杂志,2011,36(21):2920-2922.
[38]杨华春,杨致礼.海藻、甘遂反甘草的毒性实验[J].中国兽医杂志,1992,18(1):41.
[39]王为民.对乌头反贝母、瓜蒌、半夏的探讨[J].时珍国医国药,2004,15(3):183.
[40]卢希平,高鹏.不能和强心甙联用的中药作用分析[J].现代中西医结合杂志,2009,18(17):2096-2097.
[41]Reardon S.Project ranks billions of drug interactions[J].Nature,2013,503(7477):449-450.
[42]Zhang Y,Wang D,Tan S,et al.A systems biology-based investigation into the pharmacological mechanisms of wu tou tang acting on rheumatoid arthritis by integrating network analysis[J].Evid Based Complement Alternat Med,2013,2013:548498.
[43]Zhao S,Li S.Network-based relating pharmacological and genomic spaces for drug target identification[J].PLoS One,2010,5(7):e11764.
[44]Wu X,Jiang R,Zhang MQ,et al.Network-based global inference of human disease genes[J].Mol Syst Biol,2008,4:189.
[45]Li S,Zhang B,Zhang N.Network target for screening synergistic drug combinations with application to traditional Chinese medicine[J].BMC Syst Biol,2011,5 Suppl 1:S10.
[46]Fang H,Wang Y,Yang T,et al.Bioinformatics analysis for the antirheumatic effects of Huang-Lian-Jie-Du-Tang from a network perspective.Evid.Based.Complement[J].Alternat.Med.,2013,2013(9):245357.
[47]程肖蕊,周文霞,张永祥.网络药理学实验研究相关技术[J].中国药理学与毒理学杂志,2012,26(2):131-137.
[48]Fakhari FD,Dittmer DP.Charting latency transcripts in Kaposi′s sarcoma-associated herpesvirus by whole-genome real-time quantitative PCR[J].J Virol,2002,76(12):6213-6223.
[49]Guo X.Surface plasmon resonance based biosensor technique:a review[J].J Biophotonics,2012,5(7):483-501.
[50]Wartchow CA,Podlaski F,Li S,et al.Biosensor-based small molecule fragment screening with biolayer inerferometry[J].J Comput-aided Mol Desigh,2011,25(7):669-676.
[51]Hsieh Y,Korfmacher WA.Increasing speed and throughput when using HPLC-MS/MS systems for drug metabolism and pharmacokinetic screening[J].Curr Drug Metab,2006,7(5):479-489.
[52]Cagnolo L,Salvo A,Valladares G.Network topology:patterns and mechanisms in plant-herbivore and host-parasitoid food webs[J].J Anim Ecol,2011,80(2):342-351.
[53]Brinda KV,Vishveshwara S,Vishveshwara S.Random network behavior of protein structures[J].Mol Biosyst,2010,6(2):391-398.
[54]Hou L,Wang L,Berg A,et al.Comparison and evaluation of network clustering algorithms applied to genetic interaction networks[J].Front Biosci(Elite Ed),2012,4:2150-2161.
[55]Ye H,Ye L,Kang H,et al.HIT:linking herbal active ingredients to targets[J].Nucleic Acids Res,2011,39(Database issue):D1055-1059.
[56]Zheng CJ,Han LY,Yap CW,et al.Therapeutic targets:progress of their exploration and investigation of their characteristics[J].Pharmacol Rev,2006,58(2):259-279.
[57]Li S,Wu L,Zhang Z.Constructing biological networks through combined literature mining and microarray analysis:a LMMA approach[J].Bioinformatics,2006,22(17):2143-2150.
[58]Knox C,Law V,Jewison T,et al.Drug Bank 3.0:a comprehensive resource for ‘omics’ research on drugs[J].Nucleic acids research,2011,39(Database issue):D1035-D1041.
[59]Zhu F,Han B,Kumar P,et al.Update of TTD:Therapeutic Target Database[J].Nucleic Acids Res,2010,38(Database issue):D787-791.
[60]吴磊宏,高秀梅,王林丽,等.附子多成分作用靶点预测及网络药理学研究[J].中国中药杂志,2011,36(21):2907-2910.
[61]朱伟,姚丽梅.运用Metadrug软件预测小柴胡汤化学成分的分子靶标[J].上海中医药杂志,2011,45(01):79-82.
[62]Yu S,Guo Z,Guan Y,et al.Combining ZHENG Theory and High-Throughput Expression Data to Predict New Effects of Chinese Herbal Formulae[J].Evid Based Complement Alternat Med,2012,2012:986427.
[63]朱艳芳,徐志伟,敖海清,等.调脾护心方的计算机网络药理学研究[J].中药新药与临床药理,2012,23(1):25-29.
[64]郑春松,林珠灿,许惠风,等.透骨消痛胶囊治疗骨性关节炎的多向药理学研究[J].福建中医药大学学报,2011,21(1):43-47.
[65]吴磊宏,高秀梅,程翼宇,等.基于中医主治关联的中药饮片网络药理学研究[J].中国中药杂志,2011,36(21):2916-2919.
[66]Yue QX,Cao ZW,Guan SH,et al.Proteomics characterization of the cytotoxicity mechanism of ganoderic acid D and computer-automated estimation of the possible drug target network[J].Mol Cell Proteomics,2008,7(5):949-961.
[67]Li S,Zhang B,Zhang N.Network target for screening synergistic drug combinations with application to traditional Chinese medicine[J].BMC Syst Biol,2011,5 Suppl 1:S10.
[68]Wu Z,Zhao XM,Chen L.A systems biology approach to identify effective cocktail drugs[J].BMC Syst Biol,2010,4 Suppl 2:S7.
[69]刘平,季光,陈凯先.病证结合与中西医结合医学学科知识理论体系的构建[J].中国中西医结合杂志,2010,30(6):565-570.
[70]牛旭艳,李健,吕诚,等.类风湿性关节炎热证“药-证对应”机制的网络药理学研究[J].中国实验方剂学杂志,2012,18(8):299-303.
[71]戴均贵,鲁丹丹,崔亚君,等.桔梗悬浮培养对细胞天麻素的生物转化[J].药学学报,2001,36(12):942-943.
ThoughtandMethodologyofToxicity-efficacyNetworkIntegratedAnalysisofToxicAconitum
Han Bo, Huang Wei, Xie Xin, Peng Cheng
(CollegeofPharmacy,ChengduUniversityofTraditionalChineseMedicine;KeyLaboratoryofChineseHerbsStandardizationofMinistryofEducation;Co-constructKeyLaboratoryofSystematicResearch,DevelopmentandUtilizationofChineseMedicinalResources,Chengdu611137,China)
Efficacy and safety are not only the solid foundation of traditional Chinese medicine (TCM)′s heritage and development, but also the fundamental premise of TCM serving the health of people in the world. Therefore, integrated analyzing the material basis, action mechanism and toxicity-efficacy relationship of Chinese materia medica′s efficacy and safety through multidisciplinary, in addition to revealing the scientific connotation “There is no death, drugs should be removed after recover.”, are the key problems to be solved in the process Chinese materia medica becoming one of the most important industries in the international market. Studying systems pharmacology and systems toxicology by utilizing complex biological networks, constructing reliable molecular effect and toxicological property networks related to Chinese materia medica targets, reflecting molecular network and toxic mechanism of related biological entity under specific disease state, integrating effect material active target networks and disease biological networks, analyzing relationships between active substance and disease, components and toxicity in “drug-target-disease” networks and “drug-target-activity/toxicity” networks using network topology and dynamics methodology, identifying target combination, pathway combination, subnet combination, drug combination, have highly improved the researching efficiency of Chinese materia medica complex pharmacodynamic substances. Mainly based on studies of Aconitum by the author′s group, this article illustrated approach to and methodology of toxicity-activity networks integrated analysis research on toxic Chinese materia medica.
Toxic Chinese materia medica; Aconitum; Toxicity-efficacy networks; Systems toxicology; Network pharmacology
国家自然科学基金重点项目(81630101);国家发改委标准化项目(ZYBZH-C-SC-51);国家自然科学基金国家基础科学人才培养基金(J1310034);四川省中医药管理局“川产道地药材综合开发与区域发展”项目(2016ZY008)
韩波(1981.03—),男,博士,教授,博士研究生导师,研究方向:中药及活性先导化合物的筛选、制备与构效关系研究,E-mail:hanbo@cdutcm.edu.cn
彭成(1964.03—),男,博士,教授,博士研究生导师,研究方向:中药毒效的系统评价与整合研究,E-mail:pengchengchengdu@126.com
R285.1
A
10.3969/j.issn.1673-7202.2017.11.007
(2017-10-09收稿 责任编辑:王明)
