基于“毒-效整合分析思路”探讨有毒中药附子的物质基础
2017-12-20缪璐琳何育霖蒙春旺苏海国
熊 亮 彭 成 缪璐琳 何育霖 蒙春旺 苏海国
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
基于“毒-效整合分析思路”探讨有毒中药附子的物质基础
熊 亮 彭 成 缪璐琳 何育霖 蒙春旺 苏海国
(成都中医药大学药学院,中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都,611137)
中药的毒与效是客观存在的,尤其在药效显著的大毒中药中,毒和效既是矛盾的,又是统一的。毒与效的物质基础往往不是孤立的,而是相互影响和相互转化的。附子是著名的有毒中药,不仅药效显著,而且毒性明显,一直是研究热点。虽然目前已从附子中获得90余个化学成分,但附子起效和致毒的根本原因仍然有待进一步揭示。其问题的复杂性在于:附子的毒与效在不同条件下可以相互转化,例如附子既可以强心,也可以导致心脏毒性;既有镇痛效果,又会产生神经毒性。而且同一组分、成分在不同条件下,可能发挥完全不同的生物学效应。导致这种现象的原因包括剂量因素、模型因素、炮制因素、配伍因素、使用方法因素、代谢因素等。本文将结合课题组近年来对附子的研究结果以及文献报道,从附子化学成分、附子化学成分的药效和毒理、附子毒-效作用的转化方面进行毒-效整合分析,探讨附子的物质基础。
附子;物质基础;毒效整合分析;化学成分;毒-效转化
附子为毛茛科乌头属植物乌头(AconitumcarmichaeliiDebx.)子根的加工品,辛、甘,大热,有毒;具有回阳救逆,补火助阳,散寒止痛功效;用于亡阳虚脱,肢冷脉微,心、脾、肾阳不足,胸痹心痛,寒湿痹痛。附子作为回阳救逆第一要药,一直都是大家研究的热点。虽然毒性大,但疗效卓著,是临床常用的中药,历代本草和历版《中华人民共和国药典》都将其收录。附子中既存在药效成分,又存在毒性成分,但长期以来大家一致认可,附子的药效成分也是其毒性成分,而且它们随着成分转化、炮制加工、剂量变化、配伍使用会发生多种“毒—效”转化[1]。一般认为,附子中的双酯型二萜生物碱是附子毒性极强的特征性物质,可引起心脏急性毒性、神经毒性、生殖毒性等[2-3],但现代研究也表明,它们在低浓度条件下又可以发挥药效。附子的不同炮制方法和煎煮方式均可以达到减毒增效的作用,双酯型生物碱迅速水解,单酯型和无酯型生物碱则逐渐增加。此外,剂量的变化、配伍使用均会使附子呈现出不同的生物学效应。本文将结合本课题组近年来对附子的研究结果以及文献报道,从附子化学成分、附子化学成分的药效和毒理、附子毒-效作用的转化方面进行整合分析,探讨附子的物质基础。
1 附子的化学成分研究
生物碱是目前附子中研究最多的化学成分,也是附子中较为特征的成分,主要包括C19型二萜生物碱类、C20型二萜生物碱类、酰胺类、季铵盐类、阿朴啡类等[4]。目前,以C19型二萜生物碱数量最多,也一直被认为是附子的有效成分和毒性成分。《中华人民共和国药典》2015版规定了6种C19型二萜生物碱的检查和含量测定,分别为乌头碱、次乌头碱、新乌头碱、苯甲酰乌头原碱、苯甲酰次乌头碱和苯甲酰新乌头碱。本文将结合本课题组研究及文献报道对附子化学成分进行介绍。
1.1 C19型二萜生物碱 附子中的C19型二萜生物碱多以乌头碱(aconitine)骨架为主,在C1、C6、C8、C14、C16、C18位通常有含氧基团取代,取代基以羟基和甲氧基为主,少数时候有羰基、亚甲二氧基、环氧醚基等。其中C-8和C-14的羟基多与乙酸或苯甲酸成酯,根据酯键的多少又可进一步将乌头碱型生物碱为无酯型、单酯型、双酯型3种,现代药理研究表明,其酯键的数量与化合物毒性密切相关,双酯型乌头碱的毒性最强,而无酯型乌头碱的毒性较弱。目前共从附子中分离得到C19型二萜生物碱50个(见表1)。
目前从附子中分离得到了16个无酯型C19二萜生物碱(图1,1-16),所有化合物的C-1均被含氧基团取代,且均为α型;C-16均被β型的甲氧基或羟基取代;C-6通常被α型含氧基团取代。化合物13-16为我国学者石建功从附子中首次发现的二萜生物碱阿拉伯糖苷类,在此之前,尚未报道附子中含有二萜生物碱苷[21]。
相对于无酯型和双酯型,附子中单酯型生物碱的报道较多。目前,已报道的附子单酯型C19二萜生物碱约20个(图2,17-36),此类生物碱14α-OH均被酯化,多数情况下为苯甲酰基(Bz),少数为乙酰基(Ac)(17,21,36)或桂皮酰基(Cn)(20)。相反,8β-OH均未被酯化,部分化合物以8β-O-醚的形式存在,如8β-OMe(23,26,27,31,32,34,35)和8β-OEt(24)。此外,在C-1、C-3、C-6、C-10、C-13、C-15、C-16和C-18通常取代含氧基团(OH或OMe),且空间构型分别为1α,3α,6α,10β,13β,15α和16β。其中以C-1、C-16和C-18的含氧取代最常见,所有化合物均含有1α-OH(OMe)和16β-OMe。除化合物17和36以外,其他化合物均在C-18位取代OMe。

图1 从附子中获得的无酯型C19二萜生物碱成分

图2 从附子中获得的单酯型C19二萜生物碱成分
双酯型二萜生物碱为常见有机酸与8β-OH和14α-OH同时酯化形成,毒性比非酯型和单酯型大很多。表1和图3归纳了近些年来从附子中发现的双酯型C19二萜生物碱。C-14位的酯键绝大多数为苯甲酸酯(OBz),少数为茴香酸酯(OAs),如37。
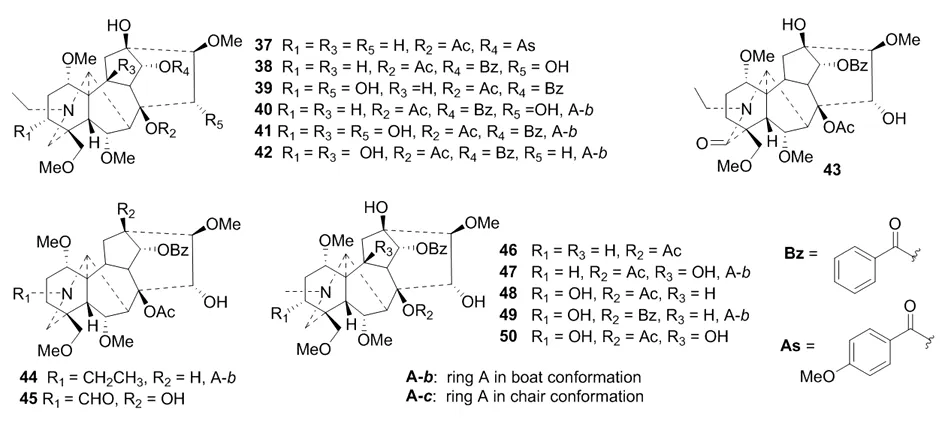
图3 从附子中获得的双酯型C19二萜生物碱成分
母核中其他位置的取代与单酯型相似,也是在C-1、C-3、C-6、C-10、C-13、C-15、C-16和C-18位取代含氧基。但目前获得的双酯型C19二萜生物碱中,C-1和C-6均被α-OMe取代,无OH取代类型;C-16均被β-OMe取代;C-18均被OMe取代。其中,乌头碱(aconitine,39)、次乌头碱(hypaconitine,46)和新乌头碱(中乌头碱,mesaconitine,48)是附子中含量较大的代表性二萜生物碱。

表1 附子中的C19型二萜生物碱
1.2 C20型二萜生物碱 C20二萜生物碱的骨架类型复杂多样,属于较原始的二萜生物碱类型,主要分为八类:阿替生型(Atisines)、光翠雀碱型(Denudatines),海替定型(Hetidines)、海替生型(Hetisines)、维特钦型(Veatchines)、纳哌啉型(Napellines)、阿诺特啉型(Anopterines)和Arcutine型。近年来从附子中发现的C20型二萜生物碱见表2和图4,其中化合物51和52为阿替生型,N原子上均有乙基取代,C-15和C-17均被含氧基团取代。化合物53为罕见的Arcutine型生物碱,由于分离纯化过程中使用了氨水和三氟乙酸,故分离得到化合物53的氢氧化物和三氟乙酸盐[18]。化合物54-58为海替生型,在54和55结构中,N原子上无甲基或乙基取代,而在56-58结构中,N原子上取代甲基,以季铵盐的形式存在。此外,C-2上连接丙酰氧基或异丁酰氧基,C-13上取代2-甲基丁酰氧基,这些含氧取代基在以往的乌头属植物中还未见报道。除以上阿替生型和海替生型以外,从附子中还发现了Napelline型、Lycoctine型和Arcutine型,其中宋果灵(59,songorine)在很多乌头属植物中均有报道。化合物60-62以季铵盐的形式存在,其阴离子的引入也与实验过程中使用盐酸和三氟乙酸有关。

表2 附子中的C20型二萜生物碱

图4 从附子中获得的C20二萜生物碱成分

序号名称化学式参考文献64uracilC4H4N2O2[17]656-hydroxymethyl-3-pyridinolC7H9NO2[21]66adenosineC10H13N5O4[22]675-hydroxymethyl-pyrrole-2-carbaldehydeC6H7NO2[11]68aconicaramideC11H14N2O3[11]69oleraceinEC12H13NO3[11]70N-(2'-β-D-glucopyranosyl-5'-hydroxysali-cyl)-4-hydroxy-3-methoxyanthranilicacidmethylesterC22H25NO12[22]71N-(2'-β-D-glucopyranosyl-5'-hydroxysali-cyl)-4-hydroxyanthranilicacidmethylesterC21H23NO11[22]72aconicarmiquinamideAC21H25N3O6[23]73aconicarmiquinamideBC19H21N3O6[23]74(2S,3S,4R,8E)-2-[(2'R)-2'-hydroxy-lignoceroylamino]-8(E)-octadecene-1,3,4-triolC42H83NO5[24]
1.3 非二萜生物碱 相对于二萜生物碱而言,其他类生物碱的研究较少,目前仅从附子中报道了11个非二萜生物碱,主要包括嘧啶、吡啶、腺苷、吡咯和酰胺类(表3和图5)。

图5 从附子中获得的非二萜生物碱成分
1.4 其他化合物 目前已报道的附子化学成分研究主要为生物碱类,非生物碱较少。迄今为止,从附子中获得22个非生物碱成分(表4和图6),主要类型为黄酮类(76-79)和芳香酸类(80-93)。

表4 附子中的非生物碱成分

图6 从附子中获得的其他成分
2 附子化学成分的药效学研究
目前对于附子化学成分的药效研究,主要集中于心血管系统和神经系统,所研究的对象多为生物碱类化合物。其中强心和镇痛研究最多,这与附子的传统功效密切相关,在一定程度上反映出附子的药效物质基础,表5列出了近年来附子化学成分药效学研究的主要结果。
2.1 对心血管的作用 附子为“回阳救逆第一品”,有显著强心作用,已在不同的动物模型上得到证实,如鼠、兔、蟾蜍、猫以及狗等。目前发现的附子强心成分既包括水溶性成分,也包括脂溶性成分。日本学者首次从附子中分离得到去甲乌药碱[27],此后多位学者均发现其具有显著的强心作用,认为去甲乌药碱为附子中的强心成分,可浓度依赖性增强心肌收缩力(±dp/dt)和最大收缩舒张速率(ph/bl),起效浓度为0.1 μM,EC50约为0.205 μM[28]。此外,有学者研究表明:从附子水提液中分离得到的尿嘧啶同样具有强心作用,可加强蟾蜍离体心脏的心肌收缩,且不影响心率[17,31]。水溶性成分附子苷也可使豚鼠离体心脏的LVSP、±dp/dtmax明显增加,且不影响心率,表明附子苷可导致心肌收缩能力增加,产生正性肌力效应[31]。氯化棍掌碱可通过增加豚鼠右心房收缩振幅与速率产生强心作用[32]。去甲猪毛菜碱除强心作用以外,因其为弱β-肾上腺素兴奋剂还具有一定的升压作用[33]。除了部分水溶性成分具有强心作用以外,一些脂溶性乌头碱类也表现出明显的强心作用,其中研究最多的当属乌头碱:乌头碱对H2O2构建的心力衰竭模型有明显强心作用,其最佳量-时-效组合为50 μM的乌头碱作用于心力衰竭模型0.5 h[34];乌头碱还可增加离体蛙心平均振幅增长率表现出一定的强心作用[35]。Liu XX等[9]从附子中分离得到5个生物碱,其中新乌头原碱、次乌头原碱、北乌宁对离体蛙心均有明显的强心作用。此外,异塔拉定、乌头原碱、3-去氧乌头原碱对离体蛙心也表现出一定的强心作用[9,35]。
除了强心作用以外,一些附子生物碱还具有保护心肌细胞的作用。本课题组从附子中分离得到的附子灵、尼奥灵对戊巴比妥造成的心肌细胞损伤具有保护作用,提高细胞生存能力[11]。具强心作用的去甲乌药碱还可选择性激活β2肾上腺素受体激动剂抑制心肌细胞凋亡,防止缺血再灌注损伤。其抗凋亡作用是通过PI3K介导,激活p-AKT,下调caspase3、9凋亡蛋白表达产生效应。这些发现表明去甲乌药碱抗凋亡作用和心肌保护作用是通过β2-AR/PI3K/AKT通路介导产生效应[29]。此外,去甲乌药碱还具有抗血小板聚集的作用[30]。
2.2 对神经系统的作用 附子化学成分对神经系统的作用主要表现为神经细胞保护和镇痛。从附子水提取物分离得到的3个新C19乌头碱型二萜生物碱(-)-(A-b)-14α-benzoyloxy-N-ethyl-3α,8β,13β,15α-tetrahydroxy-1α,6α,16β,18-tetramethoxyaconitane、(-)-(A-b)-8β,14α-dibenzoyloxy-N-ethyl-3α,13β,15α-trihydroxy-1α,6α,16β,18-tetramethoxyaconitane、(-)-(A-b)-14α-benzoyloxy-N-ethyl-6α,15α-dihydroxy-1α,8β,16β,18-tetramethoxyaconitane对无血清培养诱导的PC12损伤均具有保护作用,10 μM药物作用于细胞时可将细胞活力分别从(55.1±4.2)%提升至(79.8±5.7)%、(74.7±4.6)%和(75.8±7.6)%[12]。Dimethyl(-)-(R)-eucomate对氧糖剥夺复糖诱导SK-N-SH神经母细胞瘤细胞损伤具有保护作用,与空白组比较,可使细胞活力提升(39.96±4.63)%。阿魏酸甲酯对左旋谷氨酸诱导SK-N-SH神经母细胞瘤细胞损伤具有保护作用,与空白组比较,可使细胞活力提升(14.03±4.50)%。linocinnamarin对左旋谷氨酸诱导SK-N-SH神经母细胞瘤细胞损伤具有保护作用,与空白组比较,可使细胞活力提升(11.17±3.48)%[25]。
在镇痛方面,附子中多个乌头碱型生物碱具有明显的作用,这可能与附子治疗风湿痹痛有关。现代药理实验证明乌头碱、新乌头碱、次乌头碱、去氧乌头碱、guiwuline等均具有较强的镇痛活性,但因其毒性大、安全性小,临床应用受到限制。其中,乌头碱经皮给药时,单次给药出现一定的皮肤急性毒性,但随着用药次数增加,毒性反应出现“反转现象”,作用强度随着用药量的增加而加强,累计外用出现良好的镇痛作用[36]。次乌头碱和新乌头碱可减少老鼠抽搐次数,增加疼痛反应潜伏时间[37]。去氧乌头碱可介导κ阿片受体增强利多卡因对家兔硬膜外的镇痛效果[39]。Guiwuline在小鼠模型上具有明显镇痛作用,其ED50值为15 mg/kg[40]。

表5 附子化学成分的药效作用

表6 附子化学成分的毒性
2.3 对免疫系统和新陈代谢的影响 附子对心血管系统和神经系统的药效是目前附子研究的主要方向,但除此之外,也有大量报道表明附子还具有其他多种作用,如对免疫系统的影响、调节新陈代谢等作用。
1997年,马建等[41]研究乌头碱对正常小鼠和皮质酮所致的阳虚模型小鼠腹腔巨噬细胞在干扰素诱导情况下表面Ia抗原表达的改变,结果发现:乌头碱能提高正常小鼠和皮质酮免疫抑制阳虚模型小鼠M Ia抗原的表达,从而增强M递呈抗原能力,促进免疫应答反应。此外,从附子中分离得到的水溶性附子多糖FPS-1,可明显刺激伴刀豆球蛋白A和脂多糖造模后小鼠的淋巴细胞增殖,并促进脾细胞产生抗体,具有免疫促进作用[42]。
早期日本学者Hikino H[43]等发现生附子和炮附子的甲醇提取物可刺激小鼠肺对氨基酸的摄入,活性追踪实验发现:从中分离得到的新乌头碱具有最强的活性,这种作用可被放线菌素D拮抗,并且新乌头碱可以增加肺部蛋白质合成同时降低肾部蛋白质合成。Konno C[44]等从附子中分离出的附子多糖aconitans A、B、C、D能明显降低正常小鼠和高血糖模型小鼠的血糖水平,其中aconitan A不影响血液和细胞胰岛素水平以及己糖激酶、葡糖激酶、葡萄糖-6-磷酸酶、葡萄糖-6-磷酸脱氢酶的活性,而是刺激磷酸果糖激酶的活性[11]。
2.4 其他作用 从附子乙醇提取物中分离得到的oleracein E表现出一定的抗菌作用[11]。附子多糖FPS-1可增加小鼠齿状回区的新生细胞、提高海马区的BDNF水平,具抗抑郁作用,且这种抗抑郁和细胞增生作用可被K252a阻断[46]。去甲乌药碱和氯化棍掌碱还可影响乙酰胆碱的释放[47]。
3 附子化学成分的毒性研究
附子中的双酯型生物碱一直被认为是附子中的毒性物质,而单酯型和无酯型生物碱的毒性较弱,因此,附子的毒性物质基础研究多集中于双酯型生物碱成分,主要包括乌头碱、次乌头碱、新乌头碱(见表6)。
目前毒性报道最多的为乌头碱,其毒性主要作用于中枢神经系统、心脏和肌肉组织[61]。其中研究较为深入的为心脏毒性,3%乌头碱作用于心肌细胞30 s至30 min,随着时间增长,细胞收缩,胞体变小,细胞质间隙增大,细胞膜破裂,细胞内Na+和Ca2+含量显著升高,而K+和Mg2+含量显著降低,Na+-K+-ATP酶活力有明显的抑制,同时兴奋心肌α1受体,使其发生自发性收缩导致心律失常。因此,乌头碱引起心肌细胞损伤的机制为:乌头碱抑制心肌细胞膜上Na+-K+-ATP酶活性,导致细胞内Na+浓度增高和K+浓度降低,细胞Na+-Ca2+交换增加导致细胞内Ca2+增高,Ca2+增高可导致呼吸链中断、能量消耗增加,导致无氧代谢的增加,氧自由基增加,使生物膜上的不饱和脂肪酸发生脂质过氧化,膜脂质过氧化MDA的增加和生物膜稳定性遭到破坏,导致细胞器的变性,细胞核的损伤,细胞形态和功能损伤[49-50]。与其类似地,次乌头碱、新乌头碱、去甲乌药碱均报道有心脏毒性。李志勇等[59]发现30~120 mmol/L次乌头碱溶液能引起显著的心脏毒性,表现为LDH(乳酸脱氢酶)漏出率上升、心肌细胞搏动频率骤降及细胞膜受损甚至死亡等。韩旭等[50]对新乌头碱研究发现,其在3×10-8mol/L浓度下即可使离体豚鼠乳头肌的动作电位的形状发生“三角形”畸变兼伴有自发性动作电位,缩短动作电位时程,使其发生自发性收缩,出现心律失常。去甲乌药碱高于1 μmol/L时,对心肌细胞即产生毒性,表现为心肌细胞不节律收缩[28]。
除心脏毒性外,乌头碱还对神经系统和消化系统等产生毒性。大鼠大脑皮质神经元细胞在2%乌头碱浓度下,作用30 s细胞活力即明显降低,20 min细胞基本死亡,神经细胞内出现大量空洞和溶酶体,染色质被破坏,线粒体肿胀扩张,细胞内糖原含量下降,乙酰胆碱、儿茶酚胺、阿片肽、P物质显著增加。乌头碱对神经细胞造成毒性的机制可能与心脏毒性机制相似,通过抑制Na+-K+-ATP酶活性,引起细胞的离子通道门控系统、生物电位的改变和细胞内Ca2+超载,最终导致细胞形态和功能的损伤以及相关神经递质释放的改变,从而在动物体内表现为各种神经系统症状[51]。
小鼠结肠Cajal细胞实验发现,0.1%乌头碱作用细胞30 min,细胞间连接完全断裂,180 min时已观察不到完整细胞,细胞内MDA含量显著升高,Na+、K+、Ca2+、糖原含量降低,Na+-K+-ATP酶活性受到抑制,显示出明显毒性作用[51]。另有研究表明,高浓度乌头碱还具有明显的生殖毒性,可抑制大鼠睾丸支持细胞增殖,降低其对乳酸分泌的刺激作用[52],浓度5×102ng/mL以上的乌头碱溶液可抑制黄体细胞的增殖及激素的分泌[54]。刘强强[53]等在此基础上进一步研究发现乌头碱对雌性大鼠卵巢颗粒细胞也有抑制增殖及氧化损伤的毒性作用,其生殖毒性可能与大鼠体内孕酮、黄体生成素、卵泡刺激素、雌二醇等性激素含量降低有关。
此外,乌头碱对胚胎也有一定毒性。大鼠全胚胎培养技术研究表明,乌头碱对器官发生期胚胎有直接的胚胎毒性,延缓胚胎分化和导致神经、心脏等发育畸形,最低毒性浓度为11 μg/mL[55]。乌头碱在1.46 mg/kg浓度下还表现出肝脏及肾脏毒性[56-57]。Sun Bo运用代谢组学的方法,给予大鼠单剂量乌头碱、新乌头碱、次乌头碱后,分析体内代谢变化,结果显示肾小管功能在给药24 h内收到较大干扰,体内激素水平明显变化。乌头碱的影响比新乌头碱和次乌头碱组影响大,GC/TOF-MS分析显示前两者的毒性机制可能不同[58]。
4 附子毒-效成分的转化和整合分析
从以上总结和分析可知,目前对附子研究最多的为生物碱类,其中双酯型生物碱多报道为毒性,单酯型和无酯型生物碱、水溶性成分多报道为生物活性。但不难发现,即使是以乌头碱、次乌头碱、新乌头碱为代表的毒性成分,在一定条件下也表现出良好的活性,且这些成分之间,还会随着药材炮制、煎煮方式、配伍使用而发生转化。
4.1 剂量引起的毒-效转化 以往大量研究表明附子水提物具有明显的强心作用,可增强大鼠离体心脏的心输出量和心肌收缩力且表现出量-效关系,但加大用量便会出现心肌收缩力量不足,心输出量减少的不良反应,表现出量-毒关系[62]。比较分析附子单体化合物的作用,可以发现乌头碱既有明显的强心活性,又可产生显著的心脏毒性。温善姗等[34]发现乌头碱对心力衰竭细胞起强心作用的最佳量-效组合为50 μmol/L,而3%的乌头碱溶液对大鼠心肌细胞内线粒体、膜、溶酶体、肌纤维膜等均有毒性[51]。此外,乌头碱经皮给药时,单次给药出现一定的皮肤急性毒性,但随着用药次数增加,毒性反应出现“反转现象”,作用强度随着用药量的增加而加强,累计外用出现良好的镇痛作用[36]。
同样,次乌头碱及新乌头碱在小鼠口服给药5.8、1.8 mg/kg时出现半数死亡[48],但剂量降低至0.0063 mg/kg可减少老鼠抽搐次数,增加疼痛反应潜伏时间,表现出显著的镇痛作用[37],新乌头碱在0.16 mg/kg剂量下还可抑制角叉菜诱导的大鼠足肿模型肿胀,表现出明显抗炎作用[38]。以上说明,用药剂量是附子毒与效转化的关键点之一。
4.2 炮制引起的毒-效转化 附子是传统大毒中药,历代均很重视其炮制方法。在传统炮制的基础上,有关附子的炮制方法得到了很大发展,使得其炮制品达十种以上。附子在现代临床多用其炮制品而不用生品,亦是从用药安全性考虑。本课题组研究发现:相对于生附子而言,各种炮制品(黑顺片、白附片、盐附子、卦附片、熟附片、淡附片、黄附子、刨附片)的酯型生物碱和双酯型生物碱(新乌头碱、乌头碱和次乌头碱)含量均有不同程度的降低(见表7),提示炮制可以促进附子毒性物质乌头碱等酯型生物碱的转化[63]。
4.3 配伍引起的毒-效转化 本课题组从饮片配伍、组分配伍、成分配伍3个层次,以化学物质和生物学评价共同探讨附子配伍减毒增效的科学内涵,并筛选出附子配伍干姜治疗阳虚心力衰竭[64]、附子大黄配伍治疗阳虚便秘[65]、附子甘草配伍治疗抗心律失常[66]的最佳配伍和组分,揭示其配伍增效和减毒的作用机制。附子配伍干姜[67]、附子配伍大黄[65]、附子配伍甘草[68]、附子配伍人参[69]、附子配伍白芍[70]后,均能使其毒性成分双酯型生物碱的含量降低,促进毒性物质的转化,生物活性增强,起到增效解毒的作用。具体情况表现如下:

表7 不同炮制品中总生物碱、酯型生物碱以及双酯型生物碱的含量
附子配伍干姜后,总生物碱和酯型生物碱的溶出度增加,而双酯型生物碱即有毒组分的溶出度降低,对于心力衰竭动物模型,附子干姜配伍后能明显增强其治疗作用而降低毒性。大黄配伍附子后,酯型生物碱含量呈现不同的变化,其中有毒成分3种双酯型生物碱溶出度2~6 h较配伍前明显减少。生附子、白附片、黑顺片配伍甘草共煎后,总生物碱含量明显升高,而酯型生物碱、双酯型生物碱含量下降明显。人参附子药对配伍应用时双酯型二萜生物碱的含量明显降低,而单酯型二萜生物碱的含量明显升高。因此,可以看出,通过配伍可以使毒性成分降低,而其他有效成分增加,起到毒-效转化的作用。
4.4 使用方法引起的毒-效转化 附子在传统应用中,要求“久煎”以控制毒性。本项目组研究发现,生附子、黑顺片和白附子的总生物碱、酯型生物碱和双酯型生物碱含量均在煎煮0~6 h内呈先升高后降低的趋势:生附子总生物碱在煎煮2 h时溶出量最大,黑顺片和白附片总生物碱在1 h达到最高峰;且3种饮片的酯型生物碱含量均在煎煮2 h时达到最大,而乌头碱、次乌头碱溶出率均在煎煮2 h、1 h时达到最高,随后呈下降趋势[71]。因此,煎煮时间对附子毒-效转化有重要的影响。
项目组进一步研究表明:附子在煎煮时间、给药剂量和毒效变化的三因素之间存在密切的关系,是联合控毒的重要手段,并首次将均匀设计理论用于中药安全性评价研究中。项目组观察了不同附子煎煮时间水煎液(15 min、30 min、1 h、2 h、3 h、4 h、6 h)对疼痛、炎性反应、脾阳虚证和肾阳虚证动物模型的急性毒性和药理作用。结果显示附子15 min~4 h水煎液对各种模型均有明显的急性毒性作用。在煎煮6 h时,毒性较低的情况下,仍保留了较好的药理作用,能延长热板法小鼠痛阈值,延长冰醋酸致痛小鼠扭体反应出现的时间和减少扭体次数,降低二甲苯所致小鼠耳郭肿胀程度,降低巴豆油致肉芽肿,增加脾阳虚证和肾阳虚证小鼠的体重和升高体温,延长肾阳虚小鼠游泳时间等。在抗炎镇痛作用中,发现15 min和30 min水煎液作用最强,但同时毒性也太大[72-73]。此外,秦永刚等[74]采用离体蛙心实验,对不同蒸煮时间的附子进行了强心作用及心脏毒性的观察,发现附子蒸煮8 h、10 h、12 h具有强的正性肌力作用,且心脏毒性显著减低。以上表明:不同的煎煮方法是促进附子毒-效转化的重要手段。
4.5 代谢引起的毒-效转化 药物代谢可影响药物作用的强弱和持续时间的长短,还会影响药物治疗的安全性。研究发现,大鼠尾静脉给药0.6 μg/kg乌头碱、新乌头碱、次乌头碱后,大鼠体内不仅检测到了乌头碱、新乌头碱、次乌头碱,在水解酶的作用下,还检测到了苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱、乌头原碱、新乌头原碱,表明毒性很大的双酯型生物碱在体内可被代谢为毒性较低的单酯型生物碱和无酯型生物碱,并且双酯型生物碱在体内的消除比其代谢产物苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱、乌头原碱、新乌头原碱快2.6-7.5倍,即毒性越大的乌头碱类生物碱被机体消除的速率越快[75]。另有研究表明,在大鼠肝微粒体的作用下,乌头碱比苯甲酰乌头原碱、乌头原碱更易代谢。通过组织分布实验发现这3种生物碱在所有器官中均有分布,但乌头碱的分布区域最小[76]。此外,与其他药物配伍使用也可影响附子生物碱的代谢过程。例如,在中国以及其他亚洲国家,绿豆是一种传统的解毒药,乌头碱与500 μg/kg的绿豆提取物合用后,可将乌头碱Cmax、AUC0→t和AUC0→∞减少1.5倍。通过机制研究发现,绿豆降低乌头碱急性毒性的机制是阻止乌头碱在肠的吸收[77]。
5 结语
附子作为疗效显著的大毒中药,历来是人们关注和研究的热点,在过去的100年间,人们对附子开展了大量的研究,以期揭开其神秘的面纱,明晰其治病和致毒的根本原因,但现在看来,仍然任重而道远。在化学成分研究方面,近年来取得了很大的进展,共从附子(the lateral roots ofAconitumcarmichaelii)中获得90余个化合物(不含川乌),但大部分化学成分研究集中于附子脂溶性成分,对传统应用的附子水煎液研究较少;大部分研究集中于生物碱类,对其他成分的深入研究较少;大部分针对附子生物碱的研究多集中于二萜生物碱类,对其他生物碱的研究较少;后续的活性筛选、药效研究和毒理研究不足。因此,附子毒-效作用的本质仍然迷雾重重,这可能需要我们换一种方式去理解有毒中药的整体情况,在现有条件和背景下,采用整合分析的方式去探讨毒-效相互转化和辨证统一的关系。
中药的毒与效是客观存在的,尤其在疗效显著的大毒中药中,毒和效既是矛盾的,又是统一的。同一组分、成分在不同条件下,可能发挥完全不同的生物学效应,也可能向不同的成分转变,实现毒与效的转化。这种不同条件可以是最常见的化学因素、也可以是剂量因素、模型因素、炮制因素、配伍因素、使用方法因素、代谢因素等,这与中医药的传统思想是完全吻合的。附子既可以强心,也可以导致心脏毒性;既有镇痛效果,又会产生神经毒性。因此,毒效整合分析思路打开了了解附子物质基础的另一扇窗户,也为认识其他有毒中药提供了一种方式,但是仍然有大量的基础工作亟待开展,以形成一个相对完整的毒-效转化网络。
[1]周远鹏.附子研究的回顾和思考——生附子去毒和心血管活性部位或成分的研究(三)[J].中药药理与临床,2014,30(4):131-134.
[2]谢晓芳.附子心脏毒作用机制研究[D].成都:成都中医药大学,2012.
[3]彭成.有毒中药附子川乌草乌的安全性评价与应用[M].成都:四川科学技术出版社,2014:143-158.
[4]吴克红,唐力英,王祝举,等.附子的化学和生物活性研究进展[J].中国实验方剂学杂志,2014,20(2):212-220.
[5]Shen Y,Zuo AX,Jiang ZY,et al.Two new C20-diterpenoid alkaloids form Aconitum carmichaelii[J].Helv Chim Acta,2011,9(1):122-126.
[6]Konno C,Shirasaka M,Hikino H.Structure of senbusine A,B and C,diterpenie alkaloids of Aconitum carmichaeli roots from China[J].J Nat Prod,1982,45(2):128-133.
[7]Gao F,Li YY,Wang D,et al.Diterpenoid alkaloids from the Chinese traditional herbal “Fuzi” and their cytotoxic activity[J].Molecules,2012,17(5):5187-5194.
[8]陈洪超,王宪楷,赵同芳,等.中坝鹅掌叶附子中的生物碱成分[J].天然产物研究与开发,2003,15(4):324-325,340.
[9]Liu XX,Jian XX,Cai XF,et al.Cardioactive C19-diterpenoid alkaloids from the lateral roots of Aconitum carmichaeli “Fu Zi”[J].Chem Pharm Bull(Tokyo),2012,60(1):144-149.
[10]Meng XH,Guo QL,Zhu CG,et al.Unprecedented C19-diterpenoid alkaloid glycosides from an aqueous extract of “fu zi”:Neoline 14-O-L-arabinosides with four isomeric L-anabinosyls[J].Chin Chem Lett,2017,28(8):1705-1710.
[11]Xiong L,Peng C,Xie XF,et al.Alkaloids isolated from the lateral root of Aconitum carmichaelii[J].Molecules,2012,17(8):9939-9946.
[12]Jiang B,Lin S,Zhu C,et al.Diterpenoid alkaloids from the lateral root of Aconitum carmichaelii[J].J Nat Prod,2012,75(6):1145-1159.
[13]张卫东,韩公羽,梁华清.四川江油附子生物碱成分的研究[J].药学学报,1992,27(9):670-673.
[14]Hikino H,Kuroiwa Y,Konno C.Structure of hokbusine A and B,diterpenic alkaloids of Aconitum carmichaeli roots from Japan[J].J Nat Prod,1983,46(2):178-182.
[15]Hang GY,Cai P,Wang JZ,et al.Correction of the spectroscopic data of hokbusine A:confirmation of the C-8 methoxyl group[J].J Nat Prod,1988,51(2):364-366.
[16]Wang XK,Zhao TF,Lai S.A new N-formyl C19-diterpenoid alkaloid,aldohypaconitine,from cultivated Aconitum carmichaeli Debx[J].Chin Chem Lett,1994,5(8):671-672.
[17]韩公羽,梁华清,张卫东,等.四川江油附子生物碱和新的强心成分研究[J].天然产物研究与开发,1997,9(3):30-34.
[18]Meng XH,Jiang ZB,Guo QL,et al.A minor arcutine-type C20-diterpenoid alkaloid iminium constituent of“fu zi”[J].Chin Chem Lett,2017,28(3):588-592.
[19]张思佳,刘敏卓,刘静涵,等.附子的化学成分研究[J].药学与临床研究,2010,18(3):262-264.
[20]Meng XH,Jiang ZB,Zhu CG,et al.Napelline-type C20-diterpenoid alkaloid iminiums from an aqueous extract of “fu zi”:solvent-/base-/acid-dependent transformation and equilibration between alcohol iminium and aza acetal forms[J].Chin Chem Lett,2016,27(7):993-1003.
[21]雷崎方,孙桂波,沈寿茂,等.附子的化学成分研究[J].中草药,2013,44(6):655-659.
[22]He CJ,Peng C,Xie XF,et al.Two new dianthramide glucosides with cardiomyocytes protective activity from Aconitum carmichaelii[J].Phytochem Lett,2013,6(2):299-301.
[23]Jiang ZB,Meng XH,Jiang BY,et al.Two 2-(quinonylcarboxamino)benzoates from the lateral roots of Aconitum carmichaelii[J].Chin Chem Lett,2015,26(6):653-656.
[24]Shim SH,Lee SY,Kim JS,et al.Norditerpenoid alkaloids and other components from the processed tubers of Aconitum carmichaeli[J].Arch Pharm Res,2005,28(11):1239-1243.
[25]Jiang ZB,Jiang BY,Zhu CG,et al.Aromatic acid derivatives from the lateral roots of Aconitum carmichaelii[J].J Asian Nat Prod Res,2014,16(9):891-900.
[26]徐暾海,赵洪峰,徐雅娟,等.四川江油生附子强心成分的研究[J].中草药,2004,35(9):964-966.
[27]Kosuge T,Yokota M.Letter:Studies on cardiac principle of aconite root[J].Chem Pharm Bull(Tokyo),1976,24(1):176-178.
[28]石晓路,喻晓春,崔海峰,等.去甲乌药碱与6-姜酚对心肌细胞的正性肌力作用[J].中国实验方剂学,2013,19(14):208-211.
[29]Wu MP,Zhang YS,Zhou QM,et al.Higenamine protects ischemia/reperfusion induced cardiac injury and myocyte apoptosis through activation of β2-AR/PI3K/AKT signaling pathway[J].Pharmacol Res,2016,104:115-123.
[30]Yun-Choi HS,Pyo MK,Park KM,et al.Anti-thrombotic effects of higenamine[J].Planta Med,2001,67(7):619-622.
[31]王桂玲.附子有效成分分离鉴定及药理作用研究[D].延吉:延边大学,2005.
[32]Konno C,Shirasaka M,Hikino H.Cardioactive principle of aconitum carmichaeli roots[J].Planta Med,1979,35(2):150-155.
[33]陈迪华,梁晓天.中药附子成分研究Ⅰ.去甲猪毛菜碱(salsolinol)的分离及其结构测定[J].药学学报,1982,17(10):792-794.
[34]温善姗,万海同,张宇燕,等.乌头碱对心衰细胞强心作用的量-时-效关系的实验研究[J].中国中医急症,2012,21(4):562-564.
[35]王璐,丁家星,刘秀秀,等.附子中胺醇型二菇生物碱的鉴定及其强心活性研究[J].药学学报,2014,49(12):1699-1704.
[36]孙虎,王平.乌头碱经皮给药的急性毒性及相关的镇痛作用研究[J].中成药,2012,34(11):2064-2067.
[37]Nesterova YV,Povet′yeva TN,Suslov NI,et al.Analgesic activity of diterpene alkaloids from Aconitum baikalensis[J].Bull Exp Biol Med,2014,157(4):488-491.
[38]Hikino H,Takata H,Fujiwara M,et al.Mechanism of inhibitory action of mesaconitine in acute inflammations[J].Eur J Pharmacol,1982,82(1-2):65-71.
[39]Komoda Y,Nosaka S,Takenoshita M.Enhancement of lidocaine-induced epidural anesthesia by deoxyaconitine in the rabbit[J].J Anesth,2003,17(4):241-245.
[40]Wang DP,Lou HY,Huang L,et al.A novel franchetine type norditerpenoid isolated from the roots of Aconitum carmichaeli Debx.with potential analgesic activity and less toxicity[J].Bioorg Med Chem Lett,2012,22(13):4444-4446.
[41]马健,陆平成,牧野充弘,等.乌头碱对小鼠腹腔巨噬细胞Ⅰa抗原表达影响的研究[J].中国药理学通报,1997,13(4):341-344.
[42]Zhao C,Li M,Luo Y,et al.Isolation and structural characterization of an immunostimulating polysaccharide from fuzi,Aconitum carmichaeli[J].Carbohydr Res,2006,341(4):485-491.
[43]Hikino H,Takata H,Konno C.Anabolic principles of Aconitum roots[J].J Ethnopharmacol,1983,7(3):277-286.
[44]Konno C,Murayama M,Sugiyama K,et al.Isolation and hypoglycemic activity of aconitans A,B,C and D,glycans of Aconitum carmichaeli roots[J].Planta Med,1985,51(2):160-161.
[45]Hikino H,Kobayashi M,Suzuki Y,et al.Mechanisms of hypoglycemic activity of aconitan A,a glycan from Aconitum carmichaeli roots[J].J Ethnopharmacol,1989,25(3):295-304.
[46]Yan HC,Qu HD,Sun LR,et al.Fuzi polysaccharide-1 produces antidepressant-like effects in mice[J].Int J Neuropsychopharmacol,2010,13(5):623-633.
[47]Nojima H,Okazaki M,Kimura I.Counter effects of higenamine and coryneine,components of aconite root,on acetylcholine release from motor nerve terminal in mice[J].J Asian Nat Prod Res,2000,2(3):195-203.
[48]宋东江,陆满文,李汉青.乌头碱类化合物毒理学研究概况[J].中国药理学通报,1989,5(5):272-274.
[49]周远鹏.附子致心律失常和抗心律失常作用研究的综述及其思考(四)[J].中药药理与临床,2015,31(5):153-158.
[50]韩旭.附子及新乌头碱致心律失常机制研究[D].石家庄:河北医科大学,2011.
[51]彭成.有毒中药附子、川乌、草乌的安全性评价与应用[M].成都:四川科学技术出版社,2014:150-155.
[52]张建军.乌头类中药雄性大鼠生殖毒性体内外试验研究[D].成都:四川大学,2007.
[53]刘强强,何晓娟,严光焰,等.乌头碱对大鼠卵巢颗粒细胞毒性研究[J].现代预防医学,2010,37(2):299-301.
[54]庞凌烟,申蕃,何晓娟,等.乌头碱对大鼠卵巢黄体细胞的毒性研究[J].华西药学杂志,2010,25(3):278-280.
[55]Xiao K,Wang L,Liu Y,et al.Study of aconitine toxicity in rat embryos in vitro[J].Birth Defects Res B Dev Reprod Toxicol,2007,80(3):208-212.
[56]雷怀成,易建华,刘涛.乌头碱中毒肝细胞凋亡的观察[J].卫生毒理学杂志,2004,18(3):199-200.
[57]雷怀成,易建华.乌头碱中毒肾小管上皮细胞凋亡的观察[J].工业卫生与职业病,2005,31(2):83-85.
[58]Sun B,Li L,Wu S,et al.Metabolomic analysis of biofluids from rats treated with Aconitum alkaloids using nuclear magnetic resonance and gas chromatography/time-of-flight mass spectrometry[J].Anal Biochem,2009,395(2):125-133.
[59]李志勇.附子成分次乌头碱心脏毒性及中毒机制研究[D].北京:北京中医药大学,2008.
[60]Muroi M,Kimura I,Kimura M.Blocking effects of hypaconitine and aconitine on nerve action potentials in phrenic nerve-diaphragm muscles of mice[J].Neuropharmacology,1990,29(6):567-572.
[61]陈荣昌,孙桂波,张强,等.附子毒性研究进展[J].中国中药杂志,2013,38(8):1126-1129.
[62]孙蓉,严敏,王懿,等.附子水提组分含药血清对大鼠离体心功能影响的“毒-效”关联研究[J].中国药物警戒,2014,11(10):587-591.
[63]叶强,郭一平,彭成.炮制方法对附子生物碱类成分的影响[J].华西药学杂志,2013,28(3):275-277.
[64]曾代文,彭成,余成浩,等.附子干姜组分配伍对急性心衰心阳虚证大鼠血流动力学的影响[J].中药药理与临床,2011,27(5):93-96.
[65]王岚,彭成,郭力.附子大黄配伍对阳虚便秘动物的治疗作用及其机制研究[J].中国中西医结合消化杂志,2006,14(2):82-85.
[66]胡一冰.附子甘草药对组分配伍减毒机制研究[D].成都:成都中医药大学,2005.
[67]叶强,郭一平,彭成,等.附子无姜不热的成分研究[J].中成药,2013,35(5):1035-1039.
[68]张丹,叶强.附子配伍不同甘草炮制品及其比例的研究[J].中国医院药学杂志,2013,33(13):1102-1104.
[69]马增春,周思思,梁乾德,等.基于UPLC-TOF/MS分析人参附子配伍减毒的物质基础[J].药学学报,2011,46(12):1488-1492.
[70]越皓,皮子凤,宋凤瑞,等.附子不同配伍药对中生物碱成分的电喷雾质谱分析[J].药学学报,2007,42(2):201-205.
[71]杨卓.附子煎煮时间、给药剂量与毒性的相关性研究[D].成都:成都中医药大学,2005.
[72]陈学习.附子对病证动物模型基础毒性作用的实验研究[D].成都:成都中医药大学,2006.
[73]张宏,彭成,余成浩.附子煎煮时间、给药剂量与温阳功效的相关性研究[J].中国中药杂志,2007,32(20):2118-2123.
[74]秦永刚,张美荣,张建平,等.不同蒸煮时间对附子强心作用及心脏毒性的影响[J].医学信息,2002,15(10):618.
[75]Ye L,Gao S,Feng Q,et al.Development and validation of a highly sensitive UPLC-MS/MS method for simultaneous determination of aconitine,mesaconitine,hypaconitine,and five of their metabolites in rat blood and its application to a pharmacokinetics study of aconitine,mesaconitine,and hypaconitine[J].Xenobiotica,2012,42(6):518-525.
[76]Zhang H,Sun S,Zhang W,et al.Biological activities and pharmacokinetics of aconitine,benzoylaconine,and aconine after oral administration in rats[J].Drug Test Anal,2016,8(8):839-846.
[77]Gao E,Yu X,Liu T,et al.Comparative study on effects of single and multiple oral administration of mungbean(Phaseolus radiatus L.)seed extract on the pharmacokinetics of aconitine by UHPLC-MS[J].Biomed Chromatogr,2014,28(10):1313-1319.
DiscussiononMaterialBasisofToxicHerbRadixAconitiLateralisPraeparataBasedonthe“IntegratedAnalyticalMethodofToxicityandEfficacy”
Xiong Liang, Peng Cheng, Miao Lulin, He Yulin, Meng Chunwang, Su Haiguo
(CollegeofPharmacy,ChengduUniversityofTraditionalChineseMedicine;KeyLaboratoryofChineseHerbsStandardizationofMinistryofEducation;Co-constructKeyLaboratoryofSystematicResearch,DevelopmentandUtilizationofChineseMedicinalResources,Chengdu611137,China)
Chinese medicinal has both toxicity and efficacy, especially in extremely toxic drugs with potent efficacy. The toxicity and efficacy of Chinese medicinal are both contradictory and unified. The toxic and effective material basis often affect and transform to each other. Radix Aconiti Lateralis Praeparata, a famous Chinese medicinal, not only has significant efficacy, but also extremely toxic. Thus, it has been a hotspot for research. Although more than 90 compounds have been isolated from Radix Aconiti Lateralis Praeparata, the basic reason for its efficacy and toxicity still remains to be revealed. The complexity of the problem is that the toxicity and efficacy of Radix Aconiti Lateralis Praeparata can transform to each other under different conditions. For example, it has significant cardiotonic effect, while it can also cause cardiotoxicity. Similarly, it can release pain, but has neurotoxicity. Moreover, the same component may exert completely different biological effect due to the different dosage, model, processing method, compatibility of Chinese medicinals, and drug metabolism. Based on our research results and literatures of Radix Aconiti Lateralis Praeparata, this paper will discuss on the material basis of Radix Aconiti Lateralis Praeparata by “integrated analytical method of toxicity and efficacy”.
Radix Aconiti Lateralis Praeparata; Material basis; Integrated analysis of toxicity and efficacy; Chemical components; Transformation between toxicity and efficacy
国家自然科学基金重点项目(81630101);国家发改委标准化项目(ZYBZH-C-SC-51);国家自然科学基金国家基础科学人才培养基金(J1310034);四川省中医药管理局“川产道地药材综合开发与区域发展”项目(2016ZY008)
熊亮(1983.06—),男,博士,教授,研究方向:中药药效物质及天然产物研究与开发,E-mail:xiling0505@126.com
彭成(1964.03—),男,博士,教授,博士研究生导师,研究方向:中药毒效的系统评价与整合研究,E-mail:pengchengchengdu@126.com
R284.1
A
10.3969/j.issn.1673-7202.2017.11.005
(2017-10-09收稿 责任编辑:王明)
