适宜加热温度保持牦牛瘤胃平滑肌加工品质和组织结构
2017-12-20李升升余群力靳义超
李升升,余群力,靳义超
适宜加热温度保持牦牛瘤胃平滑肌加工品质和组织结构
李升升1,2,余群力2,靳义超1※
(1. 青海大学畜牧兽医科学院,西宁 810016;2. 甘肃农业大学食品科学与工程学院,兰州 730070)
为研究不同温度对牦牛平滑肌加工品质和组织结构的影响。将牦牛瘤胃平滑肌分别在50、60、70、80、90、100 ℃条件下处理60 min后取样,考察不同温度对牦牛平滑肌蒸煮损失、热收缩率、剪切力、胶原蛋白含量和微观结构的影响。结果表明:随温度的升高,牦牛平滑肌的蒸煮损失、热收缩率、初级和次级肌束膜的厚度均显著增加(<0.05);剪切力、胶原蛋白含量和肌纤维直径均显著降低(<0.05);总体表现为牦牛平滑肌的加工品质随温度的升高而下降,组织结构随温度升高而收缩。 80 ℃是平滑肌加工品质形成的关键温度,80 ℃处理60 min牦牛平滑肌的蒸煮损失为31.39%±3.08%、热收缩率为30.80%±2.15%、剪切力值为86.63 N±8.72 N、胶原蛋白质量分数为49.52 mg/g±2.84 mg/g。因此,推荐牦牛瘤胃平滑肌在80~90 ℃范围内熟制具有较好的加工品质和组织形态。研究结果将为含平滑肌的内脏等副产物的精深加工提供参考。
温度;加工;品质控制;组织结构;牦牛;瘤胃平滑肌
0 引 言
平滑肌(smooth muscle)是肌肉组织的一种,广泛分布于血管壁、胃、肠等内脏器官,又称为“内脏肌”。近年来,随着人们对动物性食品消费量的增加,促进了畜禽养殖、屠宰、加工业的发展,同时畜禽宰后的副产物数量也显著增加。据报道[1-2]平滑肌含有丰富的蛋白质、脂肪、钙、磷、铁、硫胺素、核黄素、尼克酸等,其蛋白质真实消化率和氨基酸评分与牛肉接近,可见平滑肌在营养价值上与骨骼肌类似。而且,平滑肌还富含胶原蛋白和弹性蛋白,具有特有的质构和风味,因此,从数量和质量上来看,平滑肌具备深度开发和加工的潜力。
熟制是肉品深加工和开发的主要工序之一,对肉品食用和加工品质的形成具有重要的影响[3]。熟制过程对肉品质的影响主要是通过热效应造成肌肉结构改变和蛋白变性实现的。肌肉是由肌内膜将若干条肌纤维包裹形成肌束,肌束膜将不同的肌束分开,最后由肌外膜将肌束包裹形成肌肉[4],肌肉中的蛋白主要是肌动蛋白、肌球蛋白和胶原蛋白。大量研究报道表明[5],肌肉受热收缩造成形状和微观结构的变化,与此同时,在热效应作用下蛋白变性后,肌肉的系水力降低造成蒸煮损失增加;同时由于热效应蛋白受热收缩使得单位面积上肌纤维的数量增加使剪切力增加;随着热效应的继续增强,肌纤维断裂使肌肉剪切力值下降。在此过程中胶原蛋白变性成为明胶,明胶具有很强的吸水性,也会影响肌肉的蒸煮损失和剪切力。对于不同肌肉变性温度的研究表明[6-7],肌动蛋白开始热变性温度约为71 ℃、胶原蛋白约为64 ℃;而肌球蛋白在40~60 ℃基本完成变性过程。因此,选择在50~100 ℃温度下研究平滑肌的蒸煮损失、剪切力、胶原蛋白含量和微观结构的变化。
目前,对于肉品熟制的研究报道较多,郎玉苗等[8]研究表明煎制牛排的熟制温度为80 ℃、切片厚度为10 mm和肌纤维走向为垂直肌纤维时,牛排具有较好的品质。李升升[9]报道牦牛肉背最长肌的品质随加热温度的升高呈下降趋势,在80 ℃时具有较好的感官品质。张立彦 等[10]研究得出随加热温度的升高,鸡胸肉的肌纤维直径先减小后增大,肌纤维间隙先变大后变小,肌内膜及肌束膜也逐渐遭到破坏。Modzelewska-Kapitula等[11]研究指出不同温度的蒸汽和干空气加热牛肉,随温度的升高均使牛肉的蒸煮损失增加。然而,平滑肌热处理过程中加工品质和组织结构变化规律如何,尚未见相关报道。
本文结合肉品的主要熟制方式,研究50~100 ℃温度下牦牛平滑肌蒸煮损失、热收缩率、剪切力、胶原蛋白含量的影响及其组织结构的变化,旨在为平滑肌的加工提供理论依据和技术支持。
1 材料与方法
1.1 试验材料
新鲜牦牛瘤胃:购自青海裕泰食品有限公司,选取3~4岁屠宰后的牦牛瘤胃,除去瘤胃内容物,用水清洗干净瘤胃表面,在(3±1)℃条件下,用保温箱运回实验室进行试验,在实验室中除去瘤胃表面的绒毛、黏膜、脂肪,即为牦牛瘤胃平滑肌。
1.2 主要仪器与试剂
电子称(JM-B3003型,诸暨市超泽衡器设备有限公司);卡尺(0~150 mm,上海申韩量具有限公司);质构仪(CT-3型,美国布鲁克菲尔德工程公司);紫外可见分光光度计(722N型,上海精密仪器仪表有限公司);显微镜(IX71型,日本奥林巴斯株式会社);电热恒温水浴锅(HH-6型,上海比朗仪器有限公司);轮转式切片机(RM2235型,上海莱卡仪器有限公司);摊片机(HI1210型,上海莱卡仪器有限公司);烘片机(HI1220型,上海莱卡仪器有限公司)。
主要试剂:多聚甲醛(上海生工生物工程股份有限公司);无水乙醇(天津市富宇精细化工有限公司);二甲苯(天津市富宇精细化工有限公司);天狼星红染色液(北京索莱宝科技有限公司)等。
1.3 试验方法
1.3.1 样品处理
将平滑肌分成(160±10)g的肉块,随机分成6组,每组5个平行,然后将每组样品分别放于50、60、70、80、90、100 ℃的水浴锅中煮制60 min后取出,测定样品的蒸煮损失、热收缩率、剪切力、胶原蛋白含量的变化,并观察熟制品的组织结构变化。
1.3.2 指标测定方法
1)蒸煮损失的测定:样品处理前称量记为1,热处理后取出的质量记为,蒸煮损失计算按式(1)计算。
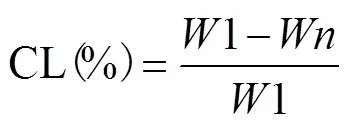
式中CL为蒸煮损失,%;1为样品处理前的质量,g;为样品处理后的质量,g。
2)热收缩率的测定:用最小刻度为1 mm卡尺测定每个样品沿肌纤维方向的长度,样品热处理前的长度记为1,样品热处理后的长度记为,长度热收缩率计算公式按式(2)计算。
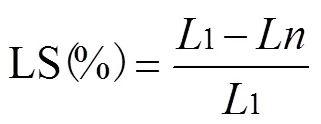
式中LS为长度热收缩率,%;1为样品热处理前的长度,mm;为样品热处理后的长度,mm。
3)剪切力的测定:采用美国布鲁克菲尔德工程公司CT-3型质构仪测定,沿平行于肌纤维方向切取长×宽为40 mm×10 mm的条形,将2~3条样品堆叠至样品的高度为10 mm测定剪切力,切刀垂直于肌纤维方向切割,剪切速度1.5 mm/s,剪切距离为20 mm。每个样品测定5次,结果取平均值。
4)胶原蛋白含量的测定:参考国标GB/T9695.23- 2008肉与肉制品:羟脯氨酸含量的测定,将测得的羟脯氨酸含量乘以系数7.25换算为胶原蛋白含量。
5)平滑肌组织结构的观察:从每个煮制后的样品上切取长×宽为10 mm×10 mm的块状,放入4%多聚甲醛溶液中固定过夜,随后用30%~100%乙醇进行梯度洗脱,之后用二甲苯洗脱2次,随后用天狼星红溶液染色。染色后的切片用显微镜在10倍物镜下观察,拍照,每个切片在不同视野下拍10张照片,用Image-pro plus软件测定肌纤维直径、初级肌束膜和次级肌束膜的厚度。
1.4 数据分析
采用SPSS17.0软件对数据进行方差分析(ANOVA),各处理平均数间采用Duncan多重比较法进行差异显著性分析,差异显著水平为=0.05,极显著水平为=0.01。
2 结果与分析
2.1 不同温度处理对牦牛平滑肌蒸煮损失的影响
蒸煮损失是肉品在蒸煮过程中因水分和其他可溶性物质的流失而引起的质量减少,在一定程度上反映肉品的系水力[12-13]。由图1不同温度处理对牦牛平滑肌蒸煮损失的影响可知,随着处理温度的升高,牦牛平滑肌的蒸煮损失呈显著增加的趋势,在50~60 ℃和80~100 ℃范围内,蒸煮损失增加但差异不显著(>0.05);在60~80 ℃范围内,平滑肌的蒸煮损失显著增加(<0.05);总体来看,牦牛平滑肌的蒸煮损失从50 ℃时的9.93%±1.71%增加到100 ℃时的34.93%±3.06%,增加了251.76%。这与郎玉苗等[8]和李升升[9]的报道指出随温度的升高,牛排和牦牛肉的蒸煮损失增加是一致的。肌肉中的主要蛋白是肌动蛋白、肌球蛋白和胶原蛋白,蛋白受热会变性,蛋白变性后系水力降低导致蒸煮损失增加[14-16]。Brunton等[7]报道肌动蛋白开始热变性温度为71 ℃;胶原蛋的变性温度约为64 ℃;肌球蛋白在40~60 ℃基本完成变性过程。从试验结果也可以看出,当温度超过60 ℃时平滑肌的蒸煮损失就显著增加,80 ℃之后蒸煮损失的增加减缓,也就是说在60~80 ℃范围内,牦牛瘤胃平滑肌随温度升高蒸煮损失增加的主要原因是肌肉中蛋白质变性。综上可见,80 ℃是平滑肌中的肌动蛋白、胶原蛋白和肌球蛋白等蛋白变性的关键温度。
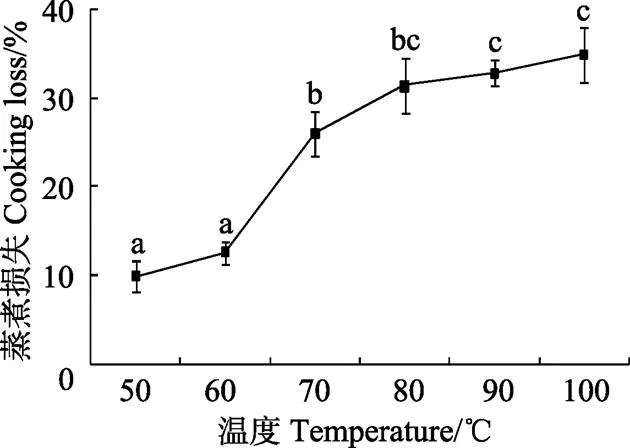
注:不同字母代表差异显著(P<0.05),下同。
2.2 不同温度处理对牦牛平滑肌热收缩率的影响
肌肉受热会收缩,导致其体积变小,热收缩率就是反映肌肉受热收缩程度的指标。由图2知,随着温度的升高,牦牛平滑肌顺着肌纤维方向的收缩率显著增加(<0.05),且在60~100 ℃范围内基本呈直线增加趋势。在50~100 ℃的范围内,平滑肌的收缩率从10.18%± 0.64%增加到41.41%±1.64%,增加了306.78%。这与李升升[9]报道牦牛肉在不同温度下的热收缩率变化规律一致。平滑肌是具有很大收缩性的肌肉,肌肉中的肌纤维蛋白和胶原蛋白会受热收缩[17],导致其热收缩率增加,此变化趋势与平滑肌蒸煮损失随温度变化基本一致。

图2 不同温度处理对牦牛平滑肌热收缩率的影响
2.3 不同温度处理对牦牛平滑肌剪切力的影响
剪切力是肉品嫩度的反映,嫩度的大小直接影响产品的食用和加工品质。平滑肌是存在于胃、肠等内脏中,这些部位的平滑肌厚度不一,对评价不同处理间剪切力的差异造成影响,为了便于比较,本试验将2~3条样品堆叠至样品高度10 mm进行测定;不同层之间的样品会产生弯曲、摩擦作用而对样品剪切力由一定的影响,在试验过程中通过多次测量抵消因样品的不同而造成的误差。由图3可知,随着处理温度的升高,牦牛平滑肌的剪切力值呈显著减小的趋势(<0.05),在60~100 ℃范围内基本呈直线减少趋势。总体来看,剪切力值由50 ℃时的116.62 N±0.78 N,减小到100 ℃时61.74 N±1.67 N,降低了47.06%。这与Modzelewska-Kapitula等[11]报道随温度的升高,干空气加热牛肉的剪切力值增加不一致。对肌肉而言,一方面,受热会造成肌原纤维和胶原蛋白收缩失水,肌纤维变粗,单位横截面上的肌纤维密度增加,使剪切力值升高[18-20];另一方面,胶原蛋白受热变性成为明胶,明胶的剪切力值较小使肉品嫩度增大[21];此外,温度升高会导致肌纤维断裂导致其剪切力值下降。总体来看,在50~60 ℃,剪切力值差异不显著可能是由于平滑肌肌纤维的收缩和胶原蛋白的膨胀相互抵消,60~100 ℃剪切力值显著减小是平滑肌胶原蛋白吸水膨胀和肌纤维受热断裂引起的。从咀嚼的角度来看剪切力值越小,越容易咀嚼,所以加热温度越高平滑肌的品质越好,结合蛋白质变性的温度,平滑肌的熟制温度在80~100 ℃较好。
2.4 不同温度处理对牦牛平滑肌胶原蛋白含量的影响
胶原蛋白是一种重要的肌肉组织成分,在维持肌肉结构、柔韧性、强度、肌肉质地等方面起着重要作用[22-24]。饲养年龄不同,肌肉中胶原蛋白的交联度不同,对肉品影响也不同,本试验中的原材料是选择同一牧场,相同饲养条件下的3~4岁牦牛,样品中胶原蛋白的交联程度基本相同,且本试验重点考虑的是平滑肌中的的胶原蛋白的热变性对其品质的影响,故从胶原蛋白总体含量上的变化说明胶原蛋白的变性程度。由图4不同温度处理对牦牛平滑肌胶原蛋白含量的影响可以看出,随着处理温度的升高,牦牛平滑肌中胶原蛋白的含量显著降低(<0.05),尤其是在60~90 ℃范围内牦牛平滑肌胶原蛋白含量呈直线下降趋势,这与Brunton等[7]报道胶原蛋在64 ℃附近变性一致;总体来看,在50~100℃范围内牦牛平滑肌胶原蛋白含量从72.87±1.97 mg/g 降低到 30.98±1.91 mg/g,降低了57.49%。这与Sanford 和Sylvia[25]报道的牛肉中胶原蛋白含量随温度升高而降低一致。平滑肌中的胶原蛋白分为可溶性和不可溶性,可溶性胶原蛋白溶于水中导致胶原蛋白含量减少;不溶性胶原蛋白随温度升高变成明胶,明胶吸水膨胀造成胶原蛋白含量相对减少[26-27]。
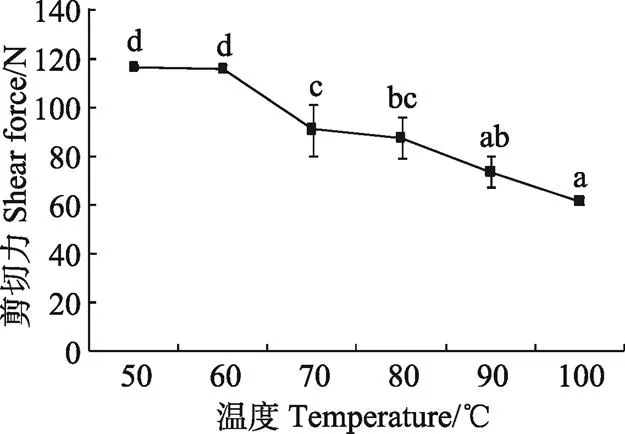
图3 不同温度处理对牦牛平滑肌剪切力的影响
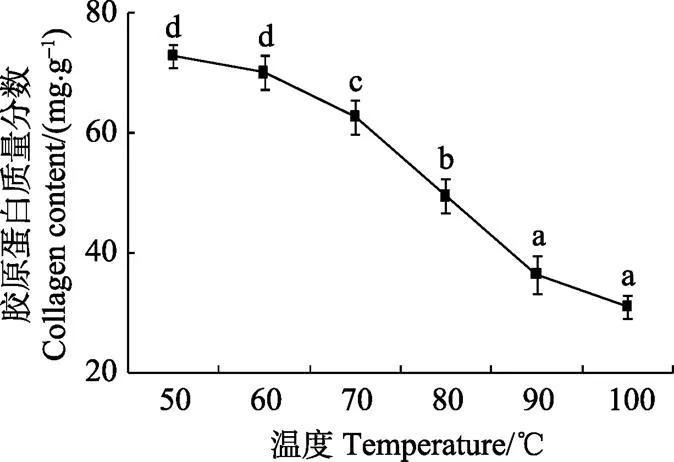
图4 不同温度处理对牦牛平滑肌胶原蛋白含量的影响
2.5 组织结构观察
对不同温度处理后牦牛平滑肌的组织结构变化进行了观察,结果如图5所示;对肌纤维直径,初级肌束膜和次级肌束膜厚度的统计见表1。由图5可知,随处理温度的升高,牦牛平滑肌肌纤维和肌束膜间的间隙从大到小;平滑肌肌纤维的直径由大到小;而平滑肌初级和次级肌束膜厚度由小到大。表1的统计结果进一步表明,随温度增加平滑肌肌纤维的直径显著减小(<0.05),由50 ℃时的131.13m减小到100 ℃的78.13m,降低了40.42%;肌束膜的厚度显著增加(<0.05),初级肌束膜由50 ℃时的8.50m增加到100 ℃的34.56m,增加了306.59%,次级肌束膜由50 ℃时的38.13m减小到100 ℃的61.28m,增加了60.71%。肌肉组织是由肌束膜包裹肌纤维而形成的,在50和60 ℃时,平滑肌肌纤维和肌束膜受热收缩,造成肌纤维直径减小[28-29],而肌束膜主要由胶原蛋白构成,胶原蛋白受热吸收膨胀抵消了受热收缩,造成肌束膜增加,同时由于肌纤维和肌束膜的收缩速率不同,造成肌纤维和肌束膜之间出现间隙,但由于肌束膜的膨胀造成其间隙减小。至70 ℃以后,肌纤维和肌束膜受热影响加剧,进一步加剧了肌纤维的收缩和肌束膜的膨胀,结果表现为肌纤维直径显著减小,初级和次级肌束膜的厚度显著增加[30-31]。80 ℃时平滑肌的肌纤维和肌束膜间的间隙减小至基本消失,说明平滑肌的肌束膜膨胀已基本填充至肌纤维之间,牦牛平滑肌在热效应下的组织结构基本形成。
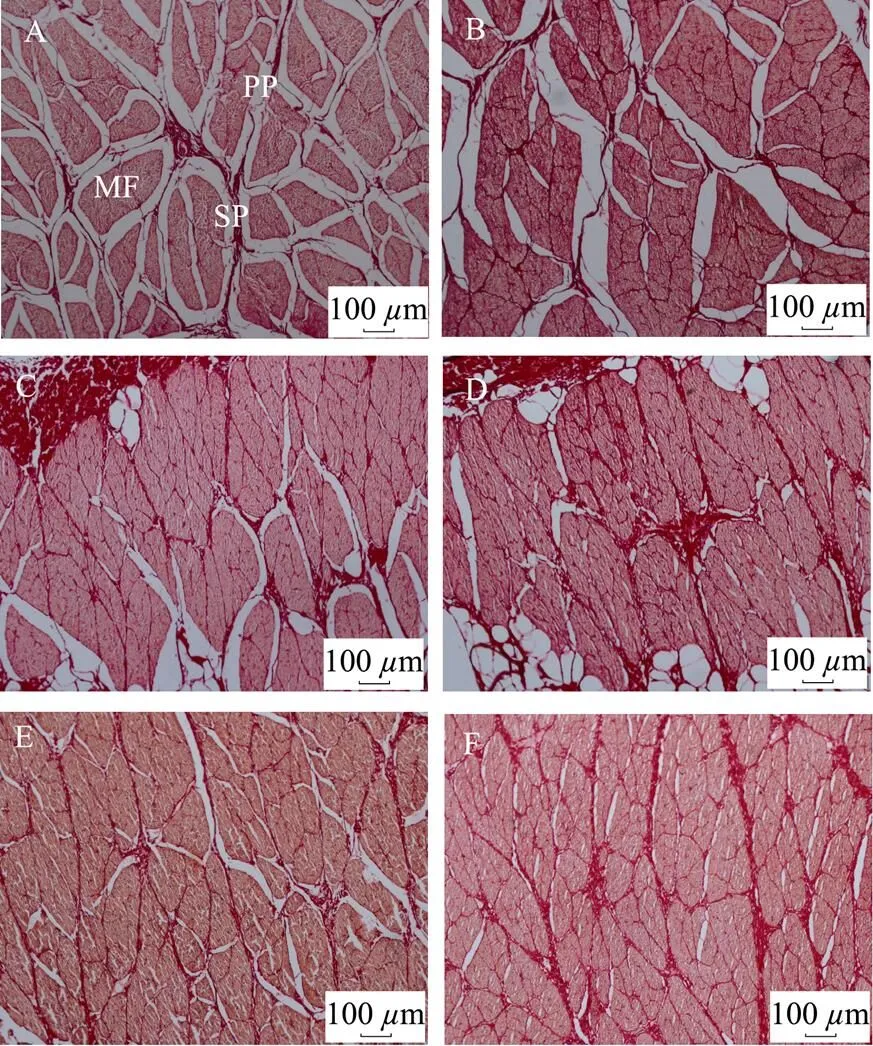
注:A、B、C、D、E、F分别代表50、60、70、80、90、100 ℃条件下加热60min平滑肌组织结构的变化;MF代表肌纤维,PP代表初级肌束膜,SP代表次级肌束膜。

表1 不同温度处理后牦牛平滑肌肌纤维直径,初级和次级肌束膜厚度的变化
3 讨 论
熟制是肉品深加工和开发的主要工序之一,对肉品食用和加工品质的形成具有重要的影响[3]。熟制过程对肉品质的影响主要是通过热效应造成肌肉结构改变和蛋白变性实现的。热变性是衡量肌肉组织不同组分在热效应下变性的主要方式,国内外已有大量的报道[6-7],报道表明不同来源的肌肉中肌动蛋白开始热变形温度为71 ℃,胶原蛋白约64 ℃,肌球蛋白在40~60 ℃完成变性过程,且绝大部分肌肉在80℃附近完全变性。热处理的目的就是要是肌肉变性能好的被人体消化吸收,而在此过程中结合剪切力、蒸煮损失等品质的变化便于更好的控制热处理温度。从试验结果来看60~80 ℃是平滑肌蛋白质变性和品质形成的关键温度范围,当温度超过80 ℃后品质基本形成,可以得出80 ℃为平滑肌品质形成的关键温度,90~100 ℃之间平滑肌的加工品质变化差异不显著(>0.05),同时考虑到工业化生产过程中温度控制和减少能源消耗,故得出平滑肌在80~90 ℃的范围内加工品质较好。
4 结 论
随处理温度的升高,牦牛平滑肌的蒸煮损失和热收缩率显著增加(<0.05);剪切力和胶原蛋白含量显著降低(<0.05)。随处理温度的增加,牦牛平滑肌的肌纤维直径减小,初级和次级肌束膜的厚度增加。综合各品质指标变化可知,在50~60 ℃和90~100 ℃范围内,牦牛平滑肌的品质变化较小,60~90 ℃范围内,牦牛平滑肌的品质变化较大,且80 ℃是牦牛平滑肌品质形成的关键温度。综上所述,推荐牦牛平滑肌在80~90 ℃范围内熟制具有较好的加工品质和组织形态。在平滑肌产品的加工和开发时,需结合产品定位消费群体,合理选择熟制温度。
[1] 高菲菲,牛胃平滑肌加工特性研究[D]. 南京:南京农业大学,2012. Gao Feifei. Study on Processing Functionalities of Beef Tripe Smooth Muscle[D]. Nanjing: Nanjing Agricultural University, 2012. (in Chinese with English abstract)
[2] Abdulatef M A, Tetsuo N, Michio M. Impact of transglutaminase on the textural, physicochemical, and structural properties of chicken skeletal, smooth, and cardiac muscles[J]. Meat Science, 2009, 83(l): 759-767.
[3] Yancey J W S, Wharton M D, Apple J K. Cookery method and end-point temperature can affect the Warner-Bratzler shear force, cooking loss, and internal cooked color of beef longissimus steaks[J]. Meat Science, 2011, 88(1): 1-7.
[4] 夏秀芳,李芳菲,王博,等. 冰温保鲜对牛肉肌原纤维蛋白结构和功能特性的影响[J]. 中国食品学报,2015,15(9):54-60. Xia Xiufang, Li Fangfei, Wang Bo, et al. Effect of controlled freezing point storage on the structural and functional properties of beef myofibrillar protein[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(9): 54-60. (in Chinese with English abstract)
[5] Van Wezemael L, De Smet S, Ueland Ø, et al. Relationships between sensory evaluations of beef tenderness, shear force measurements and consumer characteristics[J]. Meat Science, 2014, 97(3): 310-315.
[6] Stabursvik E, Martens H. Thermal denaturation of proteins in post-rigor muscle tissue as studied by differential scanning calorimetry[J]. Journal of the Science of Food and Agriculture, 1980, 31(10): 1034-1042.
[7] Brunton N P, Lyng J G, Zhang L, et al. The use of dielectric properties and other physical analyses for assessing protein denaturation in beef biceps femoris muscle during cooking from 5 to 85 ℃[J]. Meat Science, 2006, 72(2): 236-244.
[8] 郎玉苗,谢鹏,李敬,等. 熟制温度及切割方式对牛排食用品质的影响[J]. 农业工程学报,2015,31(1):317-325. Lang Yumiao, Xie Peng, Li Jing, et al. Effect of cooking final temterature and cutting method on eating quality of pan-fried steak[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(1): 317-325. (in Chinese with English abstract)
[9] 李升升. 热处理对牦牛肉品质的影响及其相关性分析[J].食品与机械,2016,32(4):207-210. Li Shengsheng. Quality changes and correlation of yak meat under heat treatment[J]. Food & Machinery, 2016, 32(4): 207-210. (in Chinese with English abstract)
[10] 张立彦,吴兵,包丽坤. 加热对三黄鸡胸肉嫩度、质构及微观结构的影响[J]. 华南理工大学学报(自然科学版),2012,40(8):116-121. Zhang Liyan, Wu Bing, Bao Likun. Effect of heating on tenderness, texture and microstructure of sanhuang chincken breast meat[J]. Journal of South China University of Technology (Natural Science Edition), 2012, 40(8): 116-121. (in Chinese with English abstract)
[11] Modzelewska-Kapituła M, Dąbrowska E, Jankowska B, et al. The effect of muscle, cooking method and final internal temperature on quality parameters of beef roast[J]. Meat Science, 2012, 91(2): 195-202.
[12] 魏超昆,刘敦华,刘关瑞. 吊挂时间对蛋鸡与肉鸡宰后肌肉品质的影响[J]. 农业工程学报,2017,33(8):286-292. Wei Chaokun, Liu Dunhua, Liu Guanrui. Effect of shackling time on muscle quality of post-slaughter of layer and broiler[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(8): 286-292. (in Chinese with English abstract)
[13] 薛山,贺稚非,李洪军. 伊拉兔宰后肌糖原变化及其与兔肉品质的相关性[J]. 中国农业科学,2014,47(4):814-822. Xue Shan, He Zhifei, Li Hongjun. Variation of muscle glycogen of IRA rabbit after slaughter and its correlation with changes of rabbit meat quality[J]. Scientia Agricultura Sinica, 2014, 47(4): 814-822. (in Chinese with English abstract)
[14] In-kwon H, Young-seung L. Textural properties and water- holding capacity of broiler breast meat cooked to various internal endpoint temperatures[J]. Food Science, 2012, 21(5): 1497-1499.
[15] Li Chao, Wang Daoying, Dong Han, et al. Effects of different cooking regimes on the microstructure and tenderness of duck breast muscle[J]. Journal of Food Agriculture and Environment, 2013, 93(8): 1979-1985.
[16] Brunton N P, Lyng J G, Zhang L, et al. The use of dielectric properties and other physical analyses for assessing protein denaturation in beef biceps femoris muscle during cooking from 5 to 85 ℃[J]. Meat Science, 2006, 72(2): 236-244.
[17] Lin Yungkai, Lin Tungyung, Su Houpin. Extraction and characterization of telopeptide-poor collagen from porcine lung[J]. Food Chemistry, 2011, 124(4): 1583-1588.
[18] Lorenzen C L, Taylor J F, Neely T R, et al. Beef customer satisfaction: Trained sensory panel ratings and Warner-Bratzler shear force values[J]. Journal of Animal Science, 2003, 81: 143-149.
[19] Bayraktaroglu A G, Kahraman T. Effect of muscle stretching on meat quality of biceps femoris from beef[J]. Meat science, 2011, 88(3): 580-583.
[20] Yulong Bao, Per E. Relationship between oxygen concentration, shear force and protein oxidation in modified atmosphere packaged pork[J]. Meat Science, 2015, 110: 174-179.
[21] Gudmundsson M, Hafsteinsson H. Gelatin from cod skins as affected by chemical treatments[J]. Journal of Food Science, 1997, 62(1): 37-39.
[22] Fang S H, Nishimura T, Takahashi K. Relationship between development of intramuscular connective tissue and toughness of pork during growth of pigs[J]. Journal of Animal Science, 1999, 77(1): 120-130.
[23] Powell T H, Hunt M C, Dikeman M E. Enzymatic assay to determine collagen thermal denaturation and solubilization[J]. Meat Science, 2000, 54(4): 307-311.
[24] De Huidobro F R, Miguel E, Blázquez B, et al. A comparison between two methods (Warner–Bratzler and texture profile analysis) for testing either raw meat or cooked meat[J]. Meat Science, 2005, 69(3): 527-536.
[25] Sanford J R, Sylvia c. Determination of collagen in raw and cooked beef from two muscles by alkali-insoluble, autoclave- soluble nitrogen and by hydroxyproline content[J]. Agricultural and Food Chemistry, 1962, 10(1): 40-42.
[26] Anton F, Madalina G A, Mihaela B, et al. Collagen hydrolysate based collagen/hydroxyapatite composite materials[J]. Journal of Molecular Structure, 2013, 1037(4): 154-159.
[27] Lepetit J. A theoretical approach to the relationships between collagen content, collagen cross-links and meat tenderness[J]. Meat Science, 2007,76(1): 147–159.
[28] Roldán M, Antequera T, Pérez-Palacios T, et al. Effect of added phosphate and type of cooking method on physico-chemical and sensory features of cooked lamb loins[J]. Meat Science, 2014, 97(1): 69-75.
[29] Hopkins D, Thompson J. Factors contributing to proteolysis and disruption of myofibrillar proteins and the impact on tenderisation in beef and sheep meat[J]. Australian Journal of Agricultural Research, 2002, 53(2): 149-166.
[30] Matthew D, Shoulders, Ronald T Raines. Collagen structure and stability[J]. Annual Review of Biochemistry, 2009, 78(3): 929-958.
[31] Cross H R, Carpenter Z L, Smith G C. Effects of intramuscular collagen and elastin on bovine muscle tenderness[J]. Journal of Food Science, 1973, 38(6): 998-1003.
李升升,余群力,靳义超.适宜加热温度保持牦牛瘤胃平滑肌加工品质和组织结构[J]. 农业工程学报,2017,33(23):300-305. doi:10.11975/j.issn.1002-6819.2017.23.039 http://www.tcsae.org
Li Shengsheng, Yu Qunli, Jin Yichao. Maintaining processing quality and histological structure of yak rumen smooth muscle by proper heating temperature[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(23): 300-305. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.23.039 http://www.tcsae.org
Maintaining processing quality and histological structure of yak rumen smooth muscle by proper heating temperature
Li Shengsheng1,2, Yu Qunli2, Jin Yichao1※
(1.810016,; 2.730070,)
Smooth muscle is a category of muscle tissue, and is widely distributed in blood vessels, stomach, intestines and other internal organs. Smooth muscle has wealthy nutritional value, special flavor and texture. Smooth muscle included in animal organs can be cooked to special dishes in lots of Asian countries. However, smooth muscle is treated as by-product and little as valuable muscle compared to skeletal muscle. In order to meet consumers’ demand for new valuable food resource and high edible quality, we investigated the processing quality and histological structure change of yak rumen smooth muscle under different temperatures. The yak rumens were picked from a commercial abattoir, and the yaks were aged 36-38 months, had the same feeding background, and were slaughtered by conventional slaughtering method. The rumens were obtained, vacuum packaged and transported to the laboratory at (3±1) ℃. The smooth muscle was obtained after removing the villi, mucosa and fat. The yak rumen smooth muscle was cooked at 50, 60, 70, 80, 90, 100 °C for 60 min, respectively. And the cooking loss, heat shrinkage rate, Warner-Bratzler shear force (WBSF), collagen content and histological structure of yak rumen smooth muscle were evaluated. The results showed that cooking temperature had significant effect on WBSF, cooking loss, heat shrink rate, collagen content and histological structure. As the increasing of cooking temperature, the cooking loss value and heat shrinkage rate significantly increased (<0.05); the initial cooking loss value of yak rumen smooth muscle was 9.93%±1.71% and then increased to 34.93%±3.06%; the heat shrinkage rate increased by 306.78%, from 10.18%±0.64% to 41.41%±1.64%. However, WBSF and collagen content significantly decreased (<0.05) with the increase of cooking temperature; the value of WBSF from (116.62±0.78) N to (61.74±1.67) N; the content of collagen decreased by 57.49%, from (72.87±1.97) to (30.98±1.91) mg/g. The histological structure indicated that with the increasing of cooking temperature, the muscle fiber diameter of yak rumen smooth muscle and the crack between smooth muscle fiber changed from big to small, but the thickness of the primary and secondary perimysium changed from small to big. The muscle fiber diameter of the yak smooth muscle decreased from (131.13±13.94)m to (78.13±6.51)m; but the thickness of the primary and secondary perimysium increased by 306.59% and 60.71%, respectively. From the quality and structure change of yak rumen smooth muscle under different temperatures, the yak rumen smooth muscle processing quality decreased with the increase of temperature, and the histological structure shrank with the increase of temperature. In order to satisfy the needs of consumers, food industry and institute should pay more attention to cooking temperature, and should choose suitable cooking style to different products which focuse on different consumers. In summary, we suggest the yak rumen smooth muscle is cooked at 80-90 ℃ for 60 min, and the product will have satisfying processing quality and shape. The result will provide technical reference for the processing of by-products which include smooth muscle.
temperature; processing; quality control; histological structure; yak; rumen smooth muscle
10.11975/j.issn.1002-6819.2017.23.039
TS251.5
A
1002-6819(2017)-23-0300-06
2017-08-23
2017-11-08
国家自然科学基金资助项目(31701625);国家肉牛牦牛产业技术体系资助(CARS-38);藏牦牛品质杂交利用及特色产品开发技术研究资助(2014-HZ-806)
李升升,山西临汾人,博士生,助理研究员,主要研究方向为畜产品科学与工程。Email:lishsh123@163.com
靳义超,研究员,主要研究方向为畜产品加工。 Email:jinyichao88@163.com
