GATA3-IL-13通路基因多态性和IL-13水平与哮喘病的相关性研究①
2017-12-20张广洋郭耀杰孙妍妍李姗蔓鲁建江尹晓文
张广洋 郭耀杰 孙妍妍 李姗蔓 鲁建江 尹晓文
(石河子大学化学化工学院/新疆兵团化工绿色工程重点实验室,石河子 832003)
GATA3-IL-13通路基因多态性和IL-13水平与哮喘病的相关性研究①
张广洋 郭耀杰 孙妍妍 李姗蔓 鲁建江 尹晓文②
(石河子大学化学化工学院/新疆兵团化工绿色工程重点实验室,石河子 832003)
目的哮喘是一种慢性炎症性呼吸道疾病,有数据表明GATA3-IL-13 基因参与哮喘病的生物学理论是可信的。本研究目标是调查哮喘患者中GATA3-IL13 通路基因的多态性与IL-13水平的关系,评估在新疆人口中GATA3-IL-13基因多态性与IL-13水平的相关性。方法279例哮喘患者和277例对照组(健康人)通过MassARRAY SNP 分型系统进行分析,通过ELISA法检测IL-13的水平,运用SPSS22.0和Graph Pad Prism 6.0 软件进行数据统计和分析。结果哮喘组IL-13水平中(rs2066960 AA),GATA3(rs3781093 CC)基因型与CC (rs2066960)、TT (rs3781093)相比具有增加患病的风险(P<0.05)。同样的,IL-13(rs2066960) C-A等位基因具有增加哮喘患病的风险(P<0.05)。而 rs3781093 C-T等位基因没有显著性差异(P>0.05)。结论哮喘组GATA3(rs3781093)风险性位点发现与哮喘病相关,rs2066960等位基因的C-A突变与血清中IL-13水平的表达有关。
IL-13;GATA3;基因多态性;IL-13水平;哮喘
哮喘是一种慢性炎症性呼吸道疾病,全世界有3亿多哮喘患者伴有呼吸道阻塞、黏液分泌过多和气道高反应的影响[1,2]。哮喘的病理过程可能受到遗传和环境因素的综合影响,但具体机制还没有完全解释清楚。
IL-13和其他促炎症因子一样与哮喘有关。Th2细胞因子中的IL-13和IL-4承担了重要的炎症反应通路和许多生物活性物质的激活,在哮喘的发展中起着重要的作用,同时IL-13水平在支气管哮喘患者中的表达量增加[3]。Blease等[4]证实,通过人体血清中的IL-13结合到假单胞菌的外毒素的衍生物,可以杀死体内的IL-13生产细胞来限制IL-13的产生,从而抑制了曲菌诱导呼吸道疾病的所有特征。Walter等[5]证实了通过改变IL-13缺陷小鼠的过敏原,尽管它们出现精力充沛,Th2结果偏奇,嗜酸性炎症的情况,但是没有产生引起过敏原反应的AHR。
GATA3是转录因子,在IL-13基因启动子区域GATA位点对IL-13的基因表达起重要作用。GATA3首次在小鼠实验中报道没有功能[6],然而根据相关研究表明,Th1细胞中的GATA3的诱导表达引起了对IL-13和IL-4基因座的染色质重新组装[7,8]。但是在另一项关于Th1细胞中的GATA3表达的相似研究,只有IL-13的分泌有显著水平而IL-4没有。他们描述了GATA3在中性条件下的CD8 T细胞中的IL-13表达显著增强[9]。经验证GATA3在T细胞中的强制性表达导致了IL-13的负转录调控,在老鼠中GATA3突变体的显性失活抑制了IL-13的产生[10,11]。Th2细胞中的GATA3的结合位点位于IL-13基因上游的1.6个kb处。RNA聚合酶Ⅱ结合组蛋白乙酰转移酶与GATA3一起绑定的结果导致了组蛋白的乙酰化作用,并且伴随着IL-13基因的表达[12]。
国内外均有研究发现许多基因与哮喘易感性相关,国内暂未发现IL-13-GATA3通路与哮喘的相关性研究报道。由于生活环境、地理位置、种族与人体存在差异,本文探究了IL-13/GATA3 基因的多态性与我国西部地区哮喘病人的易感性是否有关,以进一步揭示哮喘的遗传学发病机制。
1 对象与方法
1.1实验对象
1.1.1对象及分组 自2016年3月到2017年3月从医院儿科和呼吸科收集哮喘患者279例纳入本研究。哮喘患者的诊断标准是根据《全球哮喘防治指南》[13],在医院健康体检中心招募277例志愿者作为对照组,组成病例-对照研究。其中儿童哮喘178例,儿童健康177例,年龄(4.65±2.99)岁;成人哮喘101例,成人健康100例,年龄(48.60±7.30)岁;儿童年龄0~14岁;成人18~78岁;均排除其他呼吸系统疾病的影响。两组儿童和成人均来自中国西部地区。本研究得到患者家属知情同意及医院医学伦理委员会的批准。
1.2实验方法
1.2.1DNA提取 抽取参与者2 ml外周静脉血,血液样本置于-80℃保存。根据DNA试剂盒(北京天根生物生化科技有限公司,No.DP318)说明书提取血液中的基因组DNA。核酸蛋白仪(Nanodrop2000)检测提取DNA的浓度,DNA样本存于-80℃保存备用。
1.2.2PCR扩增 rs2066960和rs3781093 SNP位点相应引物由上海生工生物工程股份有限公司合成,PCR过程所用10×PCR Buffer,25 mmol/L MgCl2购自北京天根生物生化科技有限公司,PCR仪为Applied Biosystems公司的GeneAmp PCR System 9700。扩增DNA样品。具体反应过程如下:rs2066960 PCR反应上游引物序列为:5′-ACGTTGGATGTGTGAGCTGTTACTAGTGGG-3′,PCR反应下游引物序列为:5′-ACGTTGGATGAACAATGCAGCCATTCTCCC-3′;rs3781093上游引物序列为:5′-ACGTTGGATGTCAAGGCTGCTCATCTCATC-3′,下游引物序列为:5′-ACGTTGGATGTATCTTGCCTCC-GCTGTCTC-3′。PCR反应程序:94℃15 min;94℃20 s、56℃ s、72℃ 1 min,45个循环,72℃总延伸。扩增产物经2%琼脂糖凝胶电泳法对样品进行抽检结果如图1所示
1.2.3测序和分型结果 样品经SAP处理、延伸反应、产物纯化用于Nanodispenser SpectroCHIP芯片点样。将样品转移到SpectroCHIP 芯片后,即可放入质谱仪。进行MassARRAY Analyzer Compac(Sequenom,Inc.)检测,TYPER 软件分析实验结果,获得分型数据。
1.2.4血清IL-13水平的测定 采集哮喘患者及健康组外周静脉血后,离心收集血清放入-80℃冰箱用于检测。根据ELISA 试剂盒(USCN公司)说明书测定血清中IL-13的水平。

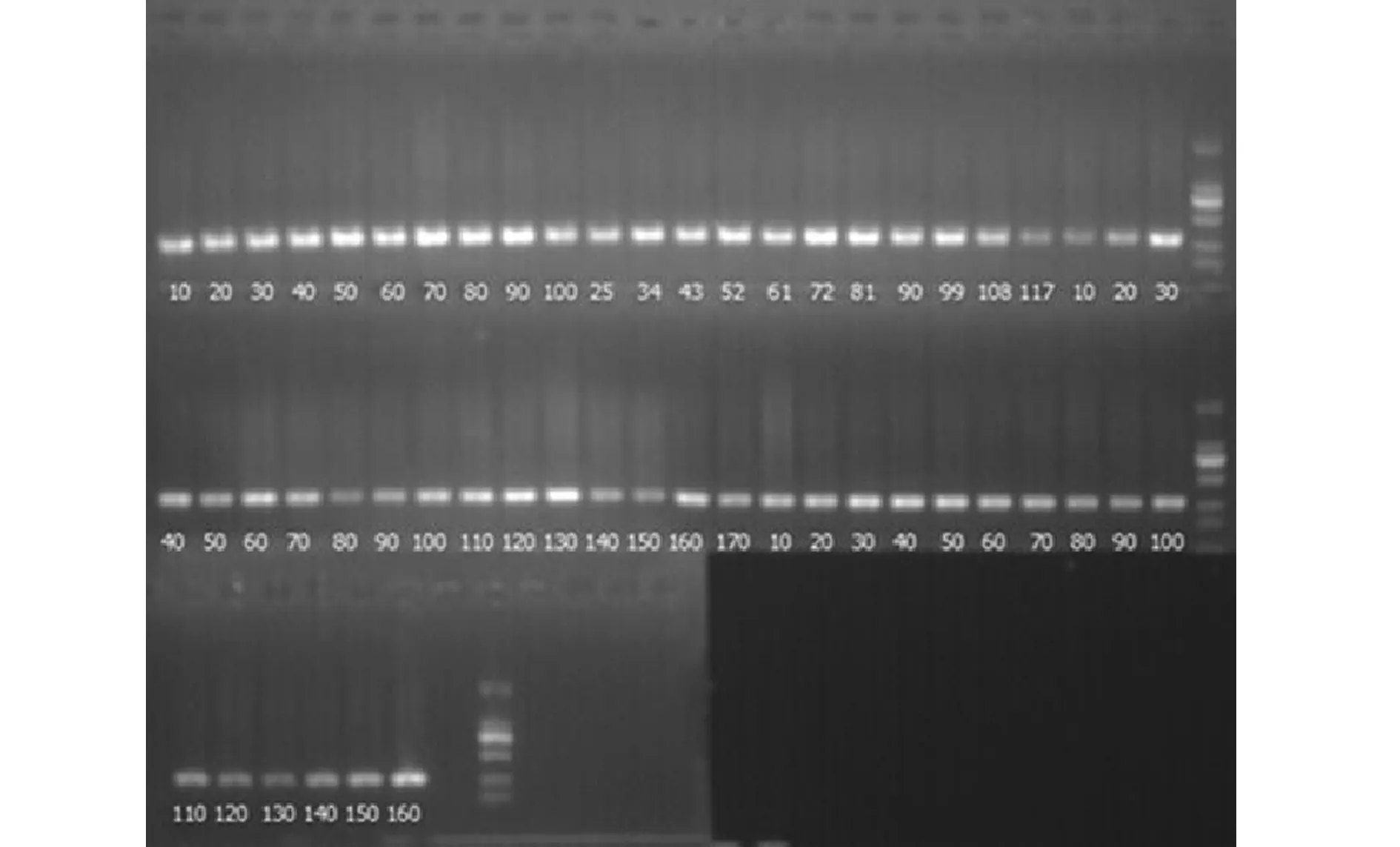
图1 PCR 产物琼脂糖凝胶电泳图Fig.1 DNA maps of PCR-RFLP
2 结果
2.1IL-13/GATA3 基因多态性位点散点图及频率分布 哮喘组及健康组IL-13/GATA3(rs2066960,rs3781093)基因多态性位点,均利用Hardy-Weinberg 遗传平衡定律检验,均符合该定律(P>0.05),说明两组均有群体代表性。
运用时间飞行质谱生物芯片系统(MassARRAY®MALDI- TOF System) 检测基因位点, 分型结果散点图显示聚类明显符合进一步探究(图2)。统计结果显示IL-13基因(rs2066960)等位基因及3种基因型分布与对照组相比差异具有统计学意义(P<0.05),等位基因的差异性风险因子OR>1,增加患病风险:哮喘组GATA3基因位点(rs3781093)的基因型TT与CC具有统计学意义(P=0.001),而等位基因频率差异无统计学意义(P=0.092),见表1。

图2 基因型质谱散点图Fig.2 Mass spectrum scatter plotNote: A.rs2066960;B.rs3781093.
2.2不同基因型对应IL-13水平变化 哮喘组血清IL-13水平(31.68±4.08)pg/ml高于对照组(16.00±2.22)pg/ml,见图3,差异具有统计学意义(P=0.000)。基因多态性位点(rs2066960)CC 基因型的哮喘患儿血清IL-13的 水平为(14.02±9.92)pg/ml,AA基因型患儿IL-13的水平为(46.12±24.96)pg/ml,两者比较差异具有统计学意义(P=0.036),见表2,图3。
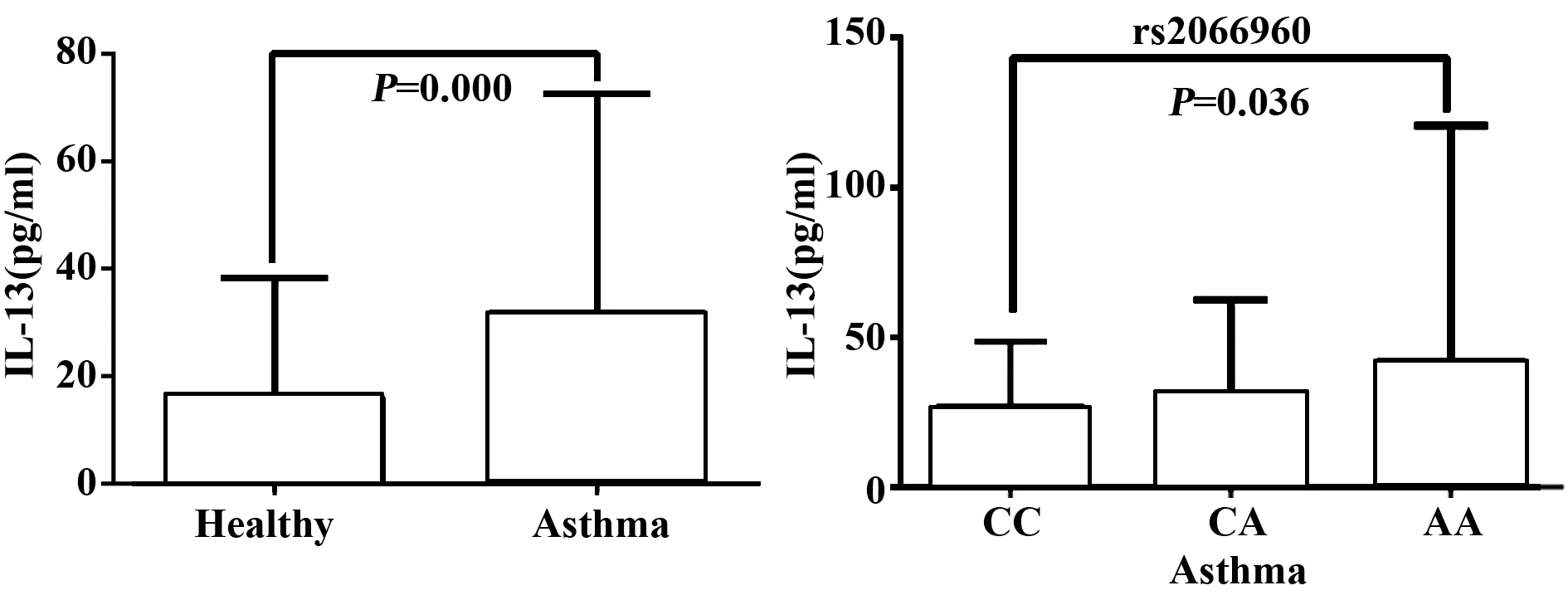
图3 哮喘患者中不同基因型IL-13的水平Fig.3 Serum levels of IL-13 with three genotypes of rs2066960 in asthmatic
表1IL-13/GATA3基因多态性位点(rs2066960,rs3781093)的基因型及等位基因频率分布[n(%)]
Tab.1GenotypeandallelefrequencydistributionsofIL-13/GATA3(rs2066960,rs3781093)inpatientswithasthmaandhealthy[n(%)]

SNPAsthma(%)Healthy(%)OR(95%CI)Prs2066960Allelen=279n=277C321(57.5)370(66.8)1A237(42.5)184(33.2)1.485(1.163-1.895)0.001GenotypeCC90(32.3)122(44.0)1AC141(50.5)126(45.5)1.517(1.055-2.181)0.025AA48(17.2)29(10.5)2.244(1.314-3.833)0.003AC+AA189(67.7)155(56.0)1.653(1.170-2.335)0.004rs3781093AlleleT354(63.4)378(68.2)1C204(26.6)176(31.8)1.238(0.966-1.587)0.092GenotypeTT120(43.0)116(41.9)1CT114(40.9)146(52.7)0.755(0.530-1.075)0.119CC45(16.1)15(5.4)2.900(1.533-5.487)0.001CT+CC159(57.0)161(58.1)0.955(0.682-1.336)0.787
表2不同基因型患儿血清中IL-13水平的比较(pg/ml)
Tab.2DistributionsofasthmaticIL-13levelsbetweengenotypesinpatientswithasthma(pg/ml)

SNPIL-13(x±s)Prs2066960CC14.02±9.921AC32.46±32.820.353AA46.12±24.960.036rs3781093TT27.23±24.031CT26.90±29.840.931CC35.02±34.380.177
3 讨论
支气管哮喘是最常见的慢性呼吸系统疾病,该疾病反复发作,给患者家庭带来了严重的经济负担,影响了患者的健康与学习生活。近年来,世界各国哮喘的患病率不断上升:我国儿科哮喘协作组与“全国哮喘患病(年龄>14岁)情况及相关危险因素流行病学调查”进行的全国规模的哮喘患病率调查显示我国哮喘患病率存在上升趋势[14]。哮喘病的发病因素复杂与基因及生长环境关,目前全基因组发现许多与哮喘病相关的基因,许多基因在部分人群中得到验证[15]。
哮喘的主要特征,例如肺嗜酸性,血清IgE浓度升高,呼吸道的高反应性和过量的呼吸道黏液分泌,被认为是由Th2细胞因子引起的,包括IL-14、IL-15、IL-13。特别是IL-13在调解呼吸道气道高反应和黏液转化过敏性哮喘中起着至关重要的作用,这些元素与哮喘疾病症状密切相关[16]。Rayees等[17]阐述了GATA3与IL-13基因之间存在的潜在联系,因此开展IL-13-GATA3通路基因多态性哮喘的相关性是有必要的。
鉴于IL-13-GATA3在哮喘发展中扮演的重要角色,国内外已经进行了大量研究探讨IL-13的基因多态性和哮喘风险之间的联系。2005年Moissidis等[18]发现了IL-13基因的多态性与美国非裔哮喘患者的相关性。2006年Kim等[19]证实了IL-13 基因和IL-13Ralpha1基因的交互作用与韩国儿童哮喘有关且风险性位点的免疫球蛋白浓度高于其他位点。2008年在委内瑞拉人口中也发现了IL-13基因的多态性与哮喘及慢性阻塞性肺病的相关性[20]。2015年Dixit等[21]发现了IL-13基因与IL-4R基因多态性的交互作用与印度儿童哮喘的相关性。Liu等[22]通过对白种人、亚洲人、非裔美国人儿童哮喘与IL-13基因多态性的Meta分析,得出IL-13基因位点突变增加儿童哮喘患病风险。金纪伟等[23]发现IL-13(rs20541)基因多态性与在中国皖南地区汉族人口支气管哮喘有关,但周广花等没能发现该基因与新疆维族人口支气管哮喘有关。
rs2066960位点SNP与哮喘病患者及免疫球蛋白的相关性已经在巴西、英国人口发现,该位点在中国西北地区人口与哮喘病及IL-13水平也有显著性差异[24,25]。在GATA3、IL-13基因的多态性与过敏性鼻炎儿童的纵列研究中,发现GATA3-IL-13的交互作用增加了儿童患病风险[26]。2016年Perez-Andreu等[27]在探究GATA3全基因组与青少年和成人的急性淋巴细胞白血病的易感性时,发现rs3781093位点与患病风险有关。GATA3(rs3781093)风险性位点与哮喘病相关,中国其他地区人口中暂未发现该位点与哮喘病的关系。此发现对探究GATA3基因的多态性与哮喘病的关系具有重大的意义。
本研究显示哮喘组患儿血清中IL-13水平高于对照组,存在显著性差异,说明血清中IL-13的水平与哮喘相关;rs2066960的基因频率与对照组有显著性差异,AA基因型有增加患哮喘的风险;ELISA结果显示AA基因型IL-13水平高于CC基因型患者且差异有统计学意义(P<0.05),表明携带AA基因型的人群患哮喘风险更大。本研究没能发现rs3781093基因型与IL-13水平的差异性,统计学数据显示没有意义,这可能与样本个体差异及样本量小有关。rs2066960位于IL-13基因的内含子区域,该位点的C-A突变与IL-13基因表达水平相关,推测该位点可能会控制IL-13水平的表达。
综上所述,本研究发现IL-13-GATA3 基因SNP位点(rs2066960,rs3781093)的基因多态性与我国西部地区哮喘易感性相关,且rs2066960多态性影响患者血清中IL-13水平的表达,该结论有助于进一步揭示哮喘的发病机制。中国是一个幅员辽阔的民族国家,应进行多民族、多地区的进一步分析,并结合环境及动物模型进一步阐述哮喘的发病机制。
[1] Murphy DM,O′Byrne PM.Recent advances in the pathophysiology of asthma[J].Chest,2010,137(6):1417-1426.
[2] Holgate ST.Innate and adaptive immune responses in asthma[J].Nat Med,2012,18(5):673-673.
[3] Huang SK,Xiao HQ,Kleinetebbe J,etal.IL-13 expression at the sites of allergen challenge in patients with asthma[J].J Immunol,1995,155(5):2688-2694.
[4] Blease K,Jakubzick C,Westwick J,etal.Therapeutic effect of IL-13 immunoneutralization during chronic experimental fungal asthma[J].J Immunol,2001,166(8):5219-5224.
[5] Walter DM,Mcintire JJ,Berry G,etal.Critical role for IL-13 in the development of allergen-induced airway hyperreactivity[J].J Immunol,2001,167(8):4668-4675.
[6] Zhang DH,Yang L,Cohn L,etal.Inhibition of allergic inflammation in a murine model of asthma by expression of a dominant-negative mutant of GATA-3[J].Immunity,1999,11(4):473-482.
[7] Takemoto N,Kamogawa Y,Jun-Lee H,etal.Chromatin remodeling at the IL-4/IL-13 intergenic regulatory region for Th2-specific cytokine gene cluster[J].J Immunol,2000,165:6687-6691.
[8] Lee HJ,Takemoto N,Kurata H,etal.Gata-3 Induces T helper cell type 2 (Th2) cytokine expression and chromatin remodeling in committed Th1 cells[J].J Exp Med,2000,192(1):105-115.
[9] Ouyang W,Ranganath SH,Weindel K,etal.Inhibition of Th1 development mediated by GATA-3 through an IL-4-independent mechanism[J].Immunity,1998,9(5):745-755.
[10] Cecile LB,Cecelia DT,Iman M,etal.Interleukin-13 gene expression is regulated by gata-3 in T cells[J].J Biolog Chemistry,2002,277:18313-18321.
[11] Zhang DH,Yang L,Ray A.Differential responsiveness of the IL-5 and IL-4 genes to transcription factor GATA-3[J].J Immunol,1998,161(8):3817-3821.
[12] Yamashita M,Ukai-Tadenuma M,Kimura M,etal.Identification of a conserved GATA3 response element upstream proximal from the interleukin-13 gene locus[J].J Biolog Chem,2002,277(44):42399-42408.
[13] Bateman ED,Hurd SS,Barnes PJ,etal.Global strategy for asthma management and prevention:GINA executive summary[J].Eur Respirat J,2008,31(1):143-178.
[14] 全国儿科哮喘协作组.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.
[15] Klaus B,Patrick S,Kasper N,etal.A genome-wide association study identifies CDHR3 as a susceptibility locus for early childhood asthma with severe exacerbations[J].Nat Genet,2014,46(1):51-55.
[16] Yang G,Volk A,Petley T,etal.Anti-IL-13 monoclonal antibody inhibits airway hyperresponsiveness,inflammation and airway remodeling.[J].Cytokine,2004,28(6):224-232.
[17] Rayees S,Malik F,Bukhari SI,etal.Linking GATA-3 and interleukin-13:implications in asthma[J].Inflammation Res,2014,63(4):255-265.
[18] Moissidis I,Chinoy B,Yanamandra K,etal.Association of IL-13,RANTES,and leukotriene C4 synthase gene promoter polymorphisms with asthma and/or atopy in African Americans[J].J Hum Genet,2005,7(6):406-410.
[19] Kim HB,Lee YC,Lee SY,etal.Gene-gene interaction between IL-13 and IL-13R|[alpha]|1 is associated with total IgE in Korean children with atopic asthma[J].J Human Genetics,2006,51(12):1055-1062.
[20] Larocca NE,Moreno D,Toro F,etal.IL-4,intron 3 variable number tandem repeats analysis (vntr),and IL-13-1055 gene polymorphism in patients with asthma and copd in venezuela[J].J Allergy Clin Immunol,2008,121(2):S77-S77.
[21] Dixit P,Awasthi S,Agarwal S.Association of interleukin genes polymorphism with asthma susceptibility in Indian children:a case-control study[J].Anna Human Biol,2015,42(6):552-559.
[22] Liu Z,Li P,Wang J,etal.A meta-analysis of IL-13 polymorphisms and pediatric asthma risk[J].Med Sci Monitor,2014,20(20):2617-2623.
[23] 金纪伟,姜玉新,刘文艳,等.IL-4R、IL-13、ADAM33基因多态性与中国皖南地区汉族人群支气管哮喘的相关性研究[J].中国免疫学杂志,2011,27(2):135-139.
[24] Grant AV,Araujo MI,Ponte EV,etal.Functional polymorphisms in IL13 are protective against high schistosoma mansoni infection intensity in a brazilian population[J].PLoS One,2012,7(5):e35863.
[25] Sadeghnejad A,Karmaus W,Arshad SH,etal.IL13,gene polymorphism association with cord serum immunoglobulinE[J].Pediat Allergy Immunol,2007,18(4):288-292.
[26] Huebner M,Kim D,Ewart S,etal.Patterns of GATA3 and IL13 gene polymorphisms associated with childhood rhinitis and atopy in a birth cohort[J].J Allergy Clin Immunol,2008,121(2):408-414.
[27] Perez-Andreu V,Roberts KG,Xu H,etal.A genome-wide association study of susceptibility to acute lymphoblastic leukemia in adolescents and young adults[J].Blood,2014,125(4):680-686.
GATA3-IL-13pathwaygenepolymorphismsareassociatedwithserumIL-13andasthma
ZHANGGuang-Yang,GUOYao-Jie,SUNYan-Yan,LIShan-Man,LUJian-Jiang,YINXiao-Wen.
SchoolofChemistryandChemicalEngineering;KeyLaboratoryforGreenProcessingofChemicalEngineeringofXinjiangBingtuan,ShiheziUniversity,Shihezi832003,China
Objective:Asthma is a chronic inflammatory respiratory disease.The data show that involvement of the GATA3-IL-13 gene in asthma is biologically plausible.The objective of this study is investigated the association of GATA3-IL13 gene polymorphisms and IL-13 levels with asthma;assess the correlations between GATA3-IL-13 gene SNPs polymorphisms and serum levels of IL-13 in population of Xinjiang (China).MethodsA case group of 279 patients and 277 healthy controls were genotyped to perform using the MassARRAY SNP genotyping system.In 279 asthma patients and 277 controls,IL-13 levels were measured by ELISA.Data were analyzed using the statistical package for social science (SPSS) 22.0 (IBM,NY,USA) and Graph Pad Prism 6.0.ResultsPatients were found that IL-13 levels were associated with asthma in asthmatic and the IL-13(rs2066960 AA),GATA3 (rs3781093 CC) genotype was associated with a notably increased risk of asthma compared with the CC (rs2066960),TT (rs3781093) genotype (P<0.05).Similarly,IL-13(rs2066960) C-A alleles were significantly associated with risk of asthma (P<0.05).However,the rs3781093 C-T alleles had no obvious differences (P>0.05).In addition,the patients carrying the rs2066960 AA genotype presented with higher IL-13 levels compared to the CC group.ConclusionThis result suggests that the rs2066960 C-A variant is associated with IL-33 levels in patients with asthma.
IL-13;GATA3;Gene polymorphisms;IL-13 levels;Asthma
10.3969/j.issn.1000-484X.2017.12.019
R392
A
1000-484X(2017)12-1849-05
①本文为国家自然科学基金资助项目(No.21567024)。
②石河子大学医学院第一附属医院,石河子 832002。
张广洋(1990年-),男,硕士,主要从事环境与基因的多态性对哮喘病的研究,E-mail:zhangguangyang_xj@163.com。
及指导教师:鲁建江(1967年-),男,博士,副教授,主要从事环境监测分析研究,E-mail:lujianjiang_xj@163.com。
尹晓文(1968年-),女,硕士,儿科主任医师,主要从事小儿支气管炎、心肌炎、充血症及多发病的治疗和研究,E-mail:lujiaying_2009@163.com。
[收稿2017-07-03 修回2017-08-14]
(编辑 张晓舟)