血清细胞因子IL-17与脱髓鞘性神经病多发性硬化相关性的研究: Meta分析①
2017-12-20马金昀张若曦程晓东
马金昀 张若曦 程晓东
(上海中医药大学附属岳阳中西医结合医院临床免疫研究所,上海 200437)
·临床免疫学·
血清细胞因子IL-17与脱髓鞘性神经病多发性硬化相关性的研究:Meta分析①
马金昀 张若曦②程晓东
(上海中医药大学附属岳阳中西医结合医院临床免疫研究所,上海 200437)
目的系统评价血清细胞因子白细胞介素17(Interluekin-17,IL-17)与脱髓鞘性神经病多发性硬化(Multiple sclerosis,MS)的相关性。方法全面检索PubMed、SpringerLink、Embases、OVID、中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)、中国生物医学文献服务系统(SinoMed)、万方医药期刊数据库(WAN FANG)等。中文检索词以“多发性硬化”和“白细胞介素17或Interleukin-17或IL-17”为并列检索词,英文检索词为“multiple sclerosis or MS”and“Interleukin-17 or IL-17”。软件版本为Review Manager 5.3,检索年限限定2000年1月1日到2017年3月10日,检索语言不限。结果最终纳入8个病例对照研究,发表年份在2008~2016年间,共纳入544例研究对象,其中MS组299例,对照组245例,合并分析结果显示:合并效应加权均差WMD=38.65,95%可信区间:(18.66,58.63),表明总体合并结果有显著性差异,即MS组血清IL-17水平明显高于对照组。结论MS患者血清IL-17水平明显高于健康人群,IL-17水平可能作为诊断MS的一个新的生物标志物和有效防治MS的一个新靶点。
白细胞介素17; 脱髓鞘;中枢神经系统;多发性硬化; Meta分析
多发性硬化(Multiple sclerosis,MS)是一种中枢神经系统(Central nervous system,CNS)炎性髓鞘脱失和神经变性的自身免疫性疾病,是青年人群最常见的脱髓鞘神经疾病,其临床特征有生活质量下降、疲劳、运动能力下降、认知功能障碍、抑郁、情绪多变等[1-3]。目前MS的诊断主要根据临床症状和炎症病变区的放射学证据,缺乏其他更精确的诊断方法。
MS患者脑病变区有大量外周T淋巴细胞浸润, 其中Th17细胞可能在MS的发病中发挥重要作用[4],其发挥作用的机制可能是通过分泌白细胞介素17(Interleukin-17,IL-17)诱导血脑屏障内皮细胞分泌CCL2、IL-6和IL-8(CXCL8) ,诱导内皮细胞活性氧簇形成,同时,IL-17可以通过破坏紧密连接蛋白的表达和影响内皮细胞的收缩性介导血脑屏障功能异常,进入CNS后进一步诱导神经小胶质细胞分泌CXCL2和IL-6,星形胶质细胞分泌IL-6、IL-1β、一氧化氮(Nitric oxide,NO),招募嗜中性粒细胞至炎症区域,促进炎症的发展[5,6]。而且,IL-17与TNF-α以协同作用的方式通过不同的内皮细胞和上皮细胞促进P-选择素、E-选择素、CXCL1、CLCL2、CXCL5、GM-CSF、G-GSF 的表达,促进氧化应激诱导少突胶质细胞的凋亡[7,8]。可以看出,IL-17促进炎症发展,介导髓鞘脱失,参与MS的发病。
目前,有较多的研究探索了血清IL-17水平与MS之间的相关性,但是这些研究证据等级较低,实验结果之间存在较大的差异性。因此,本研究运用Meta分析的方法收集所有相关研究的实验数据进行综合分析,提供更可靠的循证医学证据。
1 资料与方法
1.1检索策略 本研究采用系统综述和meta分析优先报告条目(Preferred Reporting Items for Systematic Reviews and Meta-Analysis,PRISMA)评价指南对文献质量进行评价[9]。文献检索数据库选择PubMed、SpringerLink、Embases、OVID、中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)、中国生物医学文献服务系统(SinoMed)、万方医药期刊数据库(WAN FANG)等。中文检索词以“多发性硬化”和“白细胞介素17或Interleukin-17或IL-17”为并列检索词,英文检索词为“multiple sclerosis or MS”and“Interleukin-17 or IL-17”。检索年限限定2000年1月1日到2017年3月10日,检索语言不限。
1.2文献选择
1.2.1纳入标准 (1)研究设计类型为病例对照研究;(2)MS的诊断标准为Poser或McDonald国际诊断标准;(3)涉及检测血清IL-17水平的研究,原文中数据可提取均值和标准差;(4)原始文献为公开发表文献。
1.2.2排除标准 (1)重复发表文献,剔除针对同一研究人群发表的多个文献,只选其中质量最好的或样本量最大的;(2)样本量小于10或者样本量不详的文献;(3)数据不完整,无法提取数据统计的文献;(4)动物实验;(5)发表时间在2000年以前的文献。
1.3数据提取和整理 由2名研究者独立进行,对纳入的文献进行数据提取和质量评价,结果不同时经商讨决定,商讨意见不能统一时,请该研究领域较权威的专家进行判定。文献提取的内容包括:作者、诊断标准、样本量、实验组IL-17水平、对照组IL-17水平。
1.4统计学分析 使用Review Manager 5.3分析软件,对于连续性资料血清IL-17水平采用均数差(Mean difference,MD)及其95%CI为疗效分析统计量。以P<0.05为差异有统计学意义。文献异质性分析,差异性水平设定为P=0.1,以P<0.1为存在异质性;同时采用I2值对异质性进行定量分析,以I2≥50%为异质性较大,Meta分析采用随机效应模型;以I2<50%为异质性较小,采用固定效应模型。
2 结果
2.1检索结果 从2000年1月1日到2017年3月10日,共检索到1 093篇关于IL-17和MS关系的文章,其中PubMed 186篇;SpringerLink 180篇;OVID 22篇;Embases 183篇;CNKI有225篇; VIP 20篇;SinoMed 64篇;万方数据库213篇(如图1)。经过查重后,排除重复文献450篇,对剩余643篇文献进行标题和摘要阅读,排除非病例对照研究文章、动物实验、与主题明显不相符的文献558篇,剩余85篇文献进行全文阅读,排除样本量太少、数据不完整的文献53篇,纳入文献10篇,采集文献基本信息时,有2篇采集的为非血清标本,予以排除,最终纳入8篇,其中中文4篇,英文4篇。

图1 文献筛选流程图和结果Fig.1 Literature screening process and results
表1纳入文献的基本特征
Tab.1Detailsofincludedstudies

StudyDiagnosticCriteriaCountryNumberofsubjectsExperimentalgroupControlgroupSerumlevelofIL-17(x±s,pg/ml)ExperimentalgroupControlgroupWangLJ(2016)[10]McDonaldChina454530.97±9.4425.56±5.52ZhenJ(2016)[11]McDonaldChina173056.80±12.1035.90±14.50HasheminiaSJ(2015)[12]McDonaldIran454581.91±15.0032.24±10.00TangSC(2014)[13]McDonaldChina452533.68±9.0720.17±4.97LiangJL(2014)[14]McDonaldChina202588.58±10.5517.44±1.72SuSH(2014)[15]McDonaldChina5120113.55±29.7461.93±10.71ChenYC(2012)[16]McDonaldChina393956.50±193.405.27±1.97GraberJJ(2008)[17]McDonaldAmerica371689.40±23.3036.10±11.70
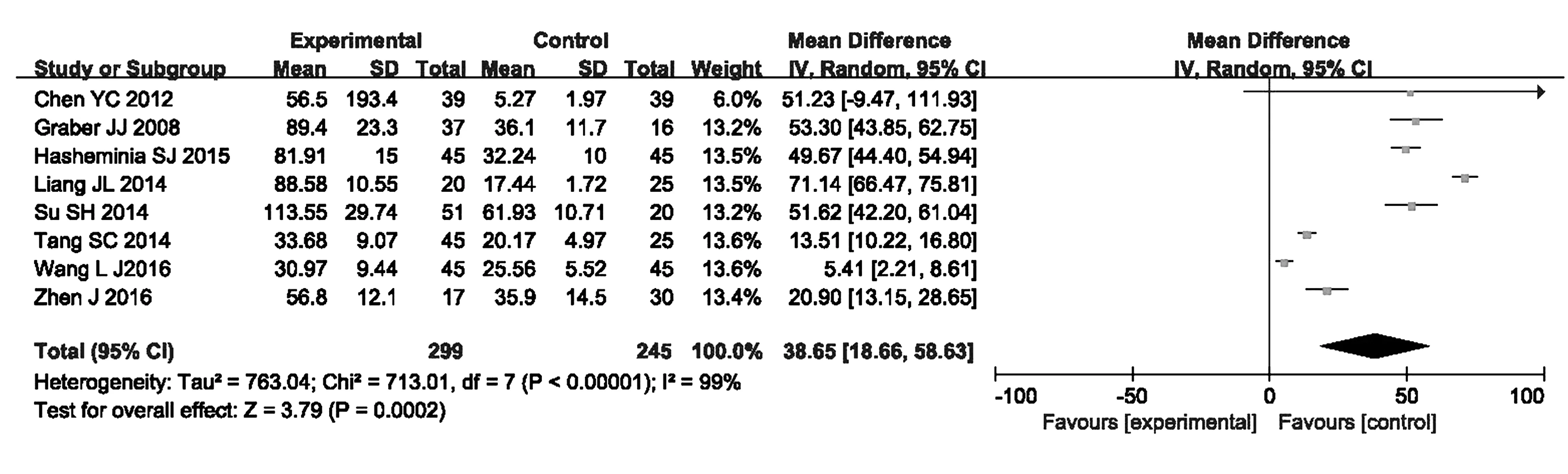
图2 血清IL-17水平与MS关系的森林图Fig.2 Forest plot showing correlation between serum IL-17 and MS
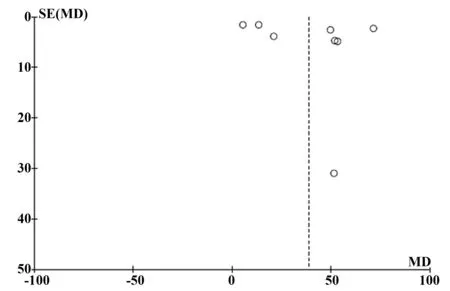
图3 血清IL-17水平与MS关系的漏斗图Fig.3 Funnel plot showing relationship between serum IL-17 and MS
2.2纳入概况 研究共纳入的8篇文献发表年份在2008~2016年间,共纳入544例研究对象,其中样本量最少45例,最多90例;其中6项研究人群来自中国,1项来自伊朗,1项来自美国,所有研究病例组均采用McDonald诊断标准,6项研究的对照组均选取体检中心来源的健康人群,2项研究为无神经系统炎性疾病病史的健康人群。纳入文献基本特征见表1。
2.3Meta分析结果
2.3.1文献异质性检验与合并分析 MS组与对照组血清IL-17水平比较,共有8项研究纳入此次分析,其中英文4篇,中文4篇,共544例样本,其中MS组299例,对照组245例。异质性检验分析结果显示,χ2=713.01,P<0.001,I2=99%,说明8个研究之间存在明显的异质性,故采用随机效应模型进行统计分析,合并效应WMD=38.65,95%可信区间:(18.66,58.63),Z=3.79,P=0.000 2,表明总体合并结果有显著性差异,即MS组血清IL-17水平明显高于对照组,提示血清IL-17水平与MS有明显相关性。分析结果见图2。
2.3.2文献发表偏倚 运用RevMan5.3对进行Meta分析的效应指标生成漏斗图,如图3所示。大部分研究的文献处于漏斗上半区域,接近MD横轴底部的下半区域只有1 个散点,处于上半区域的散点左右大致对称,提示发表偏倚尚不明显。
3 讨论
在本研究中,我们发现炎症因子IL-17在MS患者血清中明显升高,统计学有显著差异,这表明IL-17可能参与了MS的发病,血清IL-17水平可能成为MS一个新的诊断标志物和治疗靶点。
诸多研究表明在MS患者血液和脑脊液中的IL-17水平明显升高,尤其是在复发期[18-20],而且,主要分泌IL-17的Th17淋巴细胞在MS患者和MS的动物模型——实验性自身免疫性脑脊髓膜炎(Experimental autoimmune encephalomyelitis,EAE)的病变区域明显增加[21-26]。然而,在神经炎症中IL-17的作用仍然是不完全清楚的,它不是经典的主动或被动转移诱导EAE所必需的致病因素[27-30],尽管它可以导致病情加重[31]。由于IL-17在MS中发挥重要作用,但在人体研究其机理相对困难,因此,现在越来越多的研究聚焦在MS的动物模型EAE中IL-17的作用机制。
目前,MS/EAE中研究最深入的CNS实质细胞可能是星形胶质细胞,不管人体还是小鼠的星形胶质细胞均表达IL-17受体,可以与IL-17结合,从而产生细胞因子和趋化因子,包括IL-6、TNF-α、CCL2 (MCP-1)、CCL3 (MIP-1α)、CCL20(MIP-3α)、 CXCL1 (GROα)、CXCL2 (MIP-2)、CXCL9(MIG)、CXCL10 (IP-10)、CXCL11 (IP-9),表明了无论在体外还是体内,小鼠星形胶质细胞表面IL-17受体通过与IL-17结合在EAE的疾病进展中发挥重要作用,对人的星形胶质细胞体外培养发现同样的作用[32-34]。IL-17单独或和TNF-α协同可以促进IL-6的产生,进一步促进T淋巴细胞向Th17细胞分化[35],IL-17还可以促进小鼠星形胶质细胞IL-6受体信号通路,诱导CCL20的释放,CCL20可以诱导CCR6+Th17细胞向炎症部位趋化[36]。NF-κB是调节细胞因子和趋化因子表达的一个重要的转录因子,它可以被泛素修饰酶A20负向调控,研究发现,星形胶质细胞特异的A20缺失,增加NF-κB信号通路的表达,从而加剧EAE病情,有趣的是,A20在EAE中的功能是通过microRNA-873靶向负调控的,而microRNA-873是通过IL-17信号诱导的[37]。IL-17受体信号级联下游的一个关键的衔接分子Act1,它在很多研究中作为IL-17受体的替代物使用,在诱导EAE小鼠发病前和已经诱导发病的EAE小鼠中,靶向敲除CNS中的Act1,均可以改善EAE小鼠疾病评分,这种疾病改善作用与阻断大量免疫细胞在CNS的浸润有关[38,39]。以上多个研究均表明IL-17信号与EAE发生有显著的相关性。
在MS/EAE的CNS病损区,可以看到大量活化的神经小胶质细胞,神经小胶质细胞作为脑内常驻的固有免疫细胞,除具有免疫监视和防御功能外,是脑内炎性病变的主要效应细胞,目前关于IL-17在EAE神经小胶质细胞中的作用了解仍然非常浅陋。研究表明,神经小胶质细胞在静息态时低表达IL-17受体,在EAE发病期明显上调[40]。在体外实验中,用IL-17刺激神经小胶质细胞可以上调炎症介质的表达,包括IL-6、CXCL2,在经LPS刺激活化的神经小胶质细胞中,IL-17可以增加iNOS和NO的表达,因此触发神经小胶质细胞的细胞毒作用,诱导少突胶质细胞凋亡或坏死[41]。当神经小胶质细胞与产生IL-17的Th1/Th17细胞共培养时,小胶质细胞产生大量的IL-1β、IL-6、TNF-α,从而促进组织损伤及T淋巴细胞向Th17细胞分化,但是,在小胶质细胞单独与Th1细胞共培养时,并未产生这些细胞因子[42],可以看出,IL-17在脱髓鞘病变中发挥不可取代的作用。
在MS/EAE发展过程中,T淋巴细胞进入CNS在炎症区域大量浸润被认为是分为两波进入,初期,少量的T细胞通过CCR6-CCL20依赖的机制穿过脉络丛进入CNS,经过一系列过程,诱导第二波——大量的T细胞穿过血脑屏障进入CNS[43]。血脑屏障由连续毛细血管内皮及其细胞间的紧密连接、基膜、周细胞以及星形胶质细胞脚板围成的神经胶质膜构成,其中内皮是血脑屏障的主要结构。在MS发病期或EAE进展期,血脑屏障的周围大量富集Th17细胞和它产生的细胞因子,星形胶质细胞表面的IL-17受体与IL-17结合发生反应,诱导血脑屏障忽视对Th17细胞及其细胞因子的屏障作用,人的血脑屏障的内皮细胞可以在体外作为单层细胞被培养模拟血脑屏障进行体外实验,结果显示,IL-17能独立增加这个屏障的通透性,下调了关键的紧密结合蛋白,包括闭合蛋白和闭锁小带(ZO-1),除此之外,IL-17还可以诱导前炎症细胞因子和趋化因子(IL-6、CCL2、CXCL8)表达,促进CD4+T细胞迁移至炎症区域[44]。IL-17介导的屏障破坏伴随着紧密结合蛋白的下调和紊乱,也可以增加ICAM-1依赖的单核细胞黏附,从而促进单核细胞穿过内皮细胞层介导炎症反应,研究发现,通过药物抑制IL-17诱导的内皮细胞的收缩机制缺陷,使得CNS浸润的淋巴细胞明显减少,且阻碍了单核细胞通过血脑屏障,显著改善了EAE的病情[45],这两个实验对IL-17信号在MS/EAE的血脑屏障内皮细胞中的作用提供了重要的证据,但对于此方向的研究仍存在很多不解之谜。
髓鞘脱失进而导致神经元的轴突损伤是MS/EAE最终的病理结局,细胞因子IL-17是髓鞘脱失和损伤神经元的重要因素。近期的一个研究表明,MS患者脑脊液中IL-17水平与对照组相比明显增加,而且,其脑脊液中IL-17的水平与脑脊液中的谷氨酸盐水平呈正相关,说明Th17细胞分泌的IL-17是介导谷氨酸盐兴奋毒性的一个潜在的病理机制[46]。Siffrin等[47]研究发现,在EAE小鼠脊髓组织的活体镜检下的炎症区域内,分泌IL-17的Th17细胞与神经元形成免疫突触,这成为Th17细胞对神经元发挥毒性的间接证据。IL-17是一个损伤海马室下区和颗粒下层的神经干细胞敏感的细胞因子,在体外神经干细胞培养时加入IL-17明显抑制了神经球的增长,但没有诱导其凋亡,而且,IL-17抑制神经干细胞的增殖和分化,尤其是抑制向星形胶质细胞和少突胶质细胞分化,从而阻断了新的髓鞘再生[48]。
4 结论
本次Meta分析结果显示,血清IL-17水平与脱髓鞘神经疾病MS具有明显的相关性,MS患者血清IL-17水平明显高于健康人群,因此,血清IL-17水平可能成为MS一个新的诊断标志物和治疗靶点。
[1] Lucchinetti CF,Popescu BF,Bunyan RF,etal.Inflammatory Cortical Demyelination in Early Multiple Sclerosis.[J].N Engl J Med,2011,365(24):2188-2197
[2] Oksenberg JR,Baranzini SE.Multiple sclerosis genetics—is the glass half full,or half empty?[J].Nat Rev Neurol,2010,6(8):429-437.
[3] Winkelmann A,Loebermann M,Reisinger EC,etal.Disease-modifying therapies and infectious risks in multiple sclerosis[J].Nat Rev Neurol,2016,12(4):217-233
[4] Wing AC,Hygino J,Ferreira TB,etal.Interleukin-17 and interleukin-22 secreting myelin-specific CD4(+) T cells resistant to corticoids are related with active brain lesions in multiple sclerosis patients[J].Immunol,2016,147(2):212-220.
[5] Larochelle C,Alvarez JI,Prat A.How do immune cells overcome the blood brain barrier in multiple sclerosis?[J].FEBS Lett,2011,585:3770-3780.
[6] Douguet L,Bod L,Lengagne R,etal.Nitric oxide synthase 2 is involved in the pro-tumorigenic potential of γδ17 T cells in melanoma[J].Oncoimmunology,2016,5(8):e1208878.
[7] Griffin GK,Newton G,Tarrio ML,etal.IL-17 and TNF-alpha sustain neutrophil recruitment during inflammation through synergistic effects on endothelial activation[J].J Immunol,2012,188:6287-6299.
[8] Paintlia MK,Paintlia AS,Singh AK,etal.Synergistic activity of interleukin-17 and tumor necrosis factor-alpha enhances oxidative stress-mediated oligodendrocyte apoptosis[J].J Neurochem,2011,116:508-521.
[9] Liberati A,Altman DG,Tetzlaff J,etal.The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions:explanation and elaboration[J].J Clin Epidemiol,2009,62(10):1-34.
[10] 王利娟,李晓玲,谢沁芳,等.多发性硬化患者IL-17、IL-27 水平的动态表达及意义[J].免疫学杂志,2016,32(7):616-618.
[11] 甄 瑾,马翔凌,傅永旺,等.多发性硬化患者外周血IL-17A、IL-23、TGF-β1 的水平及临床研究[J].世界最新医学信息文摘,2016,16 (99):86-87.
[12] Hasheminia SJ,Tolouei S,Zarkesh-Esfahani SH,etal.Cytokines gene expression in newly diagnosed multiple sclerosis patients[J].Iran J Allergy Asthma Immunol,2015,14(2):208-216.
[13] Tang SC,Fan XH,Pan QM,etal.Decreased expression of IL-27 and its correlation with Th1 and Th17 cells in progressive multiple sclerosis[J].J Neurolog Sci,2015,348 :174-180.
[14] 梁军利,钱 琪,马晓丽,等.白细胞介素-17A 在复发缓解型多发性硬化发病机制中的作用研究[J].实用医学杂志,2014,30(3):409-411.
[15] 苏绍红,张俊峰.多发性硬化患者血清IL-17、IL-10 、TGF-β1及调节T 细胞水平检测的临床意义[J].医药论坛杂志,2014,35(5):12-13.
[16] Chen YC,Chen SD,Miao L,etal.Serum levels of interleukin (IL)-18,IL-23 and IL-17 in Chinese patients with multiple sclerosis[J].J Neuroimmunol,2012,243:56-60.
[17] Graber JJ,Allie SR,Mullen KM,etal.Interleukin-17 in transverse myelitis and multiple sclerosis[J].J Neuroimmunol,2008,196 :124-132.
[18] Guerrero-García Jde J,Castaeda-Moreno VA,Torres-Carrillo N,etal.Interleukin-17A levels vary in relapsing-remitting multiple sclerosis patients in association with their age,treatment and the time of evolution of the disease[J].Neuroimmunomodulation,2016,23(1):8-17.
[19] Durelli L,Conti L,Clerico M,etal.T-helper 17 cells expand in multiple sclerosis and are inhibited by interferon-beta[J].Ann Neurol,2009,65:499-509.
[20] Brucklacher-Waldert V,Stuerner K,Kolster M,etal.Phenotypical and functional characterization of T helper 17 cells in multiple sclerosis[J].Brain,2009,132:3329-3341.
[21] Jafarzadeh A,Azizi SV,Nemati M,etal.Ginger extract reduces the expression of IL-17 and IL-23 in the sera and central nervous system of EAE mice[J].Iran J Immunol,2015,12(4):288-301.
[22] 孙 博,李呼伦.在多发性硬化的免疫病理过程中不同免疫细胞的作用[J].中国免疫学杂志,2015,31(12):1585-1590.
[23] 龚业莉,李佳楠,黄丽霞.高丽参提取液对大鼠自身免疫性脑脊髓膜炎的保护作用[J].中国免疫学杂志,2016,32(11):1632-1635.
[24] Tzartos JS,Friese MA,Craner MJ,etal.Interleukin-17 production in central nervous system-infiltrating T cells and glial cells is associated with active disease in multiple sclerosis[J].Am J Pathol,2008,172:146-155.
[25] Larochelle C,Cayrol R,Kebir H,etal.Melanoma cell adhesion molecule identifies encephalitogenic T lymphocytes and promotes their recruitment to the central nervous system[J].Brain,2012,135:2906-2924.
[26] Schulze-Topphoff U,Prat A,Prozorovski T,etal.Activation of kinin receptor B1 limits encephalitogenic T lymphocyte recruitment to the central nervous system[J].Nat Med,2009,15:788-793.
[27] Yang J,Kou J,Lim JE,etal.Intracranial delivery of interleukin-17A via adeno-associated virus fails to induce physical and learning disabilities and neuroinflammation in mice but improves glucose metabolism through AKT signaling pathway[J].Brain Behav Immun,2016,53:84-95.
[28] Codarri L,Gyulveszi G,Tosevski V,etal.RORgammat drives production of the cytokine GM-CSF in helper T cells,which is essential for the effector phase of autoimmune neuroinflammation[J].Nat Immunol,2011,12:560-567.
[29] EI-Behi M,Ciric B,Dai H,etal.The encephalitogenicity of T(H)17 cells is dependent on IL-1-and IL-23-induced production of the cytokine GM-CSF[J].Nat Immunol,2011,12:568-575.
[30] Kroenke MA,Segal BM.IL-23 modulated myelin-specific T cells induce EAE via an IFN gamma driven,IL-17 independent pathway[J].Brain Behav Immun,2011,25:932-937.
[31] Mardiguian S,Serres S,Ladds E,etal.Anti-IL-17A treatment reduces clinical score and VCAM-1 expression detected by in vivo magnetic resonance imaging in chronic relapsing EAE ABH mice[J].Am J Pathol,2013,182:2071-2081.
[32] Liu G,Guo J,Liu J,etal.Toll-like receptor signaling directly increases functional IL-17RA expression in neuroglial cells[J].Clin Immunol,2014,154:127-140.
[33] Xiao Y,Jin J,Chang M,etal.TPL2 mediates autoimmune inflammation through activation of the TAK1 axis of IL-17 signaling[J].J Exp Med,2014,211:1689-1702.
[34] Yi H,Bai Y,Zhu X,etal.IL-17A induces MIP-1alpha expression in primary astrocytes via Src/MAPK/PI3K/NF-kB pathways:implications for multiple sclerosis[J].J Neuroimmune Pharmacol,2014,9:629-641.
[35] Elain G,Jeanneau K,Rutkowska A,etal.The selective anti-IL17A monoclonal antibody secukinumab (AIN457) attenuates IL17A-induced levels of IL6 in human astrocytes[J].Glia,2014,62:725-735.
[36] Meares GP,Ma X,Qin H,etal.Regulation of CCL20 expression in astrocytes by IL-6 and IL-17[J].Glia,2012,60:771-781.
[37] Wang X,Deckert M,Xuan NT,etal.Astrocytic A20 ameliorates experimental autoimmune encephalomyelitis by inhibiting NFkappaB-and STAT1-dependent chemokine production in astrocytes[J].Acta Neuropathol,2013,126(5):711-724.
[38] Yan Y,Ding X,Li K,etal.CNS-specific therapy for ongoing EAE by silencing IL-17 pathway in astrocytes[J].Mol Ther,2012,20:1338-1348.
[39] Kang Z,Altuntas CZ,Gulen MF,etal.Astrocyterestricted ablation of interleukin-17-induced Act1-mediated signaling ameliorates autoimmune encephalomyelitis[J].Immunity,2010,32:414-425.
[40] Das Sarma J,Ciric B,Marek R,etal.Functional interleukin-17 receptor A is expressed in central nervous system glia and upregulated in experimental autoimmune encephalomyelitis[J].J Neuroinflamm,2009,6:14.
[41] Kawanokuchi J,Shimizu K,Nitta A,etal.Production and functions of IL-17 in microglia[J].J Neuroimmunol,2008,194:54-61.
[42] Murphy AC,Lalor SJ,Lynch MA,etal.Infiltration of Th1 and Th17 cells and activation of microglia in the CNS during the course of experimental autoimmune encephalomyelitis[J].Brain Behav Immun,2008,24:641-651.
[43] Reboldi A,Coisne C,Baumjohann D,etal.C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE[J].Nat Immunol,2009,10:514-523.
[44] Kebir H,Kreymborg K,Ifergan I,etal.Human TH17 lymphocytes promote blood-brain barrier disruption and central nervous system inflammation[J].Nat Med,2007,13:1173-1175.
[45] Huppert J,Closhen D,Croxford A,etal.Cellular mechanisms of IL-17-induced blood brain barrier disruption[J].Faseb J,2010,24:1023-1034.
[46] Kostic M,Dzopalic T,Zivanovic S,etal.IL-17 and glutamate excitotoxicity in the pathogenesis of multiple sclerosis[J].Scand J Immunol,2014,79:181-186.
[47] Siffrin V,Radbruch H,Glumm R,etal.In vivo imaging of partially reversible th17 cell-induced neuronal dysfunction in the course of encephalomyelitis[J].Immunity,2010,33:424-436.
[48] Li Z,Li K,Zhu L,etal.Inhibitory effect of IL-17 on neural stem cell proliferation and neural cell differentiation[J].BMC Immunol,2013,14:20.
CorrelationbetweenserumcytokineIL-17anddemyelinatingneuropathymultiplesclerosis:aMeta-analysis
MAJin-Yun,ZHANGRuo-Xi,CHENGXiao-Dong.
InstituteofClinicalImmunology,PharmaceuticalResearchLaboratory,YueyangHospitalofIntegratedTraditionalChineseandWesternMedicine,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200437,China
Objective:To evaluate the association with serum Interleukin-17(IL-17) and multiple sclerosis (MS) systematically evaluated.MethodsThe retrieval words of "multiple sclerosis or MS" and "interleukin-17 or IL-17" were searched in PubMed,SpringerLink,Embases,OVID,China National Knowledge infrastructure (CNKI),Chinese VIP database,Chinese Biomedical Literature Database (CBM),Wan Fang Database through computer.Review Manager 5.3.was selected as the software edition.The time frame was ranged from January 1,2000 to March 10,2017.The language was not restricted.ResultsEventually 8 case-control studies were included with 544 cases.We found that the serum IL-17 level was associated with MS according to the weighted mean difference and 95% confidence interval (WMD = 38.65;95% CI:18.66,58.63),which had significant difference in statistics.ConclusionThe serum IL-17 level increases the risk of MS,suggesting that the serum IL-17 level can be used as a predictive biomarker for MS development and a target for MS effective prevention and treatment.
Interleukin-17;Demyelination;Central nervous system;Multiple sclerosis;Meta-analysis
10.3969/j.issn.1000-484X.2017.12.016
R446.6
A
1000-484X(2017)12-1832-06
①本文受国家自然科学基金面上项目(No.81173630,No.81673669)和上海中医药大学中医学高峰学科建设项目(No.30304114323)资助。
②上海中医药大学附属岳阳中西医结合医院药学研究室,上海 200437。
马金昀(1990年-),女,硕士,研究实习员,主要从事中枢神经系统自身免疫性疾病的研究,E-mail:wasdn2014xy@163.com。
及指导教师:程晓东(1965年-),男,博士,教授,博士生导师,主要从事神经免疫、肿瘤免疫方面的研究,E-mail:xdcheng_8@yeah.net。
[收稿2017-06-07 修回2017-08-08]
(编辑 张晓舟)