miR-125b调控ART4蛋白对肝癌细胞增殖和侵袭的影响①
2017-12-20李建华杨志良
李建华 韩 玲 杨志良
(新乡市中心医院普外科,新乡 453000)
miR-125b调控ART4蛋白对肝癌细胞增殖和侵袭的影响①
李建华 韩 玲 杨志良
(新乡市中心医院普外科,新乡 453000)
目的探讨miR-125b对ART4蛋白的调控作用及在肝癌细胞中对其增殖和侵袭能力的影响。方法qPCR检测肝癌组织和肝癌细胞中miR-125b的表达情况;过表达miR-125b 后qPCR检测ART4的表达;双荧光素酶实验检测miR-125b和ART4的关系;MTT实验检测过表达miR-125b对肝癌细胞增殖能力的影响;Transwell侵袭实验检测miR-125b的过表达对肝癌细胞侵袭能力的影响;MTT实验检测过表达ART4后逆转miR-125b对肝癌细胞增殖能力的影响;Transwell侵袭实验检测过表达ART4后逆转miR-125b对肝癌细胞侵袭能力的影响。结果miR-125b在肝癌细胞中表达水平较低,过表达miR-125b可以有效抑制ART4蛋白的表达;过表达miR-125b可以抑制肝癌细胞的增殖侵袭能力;过表达ART4后可以逆转肝癌细胞被miR-125b抑制的增殖侵袭能力。结论miR-125b在肝癌中表达下调,同时miR-125b可以调控ART4的表达影响肝癌细胞增殖和侵袭能力。
miR-125b;肝癌;ART4;Transwell
肝细胞癌(Hepatocellular carcinoma,HCC)是全球第二大癌症死亡原因,是恶性肿瘤中发病率和死亡率居高不下的一种类型[1]。尽管目前针对肝细胞癌的手术、化疗和生物治疗方法都在不断改善,但由于其本身高转移率和术后高复发率,肝细胞癌患者的预后现状很差,不能达到令人满意的程度[2]。因此,研究肝癌发病的高危因素和了解其具体分子发病机制对改善肝癌患者的治疗至关重要。
微小RNA(microRNA)是由20~24个核苷酸编码的非蛋白质RNA,其可以通过靶向结合mRNA下游的39个非翻译区位点,进而调控其靶基因的表达水平,干扰mRNA降解和翻译过程[3,4]。目前已经鉴定出多种miRNA异常表达,与多种类型的恶性肿瘤进展相关[5,6]。最近有研究发现,miRNA在肝细胞癌中明显下调,并且也显示肝细胞癌的发生,转移,复发和预后有一定相关关系[7,8]。然而,需要进一步的研究来确定miRNA对肝细胞癌发生发展的具体分子机制。以往研究报道,位于染色体脆性位点或异常基因组区域的几种miRNA在人类恶性肿瘤的进展中起着致癌或抑癌作用[9]。 MiR-125b位于19q13,在多种人类肿瘤表达水平下调,例如,在乳腺癌ERBB2依赖性SKBR3细胞系中,通过过表达MiR-125b可以抑制乳腺癌细胞的生长,迁移和侵袭行为[10]。研究人员发现miR-125b可以抑制人胃癌细胞的增殖和侵袭,甚至减弱其耐药性的产生[11]。此外,miR-125b在非小细胞肺癌中也存在表达水平降低的状态,对肺癌细胞的侵袭和迁移具有抑制作用[12]。miR-125b的过度表达可以诱导高侵袭性卵巢癌细胞从间充质转化为上皮形态,这表明miR-125b是卵巢EMT的负调节因子[13]。然而,目前尚没有相关研究miR-125b在肝细胞癌中的表达和作用。
ART4是一类在结构上与ADP-核糖基转移酶类似的修饰蛋白,其可以共价修饰细胞内影响细胞运动的靶蛋白,调控细胞的运动能力[14]。哺乳动物中ART由5名成员组成中分别是ART1~ART5,其中ART4已经在小鼠模型进行了广泛的研究[15]。在5个已知的ART中,只有ART1、ART2和ART4才具有特异酶活性,ART3和ART5似乎已经失去了相应的催化活性,通常ART4在哺乳动物中表现为活跃蛋白[16]。因此,探讨ART4的编码序列及蛋白功能发展方式是目前研究的主要方向。
在本研究中,我们将肝细胞癌组织与配对邻近非肿瘤肝组织相比,miR-125b在肝细胞癌组织中表达明显下调,且miR-125b的异常表达可以抑制体外和体内肝癌细胞株的增殖和侵袭行为。因此,我们通过研究miR-125b与ART4的关系来进一步探讨其对肝细胞癌抑制作用的具体机制。
1 材料与方法
1.1细胞株和相关试剂 细胞系和人体样本人类肝癌细胞(SMMC7721,MHCC97L,MHCC97H)由复旦大学中山医院肝癌研究所提供。 HepG2细胞系获自武汉典型培养物保藏中心(ATCC号:HB-8065,Manassas,VA)。将所有细胞系在1640 DMEM培养基,含有10%FBS,100 mg/ml青霉素和100 mg/ml链霉素的培养基中,37℃在5%CO2培养箱中培养。来自医院病理科的80例患者的组织型肝癌组织均获得了医院保护人类受试者委员会的批准,并获得了所有患者的知情同意书。
1.2方法
1.2.1qPCR实验 使用Trizol(Invitrogen)从细胞系和组织样品中提取总RNA,并通过测量其在260 nm处的吸光度来定量测定总RNA的浓度。使用SYBRH Green PCR Kit进行qPCR分析。miR-125b和U6 snRNA的引物(内部对照)购自QIAGEN(MS00003423和MS00033740)。使用22DDCT方法计算肝癌组织和相邻非肿瘤肝组织的mRNA的倍数变化。通过qPCR测定肝细胞癌细胞株中的相对mRNA水平,使用GAPDH作为内部对照引物。实验重复3次。所使用的基因的引物如下。miR-125b的前体序列如下生成:正向5′-CTATGTTTGAATGA GGCTTCAG-3′和反向5′-CGCGTCGCCGCGTGTTT-AAACG-3′。
1.2.2Western印迹分析 使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,并将其转移到硝酸纤维素膜(Bio-Rad,Hercules,CA)。使用5%脱脂牛奶充分封闭膜,并与ART4抗体(浓度1∶1 000),内参GAPDH(浓度1∶2 000),4℃,孵育过夜。次日,TBST充分冲洗过后,使用二抗辣根酶标记物(浓度1∶5 000)孵育2 h,TBST充分冲洗过后,使用增强的化学发光试剂ECL显影液检测目标蛋白的表达水平。
1.2.3荧光素酶报告基因测定 验证miR-125b和ART4的相关关系,我们使用双荧光素酶测定,将24孔板中的miR-125b或NC细胞与0.4 mg萤火虫荧光素酶报告载体和0.08 mg含有海肾萤光素酶(Promega)的pRL-TK对照载体共转染,使用siPORTneoFX(Ambion,Austin,TX),根据使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定(Applied Biosystems)测量荧光素酶活性。将萤火虫荧光素酶活性标准化后测定海肾萤光素酶活性。实验重复3次。所使用的miR-125序列见上述1.2.1。
1.2.4MTT测定肝细胞癌细胞增殖的速度 将对数期细胞使用胰蛋白酶消化后,制成单细胞悬浮液并以1×103细胞/孔的密度接种到96孔板中。在细胞培养7 d后,加入20 μl MTT测定液,每孔充分混合均匀,并在37℃下孵育4~6 h。然后使用无菌吸管吸出上清液,每孔加入150 μl二甲基亚砜(DMSO),在室温下搅拌10 min保证晶体充分溶解。然后在24、48、72和96 h进行MTT测定波长为490 nm时的吸光度,计算肝癌细胞的增殖情况。实验重复3次
1.2.5细胞侵袭测定 对肝癌细胞进行细胞迁移和侵袭能力测定。将SMMC7721细胞在含有0.1%FBS的DMEM中培养。 24 h后,在没有FBS或HGF的DMEM中的2×105个饥饿过的细胞用含有基质胶的小室(直径6.5 mm,孔径为8 μmol/L,Corning,NY,USA)接种在上室中,将具有10%FBS和HGF(20 ng/ml)的培养基置于下腔中。在37℃下孵育24 h后,小心地去除上膜表面上的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净过后,于倒置显微镜下计数。三次独立测定后取其平均值。
1.3统计学分析 所有的统计分析均采用SPSS 16.0软件包(SPSS,Chicago,IL)进行,P<0.05表示差异具有统计学意义。使用Wilcoxon秩和检验分析miR-125b在肝细胞癌和配对邻近组织中的差异表达。采用单因素方差分析方法评估细胞增殖和侵袭试验三项之间差异,采用最小差别t检验分析两组。
2 结果
2.1MiR-125b在肝细胞癌组织和不同细胞株中的表达情况 使用qPCR检测80例患者的肝细胞癌和配对临近非肿瘤肝组织中miR-125b的表达情况。结果表明,与匹配的相邻肝组织相比,miR-125b的表达在肝细胞癌组织中下调(图1A)。在不同肝癌细胞株中,在所有4种肝癌细胞株(SMMC-7721、HepG2、MHCC-97L和HCC-LM3)中观察到miR-125b的表达均较低,未超过50%相对表达量,其中(图1B) SMMC-7721和其他细胞株相比,miR-125b表达最低,而且SMMC-7721的侵袭性相对较强。因此,我们选择了SMMC-7721细胞株进行后续研究。
2.2双荧光素酶验证miR-125b与ART4的关联 我们通过生物信息学分析发现,下游几种致瘤性相关基因可作为miR-125b的潜在靶标,包括MMP11、ERBB2、ERBB3、EDN1、VEGF-A、ART4和BCL-9L等等。而且miR-125b和下游ART4基因有相似可结合的位点,为了验证二者之间是否有调节关系,我们进行双荧光素酶标记实验。首先我们构建了携带3′-UTR的荧光素酶报告因子,其中每个基因的结合位点与miR-125b结合位点相对应。荧光素酶测定显示miR-125b下游结合3′-UTR结合位点与ART4相符合,而不是其他靶点基因,过表达miR-125b可以导致荧光素酶活性的显著降低(图2B)。过表达miR-125b后可明显抑制SMMC-7721细胞中ART4的表达(图2A)。表明miR-125b可以调控下游ART4的基因表达情况,可能是通过调控ART4的表达影响肝癌细胞株的生物学行为。

图1 miR-125b的表达在肝癌癌组织和细胞株中的表达Fig.1 Expression of miR-125b in liver cancer tissues and cell linesNote: *.P<0.05.
2.3过表达MiR-125b抑制肝癌细胞株的增殖能力 为了研究miR-125b对肝细胞癌增殖能力的影响,使用SMMC-7721细胞株进行质粒转染以增加miR-125b的表达。如图3所示,与对照组相比,qPCR分析证实,转染miR-125-mimic后,SMMC-7721细胞株中miR-125b表达水平明显上调。然后进行MTT实验检测miR-125b对SMMC-7721细胞增殖情况的影响。miR-125b-mimic组的细胞的生长速度比其对照组明显减慢(P<0.01),培养96 h后抑制效果显示具有统计学意义(图3)。综上所述,过表达miR-125b后可以明显抑制SMMC-7721肝癌细胞株的增殖能力。

图2 miR-125b与ART4之间的相互关系Fig.2 Relationship between miR-125b and ART4Note: A.Effect of miR-125b on expression of ART4;B.Double luciferase to verify the relationship between miR-125b and ART4,*.P<0.05.

图3 miR-125b对肝癌细胞增殖能力的影响Fig.3 Effect of miR-125b on proliferation of liver cancer cells
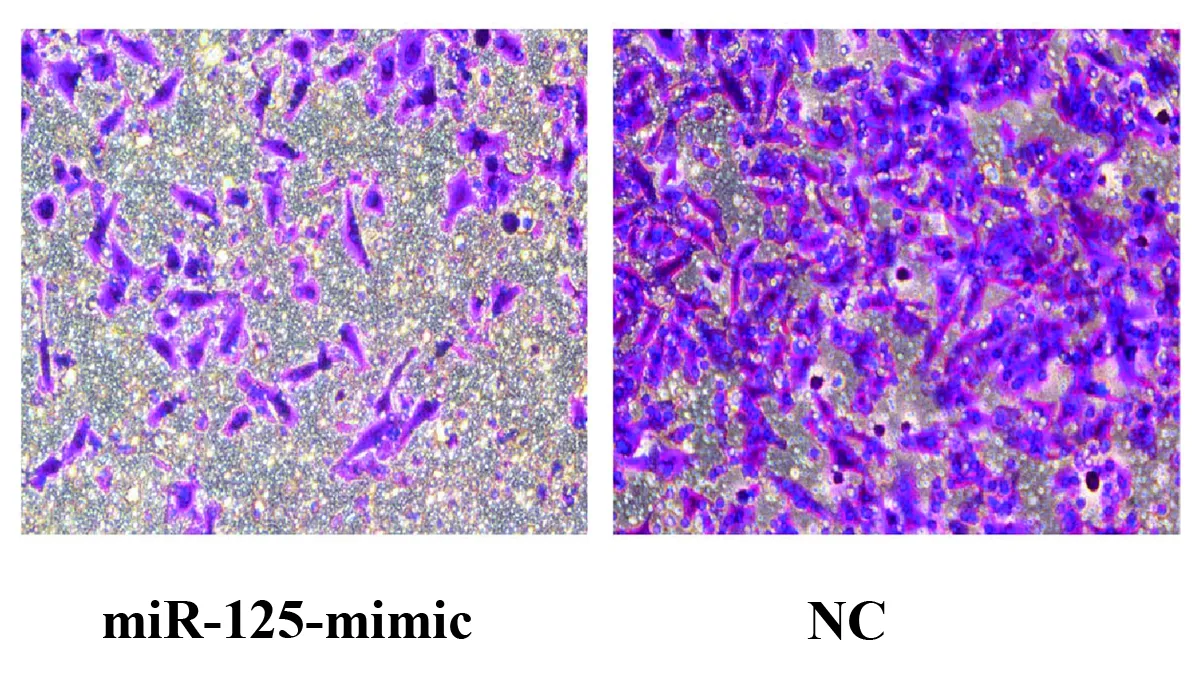

图4miR-125b对肝癌细胞侵袭能力的影响
Fig.4EffectofmiR-125boninvasionoflivercancercells
Note: *.P<0.05.
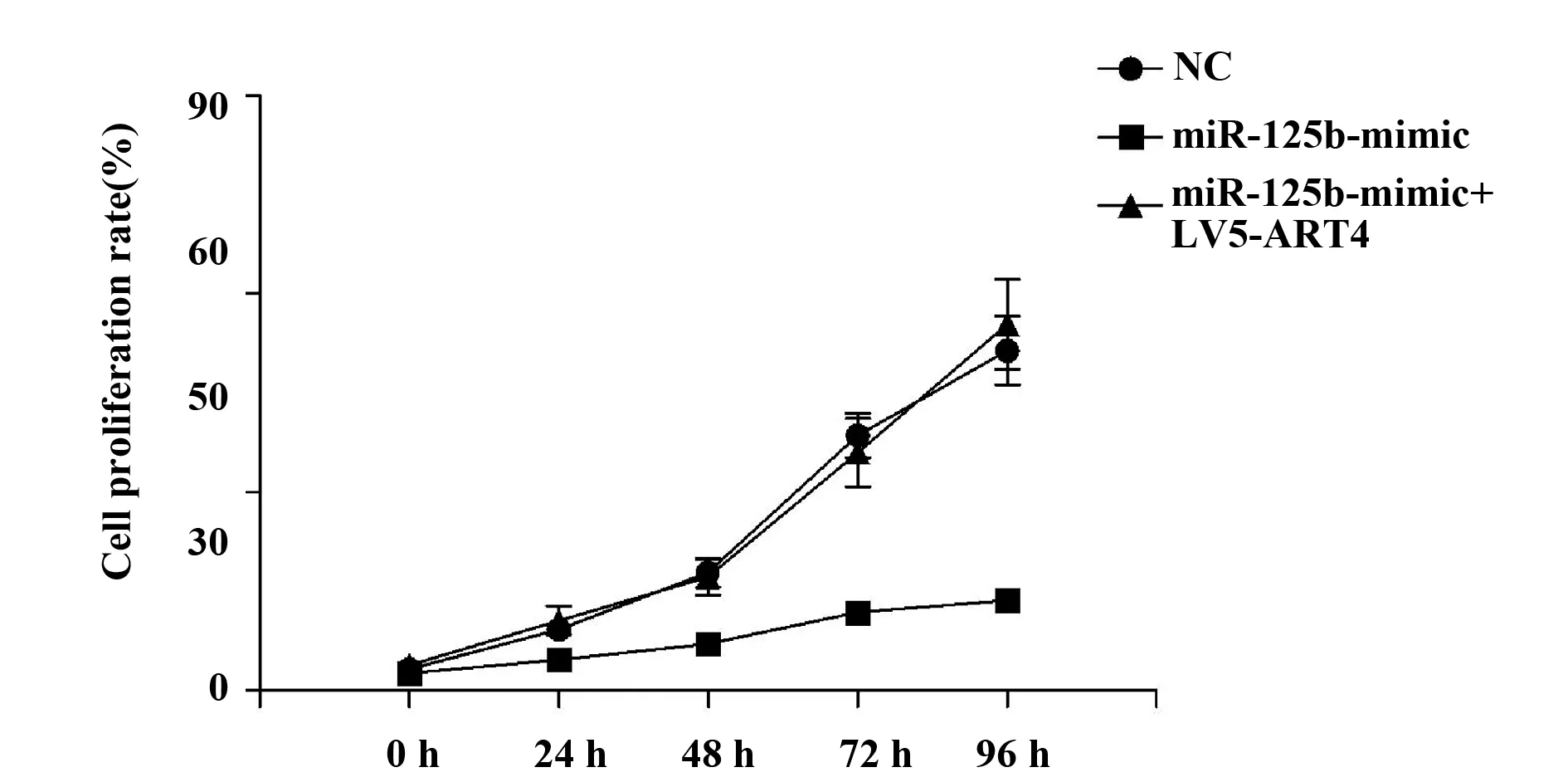
图5 过表达ART4可以逆转miR-125b对肝癌细胞增殖能力的抑制Fig.5 Overexpression of ART4 can reverse inhibitory effect of miR-125b on proliferation of liver cancer cells
2.4过表达miR-125b抑制肝癌细胞侵袭能力 为了研究miR-125b对肝细胞癌侵袭能力的影响,使用SMMC-7721细胞株进行慢病毒转染以增加miR-125b的表达。如图4所示,Transwell侵袭实验检测miR-125b对SMMC-7721细胞增殖情况的影响。miR-125b-mimic组侵袭细胞数目比其对照组明显减少[(186.5±15.1)% vs(48.4±4.2)%,P<0.01],差异具有统计学意义(图4,P<0.05)。综上所述,过表达miR-125b后可以明显抑制SMMC-7721肝癌细胞株的侵袭能力。
2.5过表达ART4可以逆转miR-125b对肝癌细胞增殖能力的抑制 如上述实验所示,过表达miR-125b后肝癌细胞株增殖能力受到抑制,然后我们miR-125b-mimic组细胞中过表达ART4蛋白,观察肝癌细胞株的增殖能力是否能被逆转。实验结果(图5),miR-125b-mimic+LV5-ART4组肝癌细胞株的细胞生长速度快于对照组。我们可以得到结论,在肝癌细胞株中过表达ART4蛋白可以逆转miR-125b对其的抑制能力,也侧面说明了miR-125b和ART4之间有间接调控关系。


图6过表达ART4可以逆转miR-125b对肝癌细胞侵袭能力的抑制
Fig.6OverexpressionofART4canreverseinhibitoryeffectofmiR-125boninvasionoflivercancercells
Note: *.P<0.05.
2.6过表达ART4可以逆转miR-125b对肝癌细胞侵袭能力的抑制 如上述实验所示,过表达miR-125b后肝癌细胞株侵袭能力受到抑制,然后我们miR-125b-mimic组细胞中过表达ART4蛋白,观察肝癌细胞株的侵袭能力是否能被逆转。实验结果如图6,miR-125b-mimic+LV5-ART4组肝癌细胞株的细胞侵袭数目明显多于对照组[(146.5±12.8)% vs(44.7±3.1)%,P<0.01],差异具有统计学意义(P<0.05)。我们可以得到结论,在肝癌细胞株中过表达ART4蛋白可以逆转miR-125b对其的抑制能力,也侧面说明了miR-125b和ART4之间有间接调控关系。
3 讨论
肝细胞癌(HCC)在全球范围内都是影响人类健康的主要问题,对于感染了肝炎病毒的患者来说,肝癌的患病率会明显升高[17]。目前手术仍是肝细胞癌最主要的治疗疗法,虽然化疗、放疗及生物疗法一直在发展,但一切都是以手术为中心[18]。然而,超过80%的患者因肝功能受损或其他器官的原因,错了肝移植的最佳时期,手术切除局部肝脏是唯一的治疗方案[19,20]。因此,除了手术治疗之外,寻找发现新的分子靶向治疗方案显得尤为重要,可以明显延长肝癌晚期患者的生存率,改善其生存质量[21]。尽管目前寻找肝癌有效的治疗靶向分子研较多,但是都尚在实验室阶段,探讨其具体分子机制也是必要的过程[22]。
最近几项研究表明,肝癌组织中多种miRNA的表达下调明显,可能与肝细胞癌的恶性进展相关[23]。然而,由于miRNA可以在转录后调节数个下游靶信号通过相关信号通路影响肿瘤的行为,而信号通路的范围较广泛,未能彻底研究透彻,所以miRNA在肝细胞癌中的致癌原因和具体过程尚未得到充分的阐明。因此,探索肝癌肿瘤发展的miRNA的临床潜力和分子机制对于延缓肝细胞癌发展和改善患者生活质量是有帮助的。
以前的研究表明miR-125b在多种不同类型的肿瘤中表达下调,包括乳腺癌、卵巢癌、肺癌和胃癌等等[24-26]。而且人类miRNA微阵列的结果已经表明肝癌组织中miR-125b低表达水平是普遍存在的[27]。然而这些研究都很少关注肝癌患者肿瘤样本中miR-125b与相关下游靶基因作用后对其治疗和预后价值的估计。在本研究中,肝癌组织与匹配非肿瘤相邻肝组织相比,我们首次证实了miR-125b在肝细胞癌中显著下调,而且miR-125b的低表达状态与肝癌患者的进展有一定关系。在肝细胞株中也同时观察到miR-125b的表达水平较低,miR-125b的低表达水平可以抑制体外和体内肝细胞癌的增殖和侵袭行为。同时我们发现,MTT测定显示,培养7 d后miR-125b对肝癌细胞的增殖的抑制具有统计学意义,然而细胞侵袭能力的测定结果为24 h,表明miR-125b对肝癌细胞侵袭能力的抑制作用不是由细胞增殖减少引起的。因此,需要进一步的实验来阐明机制。
曾经有研究表明,miR-125b可以阻断p53肿瘤抑制基因的翻译过程,影响其下游基因的表达,并且干扰乙型肝炎病毒表面抗原的表达[28]。使用生物学信息检测法的分析表明,以下几种相关癌基因包括都是miR-125b的潜在靶基因,MMP11、EDN1、VEGF-A、ART4和BCL-9L。有趣的是,miR-125b的过度表达并没有明显抑制所有下游靶基因的表达情况,这证明对于不同类型的肿瘤来说,miR-125b的抑制作用是不相同的[29]。而且根据双荧光素酶报道分析证实,在肝癌细胞中,ART4是miR-125b下游的有效靶基因。通过qPCR和Western blot蛋白质印迹分析的结果也进一步证实了这些发现的正确性。基于这些数据,我们怀疑miR-125b可以通过下调ART4来抑制肝细胞癌的增殖和侵袭。
以前的研究表明,靶向沉默ART4的表达能够在体内抑制肿瘤生长和肿瘤血管生成[30],并且在缺氧条件下对肝细胞癌患者具有抗肿瘤功效[31]。我们的研究表明,ART4的上调可以逆转miR-125b对肝细胞癌的抑制能力,进一步证实miR-125a通过调控ART4的表达发挥相应作用。
我们通过检测肝癌细胞的生物学行为检测发现,miR-125b的过表达可以抑制肝癌细胞的增殖和侵袭,通过前面实验的结果,我们可以发现miR-125b在肝癌细胞中表达下调,ART4在肝癌细胞系中上调。于是我们推测,在生理状态下,miR-125b保持稳定高表达的状态,当外界因素或自身情况影响抑制miR-125b的表达进入病理状态时,机体的平衡状态被破坏,可能引起部分肝细胞的恶性突变,引发肝细胞癌的发生,且随着病程进展,可以影响到肝癌细胞的生物学行为。综上所述,本实验阐明了miR-125b/ART4在肝癌中发生发展中的作用,有可能为肝癌的早期诊断和治疗进展方面提供参考意见。
[1] Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[3] 郑荣寿,左婷婷,曾红梅,等.中国肝癌死亡状况与生存分析[J].中华肿瘤杂志,2015,37(9):697.
[4] Ding J,Huang S,Wu S,etal.Gain of miR-151 on chromosome 8q24.3 facilitates tumour cell migration and spreading through down regulating RhoGDIA[J].Nat Cell Biol,2010,12(4):390-399.
[5] He XX,Chang Y,Meng FY,etal.MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo[J].Oncogene,2012,31(28):3357-3369.
[6] Yang F,Zhang L,Wang F,etal.Modulation of the unfolded protein response is the core of microRNA-122-involved sensitivity to chemotherapy in hepatocellular carcinoma[J].Neoplasia,2011,13(7):590IN3-600IN4.
[7] Caygill EE,Johnston LA.Temporal regulation of metamorphic processes in Drosophila by the let-7 and miR-125 heterochronicmicroRNAs[J].Curr Biol,2008,18(13):943-950.
[8] Garbuzov A,Tatar M.Hormonal regulation of Drosophila microRNA let-7 and miR-125 that target innate immunity[J].Fly,2010,4(4):306-311.
[9] 鲁艳明,银 铎,王 宁,等.miRNA-200c 对卵巢癌细胞侵袭能力影响观察[J].中华肿瘤防治杂志,2014,21(10):732-735.
[10] 李 枫,姚 丽,张喜红,等.miRNA-22 在卵巢癌组织的表达及其对卵巢癌细胞增殖,迁移与侵袭的影响[J].中国病理生理杂志,2016,32(12):2251-2255.
[11] Kim SW,Ramasamy K,Bouamar H,etal.MicroRNAs miR-125a and miR-125b constitutively activate the NF-κB pathway by targeting the tumor necrosis factor alpha-induced protein 3(TNFAIP3,A20)[J].Proc Natl Acad Sci,2012,109(20):7865-7870.
[12] Jiang L,Huang Q,Zhang S,etal.Hsa-miR-125a-3p and hsa-miR-125a-5p are downregulated in non-small cell lung cancer and have inverse effects on invasion and migration of lung cancer cells[J].BMC Cancer,2010,10(1):318.
[13] Bi Q,Tang S,Xia L,etal.Ectopic expression of MiR-125a inhibits the proliferation and metastasis of hepatocellular carcinoma by targeting MMP11 and VEGF[J].PLoS One,2012,7(6):e40169.
[14] Parusel I,Kahl S,Braasch F,etal.A panel of monoclonal antibodies recognizing GPI-anchored ADP-ribosyltransferase ART4,the carrier of the Dombrock blood group antigens[J].Cell Immunol,2005,236(1):59-65.
[15] Friedrich M,Grahnert A,Hauschildt S.Analysis of the 3′ UTR of the ART3 and ART4 gene by 3′ inverse RACE-PCR[J].DNA Sequence,2005,16(1):53-57.
[16] Durousseau de Coulgeans C,Chiaroni J,Bailly P,etal.Sequencing of the ART4 gene in sub-Saharan cohorts reveals ethnic differences and two new DO alleles:DO* B-Ile5Thr and DO* B-Trp266Arg[J].Transfusion,2015,55(10):2376-2383.
[17] 李 焱,程 朋.中晚期肝癌临床治疗进展[J].临床肝胆病杂志,2014,30(3):233-236.
[18] 戴朝六,赵 阳.原发性肝癌的综合治疗[J].中国普外基础与临床杂志,2014,21(2):133-137.
[19] Murakami Y,Yasuda T,Saigo K,etal.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues[J].Oncogene,2006,25(17):2537-2545.
[20] 褚志强,吴向未,杨宏强,等.原发性肝癌手术治疗的生存率分析及影响因素研究[J].实用医学杂志,2013,29(5):787-789.
[21] Meng F,Henson R,Wehbe-Janek H,etal.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterology,2007,133(2):647-658.
[22] Wang J,Liu X,Wu H,etal.CREB up-regulates long non-coding RNA,HULC expression through interaction with microRNA-372 in liver cancer[J].Nucleic Acids Res,2010,38(16):5366-5383.
[23] Zhang Y,Gao JS,Tang X,etal.MicroRNA 125a and its regulation of the p53 tumor suppressor gene[J].FEBS Lett,2009,583(22):3725-3730.
[24] Wojtowicz EE,Walasek MA,Broekhuis MJC,etal.MicroRNA-125 family members exert a similar role in the regulation of murine hematopoiesis[J].Exp Hematol,2014,42(10):909-918.e1.
[25] 郭晓东,张 璇,刘树红,等.miRNA-125 在肝癌中表达变化的研究[J].现代生物医学进展,2013,(7):1253-1255.
[26] Potenza N,Papa U,Mosca N,etal.Human microRNA hsa-miR-125a-5p interferes with expression of hepatitis B virus surface antigen[J].Nucleic Acids Res,2011:gkr067.
[27] Raskopf E,Vogt A,Sauerbruch T,etal.siRNA targeting VEGF inhibits hepatocellular carcinoma growth and tumor angiogenesis in vivo[J].J Hepatol,2008,49(6):977-984.
[28] Jopling CL,Yi MK,Lancaster AM,etal.Modulation of hepatitis C virus RNA abundance by a liver-specific MicroRNA[J].Science,2005,309(5740):1577-1581.
[29] 刘建华,程 涛,王洪敏,等.血清 miRNA 表达水平检测与原发性肝癌早期诊断的研究[J].热带医学杂志,2010,10(6):666-668.
[30] Fan R,Li X,Du W,etal.Adenoviral-mediated RNA interference targeting URG11 inhibits growth of human hepatocellular carcinoma[J].Int J Cancer,2011,128(12):2980-2993.
[31] Ezzat WM,Amr KS.Insights for hepatitis C virus related hepatocellular carcinoma genetic biomarkers:Early diagnosis and therapeutic intervention[J].World J Hepatol,2016,8(30):1251.
EffectsofmiR-125bonproliferationandinvasionofhepatocarcinomacellsbyART4protein
LIJian-Hua,HANLing,YANGZhi-Liang.
DepartmentofGeneralSurgery,XinxiangCentralHospital,Xinxiang453000,China
Objective:To investigate the effect of miR-125b on ART4 protein and its effect on proliferation and invasion of hepatocellular carcinoma cells.MethodsThe expression of miR-125b in hepatocellular carcinoma and hepatocellular cells was detected by qPCR.The expression of miR-125b and ART4 was detected by qPCR after overexpression of miR-125b.The expression of miR-125b and ART4 was detected by double luciferase assay.The effect of miR-125b on the proliferation of hepatoma cells was detected by MTT assay.The effect of miR-125b on the invasion of hepatoma cells was detected by Transwell invasion assay.MTT assay was used to detect the effect of miR-125b on the proliferation of hepatoma cells after overexpression of ART4.Transwell invasion assay was used to detect the effect of miR-125b on the invasion of hepatoma cells after overexpression of ART4.ResultsThe expression of miR-125b in hepatoma cells was low,and overexpression of miR-125b could inhibit the expression of ART4 protein.Overexpression of miR-125b could inhibit the proliferation and invasion of hepatoma cells.Overexpression of ART4 could reverse the proliferation and invasion of hepatoma cells by miR-125b.ConclusionExpression of miR-125b in hepatocellular carcinoma was down-regulated.Meanwhile,miR-125b can regulate the expression of ART4 and affect the proliferation and invasion of hepatoma cells.
miR-125b;Hepatoma;ART4;Transwell
10.3969/j.issn.1000-484X.2017.12.002
R735.7
A
1000-484X(2017)12-1765-06
①本文为河南省医学科技攻关计划基金资助项目(201602362)。
李建华(1973年-),男,硕士,副主任医师,主要从事胃肠肝胆方面的研究,E-mail:yisheng111yy@163.com。
[收稿2017-05-31 修回2017-07-13]
(编辑 张晓舟)
·启事·
《中国免疫学杂志》关于彩图处理的有关说明
《中国免疫学杂志》的全部来稿一经采用,来稿所附图片根据具体需要,酌情制作彩图,彩图制作费包含在该稿件的版面制作费中,一并开具发票,望周知!
《中国免疫学杂志》编辑部