小鼠细胞差异表达蛋白SWATH定量方法的建立
2017-12-19李慎涛王劲松殷爱红
胡 家 李慎涛 王劲松 李 蕾 殷爱红*
(1.首都医科大学中心实验室,北京 100069;2.首都医科大学基础医学院,北京 100069)
·技术方法·
小鼠细胞差异表达蛋白SWATH定量方法的建立
胡 家1李慎涛1王劲松2李 蕾1殷爱红1*
(1.首都医科大学中心实验室,北京 100069;2.首都医科大学基础医学院,北京 100069)
在生物学和临床医学研究中,基于质谱的蛋白质组学研究方法已成为一种强有力的工具[1-2],目前,比较主流的蛋白质组学研究方案是使用液相色谱-串联质谱联用系统(liquid chromatograph with tandem mass spectrometry,LC-MS/MS),一次实验可鉴定到上万种蛋白质。在发现蛋白组学研究领域,稳定同位素标记和无标记相对定量的方法已被广泛用于差异蛋白表达谱研究[3-4],特别在最近一段时期,由于高分辨定量蛋白质组学的发展,一种基于数据非依赖采集(data-independent acquisition,DIA)模式的无标记定量方法,即SWATHTM(sequential windowed acquisition of all theoretical fragment ions)定量已成为新兴的强大定量工具[5]。
本实验中,提取实验组和对照组小鼠骨髓细胞样品蛋白质,进行基于超滤辅助样品制备(filter-aided sample preparation,FASP),采用液质联用技术进行蛋白质鉴定,结合SWATHTM质谱采集技术,通过相关软件分析数据,建立了一种对小鼠骨髓细胞样品进行无标记差异定量的蛋白质组学研究方法。
1 材料与方法
1.1 材料
1)实验样品:以2月龄的小鼠骨髓细胞为对照组,18月龄的小鼠骨髓细胞为实验组,两种细胞均由本实验室提供。
2)主要试剂和仪器:尿素、二硫苏糖醇(dithiothreitol,DTT)和碘乙酰胺(iodoacetamide,IAA)(Sigma公司,美国);10 000超滤浓缩管(Millipore公司,美国);胰蛋白酶(Promega公司,美国);水、乙腈、甲醇、甲酸和三氟乙酸(Fisher公司,美国)。SpeedVac真空干燥机(Thermo公司,美国);Easy-Nano LC液相色谱仪和Triple TOF6600质谱仪(Sciex公司,美国);NanoDrop微量分光光度计(Thermo公司,美国)。
1.2 小鼠细胞蛋白质提取
[6-7] 的方法,向细胞沉淀中加入5倍体积的裂解液[含20 mmol/L Tris-HCl(pH=8.0)、8 mol/L尿素、20 mmol/L DTT和蛋白酶抑制剂],涡旋均匀,置于冰上裂解细胞2 h,期间用超声破碎细胞(功率2 W、超声时间2 s、间歇2 s、20个循环),使样品溶液澄清。将样品置于高速离心机中4 ℃、40 000 g离心1 h。取离心上清、分装、保存于-80 ℃,用NanoDrop微量分光光度计对裂解细胞总蛋白质进行定量。
1.3 细胞蛋白质酶切
按参考文献[8]的方法,各取200 μg实验组和对照组蛋白质样品,加入DTT至终浓度10 mmol/L,37 ℃孵育2.5 h,使样品中蛋白质的二硫键处于打开状态,恢复至室温,加入碘乙酰胺至终浓度50 mmol/L,避光放置40 min,对打开的二硫键进行烷基化保护。将样品转移至截留相对分子质量为10 000的超滤浓缩管中,10 000 g、20 ℃离心30 min,在超滤管中加入200 μL裂解液,10 000 g、20 ℃离心30 min,重复本步骤2~3次,彻底去除十二烷基硫酸钠(sodium dodecyl sutfate,SDS)等去污剂。在超滤管中加入200 μL 50 mmol/L NH4HCO3,10 000 g、4 ℃离心30 min,重复本步骤2~3次。换一个新的超滤管套管,在内管中加入150 μL 50 mmol/L NH4HCO3,再按照 蛋白:Trypsin=50∶1的比例加入酶液,37 ℃孵育16 h。10 000 g、4 ℃离心30 min,加入100 μL 50 mmol/L NH4HCO3,10 000 g、4 ℃离心30 min,重复该步骤3次,收集多肽样品。最后,向样品中加入终浓度1%(体积分数)的甲酸,冻干样品。
1.4 液质联用方法
将酶切样品用A相溶液[含0.1%(体积分数)甲酸及2%(体积分数)乙腈]重溶后,经NanoDrop定量,18 000 g离心10 min,取4 μL上清进行纳升级液相与Triple TOF 6600质谱联用分析。色谱柱:C18除盐柱(3 μm,120 Å,350 μm×0.5 mm)、C18分析柱(3 μm,120 Å,75 μm×150 mm),柱温为40 ℃,系统柱压小于6 000 Psi;流速:300 nL/min;1 h分析梯度:0 min,5%(体积分数)B[B相溶液:含0.1%(体积分数)甲酸及98%(体积分数)乙腈];0~0.1 min,5%~9% B;0.1~32 min,9%~22% B;32~48 min,22%~32% B;48~51 min,32%~40% B;51~51.1 min,40%~80% B;51.1~56 min,80% B;56~56.1 min,80%~5% B;56.1~60 min,5% B。质谱条件:ESI源、正离子扫描模式、喷雾电压2.3 kV、离子源温度150 ℃。蛋白质鉴定质谱扫描模式:一级全扫描,质荷比(mass to charge,m/z)范围350~1 500;二级挑选40个强度高的前体离子进行诱导碰撞解离(collision induced dissociation,CID);扫描范围m/z 100~1 500,动态排除扫描,动态排除时间10 s。SWATH蛋白质定量模式:一级全扫描,m/z范围350~1 500;二级扫描窗口根据蛋白质鉴定的液相TIC图在m/z 400~1 225的范围设置了60个可变二级扫面窗口,在前体离子密集时,使用窄质量数窗口,增强选择性,在前体离子密度较低时,使用宽质量数窗口,以覆盖更广泛的前体离子;CID动态碎裂,依次均匀扫描。
1.5 数据处理
用Sciex提供的搜索引擎“Protein Pilot Software 5.0”对鉴定模式所产生的数据进行搜索,使用Uniprot Mus musculus数据库(更新于2016年8月),设置一级质量偏差10 ppm、二级质量偏差20 ppm,获得置信度较高(假阳性率<1%)的谱图库。利用PeakView2.2软件提取数据依赖采集方式(data dependent analysis,DDA)建立的谱图库中的母离子和碎片离子的保留时间,对相应SWATH产生碎片离子的保留时间进行匹配,提取相应肽段的碎片离子色谱峰,并根据色谱峰的强度和保留时间积分计算峰面积。PeakView2.2软件中设定条件如下:每种蛋白质包含肽段数至少为10且是特有肽段;每种肽段的碎片离子(transition)为6;假阳性率设为10%;提取窗口6 min;在不同的洗脱时间内,选取丰度、峰形较好的肽段对其他肽段进行保留时间的校正。结果以报告的形式输出,其中包含碎片离子峰面积、肽段峰面积和组装成相应蛋白的峰面积。采用MarkView1.2软件对数据进行差异分析,P>0.05可接受,t检验得出差异2倍以上的蛋白质。
2 结果
2.1 建立SWATHTM图谱采集方法及小鼠细胞样品的蛋白质离子文库(ion library)
对实验组和对照组2个样品进行了酶切,将酶切后各样品等量混合,上样量为800 ng,进行60 min梯度液相色谱,质谱用数据依赖采集模式(DDA-MS)。采集结束后,依据本次实验的液相总离子流图(total ions chromatograph,TIC)(图1)确定样品合适的液相分离梯度,并在质荷比(m/z)400至1 225之间设置60个SWATHTM采集可变窗口,如图2,在前体离子密集时,使用窄质量数窗口,增强选择性,在前体离子密度较低时,使用宽质量数窗口以确保覆盖更广泛的前体离子。通过可变窗口的设置,期望采集到检测范围内所有前体离子和二级产物离子信息。由此建立本次实验的SWATHTM采集方法。
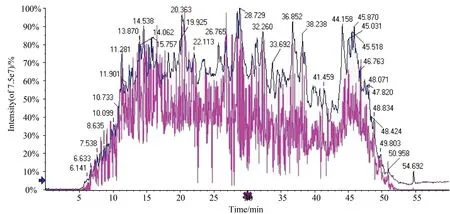
图1 蛋白质鉴定液相总离子流图(TIC)Fig.1 Total ions chromatograph (TIC) of protein identification
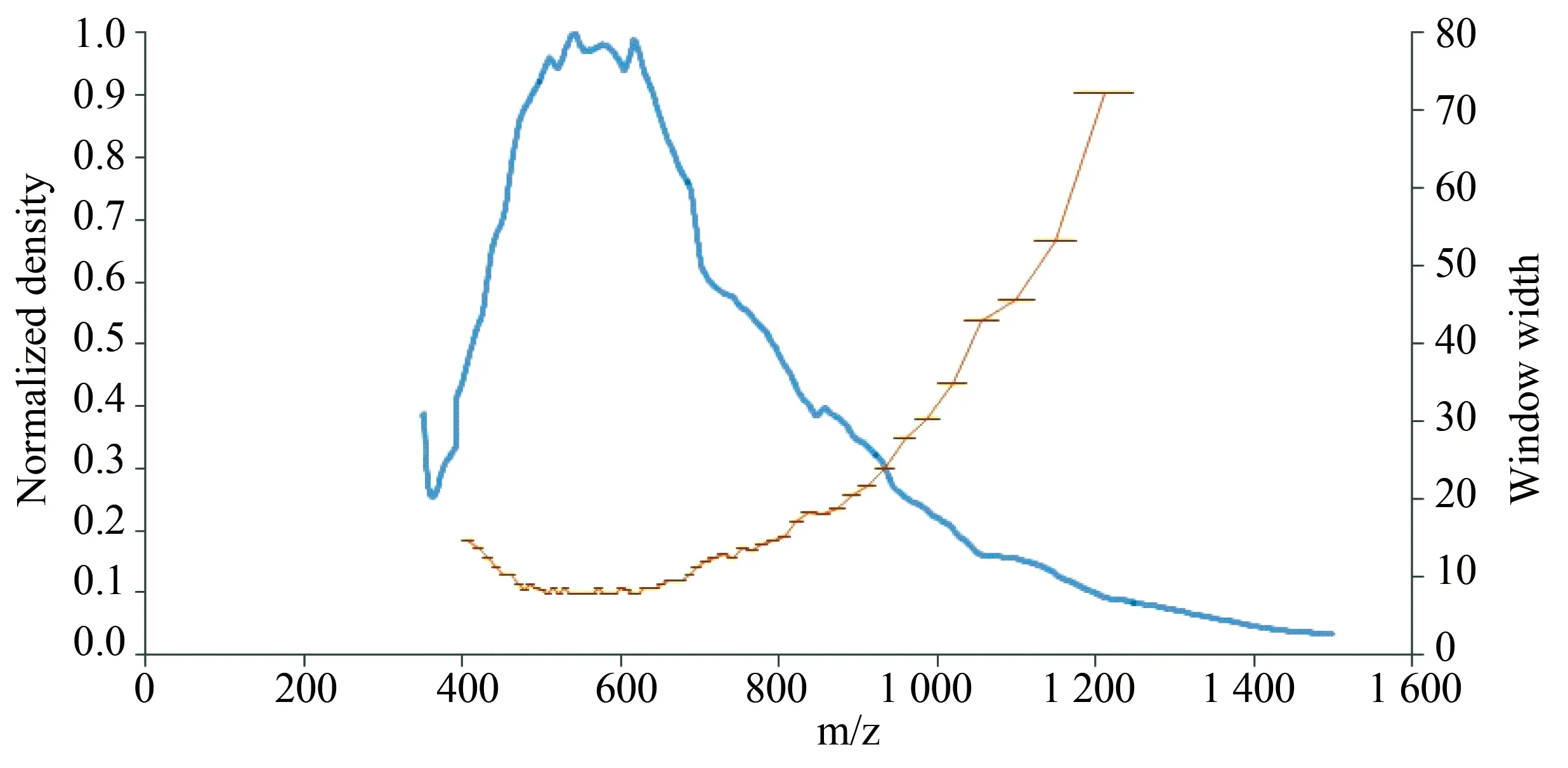
图2 设置60个SWATHTM采集窗口Fig.2 Set 60 SWATHTM acquisition windows
The blue line represents the ion density,the orange line represents the width of the variable windows;SWATHTM:sequential windowed acquisition of all theoretical fragment ions;m/z:mass to charge.
SWATHTM定量是一种质谱数据非依赖采集模式(DIA-MS),并依赖二级质谱信息对蛋白质进行定量的方法。DDA-MS采集数据的质量较高,但SWATHTM采集的数据信息比DDA-MS要丰富一些[9],因此通过DDA-MS采集数据建立SWATHTM定量的蛋白质离子文库,并且为了确保SWATHTM定量分析不遗漏数据信息,将多次DDA-MS采集的小鼠样品数据一并通过ProteinPilot软件(Sciex)搜索Uniprot的Mus musculus蛋白质数据库,共鉴定到3 043种蛋白质,将这些蛋白质多肽的二级质谱信息和液相离子保留时间构建成本次SWATHTM定量的蛋白质离子文库。
2.2 SWATHTM采集
调用已建立的SWATHTM采集方法,每个样品进3针,图3为2个样品的3次重复进样TIC图,横坐标为质谱采集时间、纵坐标为样品离子强度,彩色曲线为2个样品各重复3次进样的总离子流图。可见样品重复性好,且质谱检测离子强度高、出峰很多,样品制备和液相分离效果理想。
2.3 差异蛋白质鉴定
将SWATHTM数据经过PeakView2.2及MarkView1.2软件分析,共鉴定到97种显著表达差异2倍以上的蛋白质,如图4,其中上调蛋白质43种,其中上调3倍以上的蛋白质有15种;下调蛋白质54种,其中下调0.3倍以上的蛋白质有16种,变化越明显说明蛋白质表达差异越大。经过蛋白质功能分析显示,鉴定的这些差异蛋白有一些与细胞衰老有关。本文重点介绍实验方法,涉及所鉴定蛋白的具体数据将在另一篇文章详细描述。
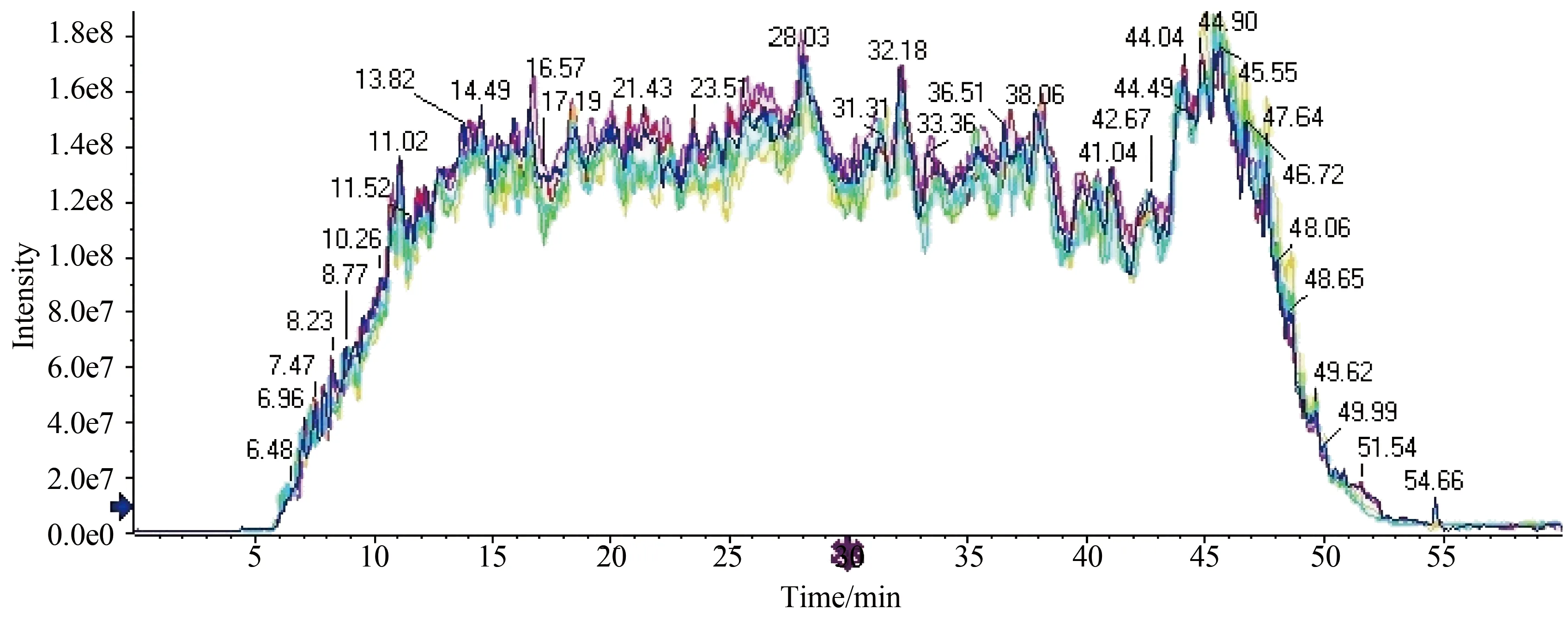
图3 SWATHTM采集两个样品3次重复进样的TIC图Fig.3 TIC of 3 repeated injections of 2 samples with SWATHTM MSTIC:total ions chromatograph;MS:mass spectrometry.
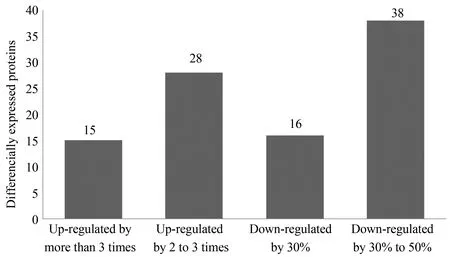
图4 SWATHTM定量两个样品的差异表达蛋白数Fig.4 Differentially expressed proteins identified by SWATHTM MSMS:mass spectrometry;SWATHTM:sequential windowed acquisition of all theoretical fragment ions.
3 讨论
SWATHTM技术通过均匀扫描和采集检测范围内所有前体离子及二级产物离子信息,并依据二级产物离子峰面积进行蛋白质定量,能有效规避DDA定量模式中由于高丰度信号影响和动态排除等引起的定量灵敏度不高和重现性差等问题,同时提高了高分辨质谱的定量通量[10-11]。SWATHTM技术自2012年推出以来,在蛋白质组学研究中得到了广泛的应用。Huang等[12]用SWATHTM采集方法对鼠细胞裂解液蛋白质组进行分析,在没有进行样品预分离的条件下,鉴定到3 600种蛋白质,并对这些蛋白质进行了绝对定量。Lambert 等[13]利用亲和纯化结合SWATHTM技术(AP-SWATHTMMS)研究蛋白质相互作用,能够特异性地富集到靶蛋白的相互作用蛋白,实现了复合蛋白质的准确鉴定。Sidoli等[14]采用重标同位素标记组蛋白翻译后修饰多肽,再用SWATHTM定量分析,检测到组蛋白H3多肽丰度差异极大,跨越了4个数量级。由此可见TripleTOF质谱仪搭配SWATHTM采集模式分析样品,可以全面、准确定量分析所获得的二级质谱信息,在高通量蛋白质组学层面实现了与针对特定蛋白质定量质谱技术(如SRM等)相当的定量能力[10,15]。
本实验以两个样品为例,介绍了一种大规模非标定量蛋白质的方法。通过对实验组和对照组样品进行FASP酶切,建立SWATHTM采集方法,对样品各进行3次SWATHTM采集,通过软件分析实验结果,可一次性对两组样品的几千种差异蛋白质进行定量分析。该实验流程适用于多组样品的高通量蛋白质组学定量分析,比如不同时间点、不同药物、不同浓度试剂处理的样品等等,由于版权所限不在此展示。
实验流程中应用的高分辨质谱系统Triple-TOF 6600,搭载SWATHTM2.0采集技术,扫描速度快且质量数窗口可变。在前体离子密集时,使用窄质量数窗口,增强选择性,在前体离子密度较低时,使用宽质量数窗口,以覆盖更广泛的前体离子。与传统的LC-MS/MS系统方案相比,SWATHTM采集模式能够将扫描区间内所有的肽段母离子经过超高速扫描并进行二级碎裂,从而获得完整的肽段信息。在对大规模蛋白质进行定量分析时,无需对样品进行预分离和标记,一次实验能实现多组样品中几千种蛋白质的相对定量,省时省力并节省实验成本。
4 参考文献
[1] Indovina P,Marcelli E,Pentimalli F,et al.Mass spectrometry-based proteomics: the road to lung cancer biomarker discovery[J].Mass Spectrom Rev,2013,32(2):129-142.
[2] Carretero J,Shimamura T,Rikova K,et al.Integrative genomic and proteomic analyses identify targets for Lkb1-deficient metastatic lung tumors[J].Cancer Cell,2010,17(6):547-559.
[3] Ghosh D,Li Z,Tan X F,et al.iTRAQ based quantitative proteomics approach validated the role of calcyclin binding protein (CacyBP) in promoting colorectalcancer metastasis[J].Mol Cell Proteomics,2013,12(7):1865-1880.
[4] Hao J,Li W,Dan J,et al.Reprogramming-and pluripotency-associated membrane proteins inmouse stemcells revealed by label-free quantitative proteomics[J].J Proteomics,2013,86:70-84.
[5] Tate S,Larsen B,Bonner R,et al.Label-free quantitative proteomics trends for protein-protein interactions[J].J Proteomics,2013,81:91-101.
[6] 胡家,李燕英,孙丽翠,等.Hela细胞蛋白质分离和肽质量指纹谱鉴定方法的建立[J].首都医科大学学报,2009,30(6):331-335
[7] 胡家,李蕾,王劲松,等.人乳牙牙髓干细胞全蛋白质非胶分级分离电泳分析[J].山西医科大学学报,2016,47(3):250-254.
[9] McQueen P,Spicer V,Schellenberg J,et al.Whole cell,label free protein quantitation with data independent acquisition: quantitation at the MS2 level[J].Proteomics,2015,1(1):16-24.
[10] 孙佳楠,段小涛,周泉,等.基于SWATH定量质谱技术的肥胖小鼠脂肪线粒体蛋白质组分析[J].中国药理学与毒理学杂志,2015,29(3):447-455.
[11] Selevsek N,Chang C Y,Gillet L C,et al. Reproducible and consistent quantification of theSaccharomycescerevisiaeproteome by SWATH-mass spectrometry[J]. Mol Cell Proteomics,2015,14(3) :739-749.
[12] Huang Q,Yang L,Luo J,et al.SWATH enables precise label-free quantification on proteome scale[J].Proteomics,2015,15(7):1215-1223.
[13] Lambert J P,Ivosev G,Couzens A L,et al.Mapping differential interactomes by affinity purification coupled with data-independent mass spectrometry acquisition[J].Nat Methods,2013,10(12):1239-1245.
[14] Sidoli S,Lin S,Xiong L,et al.Sequential Window acquisition of all theoretical mass spectra(SWATH) analysis for characterization and quantification of histone post-translational modifications[J].Mol Cell Proteomics,2015,14(9):2420-2428.
[15] Sajic T,Liu Y,Aebersold R.Using data-independent,high-resolution mass spectrometry in protein biomarker research: perspectives and clinical applications[J].Proteomics Clin Appl,2015,9 (3-4) : 307- 321.
*Corresponding author,E-mail:yinhong87@sina.com
时间:2017-12-13 21∶09
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2109.036.html
10.3969/j.issn.1006-7795.2017.06.031]
2017-03-24)
编辑 陈瑞芳
