侯氏黑散对脑缺血大鼠神经导向因子及Rho GTP酶的影响
2017-12-19刘建红常佳慧相阳阳张秋霞
陆 跃 刘建红 赵 晖 常佳慧 相阳阳 张秋霞*
(1.首都医科大学中医药学院,北京 100069;2北京火箭军医院,北京 100840)
·基础研究·
侯氏黑散对脑缺血大鼠神经导向因子及RhoGTP酶的影响
陆 跃1刘建红2赵 晖1常佳慧1相阳阳1张秋霞1*
(1.首都医科大学中医药学院,北京 100069;2北京火箭军医院,北京 100840)
目的探讨侯氏黑散对脑缺血大鼠神经导向因子Netrin-1/DCC和分子开关Rac1/Cdc42/RhoA表达的影响。方法采取线栓法制备永久性大脑中动脉栓塞(permanent middle cerebral artery occlusion,pMACO)模型。大鼠采用数字表法随机分为假手术组、模型组、侯氏黑散小剂量组、侯氏黑散中剂量组、金纳多组。运用Western blotting法和RT-PCR法检测术后7d大鼠缺血侧皮质Netrin-1、DCC、Rac1、Cdc42、RhoA蛋白和基因的表达。结果与模型组相比,侯氏黑散中剂量组、金纳多组大鼠Netrin-1蛋白的表达明显升高(P<0.01),侯氏黑散中剂量组大鼠Netrin-1基因的表达升高(P<0.05);侯氏黑散小剂量组、侯氏黑散中剂量组、金纳多组大鼠DCC、Rac1、Cdc42蛋白和基因的表达明显升高(P<0.05);侯氏黑散小剂量组、侯氏黑散中剂量组、金纳多组大鼠RhoA蛋白和基因的表达则明显下降(P<0.01)。结论侯氏黑散通过对脑缺血大鼠神经导向因子Netrin-1/DCC和分子开关Rac1/Cdc42/RhoA的调节促进脑缺血后神经功能的修复。
脑缺血;侯氏黑散;Netrin-1;DCC;Rac1;Cdc42;RhoA
侯氏黑散是治疗脑卒中的第一方。考其方药,主要由风药和补虚药两个单元组成。此方乃张仲景基于脑卒中“内虚邪中”的病机理论所创制。本课题组[1]的前期研究显示,侯氏黑散可以减少轴突再生,抑制信号通路Nogo-A/ NgR及其下游信号通路RhoA/Rock2的表达,从而减少脑缺血后轴突的损伤。轴突导向生长是神经系统发育和有效修复的核心[2]。因此,脑缺血后激活轴突导向信号,是促进神经修复的关键原因。Netrin-1是最早被发现的神经导向因子,在成熟的中枢神经系统中表达量低于胚胎期[3-4]。Netrin-1与其受体结肠癌缺失蛋白(deleted colorectal cancer,DCC)结合,并进一步启动内源性分子开关RhoA /Rac1/Cdc42,可以促进神经修复[5-7]。本部分实验在前期研究[1]的基础上,进一步通过Western blotting法和RT-PCR法检测Netrin-1、DCC、Rac1、Cdc42、RhoA蛋白和基因表达的变化。探讨侯氏黑散对脑缺血大鼠神经导向因子Netrin-1/DCC和分子开关Rac1/Cdc42/RhoA表达的影响,为侯氏黑散促进脑缺血后神经功能修复提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物及分组
雄性Sprague-Dawley(SD)大鼠,SPF级,体质量320~350 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(京)2012-0001。大鼠饲养于首都医科大学实验动物中心,实验动物许可证号:SYXK(京)2010-0020。本实验通过伦理审核(伦理编号:AEEI-2016-054)。将76只大鼠采用数字表法随机分为5组,分别为假手术组12只,模型组、侯氏黑散5.25 g/kg组、侯氏黑散10.5 g/kg组以及金纳多组各16只。
1.1.2 受试药物
侯氏黑散由菊花、人参、细辛、防风、白术、桂枝、干姜、川芎、当归以及茯苓组成。根据张仲景在《金匮要略》[8]中所记载的侯氏黑散原方剂量比例确定药物剂量。所有中药饮片均采购自北京同仁堂药店。中药饮片用30%(体积分数)乙醇回流提取[5]。采用金纳多作为阳性药,由德国威玛舒培博士药厂生产,药品批号:5260613。
1.1.3 主要试剂
Netrin-1、DCC、Rac1、Cdc42抗体购自美国Abcam公司;RhoA抗体购自美国Cell Signaling Technology公司;GAPDH抗体购自欣博盛生物科技有限公司;PVDF膜购自美国Millipore公司。RNAprepPure Tissue Kit、RNase-Free DNaseⅠ试剂盒、FastQuant RT Kit、SuperRealPreMix Plus、GeneGreen Nucleic Acid Dye、loading buffer、MarkerⅢ购自天根生化科技有限公司;琼脂糖购自法国Biowest公司;β-巯基乙醇、无水乙醇购自北京化工厂。
1.1.4 主要仪器
电子天平(美国Adrenturer公司);酶标仪(美国Moiecular Devices公司);台式离心机(德国Sartorius公司);脱色摇床(江苏海门其林贝尔仪器制造有限公司);涡旋混匀器(江苏海门其林贝尔仪器制造有限公司);电泳仪、电转仪、实时荧光定量PCR仪(美国Bio-Rad公司);超速冷冻离心机、梯度PCR仪(德国Eppendorf公司);凝胶成像系统(美国GE Healthcare公司);化学发光成像系统(法国Vilber公司)。
1.2 方法
1.2.1 模型制备
参照文献[6]方法将线栓法略加改进,制备大鼠脑缺血模型。将大鼠麻醉后仰卧固定,分离并结扎右侧颈总和颈外动脉,在颈内和颈外动脉分叉处作一切口,插入尼龙线(直径0.265 mm)约18 mm,感觉有阻力时停止进线,扎紧动脉残端,缝合皮肤。假手术组大鼠麻醉后,仅暴露颈内外动脉分支,不闭塞大脑中动脉。
1.2.2 给药及取材
假手术组、模型组灌服与给药组同体积的0.9%(质量分数)氯化钠注射液;侯氏黑散小、中剂量组及金纳多组的给药剂量按体表面积折算,其等效剂量分别为5.25 g/kg、10.5 g/kg和2.8 g/kg。各给药组于术后6 h给药1次,之后每24 h给药1次。脑缺血7d取脑组织,进行指标检测。
1.2.3 Western blotting法检测Netrin-1、DCC、Rac1、Cdc42、RhoA蛋白
取各组大鼠缺血侧皮质组织,冰上裂解30 min,4 ℃下10 000 r/min离心20 min,BCA法蛋白定量。每组均取6 μL蛋白样品进行10%(质量分数) SDS-PAGE电泳,湿转法电转50 min,将PVDF膜放置于5%(质量分数)脱脂奶粉中室温封闭1h,分别加入Netrin-1(兔源,1∶2 000)、DCC(兔源,1∶5 000)、Rac1(兔源,1∶15 000)、Cdc42(兔源,1∶5 000),RhoA(兔源,1∶15 000)和GAPDH(小鼠源,1∶40 000)一抗中,4 ℃孵育过夜,TBST漂洗4×5 min后,放入对应的山羊抗兔(IgG,1∶20 000)和山羊抗小鼠(HRP,1∶20 000)二抗中,室温孵育1 h,TBST漂洗4×5 min次,使用化学发光成像系统进行曝光。
1.2.4 RT-PCR检测Netrin-1、DCC、Rac1、Cdc42、RhoA基因
电子天平称取25~30 mg的大鼠缺血侧皮质组织,匀浆,冰上作业。使用RNAprepPure Tissue Kit从脑组织提取总RNA。用SoftMax Pro6.2.1软件检测样本在260 nm和280 nm波长下的A值。使用FastQuant RT Kit从总RNA合成cDNA。引物由大连TakaRa公司合成,选择β-actin作为内参对照。合成的引物相关情况见表1。将样本放入BIO-RAD实时荧光定量仪,打开软件,选择β-actin作为内参。扩增条件为:95 ℃ 15 min变性,95 ℃ 10 s,52 ℃ 31 s,72 ℃ 30 s,循环40次。参照文献[7]分析数据,以基因β-actin为内参对照,2-△△Ct(Ct代表循环阀值)表示Netrin-1、DCC、Rac1、Cdc42、RhoA基因相对表达量。

表1 RT-PCR引物序列Tab.1 Sequences of primers for RT-PCR
1.3 统计学方法

2 结果
2.1 各组大鼠Netrin-1、DCC蛋白和基因表达的比较
与假手术组相比,模型组大鼠Netrin-1、DCC蛋白的表达均显著升高(P<0.01)。与模型组大鼠相比,侯氏黑散中剂量组、金纳多组大鼠Netrin-1蛋白以及侯氏黑散小剂量组、侯氏黑散中剂量组大鼠DCC蛋白的表达均显著上升(P<0.01),金纳多组大鼠DCC蛋白的表达明显上升(P<0.05)。
与假手术组相比,模型组大鼠Netrin-1、DCC基因的表达明显升高(P<0.05)。与模型组大鼠相比,侯氏黑散中剂量组大鼠皮质Netrin-1 基因的表达明显上调(P<0.05);侯氏黑散小、中剂量组以及金纳多组大鼠皮质DCC基因的表达显著上升,差异有统计学意义(P<0.01)(图 1)。
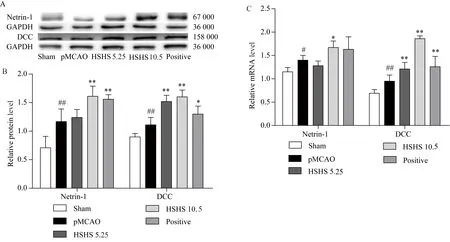
图1 侯氏黑散对脑缺血大鼠皮质Netrin-1和DCC表达的影响Fig.1 Effects of HSHS on Netrin-1 and DCC signaling expression in cortex of pMCAO rats
A:Western blotting results;B:protein level;C:mRNA level;Sham:Sham group;pMCAO: pMCAO group;HSHS:Houshihensan;HSHS5.25: low dose of Houshiheisan;HSHS10.5: middle dose of Houshiheisan;Positive: Ginaton group;#P<0.05,##P<0.01vsSham group;*P<0.05,**P<0.01vspMCAO group.
2.2 各组大鼠Rac1、Cdc42、RhoA蛋白和基因表达的比较
与假手术组相比,模型组大鼠Rac1、Cdc42蛋白和基因的表达显著降低(P<0.01),RhoA蛋白和基因的表达显著升高(P<0.01)。与模型组大鼠相比,侯氏黑散小、中剂量组以及金纳多组大鼠Rac1、Cdc42蛋白和基因的表达显著升高(P<0.01),RhoA蛋白和基因的表达显著下降(P<0.01)(图2)。
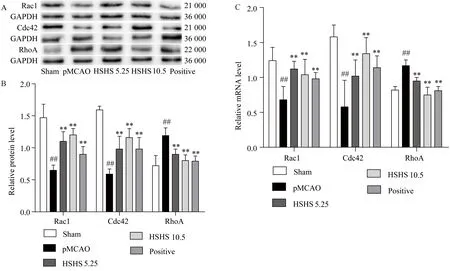
图2 侯氏黑散对脑缺血大鼠皮质Rac1、Cdc42和RhoA表达的影响Fig.2 Effects of HSHS on Rac1,Cdc42 and RhoA signaling expression in cortex of pMCAO rats
A:Western blotting results;B:protein level;C:mRNA level;Sham:Sham group;pMCAO: pMCAO group;HSHS5.25: low dose of Houshiheisan;HSHS10.5: middle dose of Houshiheisan;Positive: Ginaton group.##P<0.01vsSham group;**P<0.01vspMCAO group.
3 讨论
侯氏黑散出自东汉·张仲景的《金匮要略》[8],主治“大风四肢烦重,心中恶寒不足”。对于卒中的病因病机,唐宋以前的医家认为是风邪外犯,主“内虚邪中”之说。分析侯氏黑散,本方主要由风药和补虚药两部分药物组成。风药具有搜剔风邪治其标的作用,补虚药可以温振中阳治其本,侯氏黑散符合“内虚邪中”的病因病机理论。唐宋以降,百家争鸣,医家多从“内风”角度出发,提出了“心火暴盛”、“正气自虚”、“阴虚痰热”、“气虚血瘀”、“肝阳上亢”等诸多卒中病的病因病机学说[9-10]。与此同时,基于“外风”之说创制的侯氏黑散等方剂逐渐被医家摒弃。
清代叶天士[11]提出卒中源于“肝阳偏亢,内风时起”,民国·张锡纯等基于此提出“肝阳化风”。马萌[9]认为卒中的本质是气机病,肝阳上亢,肝升太过,肺降不及,腑气不降,大便不畅。考侯氏黑散,菊花质轻而用量独重,占全方总重量的四成,是本方的主药。《雷公炮制药性解》[10]“丹溪云:菊花属金,而有土于水,大能补阴。宜入肺肝等经,……得此补阴,则水盛而火自熄矣。”清代叶天士《本草经解》[11]谓菊花“味苦清火,火抑金胜,发花于秋,其禀秋金之气独全,故为制风木之上药也。”七版《中药学》[12]教材中记载菊花“归肝、肺经。功效:疏散风热,平抑肝阳,清肝明目,清热解毒。”总之,菊花可以清热平肝,潜阳熄风。肝平肺降,则津液得布,腑气得通。侯氏黑散重用菊花,又假矾石、牡蛎之力,具有平肝熄风的作用,不悖于唐宋以后的“内风”说。
风药一词,首见于金代张元素的《医学启源》。其弟子李东垣提出了“高颠之上,惟风可到”的理论,进一步深化了对风药的认识[12]。清代徐大椿《神农本草经百种录》[13]“凡药之质轻而气盛者,皆属风药”,首次提出了风药的概念,将菊花、桂枝等药纳入风药范畴。《本草再新》认为桂枝可“温中行血”,《药品化义》则谓其可“除肢节间痰凝血滞”[14]。现代多认为卒中病的主要病理产物之一是瘀血,桂枝等风药可温散瘀血亦可驱内风[15]。当代研究[16-17]基于临床实践提出了“风药增效”[16]、“风药活血”[17]等理论。现代药理研究显示侯氏黑散可以提高脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达,调控轴突生长抑制因子(Nogo-A)的表达[5],激活内源性神经生长因子(nerve growth factor,NGF),控制星形胶质细胞的异常激活[18],抑制淀粉样前体蛋白质(amyloid presurosor protein,APP)沉积[19],调节脑缺血后炎性反应[20],从而保护脑缺血后神经功能。
银杏叶制剂有广泛的脑保护作用,其作用机制主要有清除自由基,扩张血管,增加脑血流量,改善脑缺血、缺氧,减轻脑水肿,拮抗血小板活化因子,影响神经介质和改善学习记忆等[21]。本课题所使用的阳性药物金纳多为第4代银杏制剂,目前在临床上被广泛应用于治疗脑缺血[22]。
轴突导向生长是神经系统发育和有效修复的核心,脑缺血后轴突导向生长因子表达下降是导致轴突再生障碍的关键原因[2]。本研究通过侯氏黑散小、中计量组以及阳性药物组与模型组相对比,探究经方侯氏黑散对脑缺血大鼠皮质轴突导向生长因子Netrin-1/DCC和分子开关Rac1/Cdc42/RhoA的影响。
Netrin-1是最早被发现的神经导向因子,其广泛存在于体内多个部位,胚胎时期其主要存在于脊髓、延髓、中脑等部位的底板处,成熟期在中枢神经系统(central nervous system,CNS)和周围组织中也有存在,但总体表达量低于胚胎期[3]。DCC是Netrin-1的吸引性受体,两者结合可精准地调控轴突生长锥的生长方向,通过吸引作用来调节靶向生长[23-24]。黄欢[25]发现,Netrin-1与其受体结合后还可以促进轴突及其分支形成和生长、引导和促进血管的生成以及维持细胞存活。提示脑缺血后激活内源性Netrin-1/DCC可以促进轴突再生和导向生长,有利于神经功能恢复。
本研究结果显示,模型组大鼠缺血侧皮质Netrin-1、DCC蛋白和基因表达明显上调,脑缺血激活了Netrin-1、DCC的表达,提示机体自身对脑缺血后神经结构和功能损伤有一定的修复作用。本研究各用药组的结果显示,侯氏黑散中剂量组、金纳多组大鼠Netrin-1蛋白的表达明显升高(P<0.01),侯氏黑散中剂量组大鼠Netrin-1基因的表达升高(P<0.05);侯氏黑散小、中剂量组以及金纳多组大鼠皮层DCC 蛋白和基因的表达较模型组明显上调(P<0.05)。提示侯氏黑散可以加强机体对脑缺血后神经结构和功能损伤的修复作用,且侯氏黑散中剂量组效果优于侯氏黑散小剂量组以及阳性药物组。
Netrin-1所引起的轴突导向生长作用不仅需要与其受体DCC结合,还需要通过影响Rho族GTP酶(Rho GTPases)启动细胞内信号转导机制,促使轴突内细胞骨架的重排[26]。Rac1、Cdc42和RhoA是Rho GTPases家族中研究最多、作用机制最清楚的3个分子开关[27-28]。Rac1、Cdc42是吸引性分子开关,受Netrin-1等吸引性导向信号调控。Rac1通过促进细胞边缘层板状伪足丝状伪足的形成推动细胞迁移,Cdc42参与细胞极性建立,指导细胞运动方向,两者协同作用可以调节肌调蛋白促进轴突生长和稳定[4]。RhoA是斥向性分子开关,受Nogo-A等多种排斥信号的调控,其活化可以促进应力纤维和黏着斑的形成,导致轴突的回缩以及生长锥的塌陷[29]。Rac1、Cdc42和RhoA共同作用促使细胞骨架重排,引起神经元的导向迁移,轴突导向生长和神经环路的重塑,干扰神经元Rho GTPases的活性明显影响神经元突起的生长、侧枝形成以及定向生长[30-31]。因此,调控Rac1、Cdc42和RhoA的表达是促进中枢神经损伤修复的关键环节[32]。本研究结果显示,侯氏黑散可以上调Rac1、Cdc42的表达,同时下调RhoA的表达,且侯氏黑散中剂量组效果最优。结果提示,侯氏黑散可明显上调Rac1、Cdc42的表达,下调RhoA的表达,从而激活分子开关,有助于脑缺血后神经纤维的修复和再生。
[1] 陆跃,赵晖,姚晓泉,等.侯氏黑散中风药、补虚药对脑缺血大鼠轴突生长抑制信号通路Nogo-A/NgR与RhoA/Rock2的影响[J].北京中医药大学学报,2016,39(12): 1017-1021.
[2] Tsuchiya A,Hayashi T,Deguchi K,et al.Expression of netrin-1 and its receptors DCC and neogenin in rat brain after ischemia[J].Brain Res,2007,1159: 1-7.
[3] Izzi L,Charron F.Midline axon guidance and human genetic disorders[J].Clin Genet,2011,80(3): 226-234.
[4] Sakumura Y,Tsukada Y,Yamamoto N,et al.A molecular model for axon guidance based on cross talk between rho GTPases[J].Biophy J,2005,89 (2): 812-822.
[5] Chang J,Yao X,Zou H,et al.BDNF/PI3K/Akt and Nogo-A/RhoA/ROCK signaling pathways contribute to neurorestorative effect of houshiheisan against cerebral ischemia injury in rats[J].J Ethnopharmacol,2016,194: 1032-1042.
[6] Long E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1): 84-91.
[7] Vezzani A.VEGF as a target for neuroprotection[J].Epilepsy Curr,2008,8(5):135-137.
[8] 范永升. 全国高等中医药院校规划教材(第十版)·金匮要略[M].北京:中国中医药出版社,2016:57.
[9] 马萌.有关中风病痰热腑实问题的商榷[J].中华中医药杂志,2016,31(2): 559-561.
[10] 王艳红,关枫,杨晓秋.《雷公炮制药性解》详注[M].北京:人民军医出版社,2011:234.
[11] 叶天士. 本草经解[M].北京:学苑出版社,2011:89.
[12] 高学敏. 新世纪(第二版)全国高等中医药院校规划教材·中药学[M].北京:中国中医药出版社,2007:74.
[13] 徐大椿. 神农本草经百种录[M].北京:学苑出版社,2011:67.
[14] 张泽金.基于古今药方纵横的桂枝应用及配伍研究[D].济南:山东中医药大学,2009.
[15] 赵乾龙.浅谈外风说在中风病治疗中的意义[J].中医学报,2015,30(11): 1627-1629.
[16] 王明杰,黄淑芬.风药增效论[J].新中医,2006,38(1):1-4.
[17] 郑国庆,王艳.风药治血与中风病证治[J].中国医药学报,2001,16(1):13-17.
[18] Zhang Q,Zhao H,Wang L,et al.Effects of wind-dispelling drugs and deficiency-nourishing drugs of Houshiheisan compound prescription on astrocyte activation and inflammatory factor expression in the corpus striatum of cerebral ischemia rats[J].Neural Regen Res,2012,7(24): 1851-1857.
[19] Wang H,Wang L,Zhang N,et al.Houshiheisan compound prescription protects neurovascular units after cerebral ischemia[J].Neural Regen Res,2014,9(7): 741-748.
[20] 常佳慧,赵晖,王蕾,等.侯氏黑散化学成分对脂多糖诱导BV2细胞活化中炎性反应因子分泌平衡的影响[J].首都医科大学学报,2017,38(2): 213-219.
[21] 朱卫,张晓彪.银杏叶制剂对脑血管病治疗的概况[J].国外医学:脑血管疾病分册,1998,6(4): 43-46.
[22] 张鸿,赵冬雪,郑东明,等.金纳多注射液对局灶性脑缺血再灌注后神经细胞凋亡及相关蛋白的动态影响[J].中国医科大学学报,2004,33(6): 27-29.
[23] Bradford D,Cole S J,Cooper H M.Netrin-1: diversity in development[J].Int J Biochem Cell Biol,2009,41(3): 487-493.
[24] Dun X P,Parkinson D B.Role of netrin-1 signaling in nerve regeneration[J].Int J Mol Sci,2017,18(3).
[25] 黄欢.跑台运动训练对脑缺血损伤大鼠netrin-1及其受体DCC、Unc5B表达的影响[D].福州:福建医科大学,2011.
[26] Stephenson R E,Miller A L.Tools for live imaging of active Rho GTPases in Xenopus[J].Genesis,2017,55(1-2).
[27] Haga R B,Ridley A J.Rho GTPases: Regulation and roles in cancer cell biology[J].Small GTPases,2016,7(4): 207-221.
[28] Sit S T,Manser E.Rho GTPases and their role in organizing the actin cytoskeleton[J].J Cell Sci,2011,124 (5): 679-83.
[29] Karnoub A E,Symons M,Campbell S L,et al.Molecular basis for Rho GTPase signaling specificity[J].Breast Cancer Res Treat,2004,84(1): 61-71.
[30] Norris A D,Sundararajan L,Morgan D E,et al.The UNC-6/Netrin receptors UNC-40/DCC and UNC-5 inhibit growth cone filopodial protrusion via UNC-73/Trio,Rac-like GTPases and UNC-33/CRMP[J].Development: Engl,2014,141 (22): 4395-4405.
[31] Liu X,Lu Y,Zhang Y,et al.Slit2 regulates the dispersal of oligodendrocyte precursor cells via Fyn/RhoA signaling[J].J Biol Chem,2012,287 (21): 17503-17516.
[32] DeGeer J,Lamarche-Vane N.Rho GTPases in neurodegeneration diseases[J].Exp Cell Res,2013,319 (15): 2384- 2394.
InfluenceofHoushiheisanontheexpressionofaxonguidancefactorandRhoGTPases
Lu Yue1,Liu Jianhong2,Zhao Hui1,Chang Jiahui1,Xiang Yangyang1,Zhang Qiuxia1*
(1.SchoolofTraditionalChineseMedicine,CapitalMedicalUniversity,Beijing100069,China;2.TheGeneralHospitalofThePLARocketArmy,Beijing100840,China)
ObjectiveTo investigate the influence of Houshiheisan on the expression of axon guidance factor Netrin-1/DCC and molecular switch Rac1/Cdc42/RhoA in cerebral ischemia injury rats.MethodsThe permanent middle cerebral artery occlusion (pMCAO) model was made by the intraluminal suture method.Rats were randomly divided into sham group,model group,low dose of Houshiheisan group,middle dose of Houshiheisan group and Ginaton group.Western blotting and RT-PCR were employed to detect the expression of Netrin-1,DCC,Rac1,Cdc42 and RhoA in ischemic cerebral cortex of rats 7 days after operation.ResultsCompared with the model group,in the middle dose of Houshiheisan group and Ginaton groups,the expression of Netrin-1 protein was elevated significantly(P<0.01),middle dose of Houshiheisan group,the expression of Netrin-1 in mRNA was significantly increased(P<0.05);in the low dose of Houshiheisan,middle dose of Houshiheisan and Ginaton groups,the expression of DCC,Rac1 and Cdc42 protein and mRNA (P<0.05,P<0.01)was significantly increased;but the expression of RhoA protein and mRNA was decreased significantly (P<0.01).ConclusionThe findings demonstrated that Houshiheisan could accelerate the recovery of neurological impairment after celebral ischemia by regulating the expression of axon guidance factors like Netrin-1/DCC and molecular switch Rac1/Cdc42/RhoA.
cerebral ischemia;Houshiheisan;Netrin-1;DCC;Rac1;Cdc42;RhoA
国家自然科学基金(81373526)。This study was supported by National Natural Science Foundation of China (81373526).
*Corresponding authors,E-mail:zqx26@163.com,jhliuluan@sina.com
时间:2017-12-13 20∶53
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2053.016.html
10.3969/j.issn.1006-7795.2017.06.022]
R289.5
2017-10-16)
编辑 慕 萌
