α-突触核蛋白通过上调内吞蛋白Rab5B促进海马神经元膜表面NMDA受体内在化
2017-12-19于文娇杨巍巍李旭冉
陈 敏 于文娇 李 昕,4,5 杨巍巍,4,5 李旭冉 于 顺,4,5*
(1.首都医科大学宣武医院神经生物学研究室 北京市老年病医疗研究中心,北京 100053;2.桂林医学院附属医院神经科学实验室,广西桂林 541001;3.首都医科大学帕金森病临床诊疗与研究中心,北京 100053;4.帕金森病北京市重点实验室和教育部神经变性病重点实验室,北京 100053;5.国家老年疾病临床医学研究中心,北京 100053)
·Alpha-突触核蛋白的致病机制·
α-突触核蛋白通过上调内吞蛋白Rab5B促进海马神经元膜表面NMDA受体内在化
陈 敏1,2于文娇1,3李 昕1,3,4,5杨巍巍1,3,4,5李旭冉1,3于 顺1,3,4,5*
(1.首都医科大学宣武医院神经生物学研究室 北京市老年病医疗研究中心,北京 100053;2.桂林医学院附属医院神经科学实验室,广西桂林 541001;3.首都医科大学帕金森病临床诊疗与研究中心,北京 100053;4.帕金森病北京市重点实验室和教育部神经变性病重点实验室,北京 100053;5.国家老年疾病临床医学研究中心,北京 100053)
目的研究α-突触核蛋白(α-synuclein,α-Syn)对N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid receptors,NMDA)受体的调控及机制。方法在原代海马神经元,通过细胞外添加基因重组α-Syn和基因过表达α-Syn方法实现细胞内α-Syn含量增高,基因敲减技术抑制Rab5B,Western blotting法分析NMDA 受体NR1亚单位和Rab5B表达。结果神经元内α-Syn含量增高可以使Rab5B表达上调,并降低膜表面NR1的水平;抑制Rab5B表达可有效反转α-Syn所致的膜表面NR1水平下降。结论α-Syn通过上调Rab5B促进NMDA受体的内在化。
α-突触核蛋白;NMDA受体;内在化;Rab5B;海马神经元
α-突触核蛋白(α-synuclein,α-Syn)是由140个氨基酸构成的小分子蛋白质,在正常情况下主要以可溶性的单体形式存在于神经元[1]。然而,α-Syn的代谢发生障碍,使其在神经细胞内异常积聚,进而聚集成纤维而以包涵体的形式沉积在神经细胞内[2],形成突触核蛋白病(α-synucleinopathy)包括帕金森病(Parkinson’s disease,PD)、路易体痴呆(dementia with Lewy bodies,DLB)及多系统萎缩(multiple system atrophy,MSA)的标志性病理改变。研究[3-6]表明,异常表达的α-Syn参与突触核蛋白病所共有的海马相关记忆功能异常及认知功能下降,而记忆与认知障碍被认为与海马神经元N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体功能异常密切相关[7-8]。但是,α-Syn在病理情况下的异常高表达是否影响海马神经元NMDA受体的表达进而导致认知下降尚未明确。
研究[9]表明,分泌到细胞外的α-Syn可以被一种被称为Rab的GTP酶介导快速摄入细胞,且Rab5B被证明通过网格蛋白(clathrin)介导的内吞机制促进NMDA受体的内在化[10]。因此,本研究将利用大鼠海马原代神经元,通过基因过表达及敲减技术,研究α-Syn对NMDA受体的影响及可能机制。
1 材料与方法
1.1 材料
健康出生12 h内新生Wistar大鼠(30只,分为6组,n=5),购自中国人民解放军军事医学科学实验动物中心,实验动物许可证号:SCXK-2014-004。杜恩斯组织匀浆器(Wheaton Kimble公司,美国)。Neurobasal A培养基、B27、L-谷氨酰胺、DMEM培养基(Gibco公司,美国);胎牛血清(Berlin公司,美国);NMDA、MK-801(Sigma公司,美国);Rab5B反义寡核苷酸(百恩维公司,中国);NMDAR NR1抗体、Calnexin抗体、β-tubulin抗体(Abcam公司,美国);Rab5B抗体(Santa Cruz公司,美国);BCA蛋白质定量试剂盒(Pierce Biotech公司,美国)。
1.2 方法
1.2.1 重组人源α-Syn制备与纯化
将人源α-Syn cDNA分别插入表达载体pET(3a),然后转化至BL21(DE3)感受态细胞,在含氨苄西林的2%(质量分数)YTA 培养液中培养,以异丙基-β-D-硫代半乳糖苷诱导重组蛋白表达后,采用离子交换层析和反向层析法纯化。纯化后的蛋白分别用SDS-PAGE法和蛋白免疫印迹(Western blotting)法鉴定,BCA法测定蛋白浓度。部分纯化α-Syn委托公司标记绿色荧光素(fluorescein isothiocyanate,FITC)。
1.2.2 海马原代神经元培养
将出生12 h内新生Wistar大鼠分离得到的海马组织置于预冷解剖液中,剪碎加入0.25%(质量分数)胰酶消化40 min后终止消化;抛光滴管轻轻吹打成单细胞悬液;用200目尼龙网过滤后按2×105个/cm2的密度接种至多聚-L-赖氨酸预处理35 mm培养皿或75 cm2塑料培养瓶中。置于37 ℃,含5%(体积分数) CO2的培养箱中培养,待神经元贴壁后改用Neurobasal A培养,后每隔3 d换半液。海马原代神经元培养至9 d时,向培养基中加入表达绿色荧光蛋白的慢病毒(lentivirus-green fluorescent protein,LV-GFP)或过表达α-Syn的慢病毒(LV-GFP-α-Syn),继续培养72 h;海马原代神经元培养至12 d时,分别向培养基中加入过滤除菌的PBS、溶菌酶(lysozyme)、纯化的α-Syn或FITC-α-Syn(终浓度为10 μmol/L),孵育24 h。
1.2.3 Rab5B反义寡核苷酸的制备
Rab5B反义寡核苷酸(antisense sequence,AS)及扰乱顺序的寡核苷酸(scramble sequence,SS)其序列分别是:5′-GCTGTGCTTCTGCTAGTCATTTCAAGAGA ATGACTAGCAGAAGCACAGCTTTTTTCTCGAGG-3′和5′-GATCCCTCGAGAAAAAAGCTGTGCTTCTGCTAGT CATTCTCTTGAAATGACTAGCAGAAGCACAGC-3′。
1.2.4 细胞总蛋白及膜蛋白提取
向收集好的细胞里加入全细胞裂解液(或细胞膜裂解液),充分悬浮细胞沉淀,冰上静置裂解30 min,离心30 min(4 ℃,12 000 g),上清即全细胞蛋白(或膜蛋白),BCA法测定蛋白浓度。
1.2.5 Western blotting分析
采用7.5%(质量分数)SDS-PAGE凝胶电泳分离蛋白,经半干法将蛋白质转印至PVDF膜;PVDF膜与NMDAR NR1抗体(1∶1 000)、α-Syn抗体(3D5,1∶5 000)、Rab5B抗体(1∶1 000)、抗GFP单克隆抗体 (1∶1 000)、calnexin抗体(1:1 000)或抗β-tubulin抗体(1∶5 000),4 ℃反应过夜,后与辣根过氧化物酶标记的山羊抗兔或抗小鼠IgG(1∶5 000)室温反应1 h,ECL试剂盒检测。
1.3 统计学方法
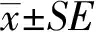
2 结果
2.1 α-Syn下调海马神经元细胞膜NMDARNR1浓度
Western blotting分析结果显示,各组细胞总蛋白中的NMDAR NR1水平无差异;在PBS、对照蛋白Lysozyme及LV-GFP处理组,细胞膜上NMDAR NR1亚基水平较高;而用外加α-Syn和FITC-α-Syn及LV-GFP-α-Syn转染处理的神经元,细胞膜组分内的NR1水平显著下降(n=5,P<0.05)(图1)。
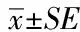
2.2 α-Syn通过上调Rab5B促进海马神经元细胞膜NMDARNR1内在化
Western blotting结果显示,与对照组相比,α-Syn处理细胞(外加人重组α-Syn组、FITC-α-Syn及LV-GFP-α-Syn)中的Rab5B蛋白表达水平增高显著(n=5,P<0.05)(图2)。利用Rab5 siRNA抑制Rab5B表达后,Rab5B表达水平下降,同时α-Syn所致的膜表面NR1降低效应被反转(图3)。
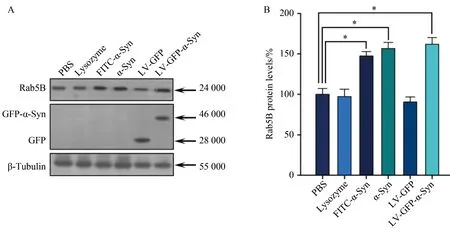
图2 α-Syn上调Rab5B蛋白的表达Fig.2 α-Syn up-regulates the expression of Rab5B protein
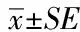
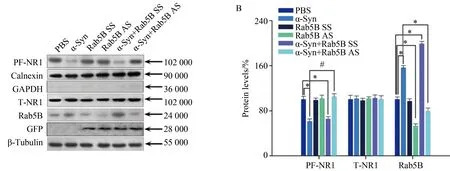
图3 抑制Rab5B蛋白表达可反转α-Syn降低的神经元膜表面NR1的效应Fig.3 Inhibition of Rab5B expression reverses the effect of α-Syn on internalization of surface NR1
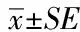
2 讨论
本研究利用原代培养大鼠海马神经元研究了α-Syn对海马神经元膜表面NMDARs的影响。除了通过基因转染方法实现细胞内α-Syn过表达外,笔者还利用α-Syn可以迅速通过细胞膜的特性,通过细胞外添加α-Syn造成细胞内α-Syn含量的增加。这种方法已在本课题组以往的研究中[11]得到论证。本研究发现,无论在α-Syn基因转染神经元还是细胞外添加α-Syn处理的神经元,膜表面NR1的水平都发生明显的下调,而细胞总NR1不变,由此推测,NR1发生了内在化。鉴于NR1是构成功能性NMDARs的必须亚单位[8],其在膜表面的减少意味着功能性NMDARs的减少。已知,Rab5B是一种调节内吞机制的蛋白质,以往在多巴胺神经细胞证明该蛋白参与了α-Syn对NMDA受体内在化的调控[12]。因此,在本研究进一步观察了Rab5B在α-Syn调节海马神经元内在化过程中的作用。结果显示,海马神经元细胞内α-Syn含量增加伴随Rab5B表达的增加,而抑制Rab5B的表达则显著缓解过α-Syn所致的细胞膜表面NR1下调。这些结果提示Rab5B参与了α-Syn对海马神经神经元膜表面NMDA受体内在化的调控。
NMDA受体丰富表达于海马神经元,通过介导海马神经元长时程增强电位形成而参与学习和记忆活动,该受体在海马神经元膜表面减少将影响动物的学习和记忆功能[8]。研究[13-14]显示,在阿尔茨海默病、PD和DLB患者以及模型动物的海马神经元膜表面的NMDA受体的密度降低,且这一改变与认知功能下降具有相关性。本研究探究了突触核蛋白病的关键致病蛋白α-Syn与NMDA受体内在化的相关机制,对揭示PD及DLB等与α-Syn相关的神经退行性疾病的认知功能障碍的机制提供了线索。
[1] Shrivastava A N,Aperia A,Melki R,et al.Physico-pathologic mechanisms involved in neurodegeneration: misfolded protein-plasma membrane interactions[J].Neuron,2017,95(1):33-50.
[2] McCann H,Cartwright H,Halliday G M.Neuropathology of alpha-synuclein propagation and braakhypothesis[J].Mov Disord,2016 (31): 152-160.
[3] Aarsland D,Andersen K,Larsen J P,et al.Risk of dementia in Parkinson’s disease[J].Neurology,2001,56:730-736.
[4] Visvanathan R.Dementia with Lewy bodies[J].J Clin Neurosci,2004,11(6):573-576.
[5] Lim Y,Kehm V M,Lee E B,et al.α-Syn suppression reverses synaptic and memory defects in a mouse model of dementia with Lewy bodies[J].J Neurosci,2011,31(27):10076-10087.
[6] Sardi S P,Clarke J,Kinnecom C,et al.CNS expression of glucocerebrosidase corrects alpha-Synuclein pathology and memory in a mouse model of Gaucher-related synucleinopathy[J].Proc Natl AcadSci U S A,2011,108(29):12101-12106.
[7] Diógenes M J,Dias R B,Rombo D M,et al.Extracellular alpha-Synuclein oligomers modulate synaptic transmission and impair LTP via NMDA-receptor activation[J].J Neurosci,2012,32(34):11750-11762.
[8] Paoletti P,Bellone C,Zhou Q.NMDA receptor subunit diversity: impact on receptor properties,synaptic plasticity and disease[J].Nat Rev Neurosci,2013,14(6):383-400.
[9] Shi M M,Shi C H,Xu Y M.RabGTPases: the key players in the molecular pathway of parkinson’s disease[J].Front Cell Neurosci,2017,11:81.
[10] Arnett A L,Bayazitov I,Blaabjerg M,et al.Antisenseoligonucleotide against GTPase Rab5b inhibits metabotropic agonist DHPG-inducedneuroprotection[J].Brain Res,2004,1028(1):59-65.
[11] 殷娟娟,韩俊燕,李昕,等.α-突触核蛋白功能片段向多巴胺能神经细胞内的转运及其对细胞增殖的影响[J].首都医科大学学报,2007,28 (3): 345-349.
[12] Cheng F,Li X,Li Y,et al.alpha-Synuclein promotes clathrin-mediated NMDA receptor endocytosis and attenuates NMDA-induced dopaminergic cell death[J].J Neurochem,2011,119(4):815-825.
[13] Hanson J E,Pare J F,Deng L,et al.Altered GluN2B NMDA receptor function and synaptic plasticity during early pathology in the PS2APP mouse model of alzheimer’s disease[J].Neurobiol Dis,2015,74:254-262.
[14] Wang Q,Li J,Wei X,et al.Alterations of NMDA receptor binding in various brain regions among 6-hydroxydopamine-induced Parkinsonian rats[J].Int J Neurosci,2014,124(6):457-465.
α-SynucleinpromotesNMDAreceptorinternalizationbyupregulationofendocytosisproteinRab5B
Chen Min1,2,Yu Wenjiao1,3,Li Xin1,3,4,5,Yang Weiwei1,3,4,5,Li Xuran1,3,Yu Shun1,3,4,5*
(1.DepartmentofNeurobiology,XuanwuHospital,CapitalMedicalUniversity,BeijingInstituteofGeriatrics,Beijing100053,China;2.LaboratoryofNeuroscience,AffliliatedHospitalofGuilinMedicalUniversity,Guilin541001,GuangxiZhuangAutomousRegion,China;3.ClinicalCenterforParkinson’sDisease,CapitalMedicalUniversity,Beijing100053,China;4.BeijingKeyLaboratoryforParkinson’sDiseaseandKeyLaboratoryofNeurodegenerativeDiseases,MinistryofEducation,Beijing100053,China;5.NationalClinicalResearchCenterforGeriatricDisorders,Beijing100053,China)
ObjectiveTo investigate the effect of α-synuclein (α-Syn) on surface N-methyl-D-aspartic acid receptors (NMDARs) in cultured rat hippocampal neurons.MethodsIncreased intracellular α-Syn was realized by extracellular addition of recombinant human α-Syn to the culture medium or transfection of human α-Syn gene to the neurons.Western blotting analysis was applied to observe the effects of α-Syn on levels of NMDA receptor NR1 subunit and Rab5B under conditions with or without Rab5B knockdown.ResultsIntracellular elevation of α-Syn decreased the surface expression of NMDA NR1 and cytoplasmic levels of Rab5B;Inhibition of Rab5B expression reversed the effects of α-Syn.ConclusionThe accumulation of α-Syn in hippocampal neurons can promote the internalization of surface NMDARs through an endocytic mechanism that requires participation of Rab5B.
α-synuclein;NMDA receptor;internalization;Rab5B;hippocampal neurons
国家自然科学基金(81371200,81071014,81401042),北京市医院管理局“使命”计划专项经费资助(SML20150803),北京市科学技术委员会资助(Z161100005116011,Z171100000117013),北京市卫生和计划生育委员会项目(PXM2017_026283_000002),广西自然科学基金(2014GXNSFAA118197)。This study was supported by National Natural Science Foundation of China (81371200,81071014,81401042),Beijing Municipal Administration of Hospitals’ Mission Plan (SML20150803),Beijing Municipal Science &Technology Commission (Z161100005116011,Z171100000117013),Beijing Municipal Commission of Health and Family Planning (PXM2017_026283_000002),Natural Science Foundation of Guangxi (2014GXNSFAA118197).
*Corresponding author,E-mail:yushun103@163.com
时间:2017-12-13 20∶53
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2053.018.html
10.3969/j.issn.1006-7795.2017.06.017]
Q 189
2017-10-23)
编辑 慕 萌
