液体活检技术在结直肠癌精准医疗中的应用与挑战
2017-12-19杨盈赤张忠涛
杨盈赤 张忠涛
(首都医科大学附属北京友谊医院普外科,北京 100050)
·消化外科专题·
液体活检技术在结直肠癌精准医疗中的应用与挑战
杨盈赤 张忠涛*
(首都医科大学附属北京友谊医院普外科,北京 100050)
随着精准医疗在肿瘤临床领域中的广泛开展,对肿瘤分子生物学特性进行实时动态监测的需求越来越高。近年来,液体活检以简便快捷、微创、实时、特异性高和克服时空异质性等特点在肿瘤临床诊断与治疗中发挥着越来越重要的价值。本文围绕液体活检的两种主要技术:循环肿瘤细胞和循环肿瘤DNA检测技术的特点,介绍了其在结直肠癌精准医疗领域的最新研究进展,探讨了面临的挑战和可行的解决方案。
液体活检;结直肠癌;循环肿瘤细胞;循环肿瘤DNA
随着生物技术的不断发展和精准医疗的推进,结直肠癌的治疗模式也逐渐发展为以手术治疗为主的综合性治疗[1]。在这项系统而精细的“医学工程”中,从组织到细胞直至分子层面的关于肿瘤的全方位信息,为早期诊断、用药指导、术后监测和疗效评估等临床诊疗环节提供了保障。液体活检(liquid biopsy,LB)作为精准医疗新技术,因其可定性定量检测肿瘤直接相关的肿瘤细胞和DNA,并具有非入侵性、取样便捷、实时监测等特点,逐步在肿瘤诊疗中发挥越来越重要的作用[2]。
其中检测循环肿瘤细胞(circulating tumor cell,CTC)和循环肿瘤DNA(circulating tumor DNA,ctDNA)是液体活检中最具代表性的两种技术[3]。本文着重介绍液体活检技术在结直肠癌诊疗中的应用进展和面临的挑战。
1 CTC和ctDNA技术简介
CTC是指由肿瘤原发灶或转移灶进入血液循环的肿瘤细胞。1869年首次提出循环肿瘤细胞的概念[3]。CTC 的分离方法主要有两类,一是物理学方法,如依据细胞直径、密度、电荷及可塑性等,采用密度梯度离心法、膜过滤法、介电电泳等方法加以分选;二是免疫学方法,如基于细胞抗原表达、蛋白分泌及侵袭性等,根据其表面标志物如 Ep CAM、CK等实现细胞分离富集[4]。分离富集得到的CTC可用于后续的鉴定分析,根据不同应用目的而选择不同的鉴定方法,目前临床应用较为成熟的是基于免疫荧光、原位杂交等方法[5]。
ctDNA指来自于肿瘤细胞的凋亡、坏死或分泌释放到外周血的游离DNA(circulating free DNA,cfDNA),因其携带了肿瘤的基因变异特征,如突变、插入、缺失、重排、拷贝数异常和甲基化等,这是检测ctDNA的理论基础。ctDNA的检测可分为定性和定量两个方面,前者主要检测血浆中肿瘤特异性基因变异,后者则检测血浆中ctDNA总量。这两种方法均可以反映肿瘤的存在和严重程度,但目前ctDNA定性分析在临床实践中应用较为成熟,如检测基因突变、插入、缺失、融合、重排、拷贝数变异、甲基化、微卫星不稳定 (microsatellite instability,MSI) 和杂合性缺失(loss of heterozygosity,LOH) 等[6]。
2 CTC检测在结直肠癌诊疗中的应用
2.1 辅助诊断
许多研究[7-9]证实CTC可很好地反映结直肠癌患者的临床病理特点并有助于辅助诊断。在临床诊断阶段可充分利用CTC检测,联合影像学检查,在传统TNM分期基础上,辅助精准分期,及时了解早期微转移灶存在风险,制定更为合理的个体化治疗方案。CTC数量与淋巴结转移与否密切相关,不仅淋巴结转移性结直肠癌患者的CTC数量明显高于非转移性患者,而且与患者是否有腹腔转移具有明显相关性[7]。同时CTC同肿瘤侵犯深度、是否血管侵犯及肝转移等均具有明显的相关性[8]。目前,美国癌症联合会(American Joint Committee on Cancer,AJCC)乳腺癌系统分期中[9],在临床和(或)影像学未发现转移证据的情况下,如果在骨髓或循环血中发现播散肿瘤细胞(即CTC),可作为一个新的M分期(远端转移)-cM0(i+)标准,介于M0和M1之间,这种分期是否适合应用于结直肠癌,将来在更多的循证医学证据支持下会成为指南更新的热点。
2.2 预后评价和复发转移预测
胃肠道肿瘤中结直肠癌是首先被食品药品监督管理局(Food and Drug Administration,FDA)批准适用于CTC检测判断预后[2],目前关于CTC与结直肠癌患者的预后相关性的研究数量远远多于其他胃肠道肿瘤,多项研究[10-13]证实了CTC可以对结直肠癌患者的长期生存进行很好的预判。术后高CTC数目明显升高或持续升高均提示结直肠癌患者预后不良[10]。对于术前接受过短期放射治疗(以下简称放疗)的直肠癌患者,虽然术前CTC水平不能评价预后,但术后 7 d的CTC浓度是局部转移的独立预后因子[11]。另外有Meta分析[12]结果均显示基线CTC计数是与结直肠癌患者无进展生存期(progress free survival,PFS) 和总生存期(overall survival,OS)有关的独立预后因素。目前CTC作为独立预后因子评价结直肠癌患者生存期已经成为一种共识,可以指导其他胃肠道肿瘤的临床实践。
结直肠癌伴有转移的患者外周血中CTC数量明显高于未转移患者和健康志愿者。有研究者[13]发现术后CTC阳性患者出现复发的危险高于术后病理淋巴结阳性的患者,而两者均阳性的患者发生复发的概率明显增加。也有研究者[14]发现手术前后CTC均阴性的结直肠癌患者无复发生存期显著高于术前后均阳性的对照组(P=0.000)。一项更加长期的研究[13]结果显示,术前检测到CTC的患者,其术后无转移复发生存期明显低于未检测出 CTC的患者,而术后数周内患者CTC数目与无复发生存期无显著相关性,但术后 2~3 年内 CTC数目与无转移复发生存期有相关性,提示不仅可以利用CTC检测预测患者术后复发转移的风险,还可在术后病程中动态跟踪监测,指导临床根据患者情况及早介入诊疗等。
2.3 治疗效果评估
临床实践中,除了手术治疗方式外,各种治疗手段如新辅助放疗及化学药物治疗(以下简称放化疗)、联合化疗、靶向治疗和生物治疗等也成为了结直肠癌综合治疗的重要组成部分。但不是所有的放化疗等辅助治疗都有利于延长生存期,如对于放化疗无效的患者来说放化疗不良反应反而影响患者的生存质量。Barbazán等[14]研究发现在治疗后,通过常规影像学检查判定为治疗有效的患者中,仍有部分CTC阳性,而这部分患者具有较差的长期生存,该研究指出通过CTC的检测可以鉴别出常规影像学检查无法发现的对治疗抵抗的患者,并且可以及时地给予针对性的治疗。
3 ctDNA在胃肠道肿瘤诊疗中的应用
3.1 早期筛查
ctDNA甲基化与早期结直肠癌肿瘤相关性的研究[15-17]较多。一项大规模、多中心、前瞻性结直肠癌临床筛查试验[15]从定期行结肠镜检查的患者中招募了超过7 900例志愿者,其中53例检查发现患有结直肠癌,血浆ctDNA中SEPT9基因异常甲基化在无症状CRC患者中作为筛查诊断试验的敏感度为48.2%,特异度为91.5%。虽然两项研究敏感度差别较大,但两研究均表明ctDNA中SEPT9基因异常甲基化检测在结直肠癌筛查或诊断中的价值。但是,目前采用ctDNA检测技术对早期患者的诊断依然处于科研探索阶段,作为一些热点突变的初筛和肿瘤组织检测的补充,更加广泛的临床应用还需更多循证医学证据的支持。
3.2 靶向治疗指导
以ctDNA中基因变异信息为基础的肿瘤分子分型能够极大地方便肿瘤个体化治疗的靶点选择,所以目前ctDNA最直接的临床应用是鉴定特异的基因突变指导靶向治疗的选择。部分对ctDNA的KRAS突变的研究[16-17]表明ctDNA能够进行相关体细胞突变分析用于肿瘤分子分型,然后选择个体化靶向治疗。Arena等[16]探索性使用一个能结合上皮生长因子受体(epidermal growth factor receptor,EGFR)胞外区域(extracellular domain,ECD) 多个位点的寡克隆抗体 MM-151 治疗西妥昔单抗和帕尼单抗耐药的结肠癌患者后,检测 ctDNA发现EGFR-ECD突变率降低。
靶向药物的使用往往会面临着耐药的出现,而KRAS、BRAF基因突变往往是转移性结直肠癌三线治疗原发抵抗的主要原因。Diaz等[17]选取KRAS野生型的转移性CRC患者,予以帕尼单抗靶向治疗,部分患者仍有耐药发生,ctDNA检测发现,KRAS突变在治疗前以低频亚克隆的形式存在(之前组织未检出);随访5~6月,该人群中ctDNA中KRAS突变检出率为38%,同时9例发生新BRAF突变。研究提示ct DNA检测可突破组织检测限制,更好反映肿瘤基因变异全貌。
3.3 预后评价和动态监测
目前已有研究[15-16,18]证实ctDNA的突变频率与结直肠癌的预后具有相关性。Lecomte等[18]对37例结直肠癌患者生存分析(平均随访22个月),结果显示KRAS突变及CDKN2A启动子超甲基化的阳性患者2年整体生存率仅为48%,而无上述基因变异的患者2年整体生存率可达100%。研究提示ctDNA中KRAS突变或CDKN2A启动子超甲基化可能是结直肠癌的独立预后因素。
ctDNA半衰期短,仅允许在几个小时的间隔内动态评估肿瘤状态,所以ctDNA检测可以更加精确地监测肿瘤患者治疗过程中的肿瘤动态和负荷变化。
系统性研究[15-16]显示,肺癌、结肠癌等发生复发转移时,ctDNA含量明显增高。另外,ctDNA中微卫星改变也用作监测治疗反应的指标和治疗后随访指标,在患者分类和监测肿瘤复发研究中已体现出潜在价值。
4 CTC和ctDNA在结直肠癌诊疗中的联合应用
ctDNA所携带的肿瘤基因变异信息较为全面,能克服肿瘤异质性问题,并且检测方法较为统一;而CTC作为完整的细胞,不仅包含DNA信息,还有RNA、蛋白质信息等,而且基于多样的分析方法,可以在细胞和亚细胞层次作分子功能研究,更能全方位揭示肿瘤特征。目前,CTC在肿瘤的临床应用多集中于辅助诊断与预后判断,ctDNA则多集中于靶向药的使用指导及耐药情况的监测;而两者都与肿瘤负荷、治疗疗效、病情进展等相关,因此,两者相互结合联合应用,临床的指导意义更大,CTC和ctDNA技术对比见表1。2015年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)会议提出,肿瘤整个疾病周期中,液体活检CTC与ctDNA应当联合应用的建议,例如,早期CTC检测到循环肿瘤细胞,提示人体内可能存在肿瘤细胞;进一步结合ctDNA基因测序提示可能患有癌症,就可以经传统影像学检测进一步确诊;然后,新一代测序技术(new generation of sequencing,NGS)全基因测序提示癌症特性,并提供对应个性化用药指导,治疗后利用CTC进行定期的监测等具体方案。
5 问题与展望
综合以上临床应用研究,CTC和ctDNA作为液体活检的两个重要组成部分,在结直肠癌的个体化诊疗的临床实践的不同阶段和方面发挥着越来越重要的作用。但就像任何一种新生事物一样,在发展的初期同样要面对很多质疑和挑战,还有很多问题需要解决。
首先,技术层面上,液体活检检测技术方法种类众多,但是缺乏行业标准;而临床中对于任何一项面向患者的检测技术,无论在特异度、敏感度和检测稳定性都有较高要求。第二,现有液体检测收费相对比较昂贵,如何不断改进技术,降低成本,减轻肿瘤患者经济负担,仍需要各方面的共同努力。第三,科研层面上,在将液体活检全面应用到临床的过程中,还有一些科学问题值得探究,并加以验证,例如液体活检如何能够敏感特异的应用到肿瘤早期筛查和诊断中;液体活检在手术、放化疗前后检测时间点如何设置更加合理;CTC本身活性状态或基因变异情况与患者预后状态的关系等。
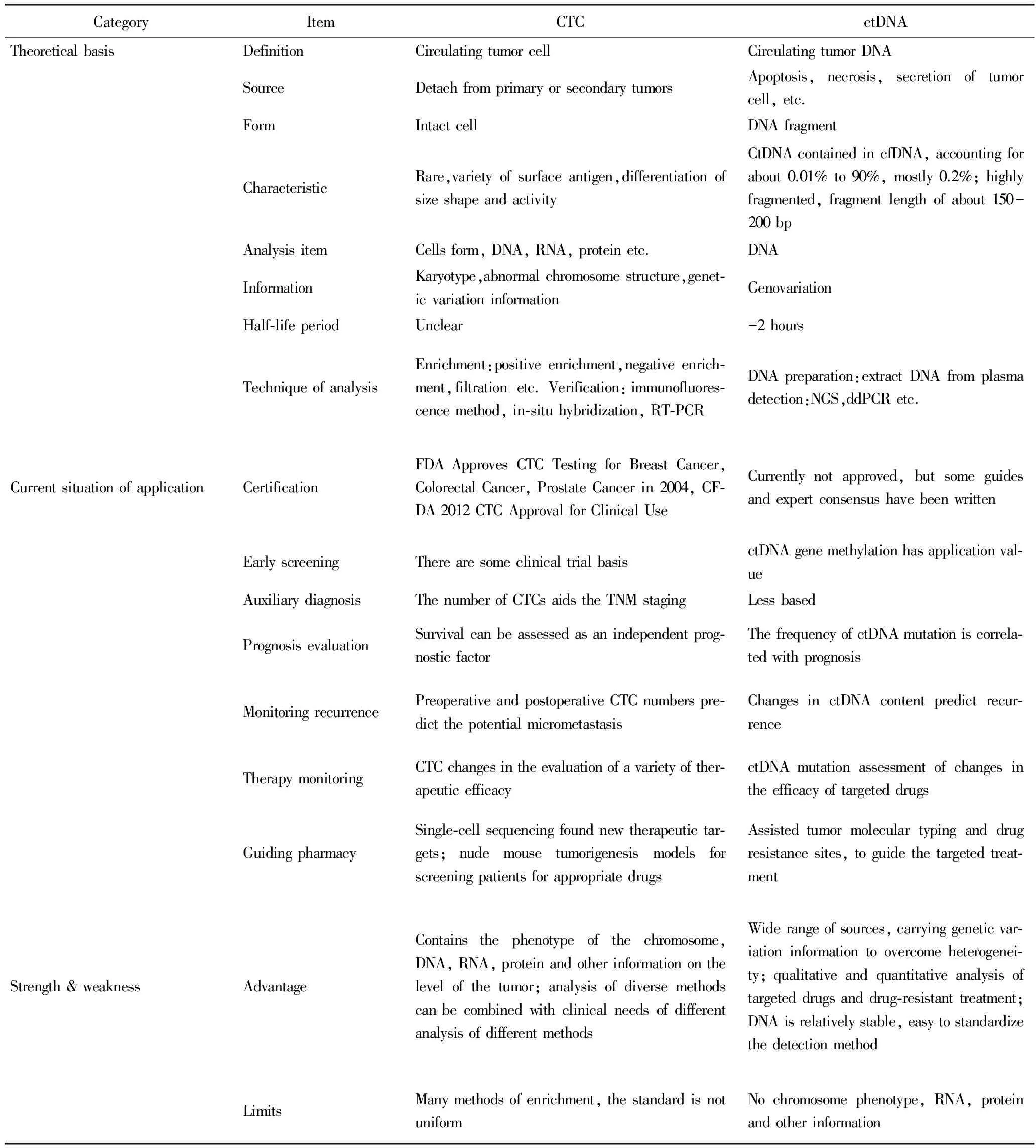
表1 CTC和ctDNA技术应用对比Tab.1 Comparison of using of CTC and ctDNA
NGS: new generation of sequencing;FDA:Food and Drug Administration;CFDA:China Food and Drug Administration;CTC:circulating tumor cell;ctDNA:circulating tumor DNA.
最后,期待通过临床医师、技术专家和政府部门三方共同推动液体活检技术在医疗临床实践中的应用,使每一位肿瘤患者能够真正在精准医疗的时代中享受到个体化诊疗的益处。
[1] Ryuk J P,Choi G S,Park J S,et al.Predictive factors and the prognosis of recurrence of colorectal cancer within 2 years after curative resection [J].Ann Surg Treat Res,2014,86(3): 143-151.
[2] Ignatiadis M,Lee M,Jeffrey S.Circulating tumor cells and circulating tumor DNA: challenges and opportunities on the path to clinical utility [J].Clin Cancer Res,2015,21(21): 4786-4800.
[3] Lowes L E,Bratman S V,Dittamore R,et al.Circulating tumor cells (CTC) and Cell-free DNA (cfDNA) Work Shop 2016: scientific opportunities and logistics for cancer clinical trial incorporation [J].Int J Mol Sci,2016,17(9): pii: E1505.
[4] Galatea K,Eleni P,Saad A,et al.Evaluation of isolation methods for circulating tumor cells (CTCs) [J].Cell Physiol Biochem,2016,40: 411-419.
[5] Dive C,Brady G.Snap shot: circulating tumor cells [J].Cell,2017,169(1):176.
[6] Newman A M,Bratman S V,To J,et al.An ultrasensitive method for quantitating circulating tumor DNA with broad patient coverage [J].Nat Med,2014,20(5): 548-554.
[7] Wong S C,Chan C M,Mab B,et al.Clinical significance of cytokeratin 20-positive circulating tumor cells detected by a refined immunomagnetic enrichment assay in colorectal cancer patients [J].Clin Cancer Res,2009,15(3): 1005-1012.
[8] Sastre J,Maestro M L,Puente J,et al.Circulating tumor cells in colorectal cancer: correlation with clinical and pathological variables [J].Ann Oncol,2008,19(5): 935-938.
[9] Amin M B,Edge S,Greene F,et al.AJCC cancer staging manual[M].8th.New York: Springer,2017.
[10] Galizia G,Gemei M,Orditura M,et al.Postoperative detection of circulating tumor cells predicts tumor recurrence in colorectal cancer patients [J].J Gastrointest Surg,2013,17 (10): 1809-1818.
[11] Nesteruk D,Rutkowski A,Fabisiewicz S,et al.Evaluation of prognostic significance of circulating tumor cells detection in rectal cancer patients treated with preoperative radiotherapy:prospectively collected material data [J].Biomed Res Int,2014,2014:712827.
[12] Rahbari N N,Aigner M,Thorlund K,et al.Meta-analysis shows that detection of circulating tumor cells indicates poor prognosis in patients with colorectal cancer [J].Gastroenterology,2010,138(5): 1714-1726.
[13] Van Dalum G,Stam G J,Scholten L F,et al.Importance of circulating tumor cells in newly diagnosed colorectal cancer [J].Int J Oncol,2015,46(3):1361-1368.
[14] Barbazán J,Muinelo-Romay L,Vieito M,et al.A multimarker panel for circulating tumor cells detection predicts patient outcome and therapy response in metastatic colorectal cancer [J].Int J Cancer,2014,135(11): 2633-2643.
[15] Church T R,Wandell M,Lofton-Day C,et al.Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer [J].Gut,2014,63(2): 317-325.
[16] Arena S,Siravegna G,Mussolin B,et al.MM-151 overcomes acquired resistance to cetuximab and panitumumab in colorectal cancers harboring EGFR extracellular domain mutations [J].Sci Translat Med,2016,8(324): 314-324.
[17] Diaz L J,Williams R T,Wu J,et al.The molecular evolution of acquired resistance to targeted EGFR blockade in colorectal cancers [J].Nature,2012,486(7404) : 537-540.
[18] Lecomte T,Berger A,Zinzindohou F,et al.Detection of free-circulating tumor-associated DNA in plasma of colorectal cancer patients and its association with prognosis [J].Int J Cancer,2002,100(5): 542-548.
Clinicalapplicationandchallengeofliquidbiopsyintheprecisionmedicineofcolorectalcancer
Yang Yingchi,Zhang Zhongtao*
(DepartmentofGeneralSurgery,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China)
With the rapid development of precision medicine in cancer,the demand for dynamic monitoring of tumor molecular characteristic has been increased.In recent years,liquid biopsy is currently playing a more and more important role in diagnosis and treatment of cancer in clinical practice due to its convenience,non-invasiveness,high specificity and overcoming temporal-spatial heterogeneity.This review introduces circulating tumor cell (CTC) and circulating tumor DNA (ctDNA) as the most important technique in liquid biopsy,mainly focusing on their technological feature,especially recent research progress in colorectal cancer.Further,the challenge and possible solution are discussed in the clinic application of liquid biopsy.
liquid biopsy;colorectal cancer;circulating tumor cells;circulating tumor DNA
国家科技支撑计划课题(2015BAI13B),北京市卫生系统高层次卫生技术人才培养计划资助项目(2015-3-005)。This study was supported by National Science and Technology Support Program(2015BAI13B),Beijing Municipal Health System High-level Health Technician Training Program(2015-3-005).
*Corresponding author,E-mail:zhongtaozt@hotmail.com.
时间:2017-12-13 21∶09
http://kns.cnki.net/kcms/detail/11.3662.R.20171213.2109.028.html
10.3969/j.issn.1006-7795.2017.06.001]
R735.3
2017-10-16)
编辑 慕 萌
