NLRP3炎症体参与末端糖基化产物诱导的人主动脉内皮细胞损伤
2017-12-19李晓晴陕西省人民医院心血管内科西安710068通讯作者mailshishuang1168163com
张 勇,李晓晴,石 爽(陕西省人民医院心血管内科,西安 710068;通讯作者,E-mail:shishuang1168@163.com)
NLRP3炎症体参与末端糖基化产物诱导的人主动脉内皮细胞损伤
张 勇,李晓晴,石 爽*
(陕西省人民医院心血管内科,西安 710068;*通讯作者,E-mail:shishuang1168@163.com)
目的 观察NLRP3炎症体在末端糖基化产物(AGEs)诱导的人主动脉内皮细胞(HAECs)细胞损伤中的作用。 方法 制备AGEs并以不同浓度AGEs处理体外培养的HAECs,再以抗氧化剂N-乙酰基-L-半胱氨酸(NAC)处理细胞。MTT法评估细胞活性;流式细胞术测定细胞内活性氧簇(ROS)生成水平;ELISA法检测细胞培养上清液中IL-1β水平;免疫印记法检测HAECs中NLRP3、ASC、caspase1 p20以及IL-1β蛋白表达水平。 结果 与正常对照相比,经不同浓度AGEs处理后的HAECs细胞活力显著下降(P<0.05);细胞内ROS生成水平显著增加(P<0.05);细胞内NLRP3、ASC、caspase-1 p20以及IL-1β蛋白表达水平显著升高(P<0.05);细胞培养上清液内IL-1β水平显著升高(P<0.05)。上述变化均具有AGEs浓度依赖性(P<0.05)。抗氧化剂NAC处理能够显著改善AGEs对细胞活力的抑制(P<0.05),抑制ROS产生(P<0.05),下调NLRP3、ASC、caspase1 p20以及IL-1β蛋白表达(P<0.05),并减少培养上清液内IL-1β水平(P<0.05)。 结论 AGEs可能通过诱导HAECs内ROS产生激活NLRP3炎症体导致细胞损伤。
末端糖基化产物; NLRP3炎症体; 活性氧簇; 人主动脉内皮细胞
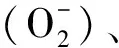
1 材料与方法
1.1 主要试剂
胎牛血清(BSA,Hyclone),甘油醛(Sigma-Aldrich),RPMI-1640细胞培养基(Hyclone),N-乙酰基-L-半胱氨酸(NAC,Sigma-Aldrich),二甲基亚砜(DMSO,Sigma-Aldrich),活性氧检测试剂盒(Beyotime),总蛋白抽提试剂盒(Beyotime),BCA蛋白浓度检测试剂盒(Thermo Scientific)NLRP3抗体(Abcam)、caspase-1 p20抗体(Abcam)、含CARD结构凋亡相关斑点样蛋白(ASC)抗体(Abcam)、IL-1β抗体(Abcam)以及GAPDH抗体(Abcam),IL-1β ELISA检测试剂盒(Invitrogen)。
1.2 AGEs的制备
参照既往文献[5]制备AGEs。在无菌条件下,将牛血清蛋白与甘油醛(0.1 mmol/L)在磷酸钠缓冲液(0.2 mmol/L,pH=7.4)中以37 ℃培育7 d。以PD-10脱盐层析柱(GE Healthcare)处理上述溶液,以去除磷酸盐及未成基团的糖类制成AGEs溶液。以未与甘油醛反应的BSA作为对照溶液。
1.3 细胞培养与处理
常规复苏HAECs,以2×108/L HAECs接种于培养瓶内。以含10 % BSA的RPMI-1640细胞培养基在细胞培养箱中进行培养(37 ℃,5% CO2,饱和湿度)。连续培养2-4代,取处于对数生长期的HAECs进行后续试验。将细胞分为:①空白对照组(control);②低浓度AGEs处理组(L-AGEs):以终浓度为10 μg/ml的AGEs溶液培养细胞48 h;③中浓度AGEs处理组(M-AGEs):以终浓度为25 μg/ml的AGEs溶液培养细胞48 h;④高浓度AGEs处理组(H-AGEs):以终浓度为50 μg/ml的AGEs溶液培养细胞48 h;⑤NAC干预组:以终浓度为50 μg/ml的AGEs溶液培养细胞48 h,更换培养基后以终浓度为5 mmol/L的NAC孵育细胞30 min。
1.4 细胞活力测定
采用四氮噻唑蓝(MTT)法检测细胞活力。取细胞接种于96孔板,各组分别设6个复孔,给予上述干预措施后,每孔中加入终浓度为5 g/L的MTT溶液(Sigma-Aldrich)20 μl并继续培养4 h。弃去液体,每孔加入150 μl DMSO并充分震荡10 min。以酶标仪(Bio-Rad)读取490 nm波长处的吸光度值(A490)并计算相对细胞活力(各组A490/对照A490)。
1.5 细胞内ROS水平测定
采用流式细胞术测定细胞内ROS水平。以活性氧检测试剂盒对细胞进行染色。以无血清RPMI-1640按照1 ∶1 000稀释DCFH-DA,调整其终浓度为10 mmol/L,并以该溶液对各组细胞在37 ℃进行孵育20 min。以无血清培养基洗涤3次,以488 nm光源激发,使用流式细胞仪(FACS Calibur,BD)在530 nm波长下探测荧光强度。
1.6 免疫印记法测定HAECs内蛋白表达
以免疫印迹法检测HAECs内NLRP3炎症体相关通路蛋白表达水平。以RIPA裂解缓冲液系统(Santa Cruz)对细胞进行裂解,之后使用总蛋白抽提试剂盒对总蛋白进行提取,以BCA法检测蛋白浓度。蛋白变性后,以SDS-PAGE分离蛋白质并电转印至PVDF膜。以5 %脱脂牛奶封闭,分别以NLRP3抗体(1 ∶2 000)、caspase-1 p20抗体(1 ∶2 000)、含CARD结构凋亡相关斑点样蛋白(ASC)抗体(1 ∶2 000)、IL-1β抗体(1 ∶2 000)以及GAPDH抗体(1 ∶3 000)在4 ℃下对PVDF膜进行孵育8 h。TBST溶液充分洗涤上述PVDF膜,使用辣根过氧化物酶标二抗在室温下孵育1 h。ECL法对所检测蛋白条带进行显影。
1.7 ELISA检测细胞培养上清液IL-1β水平
离心各组细胞所获得的细胞培养上清液经过Centricon-YM10浓缩柱处理后,按照IL-1β ELISA检测试剂盒说明书检测细胞培养液中IL-1β浓度。
1.8 统计学分析
所得数据均采用均数±标准差表示,以统计学软件SPSS 16.0分析数据。组间差异比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 NAC可逆转AGEs对HAECs细胞活力的抑制作用
MTT检测结果显示,与control组相比,L-AGEs组、M-AGEs组以及H-AGEs组细胞活力均显著下降,且具有浓度依赖性(P<0.05,见表1)。与H-AGEs组相比,抗氧化剂NAC处理后,细胞活性显著升高。
表1各组HAECs细胞活力(n=6)
Table1CellviabilityinHAECsindifferentgroups(n=6)
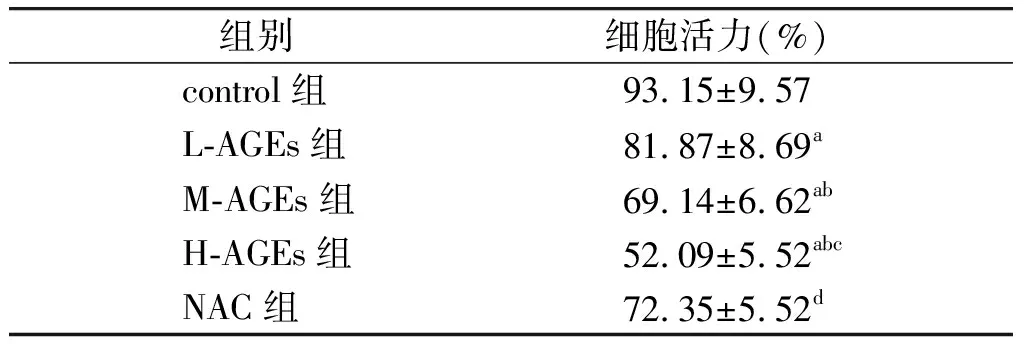
组别细胞活力(%) control组93 15±9 57 L⁃AGEs组81 87±8 69a M⁃AGEs组69 14±6 62ab H⁃AGEs组52 09±5 52abc NAC组72 35±5 52d
与control组比较,aP<0.01;与L-AGEs组比较,bP<0.05;与M-AGEs组比较,cP<0.05;与H-AGEs组比较,dP<0.05
2.2 NAC可抑制AGEs诱导的HAECs内ROS产生
与control组相比,经不同浓度的AGEs处理后,L-AGEs组,M-AGEs组以及H-AGEs组细胞内代表ROS标记物DCFH-DA荧光染色强度均显著升高,且具有AGEs的浓度依赖性(P<0.05,见图1,表2)。与H-AGEs组相比,抗氧化剂NAC处理后,NAC组细胞内DCFH-DA水平显著降低。

图1 各组细胞DCFH-DA染色流式细胞图Figure 1 DCFH-DA staining of HAECs in different groups by flow cytometry
表2各组细胞DCFH-DA染色荧光强度比较(n=3)
Table2MeanfluorescenceintensitiesinHAECsindifferentgroups(n=3)
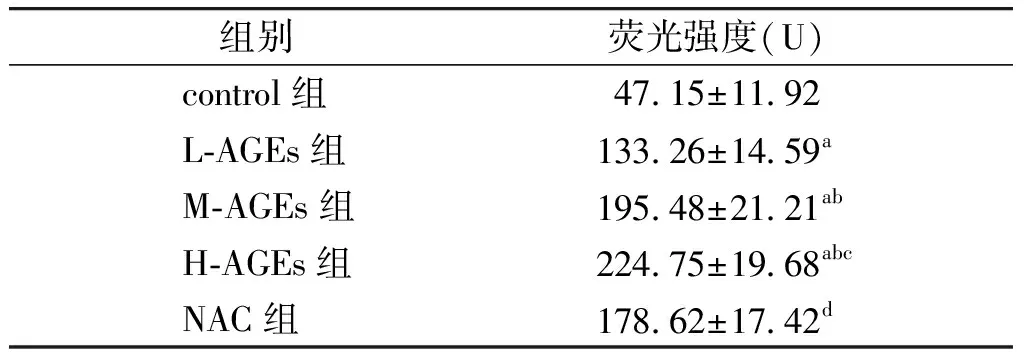
组别荧光强度(U) control组47 15±11 92 L⁃AGEs组133 26±14 59a M⁃AGEs组195 48±21 21ab H⁃AGEs组224 75±19 68abc NAC组178 62±17 42d
与control组比较,aP<0.01;与L-AGEs组比较,bP<0.05;与M-AGEs组比较,cP<0.05;与H-AGEs组比较,dP<0.05
2.3 NAC可抑制AGEs对HAECs内NLRP3炎症体活化水平的上调
免疫印记法检测结果表明,与control组相比,经不同浓度AGEs处理后,L-AGEs组、M-AGEs组以及H-AGEs组HAECs内NLRP3、ASC、caspase1 p20以及IL-1β蛋白相对表达水平均显著升高。与H-AGEs组相比,经抗氧化剂NAC处理后,NAC组HAECs内NLRP3、ASC、caspase1 p20以及IL-1β蛋白相对表达水平均显著降低(P<0.05,见图2,表3)。
2.4 NAC可抑制AGEs刺激的HAECs分泌IL-1β水平
与control组相比,经不同浓度AGEs处理后,L-AGEs组、M-AGEs组以及H-AGEs组HAECs细胞培养上清液中IL-1β浓度显著升高,且具有AGEs浓度依赖性(P<0.05,见表4)。抗氧化剂NAC处理后,与H-AGEs组相比,NAC组HAECs细胞培养上清液中IL-1β浓度显著降低(P<0.05,见表4)。
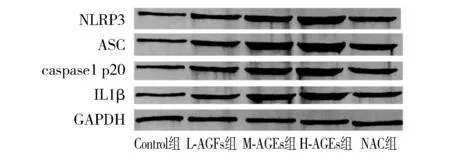
图2 各组HAECs中NLRP3、ASC、caspase1 p20、IL-1β蛋白表达Figure 2 Protein expression of NLRP3, caspase1 p20, IL-1β in HAECs in different groups
表3各组细胞NLRP3、ASC、caspase1p20以及IL-1β相对表达水平(n=3)
Table3RelateiveexpressionlevelsofNLRP3,ASC,caspase1p20andIL-1βinHAECsindifferentgroups(n=3)
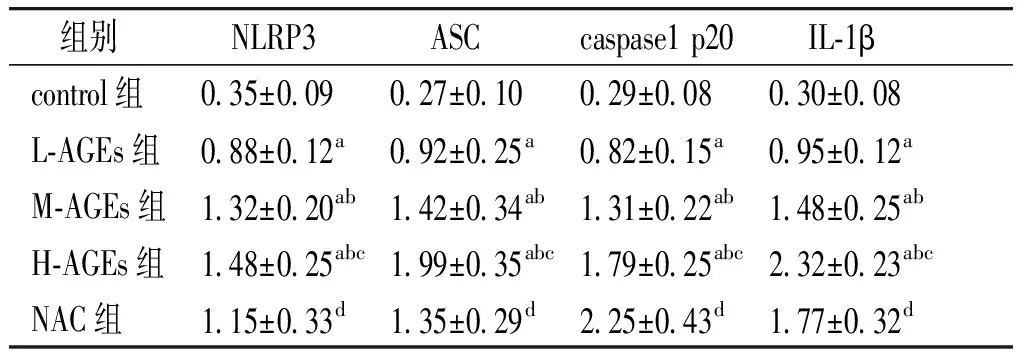
组别 NLRP3 ASCcaspase1p20 IL⁃1βcontrol组0 35±0 09 0 27±0 10 0 29±0 08 0 30±0 08 L⁃AGEs组0 88±0 12a0 92±0 25a0 82±0 15a0 95±0 12aM⁃AGEs组1 32±0 20ab1 42±0 34ab1 31±0 22ab1 48±0 25abH⁃AGEs组1 48±0 25abc1 99±0 35abc1 79±0 25abc2 32±0 23abcNAC组1 15±0 33d1 35±0 29d2 25±0 43d1 77±0 32d
与control组比较,aP<0.01;与L-AGEs组比较,bP<0.05;与M-AGEs组比较,cP<0.05;与H-AGEs组比较,dP<0.05
表4各组HAECs细胞培养上清液中IL1β浓度比较(n=6)
Table4IL-1βconcentrationsincellculturesupernatantofHAECsindifferentgroups(n=6)
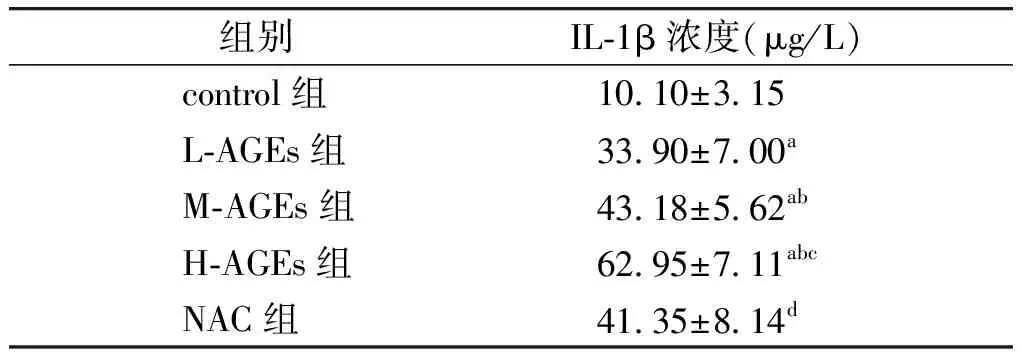
组别IL⁃1β浓度(μg/L) control组10 10±3 15 L⁃AGEs组33 90±7 00a M⁃AGEs组43 18±5 62ab H⁃AGEs组62 95±7 11abc NAC组41 35±8 14d
与control组比较,aP<0.01;与L-AGEs组比较,bP<0.05;与M-AGEs组比较,cP<0.05;与H-AGEs组比较,dP<0.05
3 讨论
在多种病理因素的作用下,核苷酸结合寡聚化结构域样受体被激活后形成的巨大的蛋白复合体,即NLRP3炎症体。该炎症体是由NLRP3蛋白、ASC及caspase-1前体构成的复合体,能够识别机体危险信号,进而诱导caspase-1前体被剪切,成为具有活性的caspase-1,从而使其下游以IL-1β为代表的炎症因子活化[6]。NLRP3的激活机制尚不完全明确,有半通道模型、溶酶体破坏模型以及ROS模型等三种学说。
目前认为,局部炎症在动脉粥样硬化中扮演重要的角色。沉默IL-1β、IL-6以及TNF-α等炎症基因可使内皮损伤减轻,减少炎症细胞及血小板的活化,延缓动脉粥样硬化的进展[7]。糖尿病的病理过程中,在慢性而持续的高血糖作用下,循环中会产生AGEs,能够引导过量ROS的生成而使血管内皮细胞处于氧化应激状态,从而使血管内皮细胞出现损伤[8]。本研究结果提示,AGEs处理能够使HAECs细胞内ROS产生增多,HAECs细胞活力明显降低。而使用抗氧化剂NAC处理细胞,可使细胞内ROS减少,HAECs细胞活力恢复,说明氧化应激是AGEs导致内皮细胞受损的重要致病因素。
NLRP3在心血管系统中广泛分布,在血管内皮亦有表达[9]。本研究结果提示,AGEs诱导的HAECs内ROS的过度产生可激活NLRP3炎症体,其激活表现为NLRP3及ASC蛋白表达水平增加。caspase-1 p20表达水平增高,说明其前体caspase-1被剪切,最终导致HAECs内IL-1β及其分泌的IL-1β增多,局部炎症产生[10]。本研究结果还表明,在抗氧化剂NAC的作用下,AGEs诱导的HAECs内ROS生成减少,NLRP3炎症体表达下调,表现为NLRP3及ASC蛋白表达降低,HAECs内IL-1β及其分泌的IL-1β水平均减少。这些结果说明ROS参与了NLRP3炎症体活化至动脉内皮细胞局部炎症产生的过程,可能是AGEs诱导动脉内皮细胞损伤的重要分子机制。
综上所述,本研究结果提示ROS诱导的NLRP3炎症体活化可能是T2DM血管局部炎症及血管内皮损伤的重要分子机制。糖尿病血管并发症发病分子机制复杂,本研究为其发病机制研究提供了新的思路,并为靶向性药物的研发提供了新的线索。
[1] Abdul-Ghani M, DeFronzo RA, Del Prato S,etal. Cardiovascular disease and type 2 diabetes: has the dawn of a new era arrived?[J]. Diabetes Care, 2017, 40(7):813-820.
[2] Nass N, Bartling B, Navarrete Santos A,etal. Advanced glycation end products, diabetes and ageing[J]. Z Gerontol Geriatr, 2007, 40(5):349-356.
[3] Vlassara H, Uribarri J. Advanced glycation end products(AGE) and diabetes: cause, effect, or both?[J]. Curr Diab Rep, 2014, 14(1):453-470.
[4] Abderrazak A, Syrovets T, Couchie D,etal. NLRP3 inflammasome: from a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J]. Redox Biol, 2015, 4:296-307.
[5] Matsui T, Nakamura N, Ojima A,etal. Sulforaphane reduces advanced glycation end products(AGEs)-induced inflammation in endothelial cells and rat aorta[J]. Nutr Metab Cardiovasc Dis, 2016, 26(9):797-807.
[6] Weichand B, Popp R, Dziumbia S,etal. S1PR1 on tumor-associated macrophages promotes lymphangiogenesis and metastasis via NLRP3/IL-1beta[J]. J Exp Med, 2017, 214(9): 2695-2713.
[7] Synetos A, Papaioannou S, Tousoulis D. Atherosclerosis and inflammation. Clinical aspects of a modern tale[J]. Hellenic J Cardiol, 2017, 58(2):122-123.
[8] Zhang WJ, Li PX, Guo XH,etal. Role of moesin, Src, and ROS in advanced glycation end product-induced vascular endothelial dysfunction[J].Microcirculation,2017,24(3):12358-12363.
[9] Wang W, Wu HQ, Sui Y,etal. Rutin protects endothelial dysfunction by disturbing Nox4 and ROS-sensitive NLRP3 inflammasome[J]. Biomed Pharmacother, 2017, 86:32-40.
[10] Luo B, Huang F, Liu Y,etal. NLRP3 Inflammasome as a molecular marker in diabetic cardiomyopathy[J]. Front Physiol, 2017, 8(519): 1-7.
NLRP3inflammasomeisinvolvedinadvancedglycationendproducts-inducedhumanaorticendothelialcellinjury
ZHANG Yong,LI Xiaoqing,SHI Shuang*
(DepartmentofCardiology,ShaanxiProvincialPeople’sHospital,Xi’an710068,China;*Correspondingauthor,E-mail:shishuang1168@163.com)
ObjectiveTo investigate the role and mechanism of nucleotide-binding, leucine-rich repeat, pyrin-domain-containing 3(NLRP3) in advanced glycation end products(AGEs)-induced cell injury of human aortic endothelial cells(HAECs).MethodsHuman aortic endothelial cells(HAECs) were assigned into control group(treated with control medium), L-AGEs group(treated with 10 μg/ml AGEs), M-AGEs group(treated with 25 μg/ml AGEs), H-AGEs group(treated with 50 μg/ml AGEs) and NAC group(treated with 50 μg/ml AGEs and then N-Acetyl-L-cysteine). Cell viability was evaluated by MTT assay. The intracellular generation of reactive oxygen species(ROS) in HAECs was determined by flow cytometry. Protein expression levels of NLRP3, ASC, caspase1 p20 and IL-1β were assessed by Western blotting. Concentration of IL-1β in cell culture supernatant was detected by ELISA.ResultsCompared with control group, the cell viability was significantly reduced dose-dependently after treated with AGEs(P<0.05), the intracellular ROS generation was significantly dose-dependently increased(P<0.05), the expression levels of NLRP3, ASC, caspase1 p20 and IL-1β were dose-dependently increased(P<0.05),and IL-1β concentration in cell culture supernatant was dose-dependently increased(P<0.05). After NAC treatment, the changes of above indexes were reversed(P<0.05).ConclusionAGEs may increase ROS-mediated NRLP3 inflammasome activation which results in HAECs injury.
advanced glycation end products; NRLP3 inflammasome; reactive oxygen species; human aortic endothelial cells
陕西省自然科学基础研究计划(2017JM8117)
张勇,男,1977-01生,博士,副主任医师
2017-08-18
R543.1
A
1007-6611(2017)12-1209-04
10.13753/j.issn.1007-6611.2017.12.001
