阴道微生态平衡与持续性高危型HPV感染分析
2017-12-19茹普霞李东燕山西医科大学第二医院妇产科太原030001
茹普霞,李东燕(山西医科大学第二医院妇产科,太原 030001)
阴道微生态平衡与持续性高危型HPV感染分析
茹普霞,李东燕
(山西医科大学第二医院妇产科,太原 030001)
目的 探讨持续性高危型HPV感染与阴道微生态平衡是否有关。 方法 选取2012-01~2015-12山西医科大学第二医院妇产科门诊就诊时进行了阴道微生态检查及HPV分型检查的患者,对筛查为高危型的HPV感染者1 246例进行研究,每隔6个月复查一次,共随访2次。同一亚型高危型HPV感染持续存在一年以上的251例患者为研究组,同期检查发现高危型HPV感染但之后一年内自然转阴的患者995例为对照组。研究内容为第一次检查时患者的阴道微生态(阴道分泌物的形态学及功能学检查)检查结果及HPV分型检查结果。 结果 细菌性阴道病组和过氧化氢缺乏组持续性高危型HPV感染发生率分别为25.04%和24.13%,与阴道微生态正常者(12.16%)相比,差异有统计学意义(P<0.05),白细胞酯酶阳性组持续性高危型HPV感染的发生率为20.68%,与阴道微生态正常组相比,差异无统计学意义(P>0.05)。研究组及对照组中HPV感染型别的构成比不同,两组之间相比差异有统计学意义(P<0.05)。 结论 阴道微生态环境的改变尤其是细菌性阴道病及过氧化氢缺乏与持续性高危型HPV感染的发生有关。
阴道微生态; 细菌性阴道病; 持续性HPV感染
宫颈的高危型HPV感染尤其是持续性感染与宫颈病变的发生有关是被大家认可的,目前对于“持续性HPV感染”尚无统一定义,许多学者认为如果在间隔4-6个月或6-12个月的相邻两次随访中,同一患者的宫颈检测样本中均显示同一亚型HPV阳性,则称为此种类亚型HPV的持续性感染[1,2]。引起HPV持续性感染发生的因素目前尚不清楚,宫颈处于阴道内,阴道内环境及阴道微生态的平衡可能与HPV持续性感染有关[3-5]。为明确高危型HPV持续性感染与阴道微生态平衡是否有关,本文对1 246例高危型HPV感染患者的阴道微生态变化进行了回顾性调查分析。
1 对象与方法
1.1 资料来源
选取2012-01~2015-12山西医科大学第二医院妇产科门诊就诊时进行了阴道微生态检查及HPV分型检查的患者,筛查为高危型HPV感染者1 246例进行研究,每隔6个月复查一次,共随访2次,同一亚型高危型HPV感染持续存在一年以上的251例患者为研究组,同期检查发现高危型HPV感染但之后一年内自然转阴的患者995例为对照组。研究内容为第一次检查时患者的阴道微生态(阴道分泌物的形态学及功能学检查)检查结果及随访HPV分型检查结果。
1.2 检测方法
1.2.1 阴道微生态的检测方法 用2支无菌棉拭子从阴道侧壁上1/3取得阴道分泌物,一支用来涂片后显微镜下检查分泌物中是否存在滴虫、菌丝、线索细胞等。另一支用来进行pH值的测定及干化学法检测阴道分泌物中的过氧化氢(H2O2)、白细胞酯酶、唾液酸苷酶(干化学法检测)。
1.2.2 HPV检测方法 用HPV检测用刷子在宫颈口内取材后用PCR方法检测HPV-DNA,可以检测到高危型HPV 15种。检测所用试剂盒由潮州凯普生物化学有限公司提供。
1.3 诊断标准
①干化学法检测所用试剂盒由北京中生金域诊断技术有限公司提供,过氧化氢(H2O2)<2 μmol/L时为阳性,白细胞酯酶>7 U/ml时为阳性,唾液酸苷酶>9 U/ml时为阳性[5]。②细菌性阴道病实验室诊断标准:用Amesel方法诊断细菌性阴道病[6]。标记为细菌性阴道病阳性。③阴道微生态正常:唾液酸苷酶(-),pH值在3.8-4.5,过氧化氢为阴性,白细胞酯酶为阴性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等。④分泌物中检查发现阴道毛滴虫、菌丝及孢子时诊断为相应的阴道炎[2]。⑤同时存在两种或两种以上阴道炎时诊断为混合性阴道炎[7]。⑥唾液酸苷酶(-),pH值在3.8-4.5,过氧化氢为阳性,白细胞酯酶为阴性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等时诊断为过氧化氢缺乏,考虑与乳杆菌功能下降有关。⑦唾液酸苷酶(-),pH值在3.8-4.5,过氧化氢为阴性,白细胞酯酶为阳性,分泌物中检查未发现阴道毛滴虫、菌丝、孢子等时。诊断为白细胞酯酶阳性。⑧HPV检查:HPV16,18,31,33,35,39,45,51,52,53,56,58,59,66,68检测阳性时为高危型HPV感染[2]。
1.4 统计学方法
调查内容由专人录入SPSS数据库,对调查的内容用SPSS 17.0统计软件分析,定量资料统计描述采用均数±标准差,两组定量资料比较采用t检验;定性资料统计描述采用率或构成比,两组或多组定性资料比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
患者年龄在26-70岁,持续性高危型HPV阳性组平均年龄为(43.08±9.07)岁,高危型HPV感染自然转阴性组平均年龄为(41.56±9.08)岁,差异无统计学意义(t=2.37,P>0.05)。两组之间年龄的构成比不同,差异有统计学意义(χ2=5.87,P<0.05,见表1)。
表1研究组及对照组的年龄分布构成(例)
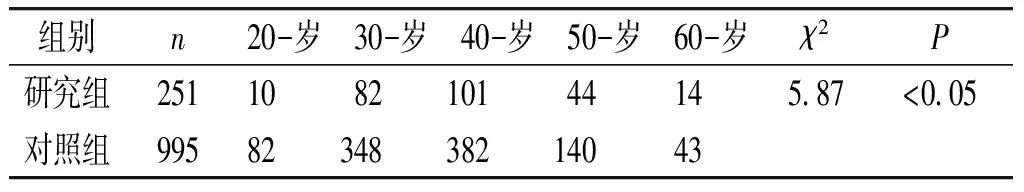
组别n20-岁30-岁40-岁50-岁60-岁χ2P研究组251108210144145 87<0 05对照组9958234838214043
2.2 阴道微生态失调的类型
第一次检查时患者中未发现滴虫性阴道炎及外阴阴道假丝酵母菌病;发现细菌性阴道病患者599例,其中研究组150例,对照组449例,由于在第一次检查时给予治疗,所以再次复查时没有发现混合性阴道炎、滴虫阴道炎及外阴阴道假丝酵母菌病;过氧化氢缺乏患者145例,其中研究组35例,对照组110例;白细胞酯酶阳性患者58例,其中研究组12例,对照组46例。阴道微生态正常的患者444例,其中研究组54例,对照组390例。
2.3 持续性高危型HPV感染的发生率
1 246例患者中持续性高危型HPV感染的发生率为20.14%。阴道微生态正常且持续性高危型HPV感染的发生率为12.16%;过氧化氢缺乏且持续性高危型HPV感染的发生率为24.13%;细菌性阴道病且持续性高危型HPV感染的发生率为25.04%;白细胞酯酶阳性且持续性高危型HPV感染发生率为20.68%;细菌性阴道病及过氧化氢缺乏与阴道微生态正常者相比,持续性高危型HPV感染发生率差异有统计学意义(P<0.05),白细胞酯酶阳性与阴道微生态正常者相比,持续性高危型HPV感染的发生率差异无统计学意义(P>0.05,见表2,3)。
表2研究组与对照组不同阴道微生态状态构成(例)

组别n过氧化氢缺乏白细胞酯酶阳性阴道微生态正常 研究组251351254 对照组99511046390
表3不同阴道微生态状态下持续性高危型HPV感染的发生率

阴道微生态HPV感染发生率(%)χ2P细菌性阴道病25 0426 88<0 05过氧化氢缺乏24 1312 22<0 05白细胞酯酶阳性20 68 3 26>0 05阴道微生态正常12 16
χ2值和P值是分别与阴道微生态正常患者比较所得
2.4 高危型HPV感染的型别
入组患者各型HPV感染均可见,两种及两种以上HPV感染认为是混合型。研究组及对照组中HPV感染型别的构成比不同,两组之间相比差异有统计学意义(P<0.05,见表4)。
表4研究组及对照组HPV感染的型别(例)

组别16型18型33型39型45型56型51型52型53型58型59型66型68型35型31型混合χ2P研究组8549833321635355555729 9<0 05对照组36545354047167037144111914243144
3 讨论
3.1 持续性高危型HPV感染与乳杆菌
阴道内的乳杆菌产生过氧化氢,维持阴道内的酸性环境可抑制其他菌和致病微生物的生长,有利于维持阴道微生态环境的平衡[8]。乳杆菌的数量或功能下降时均可表现为过氧化氢缺乏。单纯的过氧化氢缺乏多是由乳杆菌功能下降导致的。本研究表明乳杆菌缺乏也就是乳杆菌的功能下降时,持续性高危型HPV感染的发生率上升(与乳杆菌功能正常时相比),可能与乳杆菌功能下降时阴道的免疫力下降、清除病毒的能力下降有关,导致了持续性高危型HPV感染的发生。
3.2 持续性高危型HPV感染与细菌性阴道病
以往研究表明细菌性阴道病的存在与HPV感染有关[9],也有研究表明两者无关[10,11]。本研究研究表明细菌性阴道病的存在与持续性高危型HPV感染两者之间是有关联的,发生原因可能与细菌性阴道病时阴道的免疫力下降有关,清除病毒的能力下降有关。
3.3 HPV感染的型别与持续性感染
HPV感染后多在8-10月内自行消退,持续性感染多发生在35岁以上的女性,发生率在10%-15%之间,随年龄增长,自然消退率降低[2],本研究中持续性高危型HPV感染的发生率为20.14%,两组之间年龄的构成比不同,与以往研究基本相符。目前研究发现的高危型HPV型别在本研究中均可发现,有两种及两种以上型别感染同时存在的现象,同时研究表明持续性HPV感染与非持续性HPV感染组之间相比,HPV型别的构成比不同,可能某些型别的HPV感染更易发生持续性感染或更易存在阴道微生态异常[12],需要进一步研究。
研究报道[13],阴道微生态变化与HPV感染之间存在相关性,但目前尚无确切定论,尚需大样本研究进一步证实。本研究表明,阴道微生态环境的改变尤其是细菌性阴道病与持续性高危型HPV感染的发生有关,通过改善阴道微生态环境可能可以降低持续性高危型HPV感染的发生率。外源性补充乳酸杆菌数量是否能降低HPV感染率,减少宫颈病变患病率,还需我们深入探索。
[1] 刘英俏,何鑫,刘军,等.宫颈脱落细胞CA-Ⅸ的表达与高危型人乳头瘤病毒感染状态的相关性研究[J].首都医科大学学报,2015,36(2):226-230.
[2] 谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:247-252,409-410.
[3] 朱丽红,袁宁霞,杜东青.281例宫颈上皮内瘤变患者阴道微生态研究[J].中国妇幼保健,2013,28(19):3144-3147.
[4] 唐金芝,高琨,李力,等.宫颈微环境改变与HPV感染对宫颈癌的影响[J].广西医科大学学报,2013,30(6):971-973.
[5] Siddiqa A,Zainab M,Qadri I,etal.Prevalence and genotyping of high risk human papillomavirus in cervical cancer samples from Punjab,Pakistan[J].Viruses,2014,6(7):2762-2777.
[6] 李东燕,廖秦平.细菌性阴道病发生的危险因素分析[J].中国微生态学杂志,2015,27(4):480-482.
[7] 曹佳萍.臭氧雾化联合壳聚糖治疗混合性阴道炎临床分析[J].中国微生态学杂志,2015,27(4):486-487.
[8] 李东燕,廖秦平.女性阴道微生态平衡与计划生育的相关性[J].中国计划生育和妇产科,2014,6(7):29-32.
[9] 于妍妍,金哲,刘艳霞,等.宫颈高危HPV感染与阴道内环境相关因素分析[J].疑难病杂志,2011,10(9):673-675.
[10] 于德亮,田立慧,王彦锦.1 202例健康体检妇女HPV感染情况分析[J].中国妇幼保健,2012,27(20):3085-3087.
[11] 努尔比亚·阿布拉,姚丽艳.生殖道HPV与其它病原体感染关系的探讨[J].中华全科医学,2014,12(6):942-944.
[12] 崔丽阳,岳天孚.HR-HPV感染与其他女性生殖道感染因素的关系研究[J].中国妇幼保健,2014,29(3):352-354.
[13] Rodriguez-Cerdeira C,Sanchez-Blanco E,Alba A.Evaluation of association between vaginal infections and high-risk human papillomavirus types in female sex workers in Spain[J]. ISRN Obstet Gynecol, 2012, 2012:240190.
茹普霞,女,1973-12生,硕士,,副主任医师,E-mail:rpx799@163.com
2017-10-10
R711
A
1007-6611(2017)12-1288-03
10.13753/j.issn.1007-6611.2017.12.019
