当归芍药散对围绝经期模型大鼠子宫结构及雌激素受体表达的影响Δ
2017-12-19丁岩华永庆林紫微杨菲洪敏南京中医药大学药学院南京210023江苏省中药药效与安全性评价重点实验室南京210023
丁岩,华永庆,林紫微,杨菲,洪敏(1.南京中医药大学药学院,南京210023;2.江苏省中药药效与安全性评价重点实验室,南京210023)
当归芍药散对围绝经期模型大鼠子宫结构及雌激素受体表达的影响Δ
丁岩1,2*,华永庆1,2#,林紫微1,2,杨菲1,2,洪敏1,2(1.南京中医药大学药学院,南京210023;2.江苏省中药药效与安全性评价重点实验室,南京210023)
目的:探讨当归芍药散(DSS)对围绝经期模型大鼠子宫结构及子宫腔上皮和基质中雌激素受体α(ERα)、雌激素受体β(ERβ)表达的影响。方法:将40只雌性SD大鼠随机分为假手术组(生理盐水)、模型组(生理盐水)和DSS低、中、高剂量组(1.94、3.87、7.44 g/kg),每组8只。除假手术组大鼠切除卵巢附近脂肪外,其余各组大鼠切除双侧卵巢以建立围绝经期模型。造模成功后,大鼠每天ig给药1次,连续8周。给药结束后,称定大鼠子宫湿质量,观察大鼠子宫形态和结构的变化,测定子宫腔上皮及基质中ERα、ERβ表达水平。结果:与假手术组比较,模型组大鼠子宫内膜柱状上皮呈低柱状,固有层、肌层与浆膜层均显著萎缩,基质细胞可见明显核固缩,子宫湿质量、宫腔面积、内膜厚度及腺体数量均显著减少(P<0.01),子宫腔上皮及基质中ERα、ERβ表达水平均显著降低(P<0.01)。与模型组比较,DSS各剂量组大鼠子宫内膜及固有层萎缩程度差异无统计学意义,但固有层内腺体丰富,子宫湿质量、宫腔面积、内膜厚度以及子宫腔上皮和基质中ERα表达水平差异均无统计学意义(P>0.05),但DSS中、高剂量组大鼠子宫腺体数量显著增加(P<0.01),DSS高剂量组大鼠子宫腔上皮及基质中ERβ表达水平显著升高(P<0.05或P<0.01)。结论:DSS对围绝经期模型大鼠子宫腺体萎缩症状的改善作用不明显,但可增加模型大鼠的腺体数量,这可能与提高子宫腔上皮及基质中ERβ表达水平有关。
当归芍药散;围绝经期;子宫结构;雌激素受体α;雌激素受体β;大鼠
围绝经期综合征(Menopause syndrome,MPS)是指妇女在绝经前后雌激素水平波动或下降所致的以自主神经系统功能紊乱为主,伴有神经心理症状的一组症候群,中医学称之为“绝经前后诸证”。激素替代疗法(Hormone replacement therapy,HRT)是目前临床治疗MPS的主要方法,但长期应用HRT会增加卵巢癌、子宫内膜癌、乳腺癌的患病风险[1]。中医秉承整体论治、辨证施治的观点,治疗MPS具有独特的效果和优势[2]。当归芍药散(DSS)出自张仲景所著《金匮要略·妇人篇》,方中当归、芍药、川芎具有疏肝理气、活血化瘀功效;白术、茯苓、泽泻具有利水渗湿功效[3],临床用于治疗围绝经期妇女潮热、失眠、焦虑、水肿有较好疗效[4-5]。HRT治疗MPS会使女性子宫内膜过度增生[6],然而DSS在治疗MPS的同时,对子宫的影响目前未见报道。本研究建立大鼠卵巢摘除模型模拟围绝经期卵巢激素下降病理过程,观察DSS对模型大鼠子宫结构及雌激素受体α(ERα)、雌激素受体β(ERβ)表达的影响,为安全应用DSS治疗MPS提供参考。
1 材料
1.1 仪器
BSA224S-CW电子天平[赛多利斯科学仪器(北京)有限公司];EG1150包埋仪、RM 2245半自动轮转式切片机、HI 1210摊片机(上海徕卡仪器有限公司);BX43手动系统显微镜、Mantra定量病理成像分析系统(美国Perkin Elmer公司)。
1.2 药材
当归为伞形科植物当归[Angelica sinensis(Oliv.)Diels]的干燥根,来源于甘肃岷县当归生产质量管理规范(GAP)种植基地;川芎为伞形科植物川芎(Ligusticum chuanxiong Hort.)的干燥根茎,来源于四川彭州川芎GAP种植基地;白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根,产地为安徽亳州;白术为菊科植物白术(Atractylodesmacrocephala Koidz.)的干燥根茎,产地为内蒙古海格尔;茯苓为多孔菌科真菌茯苓[Poria cocos(Schw.)Wolf]的干燥菌核,产地为浙江松阳;泽泻为泽泻科植物泽泻Alisma orientalis(Sam.)Juzep.的干燥块茎,产地为四川彭州。以上药材经南京中医药大学段金廒教授鉴定,均符合2015年版《中国药典》(一部)相关药材项下标准。
1.3 药品与试剂
两步法免疫组化试剂盒、二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术有限公司,批号:K166616J、K166614A);ERα抗体、ERβ抗体[艾博抗(上海)贸易有限公司,批号:GR277257-2、GR269422-4];其余试剂均为分析纯。
1.4 动物
SPF级3月龄SD大鼠40只,♀,体质量(250±20)g,由浙江省实验动物中心提供,动物生产许可证号:SCXK(浙)2014-0001。
2 方法
2.1 DSS提取物的制备
DSS由当归3 g、芍药16 g、川芎8 g、茯苓4 g、泽泻8 g、白术4 g组成。称取10倍处方量的药材,粉碎至40目,水加热提取2次,第1次加入10倍量水回流提取2 h,第2次加入8倍量水回流提取1.5 h,合并2次提取液,减压回收溶剂,浓缩至生药量为2 g/mL,即得DSS水提取物。残渣趁热晾干,用80%乙醇回流提取2次,第1次加入10倍量80%乙醇回流提取2 h,第2次加入8倍量80%乙醇回流提取1.5 h,合并2次提取液,70℃减压浓缩至无醇味,即得DSS醇提物,此时以生药计质量浓度为2 g/mL,4℃保存,备用。给药时水提物与醇提物按1∶1(V/V)混合,即得DSS总提取物,按给药剂量要求稀释,摇匀后ig给药。质量控制参照文献[7]方法。
2.2 造模、分组与给药
将大鼠随机分为假手术组、模型组(OVX组)和DSS低、中、高剂量组,每组8只。假手术组大鼠仅切除卵巢附近脂肪,其余各组大鼠切除双侧卵巢,去卵巢手术方法参照文献[8]。术后大鼠每天im 5万U青霉素钠盐,连续3 d,以预防感染。造模大鼠于术后第5天开始观察阴道细胞涂片,连续观察3 d,若大鼠阴道涂片呈现大量多核白细胞及少量上皮细胞,表明大鼠处于间情期,判定为造模成功[9]。术后第7天开始给药:假手术组、OVX组大鼠ig等体积生理盐水,DSS低、中、高剂量组大鼠每天按1.94、3.87、7.44 g/kg剂量ig给药1次,连续给药8周。大鼠每3天称体质量1次,按照体质量调整给药剂量。
2.3 子宫组织病理学观察
末次给药后24 h,脱颈处死大鼠,打开腹腔,取出子宫,称定并记录子宫湿质量(mg)。然后将子宫立即放入4%多聚甲醛溶液中固定24 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片厚度为5µm,常规脱蜡复水后,进行苏木精-伊红(HE)染色;梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下拍摄分析大鼠子宫HE染色标本,统计大鼠子宫所有腺体数目;将染色子宫标本放大40倍,测量子宫宫腔面积;将染色子宫标本放大200倍,测量子宫内膜厚度,每个标本选取5个视野,以5个视野的平均值代表单个标本的子宫内膜厚度。
2.4 子宫上皮和基质中ERα、ERβ表达
大鼠子宫石蜡切片常规脱蜡复水,将切片置入抗原修复液(柠檬酸缓冲液,pH 6.0)中,微波中火15 min进行抗原修复。磷酸盐缓冲液(PBS)洗涤,组织区域滴加3%双氧水灭活内源性过氧化物酶。PBS洗涤后,滴加ERα、ERβ抗体,按照两步法免疫组化试剂盒、DAB显色试剂盒说明操作进行免疫组织化学染色(IHC)。显色后,梯度乙醇脱水,二甲苯透明,中性树胶封片。采用Mantra定量病理成像分析系统统计子宫腔上皮和基质中ERα、ERβ的平均光密度(OD)值。每组选5个标本,放大400倍,每个标本选取3个视野,以3个视野的平均OD值代表单个标本的OD值。
2.5 统计学方法
采用GraphPad Prism 5.0软件进行统计分析。计量资料以±s表示,采用单因素方差分析和Dunnett’s T3检验进行组间比较。P<0.05表示差异具有统计学意义。
3 结果
3.1 大鼠子宫组织的变化
3.1.1 大鼠子宫整体形态的变化假手术组大鼠子宫内膜柱状上皮呈高柱状,基质细胞胞质充盈,固有层、肌层与浆膜层组织轮廓清晰;OVX组大鼠子宫内膜柱状上皮呈低柱状,固有层、肌层与浆膜层均显著萎缩,基质细胞可见明显核固缩;与OVX组比较,DSS各剂量组大鼠子宫内膜及固有层萎缩程度无显著差异,但固有层内腺体丰富。子宫HE染色图见图1(箭头指示腺体)。
3.1.2 大鼠子宫湿质量和结构的变化与假手术组比较,OVX组大鼠子宫湿质量、宫腔面积、内膜厚度及腺体数量均显著减少(P<0.01);与OVX组比较,DSS各剂量组大鼠子宫湿质量、宫腔面积及内膜厚度均无显著差异(P>0.05),但DSS中、高剂量组大鼠子宫腺体数量显著增加(P<0.01),结果见表1。

图1 各组大鼠子宫病理切片图(HE染色,×100)Fig 1Pathological sections of uterus of rats in each group(HE staining,×100)
表1 各组大鼠子宫湿质量、宫腔面积、内膜厚度及腺体数量测定结果(±s,n=8)Tab1Determinationresultsofuterinewetmass,uterine cavity area,endometrial thicknessandthenumberofuterine glands of rats in each group(±s,n=8)

表1 各组大鼠子宫湿质量、宫腔面积、内膜厚度及腺体数量测定结果(±s,n=8)Tab1Determinationresultsofuterinewetmass,uterine cavity area,endometrial thicknessandthenumberofuterine glands of rats in each group(±s,n=8)
注:与假手术组比较,**P<0.01;与OVX组比较,##P<0.01Note:vs.shamoperationgroup,**P<0.01;vs.OVX group,##P<0.01
子宫内膜厚度,μm 637.2±242.9 297.1±120.1**284.1±62.90 290.9±101.9 327.1±112.3组别假手术组OVX组DSS低剂量组DSS中剂量组DSS高剂量组剂量,g/kg 1.94 3.87 7.44子宫湿质量,mg 649.3±247.10 187.5±72.06**189.0±58.94 187.9±32.66 229.8±94.06子宫宫腔面积,mm2 0.105±0.074 0.032±0.012**0.032±0.010 0.031±0.011 0.031±0.017腺体数量,个15.80±2.77 7.00±1.00**9.00±5.83 14.40±4.72##16.00±1.00##
3.2 大鼠子宫腔上皮及基质中ERα表达的变化
与假手术组比较,OVX组大鼠子宫腔上皮及基质中ERα的表达水平均显著降低(P<0.01),假手术组大鼠子宫腔上皮及基质中ERα表达水平约为OVX组的2倍;与OVX组比较,DSS各剂量组大鼠子宫腔上皮及基质中ERα的表达水平差异均无统计学意义(P>0.05)。IHC图见图2,测定结果见表2。

图2 各组大鼠子宫腔上皮及基质中ERα表达的IHC图(×400)Fig 2IHC figures of ERα expression in uterine cavity epithelium and matrix of rats in each group(×400)
表2 各组大鼠子宫腔上皮及基质中ERα、ERβ表达水平的测定结果(±s,n=5)Tab 2Determination results of the expression levels of ERα and ERβ in uterine cavity epithelium and matrix in each group(±s,n=5)
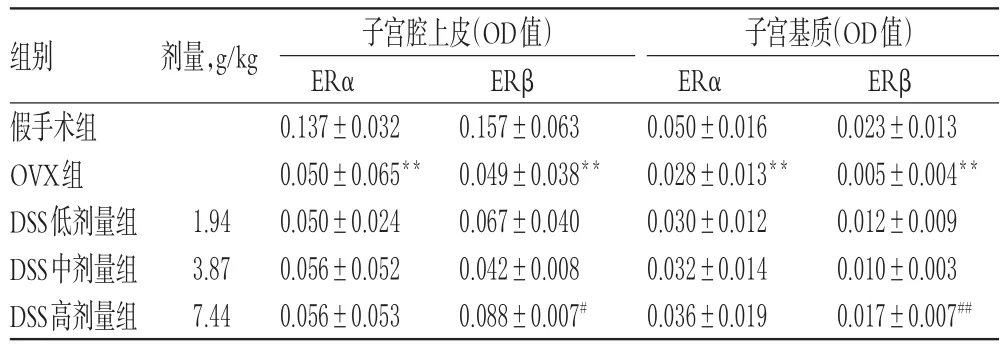
表2 各组大鼠子宫腔上皮及基质中ERα、ERβ表达水平的测定结果(±s,n=5)Tab 2Determination results of the expression levels of ERα and ERβ in uterine cavity epithelium and matrix in each group(±s,n=5)
注:与假手术组比较,**P<0.01;与OVX组比较,#P<0.05,##P<0.01Note:vs.shamoperationgroup,**P<0.01;vs.OVX group,#P<0.05,##P<0.01
ERβ 0.023±0.013 0.005±0.004**0.012±0.009 0.010±0.003 0.017±0.007##组别假手术组OVX组DSS低剂量组DSS中剂量组DSS高剂量组剂量,g/kg 1.94 3.87 7.44子宫腔上皮(OD值)ERα 0.137±0.032 0.050±0.065**0.050±0.024 0.056±0.052 0.056±0.053 ERβ 0.157±0.063 0.049±0.038**0.067±0.040 0.042±0.008 0.088±0.007#子宫基质(OD值)ERα 0.050±0.016 0.028±0.013**0.030±0.012 0.032±0.014 0.036±0.019
3.3 大鼠子宫腔上皮及基质中ERβ表达的变化
与假手术组比较,OVX组大鼠子宫腔上皮及基质中ERβ表达水平均显著降低(P<0.01),假手术组大鼠子宫腔上皮中ERβ表达水平约为OVX组的3倍,基质中ERβ表达水平约为OVX组的4倍;与OVX组比较,DSS高剂量组

图3 各组大鼠子宫腔上皮及基质中ERβ表达的IHC图(×400)Fig 3IHC figures of ERβ expression in uterine cavity epithelium and matrix of rats in each group(×400)
大鼠子宫腔上皮及基质中ERβ的表达水平均显著升高(P<0.05或P<0.01),DSS高剂量组大鼠子宫腔上皮中ERβ表达水平约为OVX组的2倍,基质中ERβ表达水平约为OVX组的3倍。IHC图见图3,测定结果见表2。
4 讨论
女性进入围绝经期后,卵巢功能逐渐衰退,生殖内分泌系统紊乱,出现潮热、失眠、焦虑、易怒等症状,以及由于雌激素水平降低导致的子宫、阴道、乳腺等生殖器官萎缩[10]。临床采用HRT治疗MPS可能引起子宫内膜癌等副作用,因此,疗效显著、副作用较少的中医药疗法日益受到关注。DSS作为经典方剂,原方主治“妇人怀妊,腹中疗痛”,现代临床证实其治疗功能性子宫出血、子宫下垂具有良好疗效。DSS对子宫的调节具有双向性,且较为复杂,既能通过抑制子宫平滑肌收缩治疗原发性痛经[7],亦有促进受孕安胎的功效[3]。临床上同样广泛使用DSS治疗MPS,虽然疗效显著,然而其对子宫的影响仍不明确。
子宫是雌激素的靶器官,也是女性生殖系统中重要器官。雌激素作用于子宫主要通过ER发挥效应,ERα和ERβ是ER的两个主要亚型。在围绝经期,由于雌激素水平下降,子宫迅速萎缩[11],同时子宫中ERα、ERβ的表达也显著下调[12]。在给予雌激素后,去卵巢大鼠子宫内膜显著性增厚且腺体数量增多,子宫组织中ERα和ERβ表达均显著上升[13],但长期应用HRT会使子宫内膜显著增生[6],诱发子宫内膜癌[14]。本研究结果显示,DSS对去卵巢大鼠子宫湿质量无明显影响,这与其他实验报道[15]一致;虽然DSS对去卵巢大鼠子宫腔面积和内膜厚度的影响均不显著,但可显著增加去卵巢大鼠子宫腺体数量。免疫组化测定结果显示,去卵巢大鼠子宫腔上皮及基质中ERα、ERβ表达水平均显著降低,DSS对去卵巢大鼠子宫腔上皮及基质中ERα的表达水平无显著影响,但可显著提高子宫腔上皮和基质中ERβ的表达水平。目前研究认为,促进子宫细胞增殖的作用主要由ERα介导。敲除ERα将导致雌激素促进子宫生长的作用消失[16]、子宫内膜腺体数量下降[17],这表明在子宫的发育及成熟过程中ERα起着主要作用。但另有研究表明,敲除ERα、ERβ的小鼠子宫表型虽与敲除ERα小鼠相似,但前者子宫直径更为狭窄、子宫壁厚度也更薄、子宫萎缩程度更为严重[18]。可见,虽然ERα为雌激素在子宫中的主要作用靶点,但ERβ亦可直接作用于子宫调节细胞增殖[19],在ERα缺失时发挥某些作用,协助维持子宫功能。本研究结果显示,DSS对去卵巢大鼠子宫上皮及基质中ERα表达均无显著影响,因此其拮抗OVX大鼠子宫萎缩效应不显著;但DSS对ERβ表达有明显上调作用,这是否与腺体数量有关,仍有待进一步研究。植物雌激素对ERβ的亲和力高于ERα[20],DSS中白芍、泽泻、当归、川芎具有植物雌激素样作用[21],且方中当归具有上调大鼠子宫内膜及固有层ERβ表达的作用[22],这可能是DSS提高子宫腔上皮及内膜中ERβ表达水平的原因。有同类研究发现,中药复方可选择性上调OVX大鼠子宫ERβ表达[23],与本研究结果一致。
综上所述,DSS对去卵巢大鼠子宫湿质量及内膜均无显著影响,但可增加子宫腺体数量,这可能与其选择性上调子宫腔上皮和基质中ERβ表达有关。本研究为临床安全应用DSS治疗MPS提供了一定的实验依据。
[1]Jones ME,Schoemaker MJ,Wright L,et al.Menopausal hormone therapy and breast cancer:what is the true size of the increased risk?[J].Br J Cancer,2016,115(5):607-615.
[2]倘余乐,段贤春,李琴,等.围绝经期综合征的中医病机及治疗进展[J].安徽医药,2013,17(5):730-732.
[3]臧海洋,尹哲.当归芍药散证治述要[J].中国中医基础医学杂志,2014,20(2):242-243、246.
[4]尚玮玮,乔善义.当归芍药散研究概况[J].中国中药杂志,2006,31(8):630-633.
[5]周强,逄冰,彭智平,等.当归芍药散加减治疗水肿二则[J].山东中医杂志,2013,52(5):366-367.
[6]Furness S,Roberts H,Marjoribanks J,et al.Hormonetherapyinpostmenopausalwomenand riskofendometrialhyperplasia[J].Cochrane DatabaseSystRev,2012,doi:10.1002/14651858.CD000402.
[7]王言才,段金廒,华永庆,等.当归芍药散抑制小鼠离体子宫收缩效应与效应物质分析评价[J].中国天然药物,2008,6(3):196-200.
[8]倪杰,侯宇,艾笛,等.骨硬化素单链抗体对去卵巢模型大鼠骨质疏松性骨折愈合的影响[J].中国药房,2013,24(45):4240-4242.
[9]蔡熙,黄晖,王岚.围绝经期动物模型的研究进展[J].中国实验方剂学杂志,2007,13(10):71-72.
[10]李彦,赵纯全.戊酸雌二醇片在妇产科的临床应用进展[J].中国药房,2014,25(10):933-935.
[11]王亚平,陈蓉,林守清,等.生殖衰老过程中子宫的变化[J].协和医学杂志,2016,7(6):401-408.
[12]Chakraborty TR,Gore AC.Aging-related changes in ovarian hormones,their receptors,and neuroendocrinefunction[J].ExpBiolMed:Maywood,2004,229(10):977-987.
[13]马晓萍,徐颖,丁婕,等.戊酸雌二醇对去卵巢大鼠子宫、阴道、乳腺雌激素受体表达的影响[J].中国药科大学学报,2014,45(3):341-345.
[14]Kaunitz AM,Manson JE.Management of menopausal symptoms[J].Obstet Gynecol,2015,126(4):859-876.
[15]孙晓,寇俊萍,李丁娟,等.当归芍药散对卵巢摘除小鼠行为学变化的影响[J].中国实验方剂学杂志,2008,14(5):44-46.
[16]Wintermantel TM,Elzer J,Herbison AE,et al.Genetic dissection of estrogen receptor signaling in vivo[J].Ernst Schering Found Symp Proc,2006(1):25-44.
[17]Lee HR,Kim TH,Choi KC.Functions and physiological roles of two types of estrogen receptors,ERα and ERβ,identified by estrogen receptor knockout mouse[J].Lab Anim Res,2012,28(2):71-76.
[18]Dupont S,Krust A,Gansmuller A,et al.Effect of single and compound knockouts of estrogen receptors alpha(ERalpha)and beta(ERbeta)on mouse reproductive phenotypes[J].Development,2000,127(19):4277-4291.
[19]Fan X,Gabbi C,Kim HJ,et al.Gonadotropin-positivepituitarytumorsaccompaniedbyovarian tumors in aging female ERbeta-/-mice[J].Proc Natl Acad Sci U S A,2010,107(14):6453-6458.
[20]朱迪娜,王磊,王思彤,等.植物雌激素的研究进展[J].中草药,2012,43(7):1422-1429.
[21]王运来,胡虒尧,方庆,等.基于生物网络的当归芍药散、桂枝茯苓丸治疗原发性痛经作用机制研究[J].中药材,2015,38(11):2348-2352.
[22]郝庆秀,王继峰,牛建昭,等.熟地等4味中药的植物雌激素作用的实验研究[J].中国中药杂志,2009,34(5):620-624.
[23]刘克菊,王文君,金慰芳,等.更年春方对卵巢切除大鼠骨与子宫组织雌激素受体亚型的调节[J].复旦学报(医学版),2005,32(4):439-442、506.
Effect of Danggui Shaoyao Powder on the Uterine Structure and Estrogen Receptor Expression in Model Rats in Perimenopausal Period
DING Yan1,2,HUA Yongqing1,2,LIN Ziwei1,2,YANG Fei1,2,HONG Min1,2(1.School of Pharmacy,Nanjing University of Chinese Medicine,Nanjing 210023,China;2.Jiangsu Key Laboratory for Pharmacology and Safety Evaluation of Chinese Materia Medica,Nanjing 210023,China)
OBJECTIVE:To investigate the effect of Danggui shaoyao powder(DSS)on uterine structure and expressions of estrogen receptor α(ERα),estrogen receptor β(ERβ)in uterine cavity epithelium and matrix in model rats in perimenopausal period.METHODS:40 female SD rats were randomly divided into sham operation group(normal saline),model group(normal saline),DSS low-dose,medium-dose,high-dose groups(1.94,3.87,7.44 g/kg),8 in each group.Except that rats in sham operation group
resection of fat nearby ovaries,rats in other groups received resection of bilateral ovaries to induce models in perimenopausal period.After modeling,rats were intragastrically administrated once a day,for 8 weeks.After administration,wet mass of uterine was weighted.Changes in uterine morphology and structure of rats were observed,expressions levels of ERα and ERβ in uterine cavity epithelium and matrix were determined.RESULTS:Compared with sham operation group,rats in model group showed low columnar in endometrial columnar epithelium,lamina propria layer,muscular layer and serous layer were significantly atrophied,stromal cells had obvious nuclear condensation.There was marked decrease in uterine wet mass,uterine cavity area and endometrial thickness as well as the number of uterine glands(P<0.01),and the expression levels of ERα and ERβ in uterine cavity epithelium and matrix were significantly reduced(P<0.01).Compared with model group,the atrophy degree of endometrium and lamina propria layer had no significant differences in DSS each dose groups.However,lamina propria layer was rich in glands,and there were significant differences in uterine wet mass,uterine cavity area,endometrial thickness,ERα expression level in uterine cavity epithelium and matrix(P>0.05).However,the number of uterine glands in DSS medium-dose,high-dose groups was significantly increased(P<0.01),and ERβ expression level in uterine cavity epithelium and matrix in DSS high-dose group was significantly increased(P<0.05 or P<0.01).CONCLUSIONS:DSS has not obvious effect on improving the symptoms of uterine gland atrophy of model rats in perimenopausal period,but it can increase the number of uterine glands,and the mechanism may be associated with improving the ERβ expression level in uterine cavity epithelium and matrix.
Danggui shaoyao powder;Perimenopausal period;Uterine structure;Estrogen receptor α;Estrogen receptor β;Rats
R285
A
1001-0408(2017)34-4788-05
DOI10.6039/j.issn.1001-0408.2017.34.09
国家自然科学基金资助项目(No.81473390);江苏省中药资源产业化过程协同创新中心开放课题(No.ZDXM-2-7);江苏省中药药效与安全性评价重点实验室资助项目(No.JKLPSE201607);江苏省高校中药学优势学科建设工程资助项目(No.PAPD)
*硕士研究生。研究方向:生殖内分泌中药药理。电话:025-85811248。E-mail:956743780@qq.com
#通信作者:副研究员,博士。研究方向:生殖内分泌中药药理。电话:025-85811248。E-mail:huayongqing@126.com
2017-06-21
2017-09-28)
(编辑:林静)
