团头鲂雌核发育群体的肌间骨形态学分析
2017-12-18关柠楠聂春红陈宇龙刘莉芳高泽霞
关柠楠,聂春红,2,陈宇龙,2,刘莉芳,2,高泽霞,2
( 1.华中农业大学 水产学院,农业动物遗传育种与繁殖教育部重点实验室,农业部淡水生物繁育重点实验室,湖北 武汉 430070; 2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430070 )
团头鲂雌核发育群体的肌间骨形态学分析
关柠楠1,聂春红1,2,陈宇龙1,2,刘莉芳1,2,高泽霞1,2
( 1.华中农业大学 水产学院,农业动物遗传育种与繁殖教育部重点实验室,农业部淡水生物繁育重点实验室,湖北 武汉 430070; 2.淡水水产健康养殖湖北省协同创新中心,湖北 武汉 430070 )
对86尾雌核发育团头鲂群体肌间骨的数目、形态、分布和长度进行了比较分析。肌间骨数目为100~136,平均数为121。依据肌间骨的数目分四区间,100~109、110~119、120~129和≥130,其中肌间骨数目在100~109的个体数占到雌核发育群体的10.5%,明显多于正常团头鲂群体肌间骨数目为100~109的个体在群体中所占比例(3.3%)。躯干轴下肌的肌间骨数目显著少于其他部位(P<0.05),尾部轴上肌和尾部轴下肌的肌间骨数目也存在显著差异性(P<0.05)。雌核发育群体100~109组合个体的肌间骨数目减少涉及到躯干部轴上肌和轴下肌以及尾部轴上肌和轴下肌4个部位的减少。雌核发育群体肌间骨数目的减少为团头鲂的良种选育提供了选育方向和基础育种材料。
团头鲂;雌核发育;肌间骨;数目;形态特征
肌间骨(又称肌间刺)是指位于椎骨两侧肌间隔中的硬骨小刺,由肌隔结缔组织直接骨化而成。按位置可分为髓弓小骨、椎体小骨和脉弓小骨,其仅存在于真骨鱼类中,通过结缔组织连在其他骨骼上[1-2]。我国淡水主要养殖鱼类,包括四大家鱼在内的鲤科鱼类,普遍存在肌间骨。然而肌间骨的存在大大影响了水产品加工以及消费者的食用,因此如何培养出肌间骨较少或不存在的真骨鱼类是现在人们主要的关注方向。国内对鱼类肌间骨的研究始于20世纪60年代,先后对鲤鱼(Cyprinuscarpio)、鲢鱼(Hypophthalmichthysmolitrix)、鳙鱼(Hypophthalmichthysnobilis)和异育银鲫(Carassiusauratusgibelio)等常见鲤科鱼类肌间骨进行了初步观察[3-4]。之后,吕耀平等[5]对低等真骨鱼类肌间骨的形态学进行了相对较系统地比较研究,柯中和等[6]对鲢鱼的肌间骨发生发育的形态学进行了观察和分析,黎玲等[7]通过比较不同倍性鲫鱼的肌间骨数目,提出了通过鱼类远缘杂交技术选育较少肌间骨优良品种的遗传改良方法。此外,徐晓锋等[8]在雌核发育群体中发现了一尾生长发育正常且无肌间骨的草鱼(Ctenopharyngodonidella)突变体。
团头鲂(Megalobramaamblycephala)俗称武昌鱼,属鲤形目、鲤科、鲌亚科、鲂属,是我国特有的重要草食性经济鱼类之一[9-11]。目前,团头鲂肌间骨的发育过程及形态研究已有相关报道[4,12-13]。笔者对团头鲂雌核发育群体肌间骨的数目和形态进行了统计分析,为鱼类雌核发育群体肌间骨的研究积累原始资料。
1 材料与方法
1.1 试验材料
团头鲂和松浦镜鲤(C.carpiosongpu)均取自华中农业大学水产学院团头鲂遗传育种中心(湖北省黄冈市团风县团风镇白鹤林村)。团头鲂雌核发育群体获得的具体操作参照文献[14]的方法,在繁殖季节,通过注射催产药物,获得团头鲂卵子和松浦镜鲤精子。将松浦镜鲤精子进行紫外线灭活处理后,用于激活团头鲂卵子,冷休克抑制卵子第二极体的排出,使卵子发育为正常的二倍体团头鲂。正常团头鲂群体为雌雄人工催产后受精获得。试验使用的团头鲂雌核发育群体及正常群体的体质量与体长见表1。
1.2 试验方法
将团头鲂试验鱼用氨基甲酸乙酯(100 mg/L)麻醉5~10 min后,用纱布将鱼体擦干,进行体质量与体长的测量,并记录数据。后用纱布将鱼体包好,置沸水锅中煮8~10 min,取出,自然冷却2 min再除去纱布,用解剖刀从侧线处割开鱼皮并用镊子小心剥离。剥去皮肤后,参考文献[4]的方法将鱼体划分为躯干部轴上肌、躯干部轴下肌、尾部轴上肌和尾部轴下肌4个部位,背腹两部分以脊椎骨作为界限,前后两部分以背鳍后基部与泄殖孔的连线为界限,小心剔除肌肉,依次从前往后取出肌间骨,将其在黑色卡纸上摆放整齐,然后用数码相机拍照记录不同部位肌间骨的形态及数目,以便对肌间骨形态进行分析,用游标卡尺测定各肌间骨的长度。
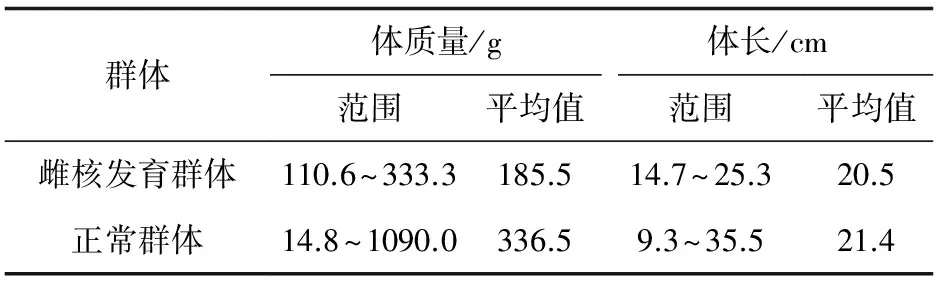
表1 团头鲂雌核发育群体和正常群体的体质量与体长
1.3 数据分析
采用单因子方差分析检验不同部位、不同形态的肌间骨数目的差异显著性。数据采用SPSS 19.0统计软件进行分析。所有试验数据均用平均值±标准差表示,显著性水平设定为0.05。
2 结果与分析
2.1 肌间骨数目
本试验86尾雌核发育团头鲂肌间骨的数目范围为100~136,平均数目为121,根据肌间骨数目的多少分为4个区间,即100~109、110~119、120~129和≥130。而正常团头鲂群体的肌间骨数目为108~130,肌间骨数目平均为119,数目在100~109的为3.3%,而在雌核发育群体中肌间骨数目在100~109的个体占到了10.5% (表2)。雌核发育群体肌间骨数目≥130的个体所占比例(17.5%)也明显大于正常群体的≥130组的个体所占比例(5.6%)。躯干轴下肌的肌间骨数目显著少于其他3个部位(P<0.05),尾部轴上肌和尾部轴下肌的肌间骨数目也存在显著差异性(P<0.05)。不同区间肌间骨数目统计分析显示,个体肌间骨总数的较少或较多都是基于4个部位肌间骨数目共同的减少或增加所致,而不是单一部位的变化导致的(表3)。
2.2 肌间骨长度
通过对雌核发育群体中每尾试验鱼的所有肌间骨长度进行测量,结果显示在100~109、110~119、120~129、≥130这4个区间中,肌间骨长度分别为(16.46±4.99) cm,(15.51±7.66) cm,(16.27±7.05) cm,(15.76±7.14) cm。通过分析各区间肌间骨长度与体质量的关系表明,肌间骨数目100~109组的肌间骨长度与个体体质量增长的线性相关性较大(即r2值较大),中间两者次之,而肌间骨数目最多的第4区间则表现为肌间骨长度与个体体质量增长的相关性较小且增长幅度也最小(表4,图1)。
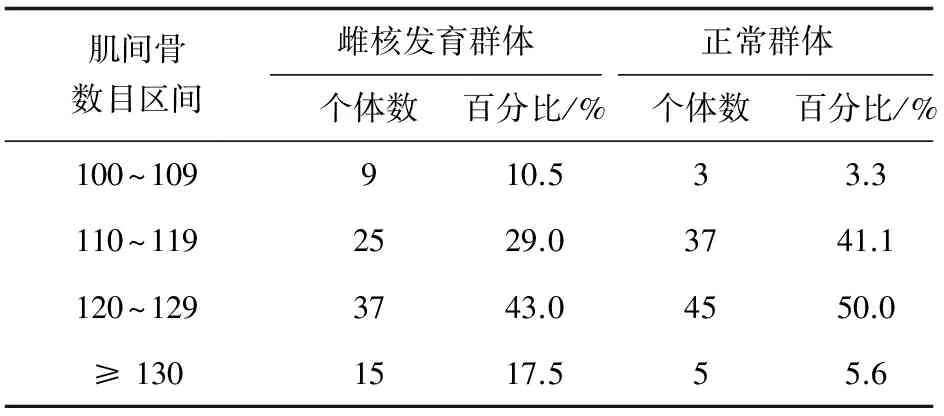
表2 团头鲂雌核发育群体与正常群体肌间骨数目区间的个数统计
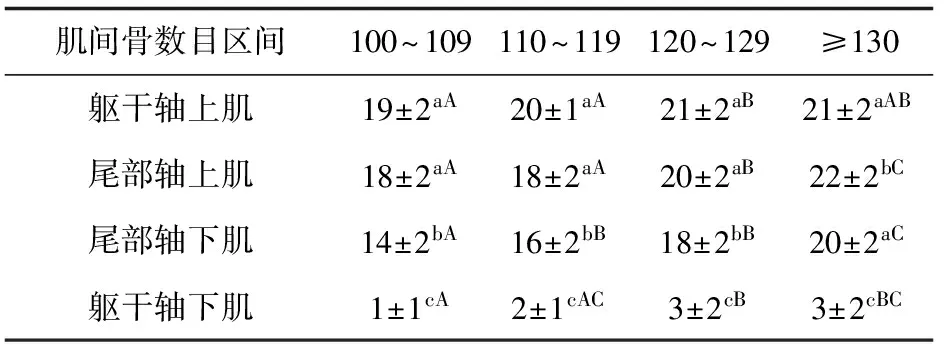
表3 雌核发育群体不同肌间骨数目区间的4个部位肌间骨数目统计(平均值±标准差)
注:同列数据后有相同小写字母表示差异不显著(P>0.05);同行数据后有相同大写字母表示差异不显著(P>0.05).

表4 雌核发育群体体长与肌间骨长度在不同肌间骨数目区间中的线性关系
注:x:体长,y:肌间骨.
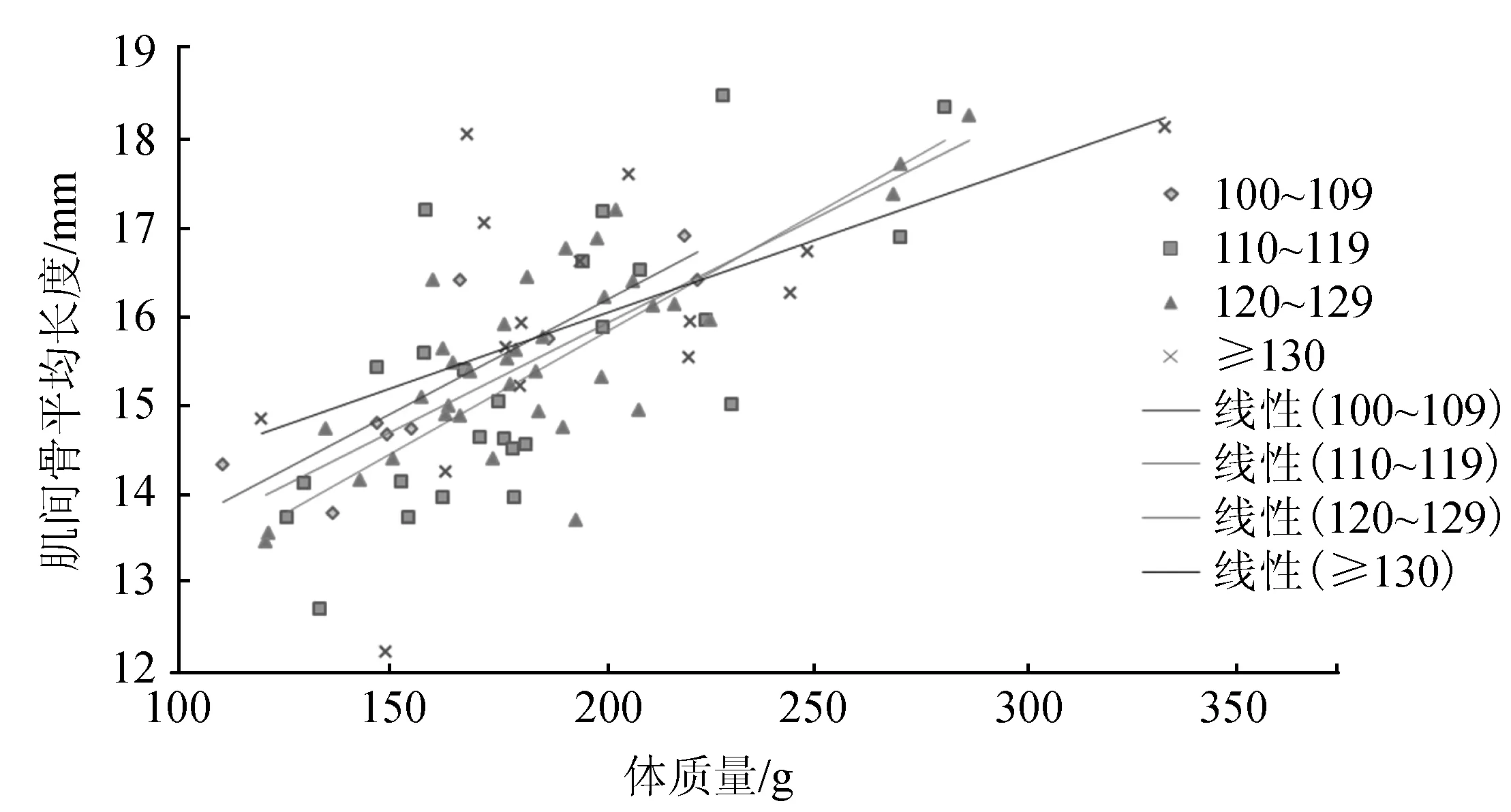
图1 雌核发育群体4种肌间骨数目区间的体质量与肌间骨长度关系
2.3 肌间骨的形态与分布
研究发现,雌核发育团头鲂群体的肌间骨形态共有6种,为“1”形、“y”形、“(”形、 “卜”形、一端多叉形和两端多叉形,主要以“1”形和“y”形为主。各个形态在不同试验鱼分布的位置、个数也不尽相同,在躯干轴上肌主要是形态较复杂的肌间骨,如“y”形、一端多叉形及两端多叉形;而尾部轴上肌和尾部轴下肌则主要以形态简单的“1”形为主,有少量的“y”形、“卜”形、一端多叉形和两端多叉形等(表5),躯干轴下肌的肌间骨数目最少且形态单一。随着肌间骨数目的增多,每一种形态的肌间骨数目都表现为增多的趋势(表6)。
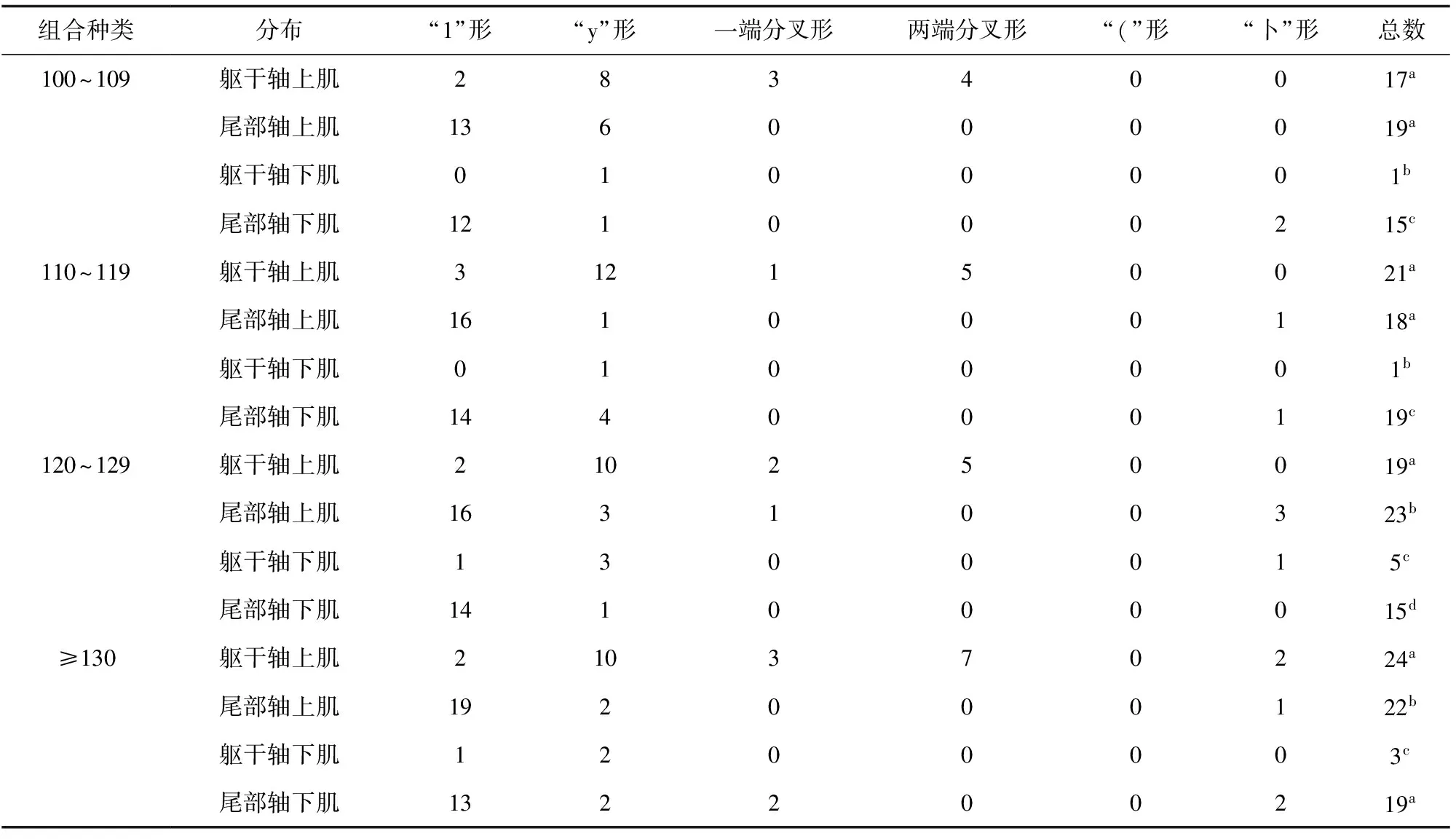
表5 雌核发育群体不同肌间骨数目区间的肌间骨形态统计
注:同列数据后字母不同表示差异显著(P<0.05).

表6 不同肌间骨数目区间的肌间骨形态数目的比较(平均值±标准差)
注:同列数据后有相同小写字母表示差异不显著(P>0.05);同行数据后有相同大写字母表示差异不显著(P>0.05).
3 讨 论
人工诱导雌核发育,可以迅速获得纯合基因型,从而使纯合二倍体的突变基因性状得以表现。徐晓锋等[8]在草鱼雌核发育群体中报道了生长发育正常的无肌间刺草鱼突变体,推测通过人工诱导雌核发育纯合二倍体使突变基因的性状得以表现。其在采用X-射线透视分析后发现其肌肉中未检测到可分辨的肌间骨,仅在背部肌肉中见到比野生型个体的肌间骨显著粗大、分布间隔均匀、折光不均匀的少量条纹,因此推断通过雌核发育技术产生了无肌间骨的突变草鱼个体。除此之外,其推测草鱼肌间骨的发育可能受多个基因的控制,且其调控机制极其复杂。本研究采用传统的形态学解剖的方法分析团头鲂雌核发育群体的肌间骨数目,结果显示雌核发育技术仅使团头鲂群体肌间骨数目低于正常范围的个体出现的频率增加,并且肌间骨数目的减少伴随着躯干部轴上肌和轴下肌以及尾部轴上肌和轴下肌4个部位数目的减少而表现,但并未产生真正的无肌间骨的团头鲂个体。此外,基于雌核发育获得了肌间骨数目较少的团头鲂雌性群体,这为下一步筛选与肌间骨数目相关遗传标记奠定了基础。可以结合雌核发育与雄激素转雄获得性逆转的雄性个体,利用肌间骨较少雌核发育雌性亲本与雌核发育转雄亲本进行人工繁殖,从而获得稳定的肌间骨数目较少的品系。
Perazza等[15]在巴西大盖巨脂鲤(Colossomamacropomum)养殖群体中发现,有50尾个体无肌间骨,这些无肌间骨的个体能正常运动并繁殖后代。笔者认为,因为肌间骨在鱼体内第一根出现、第二根、第三根直至所有的肌间骨出现以及肌间骨的生长发育是一个逐渐的过程,有一个发生和发育的过程,在这个发生发育的过程中可能受到较多基因的控制。基于Perazza等[15]报道的无肌间骨大盖巨脂鲤的现象,推测鱼类肌间骨的发生极有可能是受单基因或几个关键基因的调控,由于基因的突变,从而产生了无肌间骨大盖巨脂鲤群体,至于是何因素导致了基因的突变,以及是何基因突变导致了肌间骨的缺失,还不得而知。而肌间骨的数目可能是受多个基因控制,从而使得群体内不同个体的肌间骨数目存在一定程度的差异。

[1] 谢从新. 鱼类学[M]. 北京:中国农业出版社, 2010:56-57.
[2] 房连聪,李学军.低等真骨鱼类肌间骨发生的研究[J].水产科学,2013,32(12):749-752.
[3] 秉志. 幼鲤大侧肌隔骨针的观察[J]. 动物学报, 1962, 14(2):175-178.
[4] 董在杰, 黄代中, 李丽娟, 等.几种常见鲤科养殖鱼类肌间刺的初步研究[J].上海水产大学学报, 2006, 15(4):425-429.
[5] 吕耀平, 鲍宝龙, 蒋燕, 等. 低等真骨鱼类肌间骨的比较分析[J]. 水产学报, 2007, 31(5):661-668.
[6] 柯中和, 张炜, 蒋燕, 等. 鲢肌间小骨发育的形态学观察[J]. 动物学杂志, 2008, 43(6):88-96.
[7] 黎玲, 钟泽州, 曾鸣, 等. 不同倍性鱼肌间骨的比较分析[J]. 中国科学:生命科学, 2013, 56(4):341-350.
[8] 徐晓锋, 郑建波, 钱叶青, 等. 生长发育正常的无肌间刺草鱼突变体[J].科学通报, 2015, 60(1):52-57.
[9] 高泽霞, 王卫民, 蒋恩明, 等. 团头鲂种质资源及遗传改良研究进展[J].华中农业大学学报:自然科学版, 2014, 33(3):138-144.
[10] 王卫民. 团头鲂养殖产业现状[J]. 科学养鱼, 2009(4):44-45.
[11] 张新辉,罗伟,高泽霞,等.团头鲂三倍体的诱导及其鉴定[J].水产科学,2013,32(9):503-508.
[12] 苏锦祥, 孟庆闻, 唐宇平. 团头鲂骨骼系统的发育[J]. 水生生物学报, 1989, 13(1):3-14.
[13] 万世明, 易少奎, 仲嘉, 等.团头鲂肌间骨发育的形态学观察[J]. 水生生物学报, 2014, 38(6):1145-1152.
[14] 张新辉, 夏新民, 罗伟, 等. 团头鲂雌核发育后代的微卫星标记分析[J]. 华中农业大学学报:自然科学版,2012, 31(6):737-743.
[15] Perazza C A, Menezes J T B, Silva L A, et al. Record of lack of intermuscular bones in specimens ofColossomamacropomum(Characiformes):unusual phenotype to be incorporated into genetic improvement programs[G]//Paulino M. International Symposium on Genetics in Aquaculture Ⅻ Santiago de Compostela, Spain:Universidade de Santiago de Compostela, 2015:133.
[16] 马良骁, 董在杰, 苏胜彦, 等. 鱼类肌间刺的研究进展[J]. 江苏农业科学, 2012, 40(4):234-235.
[17] 姚文杰, 龚小玲, 吕耀平, 等. 日本鳗鲡肌间小骨的骨化过程[J].上海海洋大学学报, 2014, 23(6):810-813.
[18] Bied N C, Mabee P M. Developmental morphology of the axial skeleton of the zebrafish,Daniorerio(Ostariophysi:Cyprinidae)[J]. Developmental Dynamics, 2003, 228(3):337-357.

[20] 吕耀平, 周晨晨, 杨丽美, 等. 瓯江彩鲤肌间小骨的骨化模式[J]. 上海海洋大学学报, 2014, 23(1):58-63.
MorphologicalCharacteristicsofIntermuscularBonesinGynogeneticPopulationofBluntnoseBlackBreamMegalobramaamblycephala
GUAN Ningnan1, NIE Chunhong1,2, CHEN Yulong1,2, LIU Lifang1,2, GAO Zexia1,2
( 1. Key Laboratory of Agricultural Animal Genetics, Breeding and Reproduction, Ministry of Education,Key Laboratory of Freshwater Animal Breeding, Ministry of Agriculture, College of Fisheries, Huazhong Agricultural University, Wuhan 430070,China; 2. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China )
In the present study, the morphologic characteristics of intermuscular bones was investigated in gynogenetic population of bluntnose black breamMegalobramaamblycephalaand compared with normal population. Among the 86 individuals from gynogenetic population, the number of intermuscular bones was ranged from 100 to 136 with the average number of 121. The fish from gynogenetic population were divided into 4 intervals according to the number of intermuscular bones, including 100—109, 110—119, 120—129, and ≥130 intervals, respectively. The individuals with 100—109 intermuscular bones accounted for 10.5%, more than that in the normal population (3.3%). In gynogenetic population, the number of intermuscular bones in hypaxial muscle of dorsal part was significantly less than the other three parts including hypaxial muscle, epiaxial muscle of tail part, and epiaxial muscle of dorsal part (P<0.05). There was significant difference between hypaxial intermuscular bone and epiaxial intermuscular bone of tail part (P<0.05). The less number of intermuscular bones in 100—109 interval was found in four different parts. The less number of intermuscular bones will provide the breeding directions and basic breeding material for bluntnose black bream in future studies.
Megalobramaamblycephala; gynogenesis; intermuscular bone; number; morphologic characteristics
10.16378/j.cnki.1003-1111.2017.05.009
2016-07-28;
2017-01-20.
国家自然科学基金资助项目(31472271);国家大宗淡水鱼类产业技术体系建设项目(CARS-46-05);中央高校基本科研业务费专项(2662015PY088);武汉市青年科技晨光计划项目(2016070204010143).
关柠楠(1994-),女,硕士研究生;研究方向:鱼类遗传育种.E-mail:ningnang06@163.com.通讯作者:高泽霞(1982-),女,副教授,博士;研究方向:鱼类遗传育种.E-mail:gaozx@mail.hzau.edu.cn.
S965.119
A
1003-1111(2017)05-0596-05
