鸭绿江口赤潮监控区海域浮游植物群落
2017-12-18陈燕珍曹戈然陈宦卿刘希刚
姜 珊,陈燕珍,曹戈然,陈宦卿,刘希刚
( 国家海洋局 大连海洋环境监测中心站,辽宁 大连 116015 )
鸭绿江口赤潮监控区海域浮游植物群落
姜 珊,陈燕珍,曹戈然,陈宦卿,刘希刚
( 国家海洋局 大连海洋环境监测中心站,辽宁 大连 116015 )
研究了2011—2015年鸭绿江口辽宁东港赤潮监控区海域浮游植物群落,并分析了其与各环境因子之间的相关性。5年共检出浮游植物3门53属136种,其中硅藻门40属107种,甲藻门11属27种,金藻门2属2种。各季节优势种多为赤潮藻,如尖刺伪菱形藻、柔弱角毛藻、中肋骨条藻和丹麦细柱藻等。浮游植物数量通常在春季和秋季出现高峰,在夏季与水温呈显著负相关,相关系数-0.696(P<0.01)。与夏季和秋季相比,春季浮游植物群落结构稳定性较差,易出现细胞数量和优势度均较高的单一优势种,可见春季—初夏是该海域赤潮易发季节。近年来偶见种和暖水种成为优势种的现象指示了外来物种入侵或调查海域环境的改变。
鸭绿江口;赤潮监控区;浮游植物;环境因子
海洋浮游植物是海洋生态系统中最重要的初级生产者,其群落特征是研究海区其他生态和环境问题的基础[1]。赤潮是指海洋中某些浮游生物(尤指藻类)在一定环境条件下爆发性增殖或聚集达到某一水平,引起水色变化或对其他海洋生物产生危害作用的一种生态异常现象[2]。随着辽宁东港海水养殖业的持续发展,该海域的环境质量和环境风险愈加受到关注与重视。2000—2015年,东港附近海域发生有记录的赤潮7次,面积30~1100 km2,2000年8月和2006年6月爆发的夜光藻(Noctilucascintillans)赤潮给当地的贝类养殖业造成了巨大的损失[3-9]。赤潮对水产养殖业造成的破坏阻碍了海水养殖业的可持续发展[10]。为了解赤潮的发生及发展趋势,保护海洋生态环境,2002年国家海洋局在东港养殖区附近的鸭绿江口海域设立了赤潮监控区,每年在赤潮发生时段范围内[11]进行常规监测。近年来,有关鸭绿江口附近海域浮游植物的研究较多[12-14],但仍缺乏较长时间尺度内对鸭绿江口海域浮游植物群落的系统研究。笔者根据2011—2015年东港赤潮监控区监测数据,分析了浮游植物种类组成、数量分布和群落结构变化等生态学特征,并探讨其与环境因子的关系,为研究该海域浮游植物长期演变、海洋生态环境状况、赤潮监控与防治以及海水养殖业可持续发展提供基础资料。
1 材料与方法
东港赤潮监控区位于N 39°44′11″~39°48′7″,E 124°6′55″~124°9′3″范围内,根据地理位置以及鸭绿江径流影响,布设6个站位(图1)。
2011—2015年的5—10月,每月进行2次监测,包括水文、气象、化学及生物等指标,主要有浮游植物细胞数量、水温、盐度、化学需氧量、磷酸盐、无机氮和硅酸盐。
浮游植物样品的采集、处理分析和资料整理均按《海洋监测规范 第7部分:近海污染生态调查和生物监测》[15]中的方法执行。使用浅水Ⅲ型浮游生物网(内径37 cm,网口面积0.1 m2,全长140 cm)垂直拖网方式采样,加入样品体积5%的甲醛溶液进行固定。样品的处理与分析采用直接计数法或浓缩计数法,将待计数样品摇匀,取0.25 mL置于计数框内,在光学显微镜下进行种类鉴定和细胞计数。
Shannon-Weaver多样性指数(H′)计算公式:
式中,S为样品中的种类总数,Pi为第i种的个体数(ni)与总个体数(N)的比值。
Pielou均匀度指数(J)计算公式:
J=H′/Hmax
式中,H′为前式计算的多样性指数值,Hmax为log2S,表示多样性的最大值,S为样品中的总种类数。
优势度(Y)计算公式:
Y=(ni/N)×fi
式中,N为样品中的总个体数,ni为样品中第i种的个体数,fi为该种浮游植物在样品中的出现概率;以Y≥0.02来确定优势种[16]。
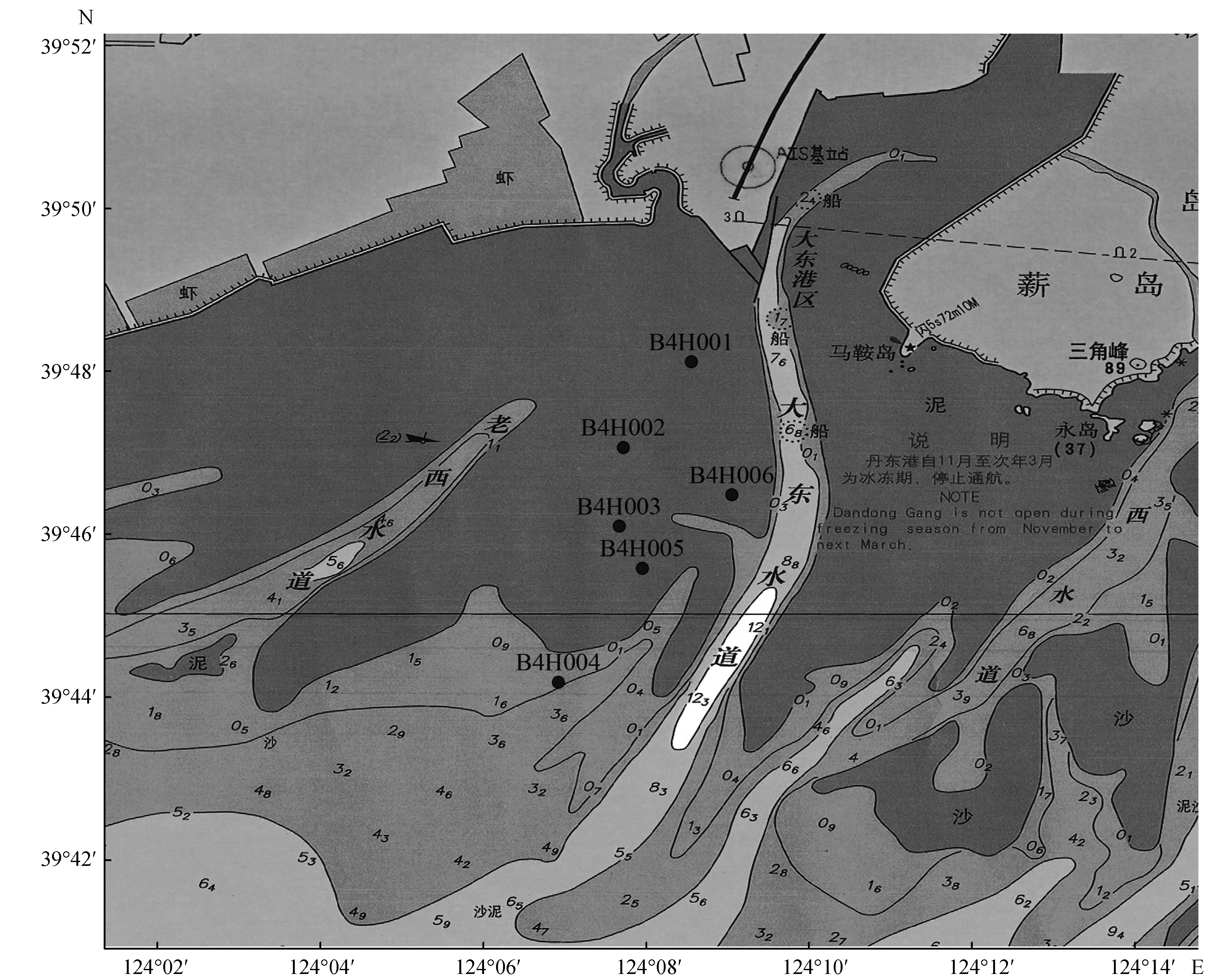
图1 调查站位[17]
2 结果与分析
2.1 浮游植物种类组成
共检出浮游植物3门53属136种(表1),硅藻40属107种,占总种数的78.7%;甲藻11属27种,占总种数的19.8%;金藻2属2种,占总种数的1.5%。各年份种类组成见图2。硅藻占大多数,其次为甲藻。硅藻门角毛藻属(Chaetoceros)最多(35种),圆筛藻属(Coscinodiscus)(13种)次之;甲藻门原多甲藻属(Protoperidinium)和角藻属(Ceratium)最多,各有6种;金藻门卡盾藻属(Chattonella)和硅鞭藻(Dictyocha)属各1种。硅藻和甲藻是调查海域浮游植物的主要组成类群。
其中赤潮藻65种(占种类数的47.8%),包括44种硅藻,19种甲藻和2种金藻。有3种曾在鸭绿江口及附近海域引发过赤潮,分别为尖刺伪菱形藻(Pseudo-nitzschiapungens)、中肋骨条藻(Sheletonemacostatum)和夜光藻。
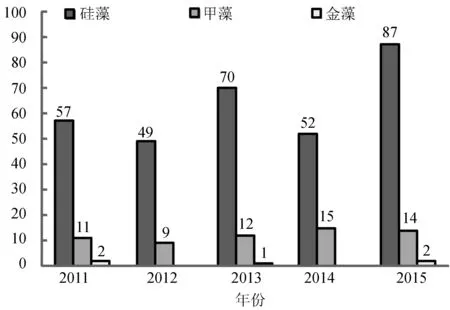
图2 浮游植物种类组成

种名 拉丁名种名 拉丁名硅藻门波状辐裥藻 Actinoptychusundulatus辐环藻Actinocyclussp.爱氏辐环藻A.ehrenbergiivar.ehrenbergii双眉藻Amphorasp.冰河星杆藻∗ Asterionellaglacialis加拉星杆藻∗ A.kariana辐杆藻Bacteriastrumsp.透明辐杆藻B.hyalinumvar.hyalinum盒形藻Biddulphiasp.长耳盒形藻∗ B.aurita长角盒形藻B.longicruris活动盒形藻B.mobiliensis高盒形藻 B.regia中国盒形藻∗ B.sinensis菱面盒形藻B.rhombusf.rhombus大洋角管藻Cerataulinapelagica大角管藻 C.daemon角毛藻Chaetocerossp.窄隙角毛藻∗ C.affinis卡氏角毛藻C.castracanei深环沟角毛藻 C.constrictus扁面角毛藻∗ C.compressus双脊角毛藻C.costatum旋链角毛藻∗ C.curvisetus丹麦角毛藻C.danicus柔弱角毛藻∗ C.debilis并基角毛藻C.decipiensf.decipiens密连角毛藻C.densus齿角毛藻∗C.denticulatusf.denticulatus冕孢角毛藻∗ C.diadema双孢角毛藻∗ C.didymusvar.didymus罗氏角毛藻C.lauderi劳氏角毛藻∗ C.lorenzianus日本角毛藻C.nipponica秘鲁角毛藻∗ C.peruvianus窄面角毛藻∗ C.paradoxus聚生角毛藻∗ C.socialis圆柱角毛藻C.teres舞姿角毛藻C.saltans暹罗角毛藻∗ C.siamense扭链角毛藻C.tortissimus范氏角毛藻C.vanheurchii棘冠藻Corethroncriophilum圆筛藻Coscinodiscussp.星脐圆筛藻∗ C.asteroplanusvar.asteroplanus蛇目圆筛藻C.argus中心圆筛藻∗ C.centralis巨圆筛藻∗C.gigasvar.gigas格氏圆筛藻∗ C.granii强氏圆筛藻C.janischii琼氏圆筛藻∗ C.jonesianus具边圆筛藻C.marginatus虹彩圆筛藻C.oculus-iridis辐射圆筛藻∗ C.radiatus细弱圆筛藻C.subtilisvar.subtilis威利圆筛藻∗ C.waillesii小环藻Cyclotellasp.条纹小环藻C.striatavar.striata双壁藻Diploneissp.布氏双尾藻∗ Ditylumbrightweillii太阳双尾藻 D.sol唐氏藻Donkiniasp.短角弯角藻∗ Eucampiazodiacus长角弯角藻E.cornuta柔弱井字藻 Eunotogrammadebile脆杆藻Fragilariasp.薄壁几内亚藻∗Guinardiaflaccida布纹藻Gyrosigmasp.波罗的海布纹藻G.balticumvar.balticum泰晤士扭鞘藻Helicothecatamesis环纹娄氏藻Lauderiaannulata丹麦细柱藻∗ Leptocylindrusdanicus易变石丝藻Lithodesmiumvariabile舟形藻Naviculasp.膜状舟形藻N.membranacea菱形藻Nitzschiasp.新月菱形藻N.closterium洛伦菱形藻N.lorenziana长菱形藻∗N.longissimavar.longissima弯菱形藻 N.sigma具槽直链藻∗ Melosirasulcatavar.sulcata羽纹藻Pinnulariasp.斜纹藻Pleurosigmasp.端尖斜纹藻P.acutumvar.acutum海洋斜纹藻P.pelagicum尖刺伪菱形藻∗Pseudo⁃nitzschiapungens柔弱伪菱形藻 P.delicatissima翼根管藻 Rhizosoleniaalataf.alata翼根管藻印度变型∗R.alataf.indica斯托根管藻∗ R.stolterforthii柔弱根管藻∗ R.delicatula钝根管藻半刺变型∗R.hebetataf.semispina刚毛根管藻∗ R.setigera笔尖形根管藻∗R.styliformisvar.styliformis优美旭氏藻矮小变型Schröderelladelicatulaf.schröderi中肋骨条藻∗Skeletonemacostatum掌状冠盖藻∗Stephanopyxispalmeriana塔形冠盖藻S.turrisvar.turris针杆藻Synedrasp.伏氏海毛藻∗Thalassiothrixfrauenfeldii菱形海线藻∗Thalassionemanitzschioides海链藻Thalassiosirasp.圆海链藻∗ T.rotula太平洋海链藻∗ T.pacifica诺氏海链藻∗T.nordendkiöldii细弱海链藻∗T.subtilis蜂窝三角藻Triceratiumfavusf.favus甲藻门亚历山大藻Alexandriumsp.塔马亚历山大藻∗A.tamarense叉角藻∗Ceratiumfurca纺锤角藻∗ C.fusus低顶角藻 C.humile卡氏角藻 C.karstenii大角角藻∗ C.macroceros三角角藻∗ C.tripos渐尖鳍藻∗ Dinophysisacuta倒卵形鳍藻∗D.fortii新月球甲藻Dissodiniumlunula膝沟藻Gonyaulaxsp.底刺膝沟藻∗G.spinifera条纹环沟藻∗Gyrodiniuminstriatum夜光藻∗Noctilucascintillans原甲藻Prorocentrumsp.微小原甲藻∗P.minimum东海原甲藻∗P.donghaiense海洋原甲藻∗P.micans原多甲藻 Protoperidiniumsp.扁平原多甲藻∗ P.depressum灰甲原多甲藻∗ P.pellucidum圆锥原多甲藻∗ P.conicum海洋原多甲藻∗ P.oceanicum五角原多甲藻∗ P.pentagonum粗梨甲藻 Pyrocystisrobusta锥状施克里普藻∗Scrippsiellatrochoidea金藻门小等刺硅鞭藻∗ Dictyochafibula海洋卡盾藻∗ Chattonellamarina
注:*为赤潮种.
2.2 浮游植物生态类型
根据郭皓[2]对浮游植物的生态类型分类,可将调查海域所得的浮游植物分为以下几个类群:
(1)广温、广盐类群 在调查海域种类较多,分布广泛,如斯托根管藻、中肋骨条藻和刚毛根管藻。
(2)近岸、沿岸类群 这一类群适盐范围相对较低,是调查海域浮游植物主要的类群,部分种类还是季节性优势种,如尖刺伪菱形藻和旋链角毛藻。广温型有丹麦细柱藻、旋链角毛藻和具槽直链藻等;温带型有柔弱角毛藻、卡氏角毛藻、太平洋海链藻和柔弱根管藻等。
(3)外洋性类群 该类群种类不多,主要有伏氏海毛藻、密连角毛藻和虹彩圆筛藻等。
(4)暖水性类群 近年暖水性类群在调查海域出现的种类渐多,频率也有所增大,部分种类有时在数量上还会占优,如大角管藻是2015年秋季的优势种之一。代表种有长角盒形藻、掌状冠盖藻和优美旭氏藻矮小变型等。
2.3 浮游植物数量分布和优势种季节演替
浮游植物细胞数量一直处于动态变化之中,并呈现出明显的季节性:数量高峰多出现在6月和9月;7—8月数量通常较少。各季节优势种多为赤潮种,如尖刺伪菱形藻、中肋骨条藻、窄隙角毛藻、旋链角毛藻和夜光藻等。主要优势种及优势度见表2。
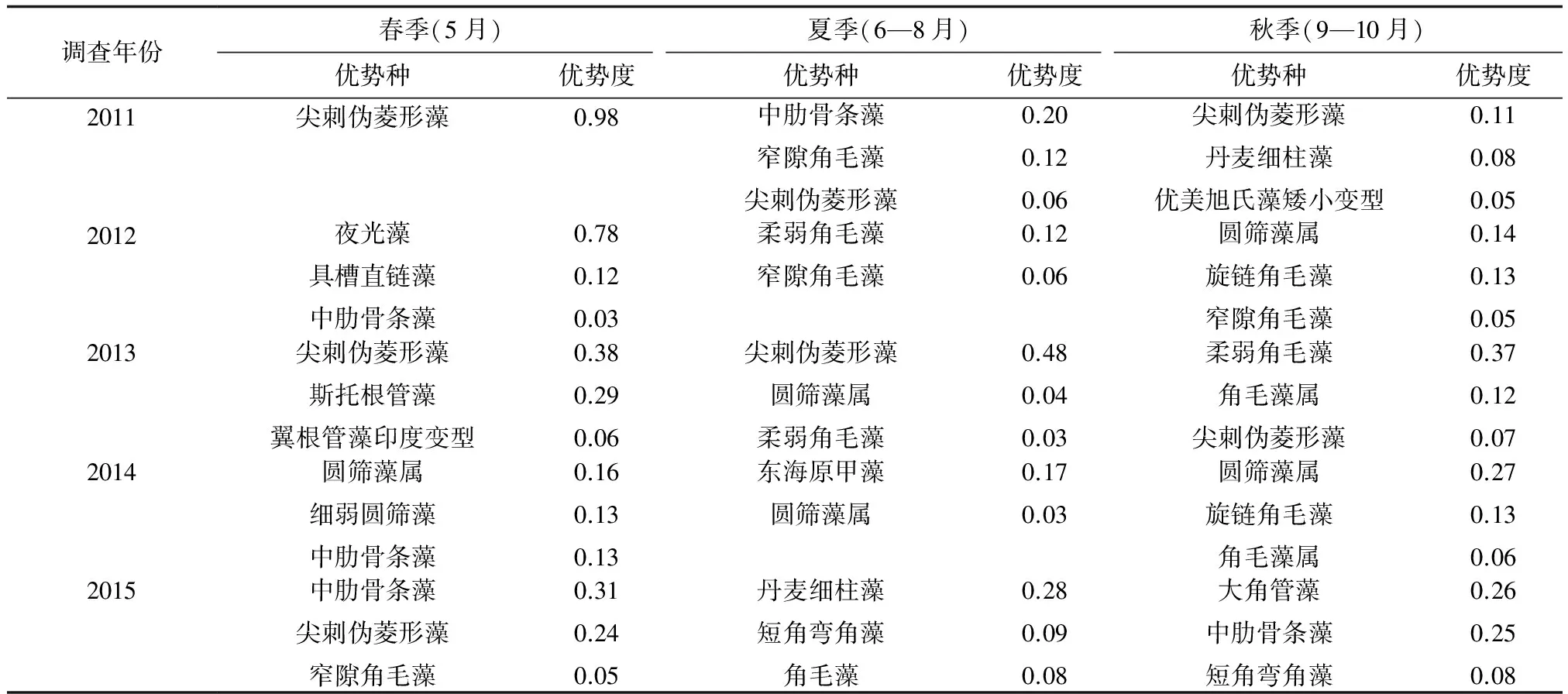
表2 浮游植物主要优势种
由表2可见,尖刺伪菱形藻在春、夏、秋3季均可以成为优势种,特别是2011年5月还引发了赤潮,导致当年春季只存在这一单一优势种,且优势度极高(0.98),适宜的氮/磷是这次尖刺伪菱形藻大量增殖的主要原因[18]。
2.4 浮游植物群落多样性分析
多样性指数和Pielou均匀度指数计算结果(表3)显示,同年不同航次间多样性指数变化非常大,最高值常出现在秋季,最低值出现在春季或夏季,当存在优势度较高的单一优势种时会极大的降低多样性指数;均匀度指数也在较大范围内变动,一般秋季均匀度最高,春季种间分布欠均匀,该指数较低。
2.5 浮游植物数量与环境因子的关系
用统计分析软件SPSS 22.0将5年中各季节浮游植物数量与水温、盐度、化学需氧量、磷酸盐、无机氮和硅酸盐各因子之间进行Pearson相关性分析,发现浮游植物数量在春、秋季与各因子之间均不存在显著的相关性;在夏季与水温呈负相关,相关系数-0.696(P<0.01),与其他因子不存在显著的相关性(表4)。Gayoso[19]对阿根廷Bahia Blanca河口浮游植物进行了15年的研究,发现浮游植物细胞丰度与水温呈负相关。但在本调查海域,分析结果表明,浮游植物数量与水温的相关性并不是绝对的,而是有条件的,即水温在相对较高的范围内(17~27 ℃)时这种负相关性才有所体现。
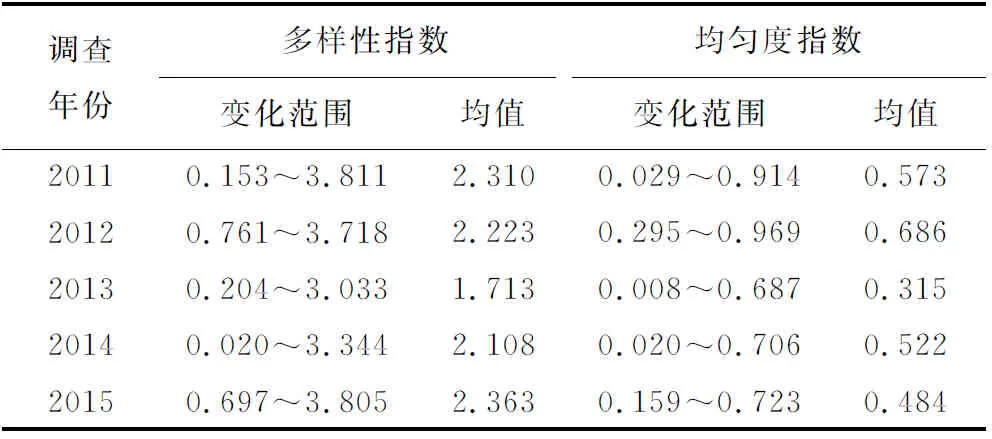
表3 群落多样性指数和均匀度指数
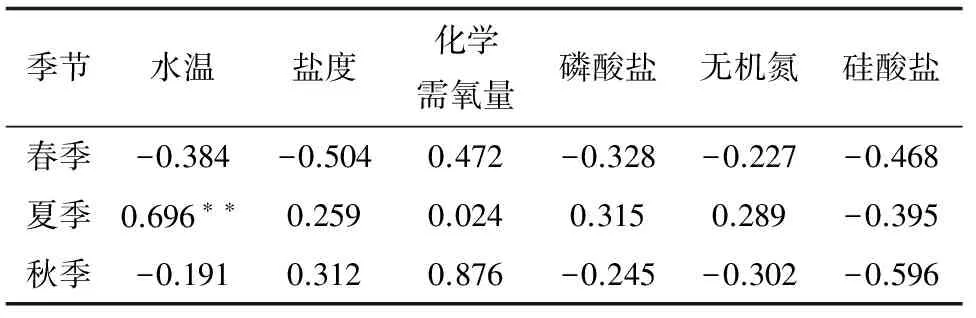
表4 浮游植物数量与环境因子的Pearson相关性分析
注:**相关性在0.01水平上显著(双尾).
3 讨 论
3.1 浮游植物群落及变化
东港赤潮监控区5年中共鉴定出3门53属136种浮游植物,硅藻和甲藻在种类组成上占绝对优势。生态类型以广布种和温带种为主,有部分外洋种和暖水种。优势种多为海区常见的赤潮种,如尖刺伪菱形藻、中肋骨条藻和旋链角毛藻等。近2年暖水性类群的出现频率有所增大,个别种类还一度成为了季节性优势种。偶见种和暖水种成为优势种这一现象可能预示着调查海域浮游植物种群的演替,同时也指示了外来物种的入侵或者环境的改变。
群落多样性是表征群落特征和群落稳定性的重要参数[20],本文采用Shannon-Weaver多样性指数和Pielou均匀度指数对调查海域浮游植物进行了群落多样性分析。通常,多样性指数和均匀度指数越高,群落越稳定。秋季浮游植物群落多样性指数和均匀度指数较高,优势种都在3种以上,说明该季节浮游植物群落结构稳定性较好;春、夏季多样性指数和均匀度指数相对较低,有时会出现绝对优势种,导致群落结构稳定性不比秋季。
3.2 浮游植物数量变化与重要赤潮藻分析
浮游植物数量有着明显的季节变化规律,通常在初夏和秋季出现高峰,5年中在5月发生赤潮1次,在6月接近形成赤潮的基准密度1次,由此推断春季—初夏可能是该海域的赤潮易发时段,可在该时段内增加监视监测频率。
尖刺伪菱形藻是调查海域出现频率最高的优势种,并且引发过赤潮,今后可作为监测重点加以关注。
东海原甲藻是我国东南沿海近年来赤潮频发的主要原因种之一,在调查海域偶尔可见,但2014年6月上旬其平均数量高达3.6×104个/L,占浮游植物总数的99.4%,与形成赤潮的基准密度(>50×104个/L)[11]仅相差一个数量级,且是当次调查的唯一优势种(优势度为0.99),而在13 d前的监测中并未检出该种。东海原甲藻的突然出现并且数量激增值得引起注意并分析原因。东海原甲藻不产孢囊,突然出现不会是由于孢囊萌发所致,更有可能是通过船舶压舱水的外排释放出了藻种,然后在适宜的环境条件下快速生长繁殖而成为优势种。同时监测的理化因子为气温18.5 ℃、水温20.4 ℃、盐度30.1、化学需氧量1.06 mg/L、硅酸盐0.452 mg/L、磷酸盐0.011 mg/L、无机氮1.031 mg/L。有研究发现,东海原甲藻生长繁殖的最适温度、盐度分别为18~22 ℃、22~31,同时海水中硝酸盐的含量对维持东海原甲藻赤潮具有重要作用[21]。此时水温和盐度在其最适范围内;化学需氧量和硅酸盐含量与上次监测相比无明显变化;磷酸盐含量为0.0115 mg/L,低于调查海域平均水平;硝酸盐异常升高(0.949 mg/L,占无机氮总量的92.0%),使总无机氮含量超过了第四类海水水质标准,氮/磷(199.4)也远高于Redfield值(16),赤潮监控区处于磷限制潜在性富营养水平[22],在未发现其他环境因子明显改变的情况下,这种富营养化状态可能支持了东海原甲藻的迅速增殖。
3.3 环境对浮游植物群落结构的影响
河口海域环境有着复杂多变的特点,由于鸭绿江径流的季节和年度变化,以及潮汐和海流影响,赤潮监控区海域水温、盐度和营养盐等都可以在短时间内发生剧烈改变,营养状态和氮/磷也有较大波动(表5),并未一直处于富营养化或者某种营养盐限制的状态。不同浮游植物生长繁殖的最适环境不尽相同,因而随着环境因子的改变优势种会发生演替,进而影响到整个浮游植物的群落结构。

表5 富营养化指数及氮/磷
为进一步了解东港赤潮监控区的浮游植物群落及其时空变化规律,需要进行长期的调查并深入研究各种影响因子及影响机制,以便科学评估海洋环境状况,合理开发利用海洋资源,实现海水养殖业的健康发展。
[1] 孙军,李冠国,范振刚.海洋生态学[M].北京:高等教育出版社,2004.
[2] 郭皓.中国近海赤潮生物图谱[M].北京:海洋出版社,2004.
[3] 国家海洋局.2000年中国海洋环境质量公报[R].北京:国家海洋局,2001.
[4] 国家海洋局.2010年中国海洋环境质量公报[R].北京:国家海洋局,2011.
[5] 国家海洋局.2011年中国海洋环境质量公报[R].北京:国家海洋局,2012.
[6] 辽宁省海洋与渔业厅.2001年辽宁省海洋环境质量公报[R].沈阳:辽宁省海洋与渔业厅,2002.
[7] 辽宁省海洋与渔业厅.2003年辽宁省海洋环境质量公报[R].沈阳:辽宁省海洋与渔业厅,2004.
[8] 辽宁省海洋与渔业厅.2004年辽宁省海洋环境质量公报[R].沈阳:辽宁省海洋与渔业厅,2005.
[9] 辽宁省海洋与渔业厅.2008年辽宁省海洋环境质量公报[R].沈阳:辽宁省海洋与渔业厅,2009.
[10] Qi Y Z,Chen J F, Wang Z H, et al.Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998[J].Hydrobiologia, 2004, 512(1):209-214.
[11] 国家海洋局.HY/T 069—2005,赤潮监测技术规程[S].北京:中国标准出版社,2005.
[12] 张晓举,温若冰,于海洋.鸭绿江口浮游植物群落特征及与环境因子的关系[J].海洋科学,2012,36(11):19-23.
[13] 宋伦,王年斌,杨国军,等.鸭绿江口及邻近海域生物群落的胁迫响应[J].生态学报,2013,33(9):2790-2802.
[14] 聂间间,刘永健,冯志权,等.春季北黄海浮游植物群落结构及年际变化[J].海洋环境科学,2014,33(2):182-207.
[15] 国家质量监督检验检疫总局.GB17378.7—2007,海洋监测规范 第7部分:近海污染生态调查和生物监测[S].北京:中国标准出版社,2007.
[16] 徐兆礼,陈亚瞿.东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J].生态学杂志,1989,8(4):13-15.
[17] 中国人民解放军海军司令部航海保证部.中国 朝鲜 黄海 鸭绿江口至海洋岛[M].2版.天津:中国航海图书出版社,2009.
[18] 姜珊,陈燕珍,刘希刚,等.2011年辽宁东港赤潮监控区浮游植物群落结构特征[J].海洋通报,2012,31(4):421-425.
[19] Gayoso A M.Long-term phytoplankton studies in the Bahia Blanca estuary,Argentina[J].ICES J Mar Sci,1998,55(4):655-660.
[20] 田伟,孙军.2009年晚春黄海南部浮游植物群落[J].海洋科学,2011,35(6):19-24.
[21] 王金辉,黄秀清.具齿原甲藻的生态特征及赤潮成因浅析[J].应用生态学报,2003,14(7):1065-1069.
[22] 郭卫东,章小明,杨逸萍,等.中国近岸海域潜在富营养化程度评价[J].台湾海峡,1998,17(1):64-70.
PhytoplanktonCommunityinDonggangRed-Tide-MonitoringArea,YalujiangRiverEstuary
JIANG Shan, CHEN Yanzhen, CAO Geran, CHEN Huanqing, LIU Xigang
( Dalian Marine Environmental Monitoring Central Station,State Ocean Administration,Dalian 116015,China )
The phytoplankton community in Donggang red-tide-monitoring area in Yalujiang River estuary was studied using data collected from 2011 to 2015. A correlation analysis of the data with the environmental factors revealed that 136 species were identified in this research, belonging to 3 phyla with 53 genera, including 40 genera and 107 species in Bacillariophyta, 11 genera and 27 species in Pyrrophyta, and 2 genera and 2 species in Chrysophyta. The seasonal dominant species were red-tide algae, includingPseudo-nitzschiapungens,Chaetocerosdebilis,Skeletonemacostatum, andLeptocylindrusdanicus. Cell density peaks were observed in spring and fall with the correlation between the density and water temperature of -0.696(P<0.01). Compared with summer and fall, phytoplankton community structure was likely less stable in spring, and the single dominant species tended to appear with high density and dominance. It is concluded that spring and early summer are the HABs-prone seasons in Donggang red-tide-monitoring area. Warm water and rare species were found at times as dominant species in recent years, indicating that alien species invasion or certain changes in marine environment may have happened in the survey area.
Yalujiang River estuary;red-tide-monitoring area;phytoplankton;environmental factor
10.16378/j.cnki.1003-1111.2017.05.013
2016-08-08;
2016-10-24.
姜珊(1983-),女,工程师;研究方向:海洋生态环境监测与评价. E-mail:js_dalian@126.com. 通讯作者:陈燕珍(1963-),女,高级工程师;研究方向:海洋环境监测、海洋开发与管理. E-mail:1002914345@qq.com.
S931.3
A
1003-1111(2017)05-0617-06
