群体与单体养殖条件下三疣梭子蟹生长、消化酶与免疫酶活性的比较研究
2017-12-18许文军郑宽宽2谢建军王庚申
何 杰, 许文军,郑宽宽2,, 谢建军,施 慧, 王庚申,汪 玮
( 1.浙江省海洋水产研究所,浙江 舟山 316021; 2.浙江省海水增养殖重点实验室,浙江 舟山 316021;3.浙江海洋大学 水产学院,浙江 舟山 316002 )
群体与单体养殖条件下三疣梭子蟹生长、消化酶与免疫酶活性的比较研究
何 杰1,2, 许文军3,郑宽宽2,3, 谢建军1,2,施 慧1,2, 王庚申1,2,汪 玮1,2
( 1.浙江省海洋水产研究所,浙江 舟山 316021; 2.浙江省海水增养殖重点实验室,浙江 舟山 316021;3.浙江海洋大学 水产学院,浙江 舟山 316002 )
水温(27±3) ℃下,将体质量为(2.18±0.14) g的三疣梭子蟹幼蟹以多只(10只)或单只的方式饲养在半径为50 cm的圆形养殖桶中,比较群养与单养条件下三疣梭子蟹的生长特性、消化酶与免疫酶活性。结果显示:(1)群养组幼蟹在蜕壳后的软壳期间被同类捕食和残杀现象严重,死亡率和残疾率显著高于单养组幼蟹(P<0.05);(2)两种养殖条件下幼蟹在夜间完成蜕壳的比例显著高于白天;群养组幼蟹在白天蜕壳的比例显著高于单养组(P<0.05);(3)群养组幼蟹的蜕壳周期显著小于单养组(P<0.05),但蜕壳同步率低于单养组,群养组幼蟹的体质量、甲宽增长率和特定生长率均略高于单养组,差异不显著;(4)群养组幼蟹肝胰腺和胃中的胰蛋白酶、脂肪酶、淀粉酶活性均高于单养组,肝胰腺中最为明显;(5)群养组幼蟹肝胰腺和血淋巴中超氧化物歧化酶的活性显著高于单养组(P<0.05),而两种养殖条件下幼蟹组织中的酸性磷酸酶、碱性磷酸酶活性差异不显著。
三疣梭子蟹;养殖条件;生长;消化酶;免疫酶
水产养殖模式是指在某一特定条件下,使养殖生产达到一定产量而采用的经济与技术相结合的规范化养殖方式[1]。养殖模式不仅影响和决定水产动物的生存对策,也改变和固化水产动物的生命代谢特征,与水产动物的生长特性与养成品质有着极为密切的关系[2]。近些年来,国内外对同种水产动物经不同模式养殖后的形态特征[3]、生长规律[4-5]、生理生化组成[6]、营养品质[7-8]等展开了较为广泛的研究,为揭示水产动物在不同养殖模式下的生理生态适应机制,提高水产动物养殖水平提供了科学依据。
三疣梭子蟹(Portunustrituberculatus)肉质鲜美,营养丰富,是我国重要的海水养殖蟹类,市场需求量逐年增加,池塘养殖业发展迅猛,2014年全国池塘养殖产量1.19×105t[9]。随着养殖模式的多元化发展,在池塘群养的基础上,开发了三疣梭子蟹单体筐养模式,生产试验初获成功,相关技术正在逐步完善与推广[10-13]。
本研究在实验室条件下,模拟池塘群养与单体筐养模式,比较了三疣梭子蟹在群养与单养条件下的生长特性、消化酶与免疫酶的活性,不仅为探明三疣梭子蟹在两种不同养殖模式下的生存对策与生命代谢特征,开发三疣梭子蟹健康高效养殖技术提供参考,同时还有助于了解三疣梭子蟹种内关系与作用机理,丰富三疣梭子蟹个体生物学、种群生态学和养殖生态学的理论知识。
1 材料与方法
1.1 材料
本试验于浙江省海洋水产研究所西闪渔业科技岛进行。用灯光诱捕的方法自养殖生产池塘捕获,挑选即将蜕壳且规格相近[体质量(1.15±0.14) g] 的幼蟹500余只,暂养于中挪营养与饲料联合实验室内半径为50 cm的10个圆形养殖桶内,水深30 cm,桶内放置一定数量的直径4 cm、长度15 cm的PVC管,供蟹隐蔽。暂养期间,连续增氧,投喂三疣梭子蟹人工配合饲料(宁波天邦饲料股份公司),投喂量约为桶内蟹总质量的4%。6月22日发现大量蟹开始蜕壳,当日共有86只蟹完成蜕壳,从中挑选附肢完整、体质健壮、规格相近[体质量(2.18±0.14) g] 的60只蟹用于正式试验。
1.2 方法
正式试验的6个养殖容器与上述的养殖桶相同,其中3个桶为群养组,每桶内均匀放置10个直径4 cm、长度15 cm的PVC管,放养10只幼蟹;3个桶作为单养组,每桶内摆放10个半径为13 cm的圆形塑料筐,每个筐内放置1个与上述相同的PVC管和1只幼蟹。所有试验蟹在放养前用干毛巾轻轻沾干体表水分后用电子天平(0.01 g)和游标卡尺(0.01 mm)逐一称量体质量、测量甲宽,并记录好其放养的位置。为能准确区分和辨认群养组的每只幼蟹,用指甲油在群养组的幼蟹甲壳上进行数字编号。整个试验期间,养殖桶内水深维持约在16 cm,连续增氧,水温为(27±3) ℃,光照周期为12 L∶12 D,每日7:00和17:00足量投喂人工配合饲料,投喂2 h后收集残饵,换水1/3。
每日观察和记录各组蟹的自残和死亡情况以及每只蟹的蜕壳时间(7:00—19:00间蜕壳的为白天蜕壳,19:00—7:00间蜕壳的为夜间蜕壳)。待新蜕壳的幼蟹甲壳变硬后用毛巾轻轻擦拭体表水分并称量体质量、测量甲宽。根据以下公式计算体质量增加率(WGR)、体质量特定生长率(SGRm)、甲宽增长率(CGR)和甲宽特定生长率(SGRC):
WGR/%=(m1-m0)/m0×100%
SGRm/%·d-1=(lnm1-lnm0)/t×100%
CGR/%=(C1-C0)/C0×100%
SGRc/%·d-1= (lnC1-lnC0)/t×100%
式中,m1为蜕壳后蟹的平均体质量(g),m0为试验开始时蟹的体质量(g),C1为蜕壳后的平均甲宽(mm),C0为试验开始时的平均甲宽(mm),t为蜕壳周期(d)。
幼蟹称量后,用1 mL无菌注射器自其游泳足基部抽取约1 mL血淋巴样品,装于2 mL离心管中,然后活体解剖取出肝胰腺、胃,装于冻存管中,每组采集4只蟹的样品,所有样品保存于-80 ℃超低温冰箱中,备用于检测消化酶和免疫酶的活性。称取约0.2 g的肝胰腺,加入1 mL(m/V=1∶5)预冷的生理盐水后,用微型匀浆器匀浆30 s后在4 ℃、12 000 r/min条件下离心20 min,取中间清液再次离心,取中间清液用于后续分析。血淋巴解冻后用微型匀浆器匀浆30 s后,在4 ℃,12 000 r/min条件下离心20 min,取出上清液(血清)待测。用南京建成生物工程研究所生产的试剂盒测定肝胰腺和胃中的胰蛋白酶、脂肪酶、淀粉酶的活力,肝胰腺和血淋巴中的超氧化物歧化酶、酸性磷酸酶和碱性磷酸酶的活力。
1.3 数据分析
试验数据以平均值±标准差表示,采用SPSS 13.0软件进行统计分析,用Levene方法进行方差齐性检测。当不满足齐性方差检测条件时进行反正弦或平方根处理,用T检验检查两群体各指标间的差异性,采用Sigmaplot 10.0软件绘图,取P<0.05为差异显著。
2 结 果
2.1 群养与单养条件下三疣梭子蟹的死亡与伤残率
群养组幼蟹在蜕壳后的软壳期间极易遭受同类的侵袭和捕食,其蜕壳后死亡率较高,约达40%(图1),显著高于单养组幼蟹(约5%);两种养殖条件下幼蟹在蜕壳前的死亡率均较低,不存在显著差异(P>0.05),群养组幼蟹的总体死亡率显著高于单个体养殖的幼蟹(P<0.05)。试验期间,群养组存活个体中有40%以上的个体出现不同程度的断肢性伤残(图2),伤残主要由蜕壳后种内相残所致,而单养组幼蟹在蜕壳前后均未出现伤残情况,存活个体的残疾率为0。

图1 两种养殖条件下三疣梭子蟹幼蟹的死亡率
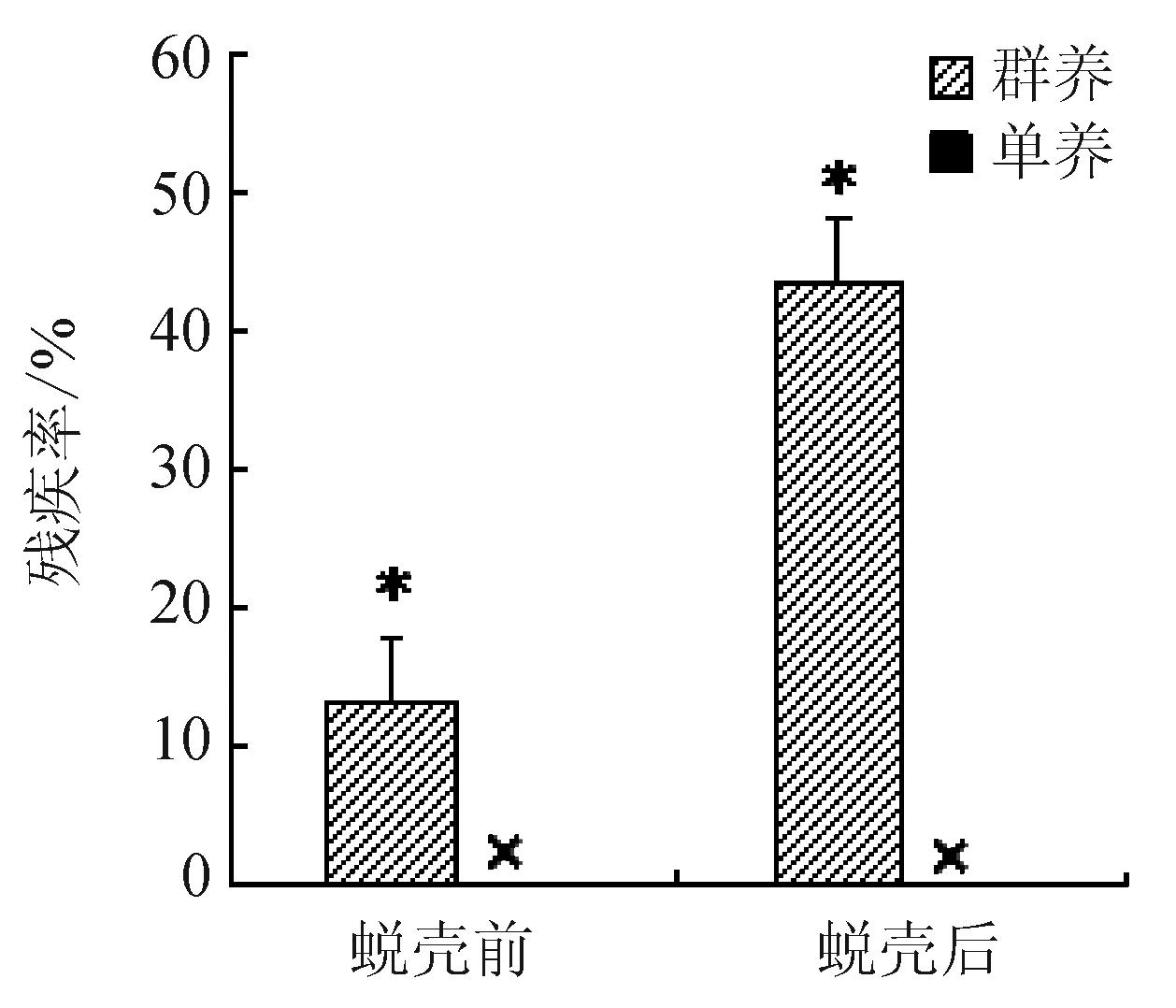
图2 两种养殖条件下三疣梭子蟹幼蟹的残疾率
所有三疣梭子蟹幼蟹存活个体均能完成蜕壳,群养和单养条件下,多数幼蟹(65%~85%)在夜间完成蜕壳,但是,两种条件下幼蟹蜕壳发生的时间存在较大差异,群养组白天蜕壳的幼蟹比例显著高于单养组幼蟹(P<0.05),相反,单养组幼蟹在夜间蜕壳的比例显著高于群养组幼蟹(图3)。

图3 两种养殖条件下三疣梭子蟹幼蟹在白天或夜间蜕壳率
2.2 群养与单养条件下三疣梭子蟹的生长
通过对两种养殖条件下三疣梭子蟹幼蟹蜕壳前后体质量、甲宽的比较发现(表1),群养组幼蟹的蜕壳周期显著小于单养组幼蟹(P<0.05);两者的蜕壳周期标准差(群养组为3.60,单养组为1.15)显示,群养组幼蟹的蜕壳整齐度低于单养组。两种条件下幼蟹的体质量和甲宽增长率表明(图4),在同一蜕壳周期内群养组幼蟹的增长率较高,但差异不显著;两种条件下幼蟹的体质量和甲宽特定生长率也表现出相同的规律(图5)。
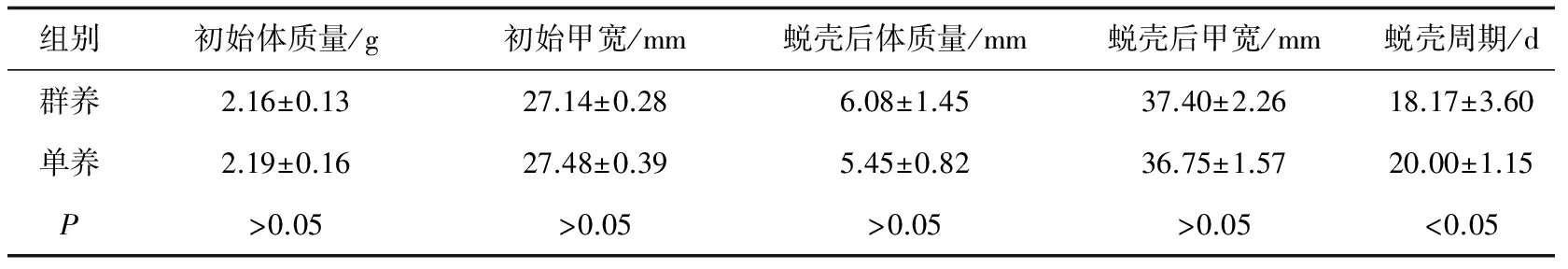
表1 两种养殖条件下三疣梭子蟹幼蟹蜕壳前后的体质量、甲宽变化

图4 两种养殖条件下三疣梭子蟹幼蟹体质量和甲宽的增长率
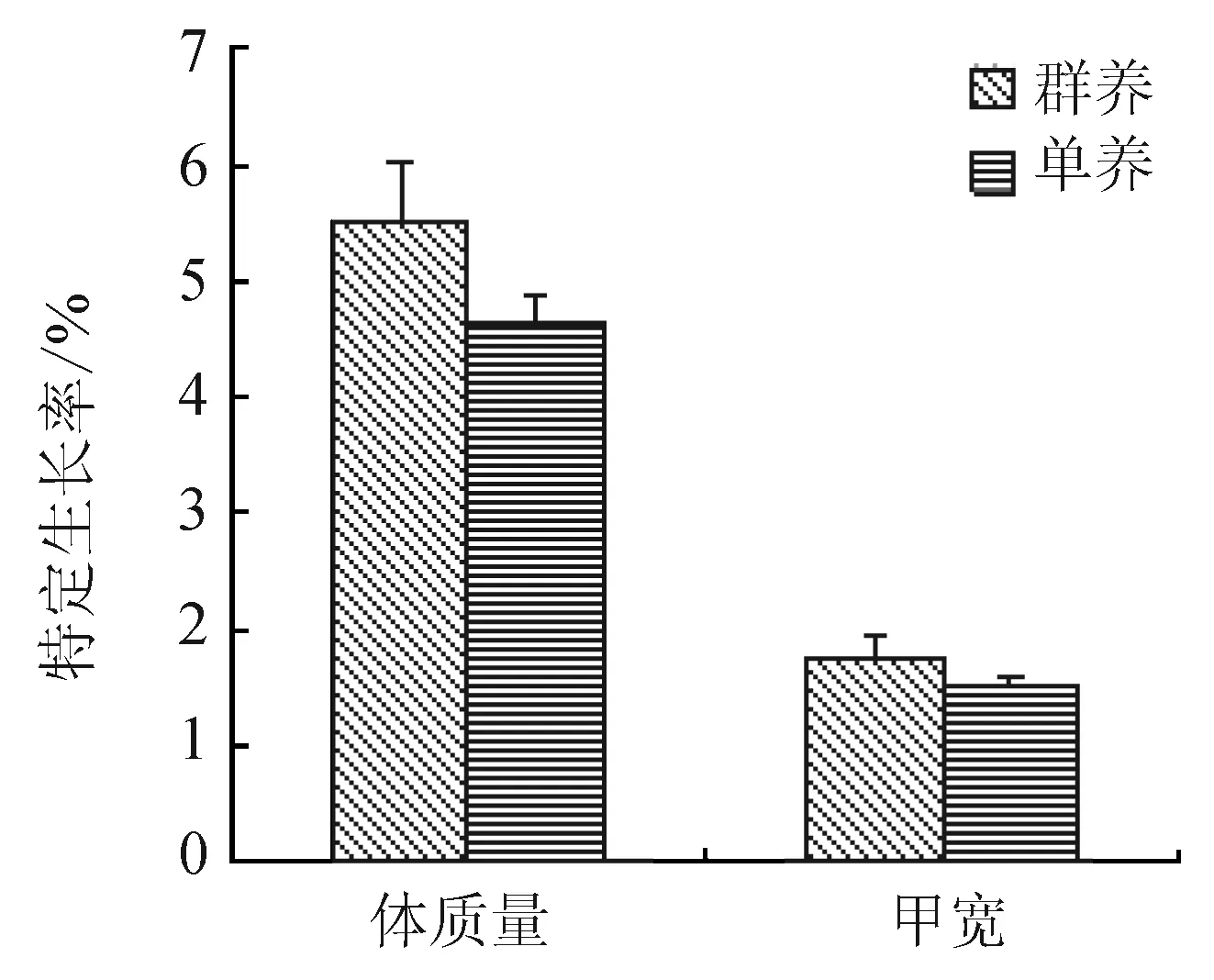
图5 两种养殖条件下三疣梭子蟹幼蟹体质量和甲宽的特定生长率
2.3 群养与单养条件下三疣梭子蟹消化酶的活力
整体上,群养组幼蟹组织中的消化酶活力较高,其中群养组幼蟹肝胰腺中胰蛋白酶、脂肪酶和淀粉酶的活力均显著高于单养组幼蟹(P<0.05),胃胰蛋白酶、脂肪酶活力略高于单养组幼蟹,但差异不显著(P>0.05)(表2)。
2.4 群养与单养条件下三疣梭子蟹免疫酶的活力
群养组幼蟹肝胰腺和血淋巴中超氧化物歧化酶的活力显著高于单养组幼蟹(P<0.05),而两组幼蟹肝胰腺和血淋巴中的酸性磷酸酶与碱性磷酸酶活力较为相近,差异不显著(P>0.05)(表3)。

表2 两种养殖条件下三疣梭子蟹幼蟹肝胰腺和胃中消化酶活力

表3 两种养殖条件下三疣梭子蟹幼蟹肝胰腺和血淋巴中免疫酶活力
3 讨 论
3.1 群养与单养条件对三疣梭子蟹生长特性的影响
同其他甲壳动物一样,三疣梭子蟹依靠蜕壳实现体型的增大和体质量的增加。然而,蜕壳期间是甲壳动物生命过程中最为脆弱的时段,蜕壳后不久的软壳时段极易遭受敌害生物和同类的侵袭[14]。本研究发现,在群养条件下,三疣梭子蟹的领域性和好斗性极强,坚硬甲壳的保护使硬壳状态下互残率和死亡率较低,但蜕壳后的软壳蟹被同类捕食的概率极高,大量幼蟹在避敌过程中自切附肢以致残疾。诸多研究表明,附肢缺失严重影响甲壳动物的摄食[15]、存活[16]、免疫力[17]、生长[18]、繁殖[19]、种内竞争力[20]以及抵御敌害能力[21]等生理生态。因此,本研究进一步探明了蜕壳期间的种内互残是导致三疣梭子蟹群养模式最终产量不高的主要原因。相比之下,单体养殖的幼蟹不存在种内捕食和残杀现象,整体死亡率和残疾率均非常低,可有效提高单位水体的养殖产量,这在养殖生产上已得到充分验证[13]。有趣的是,群养条件下三疣梭子蟹在白天蜕壳的比率显著高于单养条件下,这可能与三疣梭子蟹喜好昼伏夜出、白天隐蔽蜕壳可有效降低被同类发现和捕食的概率有关,符合动物的行为进化总是朝着有利于自身生存和繁衍方向发展的生态学理论。
本研究发现,群养条件下三疣梭子蟹的蜕壳周期较短,体质量、甲宽增长率和特定生长率均略高于单养条件下,可能是群养条件下梭子蟹活动空间大、栖息环境适宜,摄食量增加,营养物质储存较多,而单养条件下梭子蟹受狭小空间的胁迫,食欲较差,生长速度减慢[11]。但是,与单养条件相比,群养条件下幼蟹的蜕壳同步率低,这与罗氏沼虾(Macrobrachiumrosenbergii)社群控制的研究结果一致[22]。笔者认为,食物、空间竞争是导致部分个体生长快速,部分个体生长被抑制的主要原因。而同一家系的中华绒螯蟹(Eriocheirsinensis)在相同环境下群养后,蜕壳仍然极不同步,随着养殖时间的延长,规格分化日益显现,收获时的大规格个体与小规格个体体质量差异可达10倍以上,甚至部分个体生长过快出现性早熟,而部分个体几乎没有生长[23]。这进一步说明除遗传因素外,种内群体竞争是导致甲壳动物蜕壳不同步、规格分化的重要原因。
3.2 群养与单养对三疣梭子蟹消化酶与免疫酶活性的影响
消化酶活性直接影响水产动物对营养物质的消化吸收及机体的生长和发育[6]。影响水产动物消化酶活性的因素众多,如养殖环境[24-25]、养殖模式[2,6]、营养水平[26]、生长发育阶段[27]等。 王志铮等[2]比较了3种养殖模式[池塘专养、与日本沼虾(M.nipponense)套养、水库放养]下鳗鲡(Anguillajaponica)脏器消化酶的活性,发现池塘专养模式下鳗鲡的肝脏蛋白酶、胃蛋白酶、肝脂肪酶及胰腺脂肪酶活力均高于其他两种养殖模式,表明池塘专养模式下的鳗鲡对蛋白和脂肪的消化能力较强;林建升等[6]对不同养殖模式下尼罗罗非鱼(Oreochromisniloticus)消化酶活性的研究中也得出了类似的结论,一年两茬养殖模式下尼罗罗非鱼的肠总脂肪酶、肠总淀粉酶、肝胰脏总脂肪酶活性和肝胰脏总淀粉酶活性总体高于传统养殖模式和鱼虾混养模式下的尼罗罗非鱼。本研究发现,群养条件下三疣梭子蟹的胰蛋白酶、脂肪酶和淀粉酶活性均高于单养条件,可能由于群养条件下三疣梭子蟹对食物的竞争以及运动强度的加强,导致个体的食欲及消化能力加强。至于为何两种条件下三疣梭子蟹肝胰腺的消化酶活性差异更为明显,笔者认为这可能与肝胰腺是甲壳动物的营养代谢中心有关[7,28]。
超氧化物歧化酶作为抗氧化酶系统中最重要的酶之一,在控制膜脂质过氧化、预防机体衰老、保护生物体正常的生理机能中扮演着重要的角色[29-30]。酸性磷酸酶和碱性磷酸酶是生物体内两种重要的非特异性磷酸水解酶,与机体脂质代谢、细胞的消化代谢和免疫调节有关[30]。因此,超氧化物歧化酶、酸性磷酸酶、碱性磷酸酶是衡量机体免疫机能和健康状况的重要指标。本研究中,群养条件下三疣梭子蟹的肝胰腺和血淋巴中的超氧化物歧化酶活力均显著高于单养条件下的幼蟹,而两者肝胰腺和血淋巴中酸性磷酸酶和碱性磷酸酶活力相近,说明群养条件下三疣梭子蟹的免疫力较强,这与单养条件将加剧三疣梭子蟹病害频发的养殖生产实践一致[11-12],究其原因,可能与单养条件下梭子蟹运动强度小,身体机能衰退有关。
[1] 水产名词审定委员会. 水产名词[M]. 北京:科学出版社,2002.
[2] 王志铮, 赵晶, 杨磊, 等.三种养殖模式下日本鳗鲡(Anguillajaponica)养成品血清生化指标和脏器消化酶、抗氧化酶活力的差异[J]. 海洋与湖沼,2013,44(2):403-408.
[3] 王志铮, 杨磊, 朱卫东. 三种养殖模式下日本鳗鲡养成品的形质差异[J]. 应用生态学报, 2012, 23(5):1385-1392.
[4] 王妤, 章龙珍, 赵峰, 等. 不同养殖模式对点篮子鱼的生长和摄食的影响[J]. 渔业信息与战略, 2014,29(2):143-148.
[5] 王峰, 雷霁霖. 半滑舌鳎成鱼开放流水与循环水养殖模式下生长及肌肉营养成分差异研究 [J]. 水产学报, 2015,39(4):520-528.
[6] 林建升, 张秋平, 李文笙. 不同养殖模式下尼罗罗非鱼消化酶活性的比较[J]. 水产学报, 2015, 39(1):65-74.
[7] Wu X G, Cheng Y X, Sui L X, et al. Biochemical composition of pond-reared and lake-stocked Chinese mitten crabEriocheirsinensis(H. Milne-Edwards) broodstock [J]. Aquaculture Research, 2007,38(14):1459-1467.
[8] Wang S, He Y, Wang Y, et al. Comparison of flavour qualities of three sourcedEriocheirsinensis[J]. Food Chemistry, 2016(200):24-31.
[9] 农业部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京:中国农业出版社, 2014.
[10] 王春琳, 母昌考, 李荣华,等. 三疣梭子蟹单体筐养高产高效生产技术[J]. 中国水产, 2013(1):72-76.
[11] 徐永健, 申屠基康, 丁张妮. 饲养空间大小对单体筐养养殖系统中三疣梭子蟹(Portunustrituberculatus)的摄食行为与生长特性的影响研究[J]. 海洋与湖沼, 2014,45(6):1346-1352.
[12] 徐永健,申屠基康,丁张妮.砂粒粒径与砂层厚度对单体筐养养殖系统中三疣梭子蟹(Portunustrituberculatus)幼蟹摄食行为与生长特性的影响研究[J]. 海洋与湖沼, 2015,16(1):234-240.
[13] 郝明珠, 徐建瑜, 王春琳. 梭子蟹单筐养殖自动投饲系统设计与试验[J]. 渔业现代化, 2015, 42(1):20-23.
[14] 王武, 王成辉, 马旭洲. 河蟹生态养殖[M]. 北京:中国农业出版社, 2013.
[15] Edgar G J.Predator-prey interactions in seagrass beds. Ⅱ. distribution and diet of the blue manna crabPortunuspelagicusLinnaeus at Cliff Head, Western Australia[J].Journal of Experimental Marine Biology and Ecology, 1990, 139(1/2):23-32.
[16] Frisch A J, Hobbs J P. Effects of autotomy on long-term survival and growth of painted spiny lobster (Panulirusversicolor) on the Great Barrier Reef, Australia[J]. Marine Biology, 2011, 158(7):1645-1652.
[17] Slos S, De B M, Stocks R. Autotomy reduces immune function and antioxidant defence [J]. Biology Letter, 2008,5(1):90-92.
[18] Quinitio E T, Estepa F D P. Survival and growth of mud crab,Scyllaserrata, juveniles subjected to removal or trimming of chelipeds[J].Aquaculture, 2011, 318(1/2):229-234.
[19] Smith L D. The impact of limbautotomy on mate competition in blue crabsCallinectessapidusRathbun[J]. Oecologia, 1992, 89(4):494-501.
[20] Daleo P, Luppi T, Casariego A M, et al. The effect of size and cheliped autotomy on sexual competition between males of the mud crabCyrtograpsusangulatusDana[J]. Marine Biology, 2009,156(3):269-275.
[21] Smith L D. Effects of limbautotomy and tethering on juvenile blue crab survival from cannibalism [J]. Marine Ecology Progress,1995,116(1/3):65-74.
[22] Segal E, Roe A. Growth and behaviour of post-juvenileMacrobrachiumrosenbergii(de Man) in close confinement[J]. Proceedings of the World Mariculture Society, 1975,6(1/4):67-88.
[23] 董鹏生,刘青,吴旭干, 等. 中华绒螯蟹一龄性早熟和二龄成熟家系扣蟹阶段生长和早熟的比较研究[J].上海海洋大学学报,2016,25(1):51-60.
[24] 徐武杰, 潘鲁青, 岳峰, 等. 氨氮胁迫对三疣梭子蟹消化酶活力的影响[J]. 中国海洋大学学报, 2011,41(6):35-40.
[25] 江水恒, 徐善良, 邵波, 等. 野生和养殖三疣梭子蟹消化酶及SOD酶活性的比较分析[J]. 海洋渔业,2012, 34(2):163-167.
[26] 杨志刚, 阙有清, 纪连元,等. 以配合饲料替代杂鱼对中华绒螯蟹生长及消化酶活性的影响[J]. 大连海洋大学学报, 2013,28(3):293-297.
[27] 江水恒, 王丹丽, 邹秀, 等. 不同阶段三疣梭子蟹保护酶及消化酶活性研究[J]. 河北渔业, 2012(4):9-13.
[28] 常国亮, 吴旭干, 成永旭, 等. 不同脂类营养对中华绒螯蟹(Eriocheirsinensis)幼蟹生长、成活、肝胰腺指数和生化成分的影响[J]. 海洋与湖沼, 2008,39(3):276-283.
[29] 王辅明, 朱祥伟, 马永鹏, 等. 低浓度五氯酚暴露对稀有鮈鲫体内 SOD 活性、GSH和 HSP70 含量的影响[J]. 生态毒理学报, 2009, 4(3):415-421.
[30] 王卓, 么宗利, 林听听, 等. 碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP 和 AKP 酶活性的影响[J]. 中国水产科学, 2013,20(6):1212-1218.
ComparisonofGrowthPerformanceandActivitiesofDigestiveandImmuneEnzymeinSwimmingCrabPortunustrituberculatusunderGroupRearingandSingleRearingConditions
HE Jie1,2, XU Wenjun3, ZHENG Kuankuan2,3,XIE Jianjun1,2, SHI Hui1,2, WANG Gengshen1,2, WANG Wei1,2
( 1.Marine and Fisheries Research Institute of Zhejiang Province, Zhoushan 316021, China;2.Key Laboratory of Marine Culture and Enhancement of Zhejiang Province, Zhoushan 316021, China;3.Fishery School, Zhejiang Ocean University, Zhoushan 316002, China )
The comparison of growth performance and activities of digestive and immune enzymes was conducted in swimming crabPortunustrituberculatusreared under group rearing(GR, 10 inds/tank) and single rearing(SR, 1 ind/tank)conditions at water temperature of (27±3) ℃.The results showed that the cannibalism was serious in GR during the period of molting, with significantly higher total mortality rate and disability rate than in SR(P<0.05). There was significantly higher proportion of molting at night than that in daytime. However,there was significantly higher proportion of molting in GR than in SR(P<0.05). The crab juveniles in GR had significantly shorter molting period than the juveniles in SR did (P<0.05), and also had lower molt synchronization than in SR. The growth rate and specific growth rate in body weight and shell width in SR were slightly higher than in SR. There were higher activities of trypsin, lipase and amylase in hepatopancreas and stomach of juveniles in GR than those in SR, especially in hepatopancreas. The juveniles in GR had significantly higher activities of superoxide dismutase in hepatopancreas and haemolymph than the ones in SR did (P<0.05), with similar activities of acid phosphatase, and alkaline phosphatase in the two groups.
Portunustrituberculatus;rearing condition;growth;digestive enzyme;immune enzyme
10.16378/j.cnki.1003-1111.2017.05.007
2016-10-24;
2017-01-16.
浙江省科技厅计划项目(2016F50042,2015F30003);浙江海洋大学博士启动基金资助项目(22135010815);舟山市普陀区科技计划项目(2015YN209).
何杰(1985-), 男,博士;研究方向:虾蟹类健康养殖.E-mail:he_0902@126.com.通讯作者:许文军(1971-),男,教授;研究方向:海水健康养殖.E-mail: wjxu1971g@hotmail.com.
S965.252
A
1003-1111(2017)05-0585-06
