黄河鲤嗜水气单胞菌的分离、毒力及用药分析
2017-12-18赵贤亮巴新霞孔祥会
赵贤亮,陈 鹤,杨 潇,巴新霞,李 莉,孔祥会
( 河南师范大学 水产学院,河南 新乡 453007 )
黄河鲤嗜水气单胞菌的分离、毒力及用药分析
赵贤亮,陈 鹤,杨 潇,巴新霞,李 莉,孔祥会
( 河南师范大学 水产学院,河南 新乡 453007 )
自发病黄河鲤4种组织中分离致病菌,结合形态学和16S rDNA序列分析,发现分离到的细菌属气单胞菌属。回归感染试验发现,患病鱼体出现鳃盖等多处组织出血且伴随肠炎等症状,表明引起黄河鲤发病的致病菌为嗜水气单胞菌,命名为HNAh01。半致死密度测定发现,嗜水气单胞菌HNAh01的半致死密度为1.38×107cfu/mL。药敏结果表明,该致病性嗜水气单胞菌是典型的多重耐药嗜水气单胞菌,但对恩诺沙星极为敏感。因此,选择恩诺沙星对分离菌株进行体外药效学和用药分析试验。药效学试验表明,恩诺沙星对嗜水气单胞菌HNAh01的最小抑菌质量浓度为1.56 ng/mL,最小杀菌质量浓度为3.12 ng/mL,防耐药突变质量浓度为12.5 ng/mL,耐药选择窗的范围为1.56~12.5 ng/mL。用药分析结果显示,黄河鲤口服剂量为10 mg/kg时对嗜水气单胞菌HNAh01的相对保护率达83%。本文研究为嗜水气单胞菌的防治提供了理论基础与实践依据。
黄河鲤;嗜水气单胞菌;恩诺沙星;用药分析
黄河鲤(Cyrinuscarpio)是我国四大名鱼之一,其产业化迅速发展,在促进渔业经济及区域渔民增收上发挥着重要作用。但是,由于养殖生态环境恶化(水体污染、富营养化、高密度养殖等)导致各种病害频发,严重制约黄河鲤养殖业的可持续发展。嗜水气单胞菌(Aeromonashydrophila)作为一种条件性致病菌,其具有多种毒力因子及胞外产物,可引起鱼类、两栖类、爬行类等多种冷血动物和哺乳动物发病,是一种典型的人—畜—鱼共患病病原菌[1],一直是国内外学者研究的热点。嗜水气单胞菌可感染多种水产养殖鱼类,如草鱼(Ctenopharyngodonidellus)[2]、鲢鱼(Hypophthalmichthysmolitrix)[3]、鳙鱼(Aristichthysnobilis)[4]、鲤鱼[5]、鲫鱼(Carassiusauratus)[6]、麦穗鱼(Pseudorasboraparva)[7]、尼罗罗非鱼(Oreochromisniloticus)[8]和斑点叉尾(Ietaluruspunetaus)[9]等。
本研究从河南师范大学水产学院养殖基地获得患病黄河鲤,通过体表观察和剖检分析发病症状,对发病鲤的4种不同组织进行病原分离纯化,通过16S rDNA序列分析鉴定病原菌。选择病原菌进行回归感染、病原菌半数致死密度计算、药敏试验及用药分析,旨在为研究鲤鱼感染细菌性疾病及临床合理用药提供理论依据。
1 材料与方法
1.1 材料来源
病鱼采自河南师范大学水产学院养殖基地濒临死亡黄河鲤,体质量约50 g,体长约12.0 cm。患病鲤鱼鳃盖、鳍基等多处组织具有充血症状,解剖样品发现肠炎等症状。
1.2 主要试剂
细菌基础培养基、脑心浸液肉汤培养基、抗生素均购自上海生工生物工程有限公司,PCR相关试剂均为宝生物工程技术服务公司产品。引物及测序分析由上海生工生物工程有限公司完成。
1.3 菌株分离及16S rDNA测序验证
取患病鲤鱼的鳃、肠、肾和肝脏组织进行病原分离和纯化。观察细菌基础培养基上菌落生长的形态特征,并进一步用16S rDNA的PCR扩增引物(F:5′-AGAGTTTGATCATGGCTCAG-3′ 和R:5′-CTACGGTTACCTTGTTACGAC-3′)对其进行序列扩增。
PCR反应体系:模板DNA 1 μL,16S rDNA上下游引物各1 μL,dNTP 2.5 μL,PCR Buffer 2.5 μL,ExTaq 0.25 μL,ddH2O补足至25 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。将PCR产物送至上海生工生物工程有限公司测序。
将已得到的序列与GenBank进行序列相似性比对,确定其物种。
1.4 半致死密度测定
细菌在脑心浸液肉汤固体培养基上28 ℃培养16 h,挑取单菌落于新鲜脑心浸液肉汤液体培养基中过夜培养,再用无菌生理盐水(0.85%)按5倍梯度稀释,分别配成2×106~2.5×108cfu/mL 4个密度梯度的菌悬液。取50尾黄河鲤分为5组,每组10尾,分别于腹腔注射0.2 mL菌悬液,对照组每尾注射等体积生理盐水,鱼感染试验在20~26 ℃室温下进行。观察试验鱼发病症状,每12 h统计鱼的死亡情况,连续观察7 d。依据累计法(Reed-Muench法)[10]计算该病原菌的半数致死密度。
1.5 抗菌药物最小抑菌质量浓度和最小杀菌质量浓度测定
病原菌对常见抗生素的最小抑菌质量浓度测定采用96孔板进行。将2倍梯度稀释的抗菌药物分别加入至灭菌的96孔板中,第1至第11孔加药液,每孔10 μL,第12孔不加药液作为生长对照。过夜培养的菌液经脑心浸液肉汤培养基1∶1000稀释后(每孔约1×105~2×105cfu),向每孔中加100 μL,密封后置28 ℃培养箱中16~20 h,以能抑制细菌生长的最小药物质量浓度,即为最小抑菌质量浓度。从最小抑菌质量浓度以上的孔中取100 μL培养液,涂布于脑心浸液肉汤琼脂平板上,以菌落数不超过5个的最小药物质量浓度为最小杀菌质量浓度,试验重复3次。
1.6 防耐药突变质量浓度和突变选择窗的测定
防耐药突变质量浓度的测定参考文献[11]。将单菌落接种于脑心浸液肉汤培养基中,过夜培养后,菌液于3000 r/min离心5 min,将菌体悬浮于10倍原液体积的脑心浸液肉汤培养基中,震荡培养6 h,再次离心后将菌液密度用适量的脑心浸液肉汤培养基调整为3×1010cfu/mL。分别取调整好密度的菌液100 μL均匀涂抹在每个含有1~10 个最小抑菌质量浓度的恩诺沙星药物琼脂平板上,每个药物质量浓度4个平板。脑心浸液肉汤固体平板于30 ℃孵育72 h,以72 h后没有菌落生长的最低药物质量浓度即为恩诺沙星对该病原菌的防耐药突变质量浓度。突变选择窗的上界为防耐药突变质量浓度,下界为细菌的最小抑菌质量浓度,即突变选择窗的范围为最小抑菌质量浓度至防耐药突变质量浓度。
1.7 恩诺沙星的给药及细菌攻毒试验
将50 mg/mL的恩诺沙星溶液用无菌生理盐水稀释至0.625、1.25 mg/mL和2.5 mg/mL,健康黄河鲤分别口服0.2 mL药物,即口服剂量分别为2.5、5 mg/kg和10 mg/kg恩诺沙星,对照组以等体积无菌生理盐水代替。每日给药一次,连续给药6 d[12-13]。给药3 d后分别对各组试验鱼进行病原菌攻毒,每尾鱼注射0.2 mL 5×107cfu/mL HNAh01菌株。感染后每12 h观察黄河鲤的死亡情况,持续7 d。
恩诺沙星的相对保护率/%=[1-(治疗组死亡率/对照组死亡率)]×100%
2 结果与分析
2.1 病原菌分离鉴定
将发病鱼体的4种组织分离得到的病原菌在细菌基础固体琼脂培养基上28 ℃培养16 h后,菌落为园形,直径约1 mm,表面光滑,半透明,乳白色,中央隆起(图1)。
从4种组织平板中分别挑取单菌落培养并提取细菌基因组DNA,扩增16S rDNA基因序列,将PCR产物进行琼脂糖凝胶电泳,发现其片段长度约为1500 bp。PCR产物测序结果采用在线BLAST分析(http://blast.ncbi.nlm.nih.gov),结果发现分离菌序列与GenBank中多个已报道的嗜水气单胞菌序列同源性最高,达99%以上。结合分离菌的表型及分子生物学分析,判定该菌株为气单胞菌属。选取其中一株HNAh01作进一步的研究。
图1 病鱼鳃(a)、肠(b)、肾(c)和肝(d)的病原菌分离
2.2 菌株HNAh01毒力分析
人工感染试验表明,菌株HNAh01注射黄河鲤12 h后,5×107cfu/mL及2.5×108cfu/mL密度组首先出现死亡情况,攻毒48 h内,各个密度梯度中试验鱼分别出现不同数量的死亡,对照组全部正常。其中,24 h后,107cfu/mL密度组出现死亡,注射36 h后,2.5×108cfu/mL密度组鱼全部死亡(图2)。死亡鱼体从体表观察和剖检结果都表现出与自然发病相似的症状,主要表现为鳃盖、胸鳍、腹鳍等基部及多处内脏出血,确定感染鲤鱼的病原菌为嗜水气单胞菌。根据累计法计算嗜水气单胞菌HNAh01的半数致死密度为1.38×107cfu/mL,即每尾鱼注射约2.7×106cfu即会导致鱼体死亡50%。
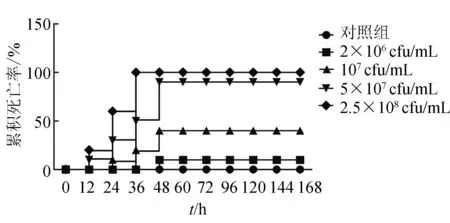
图2 嗜水气单胞菌HNAh01感染试验结果
2.3 耐药性分析
采用微量液体稀释法测定嗜水气单胞菌HNAh01对常见抗菌药物的最低抑菌质量浓度。以实验室一株敏感且低毒力菌株作为对照菌株[14],比较该分离菌株的耐药性。结果表明,嗜水气单胞菌HNAh01对链霉素、青霉素类抗生素和磺胺类抗生素均表现出较高耐药性(最小抑菌质量浓度≥64 μg/mL),且对巴洛沙星、庆大霉素、卡那霉素和头孢曲松钠也表现一定的耐药性(嗜水气单胞菌HNAh01最小抑菌质量浓度/对照菌株最小抑菌质量浓度≥4)。在所有受试的抗生素中,嗜水气单胞菌HNAh01仅对恩诺沙星和氟苯尼考表现出敏感性,特别是恩诺沙星的最小抑菌质量浓度为0.00156 μg/mL(表1)。这一结果可为发病鱼的药物防治提供用药依据,但其药物的剂量、效果还待进一步研究。

表1 嗜水气单胞菌HNAh01及对照菌株对常见抗生素的药敏试验结果
注:S,敏感,与对照菌株的最小抑菌质量浓度比≤4;R,耐药,与对照菌株的最小抑菌质量浓度比≥4;-,对照菌株和分离菌株均对此抗生素表现较强的耐药性.
2.4 恩诺沙星用药分析
微量液体稀释法及涂平板结果显示,恩诺沙星对嗜水气单胞菌HNAh01的最小抑菌质量浓度为1.56 ng/mL,最小杀菌质量浓度为3.12 ng/mL,最小杀菌质量浓度/最小抑菌质量浓度为2。防耐药突变质量浓度测定结果发现,恩诺沙星的防耐药突变质量浓度为12.5 ng/mL,突变选择窗的范围为1.56~12.5 ng/mL。这一结果暗示鱼体血液或肌肉中恩诺沙星质量浓度在达到12.5 ng/mL时,既能有效的发挥杀菌效果,又能减少恩诺沙星耐药菌株的发生概率。
[12-13]的研究,鲫鱼口灌5 mg/kg恩诺沙星时,血清中恩诺沙星的峰质量浓度达到(1.88±0.19) μg/mL,且血药质量浓度大于防耐药突变质量浓度发挥抗菌疗效的时间可达24 h以上。因此,选取3个质量浓度梯度的恩诺沙星剂量进行用药分析。健康黄河鲤分别口服2.5、5 mg/kg和10 mg/kg剂量的恩诺沙星,每日给药1次,连续给药6 d。给药3 d后,用5×107cfu/mL菌悬液感染健康黄河鲤,结果发现2.5、5 mg/kg和10 mg/kg恩诺沙星的相对保护率分别为33.3%、66.7%和83.3%,且给药组的鱼体死亡时间均推迟至少12 h,即攻毒24 h后鱼体才开始出现死亡情况(图3)。
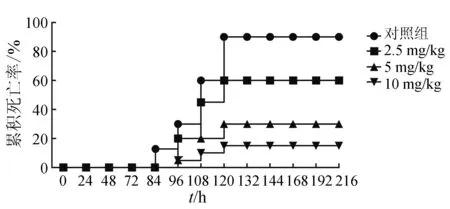
图3 口服不同剂量恩诺沙星的防治效果
3 讨 论
3.1 嗜水气单胞菌的毒力及耐药性
嗜水气单胞菌存在于许多水生动物的体表和鳃上,是鱼类最主要致病菌之一,可引起鱼类疥疮病、溃疡病、出血病、败血病等多种疾病,死亡率极高[15]。在我国淡水渔业养殖区,鱼类因感染嗜水气单胞菌发病的情况非常普遍,给水产养殖业造成了巨大的经济损失[16]。有研究发现,嗜水气单胞菌感染致病的杂交鲟(Husodauricus♀×Acipenserschrencki♂),出现体表发红、鳃丝溃烂、腹腔内脏出血、神经坏死弥散等症状[17]。在回归感染试验中,本研究分离到的嗜水气单胞菌HNAh01使试验鱼的胸鳍、腹鳍等基部及肛门充血,与自然发生的爆发症状表现一致。毒力研究表明,该菌株的半致死密度为1.38×107cfu/mL,与实验室对照菌株相比具有较强的致病性,因此其具有较高的研究价值。
在水产动物病害防治中,养殖者大量使用抗菌药物进行防治鱼类细菌性疾病。近年来,随着抗生素的大量使用,滥用或错用问题突出,水产致病菌包括嗜水气单胞菌的耐药现象越来越严重。在本研究中,分离到的嗜水气单胞菌HNAh01耐药情况十分严重,特别对链霉素、青霉素类抗生素和磺胺类抗生素均表现出较高耐药性,对巴洛沙星、庆大霉素、卡那霉素和头孢曲松钠也表现一定的耐药性,这一结果表明分离到的菌株是一株典型的多重耐药嗜水气单胞菌。在所有受试的抗生素中,嗜水气单胞菌HNAh01仅对恩诺沙星和氟苯尼考表现出敏感性。因此,在实际的生产实践中可以科学合理地使用恩诺沙星和氟苯尼考进行防治,以预防耐药菌株的产生与加重。
3.2 抗菌药物的用药分析
为了科学合理地使用抗菌药物进行水产动物病害的防治,以恩诺沙星为研究对象进行药物用量与药效的评估。恩诺沙星作为第三代喹诺酮类抗菌药物,在畜禽和水产养殖中应用广泛,具有口服吸收效果好、抗菌谱广、抗菌力强、作用迅速及与其他抗生素之间无交叉耐药性等特点[18-19]。在水产养殖用药过程中,要做到对水产养殖动物的精准用药,必须掌握致病菌对药物的敏感性,即最小抑菌质量浓度。根据抗菌药物有效血药质量浓度维持在最小抑菌质量浓度和防耐药突变质量浓度之间,且不对机体产生毒害作用的评价标准,本研究采用3个给药剂量且采取攻毒前和攻毒后连续给药的模式,结果表明,口服10 mg/kg的恩诺沙星后可以起到极好的治疗效果,且停药3 d后鱼体基本不会再出现发病症状。这一结果与徐丽娟等[12-13,20]的研究结论相似。
在水产养殖过程中,针对不同地区、不同时期及发病细菌的种类进行流行病学调查,适当调整药物剂量及种类的用药方案,结合不同药物在鱼体内的药物代谢动力学和药效学研究,不仅做到科学的“精准用药”模式,在应用中具有较好的用药效果,同时也极大缓解水产养殖动物致病菌的耐药问题。本文主要探讨恩诺沙星用药剂量及用药效果,该试验结果可为研究鲤鱼源嗜水气单胞菌分离鉴定及临床选药提供参考,为水产养殖精准用药提供依据。
参考文献:
[1] Rahim Z, Sanyal S C, Aziz K M, et al. Isolation of enterotoxigenic, hemolytic, and antibiotic-resistantAeromonashydrophilastrains from infected fish in Bangladesh[J]. Applied and Environmental Microbiology, 1984, 48(4):865-867.
[2] Mao W F, Wang Y, Wang W B, et al. Enhanced resistance toAeromonashydrophilainfection and enhanced phagocytic activities in human lactoferrin-transgenic grass carp (Ctenopharyngodonidellus)[J]. Aquaculture, 2004, 242(1):93-103.
[3] Dar G H, Dar S A,Kamili A N, et al. Detection and characterization of potentially pathogenicAeromonassobriaisolated from fishHypophthalmichthysmolitrix(Cypriniformes:Cyprinidae)[J]. Microbial Pathogenesis, 2016(91):136-140.
[4] 孙承文, 任燕, 石存斌, 等. 鲢鳙鱼源致病性嗜水气单胞菌的分离、鉴定[J]. 广东农业科学, 2010, 37(9):5-8.
[5] Gopalakannan A, Arul V. Immunomodulatory effects of dietary intake of chitin, chitosan and levamisole on the immune system ofCyprinuscarpioand control ofAeromonashydrophilainfection in ponds[J]. Aquaculture, 2006, 255(1):179-187.
[6] Brenden R A, Huizinga H W. Pathophysiology of experimentalAeromonashydrophilainfection in goldfish,Carassiusauratus(L.)[J]. Journal of Fish Diseases, 1986, 9(2):163-167.
[7] 贺文旭, 毛会丽, 杨利敏, 等. 豫北地区主要淡水鱼类感染嗜水气单胞菌的流行病学调查[J]. 水产科学, 2016, 35(3):278-283.
[8] Pridgeon J W, Klesius P H, Song L, et al. Identification, virulence, and mass spectrometry of toxic ECP fractions of West Alabama isolates ofAeromonashydrophilaobtained from a 2010 disease outbreak[J]. Veterinary Microbiology, 2013, 164(3):336-343.
[10] Thakur A K, Fezio W L. A computer program for estimating LD50and its confidence limits using modified Behrens-Reed-Muench cumulant method[J]. Drug and Chemical Toxicology, 1981, 4(3):297-305.
[11] Sindelar G, Zhao X, Liew A, et al. Mutant prevention concentration as a measure of fluoroquinolone potency against mycobacteria[J]. Antimicrobial Agents and Chemotherapy, 2000, 44(12):3337-3343.
[12] 徐丽娟, 权可艳, 王浩, 等. 恩诺沙星控制嗜水气单胞菌性鲫败血症的防耐药用药方案[J]. 中国水产科学, 2013, 20(3):635-643.
[13] 王浩, 权可艳, 徐丽娟, 等. 恩诺沙星控制草鱼维氏气单胞菌的用药方案[J]. 淡水渔业, 2013, 43(2):48-53.
[14] Wang M, Zhao X, Kong X, et al. Molecular characterization and expressing analysis of the c-type and g-type lysozymes in Qihe crucian carpCarassiusauratus[J]. Fish & Shellfish Immunology, 2016(52):210-220.
[15] 陆承平. 致病性嗜水气单胞菌及其所致鱼病综述[J]. 水产学报, 1992,17(3):282-288.
[16] Zhang X, Yang W, Wu H, et al. Multilocus sequence typing revealed a clonal lineage ofAeromonashydrophilacaused motileAeromonassepticemiaoutbreaks in pond-cultured cyprinid fish in an epidemic area in central China[J]. Aquaculture, 2014(432):1-6.
[17] 徐祥, 李华, 叶仕根, 等. 杂交鲟嗜水气单胞菌病的组织病理学研究[J]. 大连海洋大学学报, 2014,29(3):227-231.
[18] 刘开永, 汪开毓. 恩诺沙星在水产中的应用与研究[J]. 中国兽药杂志, 2004, 38(10):32-34.
[19] 黄文祥, 邓文武. 恩诺沙星在水产动物体内药物代谢的研究概况[J]. 中国实用医药, 2009, 4(12):233-234.
[20] 张雅斌, 刘艳辉, 张祚新, 等. 恩诺沙星在鲤体内的药效学及药动力学研究[J]. 大连水产学院学报, 2004, 19(4):239-242.
Isolation,Virulence,ResistanceandMedicationofAeromonashydrophilafromCommonCarpCyprinuscarpio
ZHAO Xianliang, CHEN He, YANG Xiao, BA Xinxia, LI Li, KONG Xianghui
( College of Fisheries, Henan Normal University,Xinxiang 453007, China )
A pathogenic bacterial strain was isolated from four tissues of common carpCyprinuscarpiosuffering from hemorrhagic septicemia. Combined with the morphological characteristics and the 16S rDNA sequence analysis showed that the identified isolate belongs toAeromonashydrophila, named HNAh01. Recurrent infection showed that the LD50was 1.38×107cfu/mL after artificial infect healthy common carp with hemorrhages at the base of pectoral and pelvic fins. The drug sensitivity test revealed that HNAh01 was a typical multi-drug resistantA.hydrophila. However, the pathogen was extremely sensitive to enrofloxacin and the minimum inhibitory concentration (MIC) was 1.56 ng/mL, the minimum bactericidal concentration (MBC) was 3.12 ng/mL, mutant prevention concentration (MPC) was 12.5 ng/mL, and drug selection window (MSW) in the range of 1.56—12.5 ng/mL. Medication showed that once-daily dose of 10 mg/kg for 6 d the relative protection ratio (RPS) was amounted to 83%. The methods described in this study also can be used for developing dose guidelines for other anti-bacterial drugs for the prevention and treatment ofA.hydrophila.
Cyrinuscarpio;Aeromonashydrophila; enrofloxacin; medication
10.16378/j.cnki.1003-1111.2017.05.017
2016-08-29;
2016-10-10.
国家自然科学基金资助项目(31502204);广东省海洋生物技术重点实验室开放基金资助项目(GPKLMB201503).
赵贤亮(1983—),男,博士;研究方向:水产动物免疫与病害防治.E-mail:zxl830724@163.com.通讯作者:孔祥会(1968—),男,博士;研究方向:水产动物免疫与病害防治.E-mail:xhkong@htu.cn.
S917.1
A
1003-1111(2017)05-0642-05
