催产激素对半滑舌鳎卵巢生化成分及血浆生殖激素水平的影响
2017-12-18张玉祥吴艳庆姜海滨刘立明杜荣斌
张玉祥,吴艳庆,姜海滨,刘立明,杜荣斌
( 1.烟台大学 海洋学院,山东 烟台 264005; 2.中国水产科学研究院 东海水产研究所,上海 200090;3.山东省海洋资源与环境研究院,山东 烟台 264006 )
催产激素对半滑舌鳎卵巢生化成分及血浆生殖激素水平的影响
张玉祥1,吴艳庆2,姜海滨3,刘立明1,杜荣斌1
( 1.烟台大学 海洋学院,山东 烟台 264005; 2.中国水产科学研究院 东海水产研究所,上海 200090;3.山东省海洋资源与环境研究院,山东 烟台 264006 )
在人工蓄养条件下,对半滑舌鳎注射催产激素(促黄体生成激素释放激素类似物和绒毛膜促性腺激素),研究其卵巢生化成分、血浆生殖激素水平及产卵效果的影响。通过对亲鱼采用不注射、一次性注射、二次注射的3种处理,并采用生化方法和双抗体放射免疫法分别测定了卵巢中总蛋白、粗脂肪、总糖、水分含量和血浆中甲状腺素、促卵泡成熟激素、促黄体生成激素含量的变化。试验结果表明,注射催产激素后的亲鱼,卵巢迅速发育并完成物质积累,其中粗脂肪和总糖含量均随卵巢的发育成熟而显著增高(P<0.05),产卵完成后明显下降;总蛋白的含量为6.13%~7.07%;水分含量最高,随卵巢发育成熟,先由78.78%降至64.81%,产后升至72.56%。催产剂注射24 h后可使血浆甲状腺素含量显著升高(P<0.05),有效时间可持续24 h以上,且二次注射有利于维持较高的血浆甲状腺素含量。对照组促卵泡成熟激素和促黄体生成激素含量均持续降低,注射组促卵泡成熟激素含量在24~36 h时上升,此后明显下降,促黄体生成激素含量变化对催产激素最为敏感,注射后12 h即明显上升,二次注射组的促黄体生成激素含量显著高于其他两组(P<0.05)。因此,催产激素注射可促进血浆生殖激素水平升高,且二次注射的作用更为明显。催产激素注射还可显著提高总产卵量、上浮卵量和浮卵率,且二次注射效果亦显著优于一次性注射(P<0.05)。
半滑舌鳎;催产激素;卵巢生化成分;生殖激素;产卵效果
半滑舌鳎(Cynoglossussemilaevis)属鲽形目、舌鳎科、舌鳎属,俗称牛舌头、鳎目、鳎米、龙力等,主要分布于我国的黄渤海、东海以及朝鲜、日本沿海,是一种名贵海水经济鱼类。半滑舌鳎雌雄的个体生长速度与性腺大小差异均极为悬殊,雌鱼生长速度快,卵巢发达,而雄鱼个体小,精巢退化,繁殖能力弱,自然资源量较低。自2002年半滑舌鳎人工苗种繁育技术获得突破以来,其养殖产业发展迅速,市场价格坚挺,目前年养殖产量已达万吨,年产值达20多亿元,已成为我国重要的海水养殖鱼类之一[1]。
我国目前对半滑舌鳎繁殖生物学的研究,在亲鱼性腺的分化[2]、精巢形态和组织结构及生殖细胞特征[3]、精子发生[4]和胚胎发育组织学[5]、温度对性腺组织发育的影响[6]、卵巢发育及其产卵类型[7]、卵巢发育的组织学和数量形态特征[8]等方面已有较多报道,但对其生殖内分泌生理的研究较少。以往研究表明,鱼类在排卵前血液中促性腺激素含量会急剧增加,以此调控性类固醇激素的合成和释放,促进性腺的发育与成熟[9-12]。另外,甲状腺素也被认为与鱼类的繁殖有密切的关系[13]。对半滑舌鳎的研究发现,在亲鱼产卵过程中,血清促性腺激素水平也表现为产卵前较低,临产前和产卵时明显上升的趋势[14],这与其他鱼类有类似的规律[15-16]。目前,与鱼体生殖激素生理功能相似的促黄体生成激素释放激素类似物和绒毛膜促性腺激素已广泛应用于多种鱼类的人工繁殖[17-19],据报道,促黄体生成激素释放激素类似物+绒毛膜促性腺激素+地欧酮对尼罗罗非鱼(Oreochromisniloticus)有的较好催产效果[18],地欧酮和促黄体生成激素释放激素类似物对奥利亚罗非鱼(O.aurea)的催产效果最佳[19]。但关于外源催产剂对半滑舌鳎血浆甲状腺素、促卵泡成熟激素、促黄体生成激素含量及性腺生化指标的影响尚未见报道。本文研究了催产激素注射后半滑舌鳎卵巢主要生化成分和血浆生殖激素水平的变化,及其对产卵效果的影响,以期丰富鱼类繁殖生理学内容,优化人工繁殖技术,为半滑舌鳎的人工繁育及渔业资源保护提供参考。
1 材料与方法
1.1 试验用鱼及培育
试验所用半滑舌鳎为山东东方海洋科技股份有限公司莱州育苗场人工养殖的3龄雌性亲鱼,共计24 尾,全长61.0~69.8 cm,体质量1600.0~2345.0 g;并按1∶1.5的雌雄比例挑选性成熟的3龄雄性亲鱼36尾,全长24.5~32.1 cm,体质量275.0~351.0 g。亲鱼蓄养于4 m×4 m×1.2 m的室内水泥池中,约于产卵前2个月开始进行强化培育,采用人工光温调控、饵料强化,并结合催产剂注射的方式以促进亲鱼性腺发育与产卵。培育水温由20 ℃逐渐升至25 ℃,约每10 d增加1 ℃,并使用黑色遮光幕和白炽灯进行光照度和光周期的调节,控制水面光照度为200~300 lx,光照时间由8 h/d逐渐增至12 h/d,每10 d增加1 h,日循环水量400%,并持续充气,pH 6.89~7.28。日投喂2次鲜活生物饵料(如沙蚕、贝肉等),日投饵率为2%~3%。
1.2 试验设计
以促黄体生成激素释放激素类似物和绒毛膜促性腺激素为催产剂,雌鱼注射总剂量为促黄体生成激素释放激素类似物0.20 μg/kg和绒毛膜促性腺激素 500 IU/kg;雄鱼注射剂量为雌鱼的1/2。
选取15尾雌性亲鱼进行卵巢主要生化成分的测定,分A1、B1、C1、C2、C35组,每组3尾亲鱼,A1组:不注射催产激素(对照组),取样时间计为0 h;B1组:0 h时注射1次催产激素,注射24 h后取样;C1组:0、24 h各注射1次,每次注射剂量为总剂量的1/2,36 h时取样;C2组:0、24 h各注射1次,每次注射剂量为总剂量的1/2,48 h时取样;C3组:0 h、24 h各注射1次,每次注射剂量为总剂量的1/2,60 h时取样。取样时,剪取部分卵巢组织,用精确度为0.001 g的Lucky LQ-B2003电子秤称量质量后放入聚乙烯密封袋中,于冰柜中-40 ℃冷冻保存。
另取9尾雌性亲鱼测定血浆生殖激素水平的变化,设置A、B、C 3组,每组3尾雌鱼,其中A组不注射催产剂(对照组);B组进行一次性注射;C组分两次注射,每次注射剂量为总剂量的1/2;雄性亲鱼仅注射1次。在各组采集第1次血样后,B、C组立即进行第1次注射,24 h后C组进行第2次注射。分别在试验开始后的0(首次注射前)、12、24、36、48、60 h对3组亲鱼进行血样采集。
自第1次催产剂注射后36 h开始至试验结束期间,对3组亲鱼进行人工采卵。期间随时检查卵巢发育、对卵巢充盈的亲鱼进行多次挤卵和人工授精,统计并记录每尾亲鱼的最终总产卵量与上浮卵量,计算浮卵率(见1.5)。
1.3 卵巢生化成分测定
分别采用苯酚—硫酸法测定卵巢中总糖含量[20],索氏抽提法测定卵巢中粗脂肪含量[21],凯氏定氮法测定卵巢组织中的总蛋白含量[22],直接烘干称量质量法测定卵巢组织中的水分含量[23]。
1.4 血液取样与激素含量测定
分别在各取样时间点从半滑舌鳎雌鱼的尾静脉处用2.0 mL注射器抽取血液1~2 mL于2.0 mL离心管中,并加入质量浓度2.5×10-3mg/L的肝素钠溶液0.1 mL,4 ℃下10 000 r/min离心5 min,用移液枪吸取上清液于另一个2.0 mL离心管中,置于冰柜中-40 ℃冷冻保存备用。
雌鱼血浆中甲状腺激素、血浆促卵泡成熟激素、血浆促黄体生成激素含量采用双抗体放射免疫测定法测定[24]。样品由北京华英生物技术研究所测定完成,试验中抗原以放射性同位素(125I)标记,采用此3种激素的放射免疫试剂盒(北京华英生物技术研究所生产)和γ-911全自动放免计数仪(中国科技大学实业总公司生产)测量反应后反应系中的放射免疫强度(cpm),再经过计算求得甲状腺素(ng/mL)、促卵泡成熟激素(mIU/mL)和促黄体生成激素(mIU/mL)的含量。
1.5 数据处理与分析
浮卵率/%=上浮卵量/总产卵量×100%
采用Excel 2013软件进行数据处理,使用SPSS 17.0统计软件进行单因素方差分析,并采用Duncan′s法进行多重比较,以P<0.05为各组之间差异显著,使用Origin 9.0进行绘图。
2 结 果
2.1 亲鱼卵巢主要生化成分的变化
卵巢组织中总蛋白、粗脂肪、总糖和水分含量的变化见图1。各试验组卵巢中总蛋白含量最为稳定,其含量为(6.13±0.05)%~(7.07±0.08)%,各组之间差异不显著(P>0.05);注射催产剂之后,总糖的含量出现了最为明显的变化,C组均显著高于A1组和B1组,C1和C2组的含量约为注射前A1组的2倍以上,但二者之间差异不显著(P>0.05),C1组达到峰值(4.70±0.08)‰,C3组显著降至(4.29±0.12)‰ (P<0.05);各组粗脂肪含量也出现了明显的变化,C1和C2组粗脂肪含量显著高于其他组(P<0.05),C2组达高峰值(12.28±3.09)%,C3组出现显著下降,锐减至(7.74±1.87)%的水平,且与激素注射前的含量之间无显著差异(P>0.05);水分含量自B1组开始出现显著的下降,由(77.58±3.33)%降至C2组的(64.81±2.55)%,直至C3组时又升至(72.56±5.26)%。
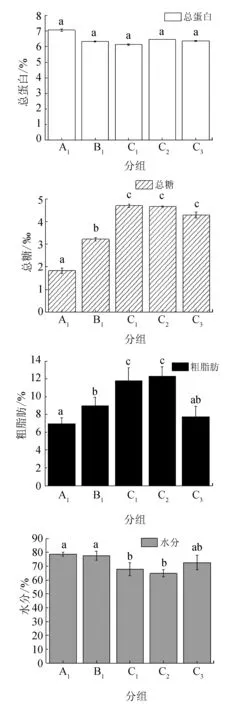
图1 卵巢主要生化成分的变化
数值为平均值±标准差(n=3),不同字母表示差异显著(P<0.05).
2.2 亲鱼血浆生殖激素含量的变化
2.2.1 甲状腺素含量的变化
雌鱼血浆中甲状腺素含量的变化见图2。试验期间,A组的甲状腺素含量最低且变化最小,仅24 h时的含量达到(9.21±1.62) ng/mL,其余5次测定值为7.83~8.99 ng/mL,相互间差异不显著(P>0.05)。B组的甲状腺素含量在第1次注射后24 h时显著上升(P<0.05),达(9.86±1.51) ng/mL,并且在之后的至少12 h内维持了较高水平,48 h时显著下降(P<0.05)。与B组相似,C组甲状腺素含量在首次注射后24 h也出现显著上升(P<0.05),而且第2次注射(24 h)后一直维持在较高含量,60 h时达最高值(10.45±0.78) ng/mL。试验最初的24 h,3组的甲状腺素含量差异不显著(P>0.05);36 h时, B、C两组显著高于A组;此后,C组显著高于A、B组(P<0.05)。
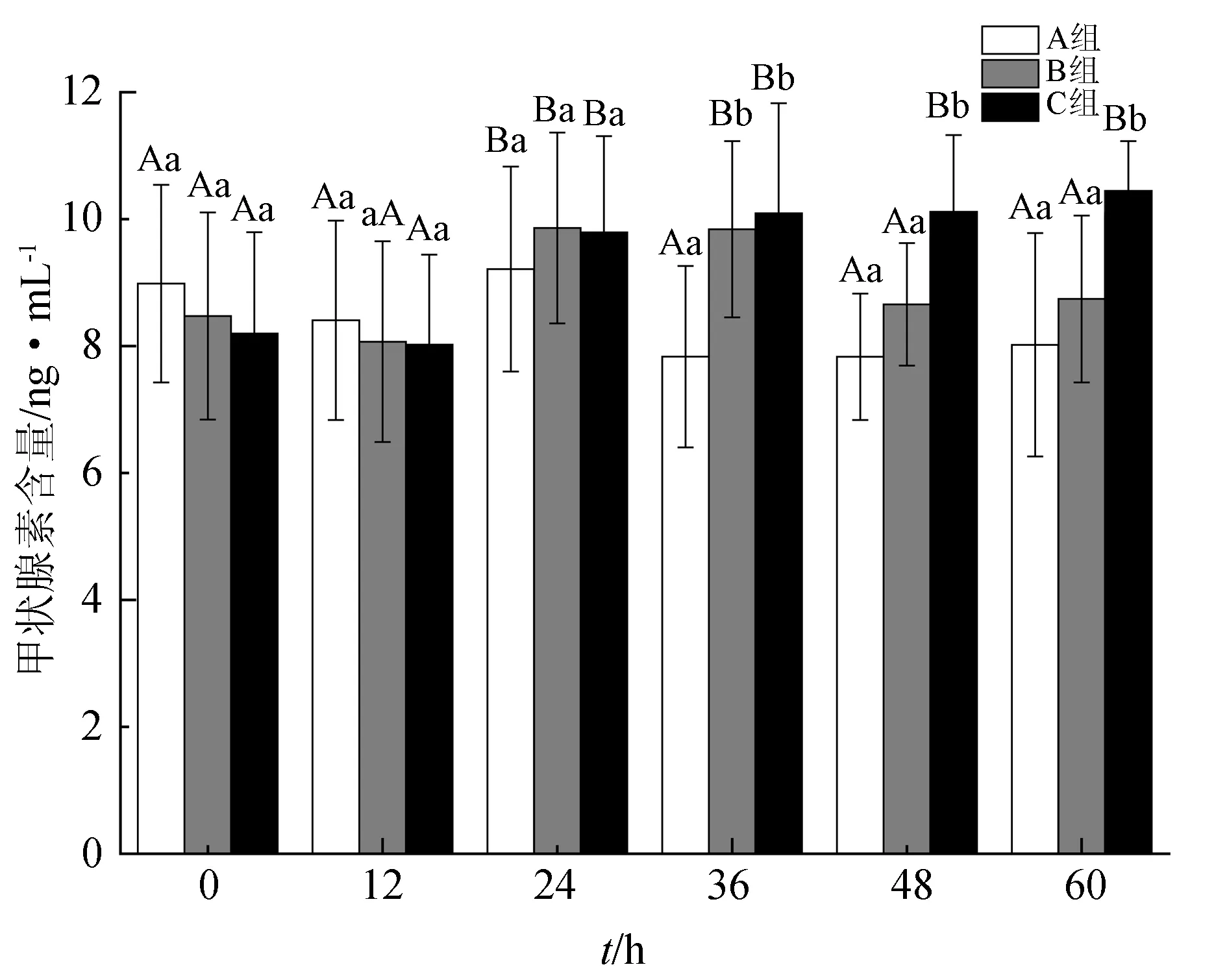
图2 血浆甲状腺素含量的变化
数值为平均值±标准差(n=3)表示,各组不同取样时间的显著性差异用不同大写字母表示(P<0.05);同一取样时间各组的显著性差异用不同小写字母表示(P<0.05).下同.
2.2.2 促卵泡成熟激素含量的变化
雌鱼血浆中促卵泡成熟激素含量的变化见图3。试验开始后,A组(空白对照组)促卵泡成熟激素含量持续降低,由最初的(20.73±2.99) mIU/mL降至60 h时的(18.24±2.27) mIU/mL,但相互差异并不显著(P>0.05)。B组在注射后12 h内无明显变化,24 h时出现显著上升,并达到峰值(21.38±2.30) mIU/mL(P<0.05),此后持续下降至与注射前相近的水平。C组的促卵泡成熟激素含量在首次注射后24 h内并未出现显著上升(P>0.05),但第2次注射后,在36 h时即显著升高(P<0.05),之后持续下降至最低值(18.38±2.71) mIU/mL(60 h)。3组的促卵泡成熟激素含量仅在24 h和36 h时出现显著差异(P<0.05),其他时间差异并不显著(P>0.05)。
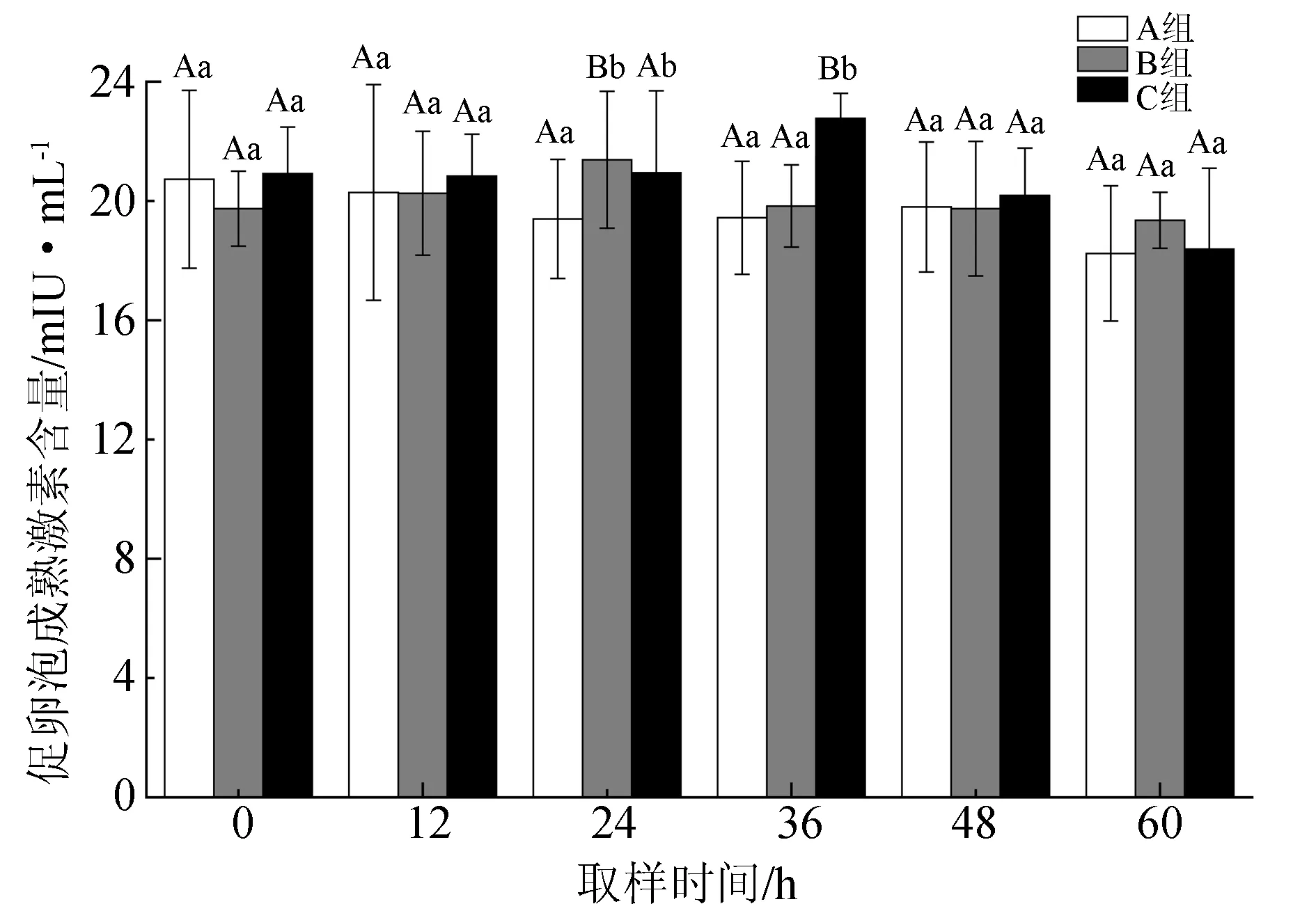
图3 血浆促卵泡成熟激素含量的变化
2.2.3 促黄体生成激素含量的变化
雌鱼血浆中促黄体生成激素含量的变化见图4。A组促黄体生成激素含量为27.28~29.14 mIU/mL,整体表现出略微下降的趋势,但并无显著性差异(P>0.05)。B组在注射后12 h时即出现显著上升(P<0.05),且显著高于对照组(A组)(P<0.05),24 h时便显著降至与未注射时相近的水平(P<0.05),之后持续降低。C组促黄体生成激素含量分别在二次注射后12 h各出现1次明显升高,第1次达到(31.88±1.69) mIU/mL(12 h),显著高于对照组(A组)(P<0.05);第2次达到(33.06±2.00) mIU/mL的峰值(36 h),此后虽明显下降(P<0.05),但均显著高于A、B两组(P<0.05)。
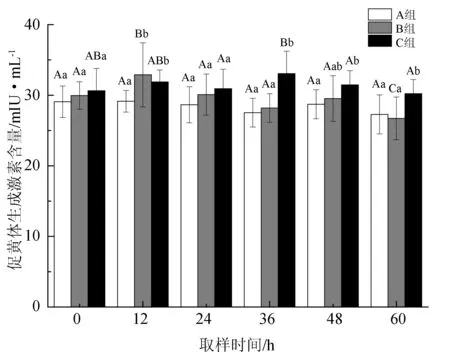
图4 血浆促黄体生成激素含量的变化
2.3 亲鱼的产卵量与浮卵率
各组亲鱼产卵量与浮卵率见表1。3组亲鱼的总产卵量之间差异显著(P<0.05),由A组到C组的产卵量呈现大幅度增加,增长率达到24.88%;3组之间的上浮卵量差异显著(P<0.05),C组是A组的逾1.5倍;A、B两组的浮卵率无显著差异,但均显著低于C组(P<0.05)。
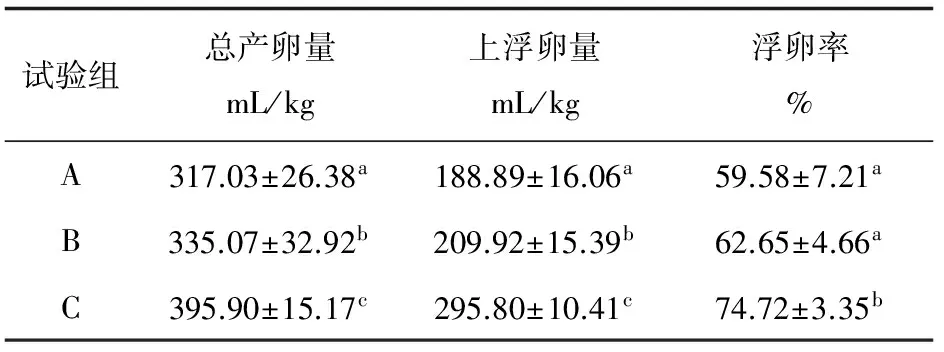
表1 亲鱼产卵量与浮卵率
注:表中数据为各组亲鱼测定数据的平均值±标准差,具有相同字母上标的同一列数据之间无显著差异(P>0.05).
3 讨 论
3.1 注射催产激素对卵巢主要生化成分变化的影响
已有研究表明,脂类对卵巢和胚胎的发育具有十分重要的作用,不仅作为亲体重要的能量来源和营养物质,也是构成卵黄蛋白原和卵黄磷脂蛋白的重要成分[25];亲鱼饲料中的脂肪含量或脂肪酸水平对其产卵量有明显影响,通常是在亲鱼饵料中添加卵磷脂、高度不饱和脂肪酸(特别是二十二碳六烯酸)等进行营养强化[26-27]。不同鱼类卵巢内粗脂肪的含量差异较大,比如凤鲚(Coiliamystus)成熟卵巢的脂肪含量为20.96%[28],异育银鲫(Carassiusauratusgibelio)Ⅳ期卵巢内脂肪的平均含量仅为2.62%[29],这种差异不仅与产卵类型和主要供能物质有关,还与卵巢发育阶段有关。据报道,在鱼类卵巢发育、成熟过程中,脂肪能够不断积累,含量持续升高,为卵母细胞的发育提供物质基础和能量来源[30]。本试验中,通过催产剂的注射可以显著促进粗脂肪的积累,二次注射效果优于一次性注射,卵巢中粗脂肪含量可由注射前的(6.97±0.67)%升至最高(12.28±1.09)%(图1),进而促进卵巢的发育成熟。自然条件下,半滑舌鳎雌鱼卵巢发育过程中粗脂肪的积累需要至少1个月的时间[8],而通过催产剂的注射可缩短卵巢中粗脂肪积累的时间,催产剂注射后36~48 h内便可完成脂肪的最终积累,这对于促进卵巢营养物质的快速积累和卵母细胞的最终发育成熟具有重要的意义。到采卵结束时,粗脂肪含量已大幅下降(图1 C3组),这是由卵巢中脂质含量较高的成熟卵子已基本排空所造成的。有研究表明,鱼类卵巢成熟过程中脂肪的积累直接来源于食物,或者由体内肝脏、肠系膜等组织器官中的脂肪间接转移而来[31]。由于催产期间并未投饵,因此卵巢中的脂肪主要来自体内的转移,因此可以认为催产剂在脂肪转移过程中扮演重要的角色,这与解竞静[32]的研究结果相一致。
蛋白质是卵巢中的又一重要营养物质,试验期间测得的各组亲鱼卵巢总蛋白的含量为(6.13±0.03)%~(7.07±0.05)%,变化并不明显。这可能是由于半滑舌鳎卵巢中的蛋白质在注射催产剂之前的Ⅳ期末已完成积累,外源激素并不能对卵巢中蛋白的积累产生明显的作用。对鲢鱼(Hypophthalmichthysmolitrix)的研究证实,卵巢中的蛋白质主要来源于食物,而不是体内的转移[33],因而催产剂并不能发挥类似于对脂肪积累的作用。其他鱼类则表现出不同的变化规律,例如长薄鳅(Leptobotiaelongata)卵母细胞内的蛋白质含量呈现出先下降后逐渐上升的规律[42],黄颡鱼(Pelteobagrusfulvidraco)则是随卵巢发育迅速增加,Ⅴ期达到最高值,产卵后下降[34]。不同鱼类卵巢内蛋白质变化规律的差异可能与鱼类卵巢发育过程中主要供能物质和卵黄生成方式的不同有关[35]。
卵巢中总糖的含量较低,最高值为(4.70±0.08)‰,其变化规律与脂类类似,催产剂可促进其含量的显著升高,在采卵结束后明显下降。在卵巢的发育过程中总糖是代谢的主要能量来源,尤其产卵时会消耗大量能量,由于催产激素可以促进甲状腺素的分泌(图2),进而促进鱼体代谢,导致总糖含量的升高,而产卵结束后(C3组),估计代谢强度的下降是造成总糖含量降低的直接原因。
鱼类卵巢中水分的含量最高,而卵子的含水量是决定鱼类卵子沉性或浮性的最关键因素,浮性卵的含水量明显高于黏性卵[36]。试验中对照组(A1组)亲鱼卵巢的含水量最高,达(78.78±1.46)%,而C2组达最低值(64.81±2.55)%,这可能是由于注射催产剂后,卵巢内粗脂肪、总糖等营养物质的迅速积累和卵母细胞的快速发育、成熟,导致其中水分含量的相对下降。产卵完成后(C3组)水分含量上升,这可能是因为产卵使卵巢中的总蛋白、粗脂肪和总糖等有机营养物大量减少,从而使得水分的含量相对升高。
3.2 注射催产激素对血浆生殖激素水平变化的影响
甲状腺激素存在于所有的脊椎动物中,包括三碘甲状腺原氨酸和甲状腺素。已有研究发现,甲状腺素不仅在鱼类(尤其是鲆鲽类)的早期变态过程中发挥生理效能[37],在鱼类生活史的各个时期均有重要的调节作用[38],甲状腺激素往往作用于性腺发育的全部过程,不仅可以诱导卵母细胞的发育,还能促进卵母细胞的最后成熟及排卵[39]。有研究表明,甲状腺激素含量在鱼类性腺发育的早期和繁殖前期均较高,它不仅参与诱导肝脏内卵黄蛋白原的生成和物质积累,还可以促进卵巢内卵黄蛋白原受体的表达,而在繁殖过程中又会降至基础水平[40-41]。不仅如此,甲状腺素还会对促黄体生成激素释放激素类似物产生影响,甲状腺素含量的升高可以增加其排卵作用[42]。本试验表明,催产剂注射24 h之内即可发挥作用,促使半滑舌鳎雌鱼血浆甲状腺素含量显著升高,首次注射有效时间可持续24 h以上,二次注射则有利于延长有效时间并维持较高的血浆甲状腺素含量(图2)。这种生理效能不仅可以促进卵母细胞的成熟,对提高亲鱼肝脏的生理活性,促进肝脏内卵黄原的发生,加快物质的积累和能量储存也有重要意义[43-44]。
促卵泡成熟激素不仅能促进鱼类卵泡生长、发育、成熟,还能促使卵巢产生性类固醇激素来调节早期卵子、精子的发生和卵黄的生成,进而直接促进卵巢的生长,增加卵巢的质量[45],而促黄体生成激素释放激素类似物和绒毛膜促性腺激素等催产剂则可以促进促卵泡成熟激素的分泌。本试验中,催产剂注射24 h之内便可发挥作用,促进半滑舌鳎雌鱼血浆促卵泡成熟激素含量显著升高,首次注射的有效时间至多维持12 h,二次注射则可显著延长有效时间(36 h以上)并维持较高的血浆含量,直至48 h后开始下降(图3)。关于促卵泡成熟激素对卵巢的作用,已有学者提出了阈值(促使卵泡发育的最低激素含量)和阈值窗(激素含量持续在阈值以上的时间)的概念[46]。因为阈值窗的长短决定了成熟卵泡的数量,所以延长阈值窗对促进单个卵泡发育成熟和诱发多个卵泡同时成熟均具有重要作用[47]。半滑舌鳎在产卵过程中,对照组促卵泡成熟激素含量持续下降,这可能是由卵细胞发育成熟对其不断地消耗造成的,因为激素需要与卵巢内的受体结合才能发挥生理作用[48-49]。目前关于硬骨鱼类促卵泡成熟激素阈值大小的研究尚未见报道,由对照组亲鱼也能够产卵的情况推测,产卵时血浆中激素含量肯定在阈值水平以上,而注射催产剂则可提高其水平,并能延长其高含量的持续时间(36 h以上),也就延长了阈值窗,尤其是二次注射时效果更佳。
促黄体生成激素是诱发鱼类排卵的主要因素之一, 其主要作用为与促卵泡成熟激素协同促进卵泡生长成熟,调节类固醇激素分泌和精卵的发生[45]。本研究发现,对照组促黄体生成激素含量持续降低,其含量变化对催产激素最为敏感,注射后12 h即显著升高(图4),这说明注射催产激素对鱼体促黄体生成激素的分泌具有显著的促进作用。促黄体生成激素主要作用于性腺发育的中后期,在亲鱼性腺发育到第Ⅳ期时,提高亲鱼血液中促黄体生成激素的含量对促进卵巢的进一步发育、卵母细胞的成熟和排卵都有较大的促进作用[11-12]。B组亲鱼在激素注射后,血浆促黄体生成激素维持较高水平的时间不超过24 h,而C组亲鱼在第2次注射后血浆的激素含量达到峰值,并一直显著高于A、B两组,这表明二次注射对其分泌的促进作用明显优于1次注射,进而对卵巢发育的促进效果也是最好的。
3.3 催产激素注射对亲鱼产卵效果的影响
已有研究表明,注射多种类型的催产激素都可以显著提高亲鱼的产卵率、卵子受精率和孵化率等[50-53]。试验中的3组亲鱼虽然都有产卵反应,但是注射催产激素可显著提高亲鱼的产卵量,且二次注射对于提高浮卵率、改善卵质的效果更好。这是由于催产剂可以促进粗脂肪、总糖等卵巢营养物质的快速积累和生殖相关激素的分泌,从而对卵子的成熟度、卵质、受精率等产生积极的影响。C组首次产卵时间比A、B两组更早,在36 h时即可人工挤卵,且挤卵过程顺畅,每次产卵量较高,产卵时间也较为同步,这是由于在催产剂注射后,C组亲鱼血浆中的甲状腺素、促卵泡成熟激素和促黄体生成激素等生殖激素均在较长时间内维持了较高的含量,延长了激素作用的阈值窗时间,卵巢发育受到更为持久的激素刺激,因而有更多卵母细胞同步成熟和更多的成熟卵子同时排放;而A组亲鱼因为卵巢发育不同步,导致个体间产卵量差异悬殊,还存在首次产卵时间推迟(36~48 h时产卵)、产卵次数多、每次产卵量少、产卵不同步等情况,甚至数次出现卵中带血、挤卵困难的现象。另外,A组多次反复挤卵也对亲鱼的性腺、内脏器官等造成了较大的物理损伤,部分亲鱼甚至出现挤卵后体表黏液层受损,皮肤颜色变淡、甚至肠道脱出等严重受伤情况,这就需要对亲鱼仔细操作并及时进行产后护理(如药浴等),否则会导致亲鱼死亡,造成损失。所以对半滑舌鳎进行二次催产激素注射可获得较佳的产卵效果,不仅提高了工作效率,节约了时间成本,还显著提高了上浮卵量,能够带来更高的经济效益。
[1] 陈松林,杜民,杨景峰,等.半滑舌鳎家系建立及其生长和抗病性能测定[J].水产学报,2010,34(12):1789-1794.
[2] 马学坤,柳学周,温海深,等.半滑舌鳎性腺分化的组织学观察[J].海洋水产研究,2006,27(2):55-61.
[3] 梁春光,康现江,李凤超,等.半滑舌鳎性腺的组织学研究[J].河北渔业,2007(11):22-28.
[4] 康现江,梁春光,郭明申,等.半滑舌鳎精子发生和精子形成的超微结构[J].动物学报,2008,54(2):356-365.
[5] 刘美,李凤超,穆淑梅,等.半滑舌鳎胚胎发育组织学观察[J].四川动物,2008,27(5):737-739.
[6] 汪娣,田永胜,陈松林.水温对半滑舌鳎性腺组织发育的影响[J].水产学报,2012,36(2):262-271.
[7] 陈彩芳,温海深,陈晓燕,等.人工养殖半滑舌鳎卵巢发育及其产卵类型研究[J].海洋科学,2010,34(8):29-34.
[8] 柳学周,徐永江,刘乃真,等.半滑舌鳎卵巢发育的组织学和形态数量特征研究[J].渔业科学进展,2009,30(6):25-35.
[9] 林浩然.激素和人工诱导鱼类繁殖[J].生物学通报,1999,34(8):4-6.
[10] 谢启文.神经内分泌学[J].医学研究通讯,1999,28(3):7.
[11] 姜仁良,黄世蕉,赵维信,等.促黄体生成素释放激素类似物对团头鲂血清中促性腺激素和17β-雌二醇含量变动的研究[J].水产学报,1986,10(2):185-193.
[12] 王德寿,林浩然.诱导大鳍鳠和长吻排卵过程中血清GTH水平的变化[J].水生生物学报,2001,25(2):185-190.
[13] Daniel G,Eales J G. Interrelationships between thyroidal and reproductive endocrine systems in fish[J].Reviews in Fish Biology and Fisheries, 1996,6(2):165-200.
[14] 王珊珊.促性腺激素在雌性半滑舌鳎繁殖周期的生理功能研究[D].青岛:中国海洋大学,2013.
[15] De Leeuw R, Resink J W, Rooyakkers E J, et al. Pimozide modulates the luteinizing hormone-releasing hormone effect on gonadotrophin release in the African catfishClariaslazera[J]. Gen Comp Endocrinol, 1985,58(1):120-127.
[16] 赵维信,黄世蕉,姜仁良.鲤鱼产卵前后血清中促性腺激素含量的动态变化[J].动物学杂志,1979,10(2):3-5.
[17] Li J L, Liu L P. Experiments on complete artificial propagation ofOreochromisaureus[J].Journal of Aquaculture,2006,27(5):25-27.
[18] 魏继海,赵永华,王燕,等.催产激素对尼罗罗非鱼人工繁殖效果的研究[J].渔业研究,2016,38(1):36-40.
[19] 李政潮,王指楠,于延正,等.生殖激素对泥鳅催产效果的研究[J].吉林农业科技学院学报,2013,22(4):7-9,47.
[20] 姜琼,谢妤.苯酚—硫酸法测定多糖方法的改进[J].江苏农业科学,2013,41(12):316-318.
[21] 全国食品工业标准化技术委员会肉禽蛋制品分技术委员会. GB/T 9695.7—2008,肉与肉制品总脂肪含量测定[S].北京:中国标准出版社,2008.
[22] 中华人民共和国卫生部. GB 5009.5—2010, 食品中蛋白质的测定[S].北京:中国标准出版社,2010.
[23] 中华人民共和国卫生部. GB 5009.3—2010. 食品中水分的测定[S].北京:中国标准出版社,2010.
[24] 陈名声,杨开祺,刘明.血清生长激素双抗体放射免疫测定[J].第四军医大学学报,1989,10(5):327.
[25] 于智勇,吴旭干,常国亮,等.中华绒螯蟹第二次卵巢发育期间卵巢和肝胰腺中主要生化成分的变化[J].水生生物学报,2007,31(6):799-806.
[26] Li Y Y,Chen W Z,Sun Z W,et al. Effects of n-3 HUFA content in brood stock diet on spawning performance and fatty acid composition of eggs and larvae inPlectorhynchuscinctus[J].Aquaculture,2005,245(1/4):263-272.
[27] Aby-ayad S M E A,Melard C,Kestemont P. Effects of fatty acids in Eurasian perch brood stock diet on egg fatty acid composition and larvae stress resistance[J].Aquaculture international,1997,5(2):161-168.
[28] 刘凯,徐东坡,段金荣,等.长江口凤鲚产卵群体肌肉及卵巢生化组成和能量密度[J].上海海洋大学学报,2009,18(3):302-307.
[29] 严安生,黄峰,熊传喜,等.异育银鲫卵巢、肌肉的生化成分和氨基酸组成特点[J].水利渔业,1997,89(2):10-12.
[30] Bell M V,Henderson R J,Sargent J R. The role of polyunsaturated fatty acids in fish[J].Comp Biochem Physio,1986,83(4):711-719.
[31] 于晓,唐文乔,王磊.长江口凤鲚繁殖群体卵巢发育过程中的体内脂肪转移[J].动物学杂志,2014,49(6):867-874.
[32] 解竞静.大黄鱼肌纤维生长和脂肪沉积规律以及甲状腺激素的作用[D].南京:南京农业大学,2006.
[33] 郑斯涌,马志章,江希明.白鲢卵巢发育过程中的磷化合物含量变化的研究[J].水产学报,1965,2(1):21-32.
[34] 殷江霞.长薄鳅的性腺发育和生殖细胞的发生[D].重庆:西南大学,2006.
[35] 姚俊杰,姜海波,胡先成,等.黄颡鱼繁殖期主要组织器官中氨基酸和脂肪酸的组成[J].贵州农业科学,2009,37(5):115-118.
[36] 刘筠.中国养殖鱼类繁殖生理学[M].北京:农业出版社,1993:29-46,53-55.
[37] Einarsdóttir I E,Silva N,Power D M,et al. Thyroid and pituitary gland development from hatching through metamorphosis of a teleost flatfish, the Atlantic halibut[J].Anatomy & Embryology,2006,211(1):47-60.
[38] Orozco A,Valverde-R C.Thyroid hormone deiodination in fish[J].Thyroid,2005,15(8):799-813.
[39] Cyr D G,Eales J G. Interrelationships between thyroidal and reproductive endocrine systems in fish[J].Reviews in Fish Biology and Fisheries,1996,6(2):165-200.
[40] Biswas A. Thyroid hormone profile during annual reproductive cycle of diploid and triploid catfish,Heteropneustesfossilis(Bloch)[J].General and Comparative Endocrinology,2006,147(2):126-132.
[41] Wallace R A. Developmental Biology[M].New York:Plenum Press,1985:117-127.
[42] Ng N K,Tsi D,Munro A D. Induced final maturation and ovulation in a small anabantoid teleost, the dwarf gourami,Colisalalia. Ⅰ. The effects of gonadotrophic preparations, LHRHa, steroids and thyroid hormones[J].Aquarium Sciences and Conservation,1997,1(3):169-188.
[43] Yamano K. The role of thyroid hormone in fish development with reference to aquaculture[J].Japan Agricultural Research Quarterly,2005,39(3):161-168.
[44] Epler P,Bieniarz K. Effects of triiodothyronine and of some gonadotropic and steroid hormones on the maturation of carp (CyprinuscarpioL.) oocytes in vitro[J].Reproduction Nutrition Development,1983,23(1):101-107.
[45] Rocha M J,Arukwe A,Kapoor B G. Fish Reproduction[M]. Enfield: Science Pub Inc,2008:37-66.
[46] Schoemaker J,Weissenbruch M M,Scheele F,et al.The FSH threshold concept in clinical ovulation induction[J].Baillière′s Clinical Obstetrics and Gynaecology,1993,7(2):297-308.
[47] Koning C H,Schoemaker J,Lambalk C B. Estimation of the follicle-stimulating hormone (FSH) threshold for initiating the final stages of follicular development in women with elevated FSH levels in the early follicular phase[J].Fertility and Sterility,2004,82(3):650-653.
[48] Gen K,Kazeto Y. Gonadotropins and their receptors in fish reproduction[J].Nippon Suisan Gakkaishi (Japan),2009,75(5):858-859.
[49] Levavi-Sivan B,Bogerd J,Maanós E L,et al. Perspectives on fish gonadotropins and their receptors[J].General and Comparative Endocrinology,2009,165(3):412-437.
[50] 朱华,胡红霞,董颖,等.不同催产剂对俄罗斯鲟人工繁殖效果的影响[J].水产科学,2014,33(1):1-7.
[51] 卢国兴.不同激素及性比对泥鳅繁殖效果的研究[D].舟山:浙江海洋学院,2013.
[52] 姜海峰,耿龙武,佟广香,等.池养镜泊湖蒙古鲌的人工繁殖及胚胎发育和胚后发育观察[J].水产科学,2016,35(2):130-135.
[53] 陈睿毅,楼宝,詹炜,等.小黄鱼亲鱼培育和催产技术的初步试验[J].水产科学,2016,35(3):250-254.
EffectsofSpawningInducingHormonesonBiochemicalCompositionofOvaryandReproductiveHormoneLevelsinPlasmainHalf-smoothTongue-soleCynoglossussemilaevis
ZHANG Yuxiang1,WU Yanqing2,JIANG Haibin3,LIU Liming1,DU Rongbin1
( 1.Ocean School, Yantai University, Yantai 264005, China; 2.East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;3.Shandong Marine Environment and Resource Research Institute, Yantai 264006, China )
Under the artificial breeding conditions, the effects of luteinizing hormone-releasing hormone analogue (LRH-A3) and human chorionic gonadotropin (HCG) injection on biochemical composition of ovary and reproductive hormone levels in plasma and spawning were investigated in half-smooth tongue-soleCynoglossussemilaevisbroodstocks in 3 groups including no injection, single injection and twice injections. The contents of total protein, total carbohydrate and crude lipid and water in ovary were determined using biochemistry methods, and the varieties of the level of thyroxine (T4), follicle-stimulating hormone (FSH), and luteinizing hormone (LH) in plasma were detected using double antibody radioimmunoassay. The results showed that ovary developed and completed the nutrition accumulation rapidly just in the broodstocks injected with exogenous hormone. The contents of total carbohydrate and crude lipid were increased significantly with the development of ovary (P<0.05), and decreased significantly after spawning; the content of total protein remained stable from 6.13% to 7.07%; moisture, the one with the maximal level, decreased from 78.78% to 64.81% with development of ovary, and increased significantly to 72.56% after spawning. The content of T4 was shown to be increased significantly at 24 hours after injection (P<0.05) and then kept a higher level for more than 24 hours, and twice injection helped to maintain a higher level of T4 in plasma. FSH and LH in control group kept decreasing while the content of FSH in group of hormone injection just increased between 24 and 36 hours and decreased later. The content of LH was most sensitive to hormone injection and increased at 12 hours after injection, significantly higher in twice injection group than that in the other two groups (P<0.05). The findings indicate that exogenous hormone injection can promote the levels of reproductive hormones in plasma, especially twice injection (P<0.05). Spawning inducing hormone injection can also lead to significantly increase in total amount of eggs, and amount and rate of floating eggs, twice injection being significantly effective than single injection (P<0.05).
Cynoglossussemilaevis; spawning inducing hormone; biochemical composition of ovary; reproductive hormone; spawning
10.16378/j.cnki.1003-1111.2017.05.001
2016-08-19;
2016-12-06.
农业部国家鲆鲽类产业技术体系项目(CARS-50-Z09);山东省现代农业产业技术体系项目(SDAIT-12-03).
张玉祥(1991-),男,硕士研究生;研究方向:水生生物学、繁殖生物学.E-mail:ytuzhangyuxiang@163.com. 通讯作者:杜荣斌(1962-),男,教授;研究方向:水产养殖学、海洋生物学.E-mail:rbdu62@163.com.
S965.399
A
1003-1111(2017)05-0543-08
