紫扇贝与海湾扇贝杂交后代的母本亲权鉴定方法
2017-12-18刘凤巧徐冬雪刘桂龙王春德
刘凤巧,刘 博,徐冬雪,马 斌,刘桂龙,陈 银,王春德
( 青岛农业大学 海洋科学与工程学院,山东 青岛 266109 )
紫扇贝与海湾扇贝杂交后代的母本亲权鉴定方法
刘凤巧,刘 博,徐冬雪,马 斌,刘桂龙,陈 银,王春德
( 青岛农业大学 海洋科学与工程学院,山东 青岛 266109 )
紫扇贝与海湾扇贝的成功杂交为改善海湾扇贝的种质提供了新的途径。但紫扇贝和海湾扇贝均为雌雄同体的动物,在育种实践中存在着精子或卵子污染的问题,为确保育种进程的顺利进行并确证后代的谱系,经常需要确定某一后代是否为真正的杂交后代及其父母本来源,因此需要建立一种方法来快速鉴定其亲本来源尤其是母本来源。本文通过比对海湾扇贝和紫扇贝mtDNA序列差异性,设计并筛选出一对特异性引物(mtDNA-Z),可在紫扇贝中扩增出约460 bp的PCR产物,而在海湾扇贝中无扩增,因此可由此建立一种鉴定杂交后代母本亲权的方法。用该方法在杂交一代紫海、海紫扇贝和回交一代紫海海、紫海紫、海紫海、海紫紫扇贝的验证结果表明,该方法简单、快速、可靠。
海湾扇贝;紫扇贝;杂交;线粒体DNA;母本亲权鉴定
海湾扇贝(Argopectenirradiansirradians)自1982年从美国引进以来, 产量逐年增加,已成为我国最重要的养殖贝类之一,但是近年来出现的种质退化问题成为制约我国海湾扇贝养殖业发展的严重障碍[1]。紫扇贝(A.purpuratus) 是原产于南太平洋的一种速生型中型扇贝,大小中等,广泛养殖于智利和秘鲁[2]。紫扇贝和海湾扇贝同属于海湾扇贝属的优良品种,存在互补的性状,通过种间杂交有望培育出生长速度快、个体大且温度适应范围广的扇贝,为了改善海湾扇贝的种质,提高扇贝养殖业的经济产量,Wang等[3]于2008年从秘鲁引进紫扇贝并与海湾扇贝成功杂交,培育出了生长优势极其显著的杂交后代。杂交F1代中存在着少量雌性可育个体,可通过回交的方法培育生长优势极其显著的杂交扇贝后代,因而具有巨大的育种潜力。但紫扇贝和海湾扇贝均为雌雄同体的动物,在繁育时两种扇贝均同时排放精子和卵子,在育种实践中存在着精子或卵子污染的问题,为确保育种进程的顺利进行并确证后代的谱系,经常需要确定某一后代是否为真正的杂交后代及其父母本来源,因此需要建立一种方法来快速鉴定其亲本来源。在杂交试验中发现,用作杂交的母体不同,其杂交F1代性状的表现也不同,有的甚至完全表现为母体的性状,因此研究杂交后代的母本来源变得尤为重要。
近年来,分子标记技术被广泛应用于种质鉴定、品种改良、遗传关系分析、系统发育等领域。利用来自核基因组的分子标记(如微卫星标记、AFLP分子标记等)鉴定方法虽然可以用来鉴定杂交后代是否为真正的杂交种,但无法辨别其父母本来源。线粒体作为独立于核基因组之外的遗传物质,具有与核基因组相似的特征,是作为遗传及发育研究的良好材料,同时又由于其特殊的遗传方式,只需对少量个体进行研究便能反应群体遗传结构,因而更便于进行群体分析[4-5]。线粒体基因被广泛应用于生物个体的遗传变异分析和系统进化等领域,其中应用线粒体相关基因进行遗传背景研究的文献报道已有很多。在大部分的真核生物中,线粒体DNA遵循母系遗传,即后代的线粒体DNA只来自于母本[6]。本研究根据线粒体基因组的母系遗传特点,设计了一对紫扇贝特异性引物,由其扩增出条带的个体为紫扇贝母本来源,能够通过PCR方法鉴定杂交后代线粒体基因的类型,从而快速鉴定杂交扇贝的母本来源。
1 材料与方法
1.1 试验材料
试验用海湾扇贝来自莱州国震水产有限公司,紫扇贝引自秘鲁,参照紫扇贝和海湾扇贝种间杂交的方法[7],用控温促熟的方法培育海湾扇贝, 使其与紫扇贝亲贝同时成熟, 用温度刺激的方法使紫扇贝和海湾扇贝同时排放精卵, 分别获得紫扇贝的精卵和海湾扇贝的精卵,建立以下家系组合:(1)紫海杂交扇贝(紫扇贝♀×海湾扇贝♂);(2)海紫杂交扇贝(海湾扇贝♀×紫扇贝♂)。在回交试验中,同样用控温促熟的方法分别获得海紫杂交扇贝和紫海杂交扇贝的卵子及紫扇贝和海湾扇贝的精子,建立以下家系组合:(1)海紫×紫杂交扇贝(海紫杂交扇贝♀×紫扇贝♂);(2)紫海×海杂交扇贝(紫海杂交扇贝♀×海湾扇贝♂);(3)紫海×紫杂交扇贝(紫海杂交扇贝♀×紫扇贝♂);(4)海紫×海杂交扇贝(海紫杂交扇贝♀×海湾扇贝♂)。用传统的海湾扇贝育苗方法对这几个家系组合进行幼虫培育,中间保苗和养成,4个月后对各组随机取贝进行试验。
1.2 试验方法
1.2.1 扇贝全基因组DNA的提取
取待鉴定扇贝闭壳肌,保存在75%的乙醇中于-20 ℃备用。用天根DNA提取试剂盒(天根生化科技有限公司,北京)分别提取全基因组DNA,用TE缓冲液稀释至终质量浓度100 ng/μL保存于-20 ℃备用,提取的全基因组DNA经1.2%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像系统照相观察。
1.2.2 特异性引物的设计
在GenBank数据库中查找紫扇贝和海湾扇贝的线粒体DNA全基因组序列(序列号KT161260.1,KT161262.1),用DNAMAN软件对两序列进行比对分析,找到差异显著的线粒体DNA序列,根据紫扇贝序列用Primer 5.0软件设计8对特异性引物mtDNA-1至mtDNA-8(表1)。引物委托生工生物工程(上海)股份有限公司进行合成,引物设计的原理参照等位基因特异PCR[8]。
1.2.3 特异性引物的筛选
用设计的8对引物分别对海湾扇贝和紫扇贝进行PCR扩增,对两种扇贝进行比较,根据PCR产物大小是否与设计的相符,初步判断所设计的引物是否具有特异性。以提取的扇贝DNA为模板,用上述引物对进行PCR扩增,反应体系为10 μL,包括0.25 U Taq DNA 酶(日本Takara公司), 1×PCR buffer(含1.5 mmol/L MgCl2), 0.2 mmol/L dNTP mix, 上下游引物各1 μmol/L, 50 ng DNA模板。反应程序为:94 ℃预变性3 min, 94 ℃ 1 min, 56 ℃ 1 min, 72 ℃ 1 min, 30个循环,72 ℃延伸10 min。 PCR 产物经1%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像系统照相观察。根据试验结果,选择PCR产物差异最明显的引物对用于构建亲权鉴定的方法。

表1 初步设计的8对特异性引物
1.2.4 特异引物扩增片段测序验证
将筛选的特异性引物在紫扇贝全基因组DNA中进行PCR扩增,琼脂糖电泳检测,用Biospin Gel Extraction Kit 胶回收试剂盒回收目的条带。将回收的DNA片段连接到pMD18-T质粒载体(日本Takara公司)上,挑选阳性克隆检测后送生工生物工程(上海)股份有限公司测序。测序结果同紫扇贝和海湾扇贝线粒体基因组全序列进行比较,验证PCR扩增获得的DNA片段是否由线粒体DNA作为模板合成。
1.2.5 特异引物在杂交一代扇贝家系组合中的验证
获得初步筛选的引物,进一步在紫海扇贝及海紫扇贝家系组合中进行验证,每个组合随机选取20个DNA样本进行PCR扩增、1%琼脂糖电泳检测,凝胶成像系统观察,以此验证筛选的特异性引物是否能鉴定杂交后代的母本来源,并且确保引物的准确性。
1.2.6 特异引物在其他杂交扇贝家系组合中的验证
随机选取海紫×紫杂交扇贝、紫海×海杂交扇贝、紫海×紫杂交扇贝和海紫×海杂交扇贝样本各20个,用特异性引物mtDNA-Z对其进行PCR扩增,1%琼脂糖电泳检测,凝胶成像系统观察。
2 结果与分析
2.1 扇贝全基因组DNA提取结果
将提取的海湾扇贝、紫扇贝及其杂交后代紫海、海紫扇贝的全基因组DNA进行琼脂糖检测,得到一条非常明亮的条带,结果见图1,说明提取的全基因组DNA质量较好,可以进行下一步试验操作。
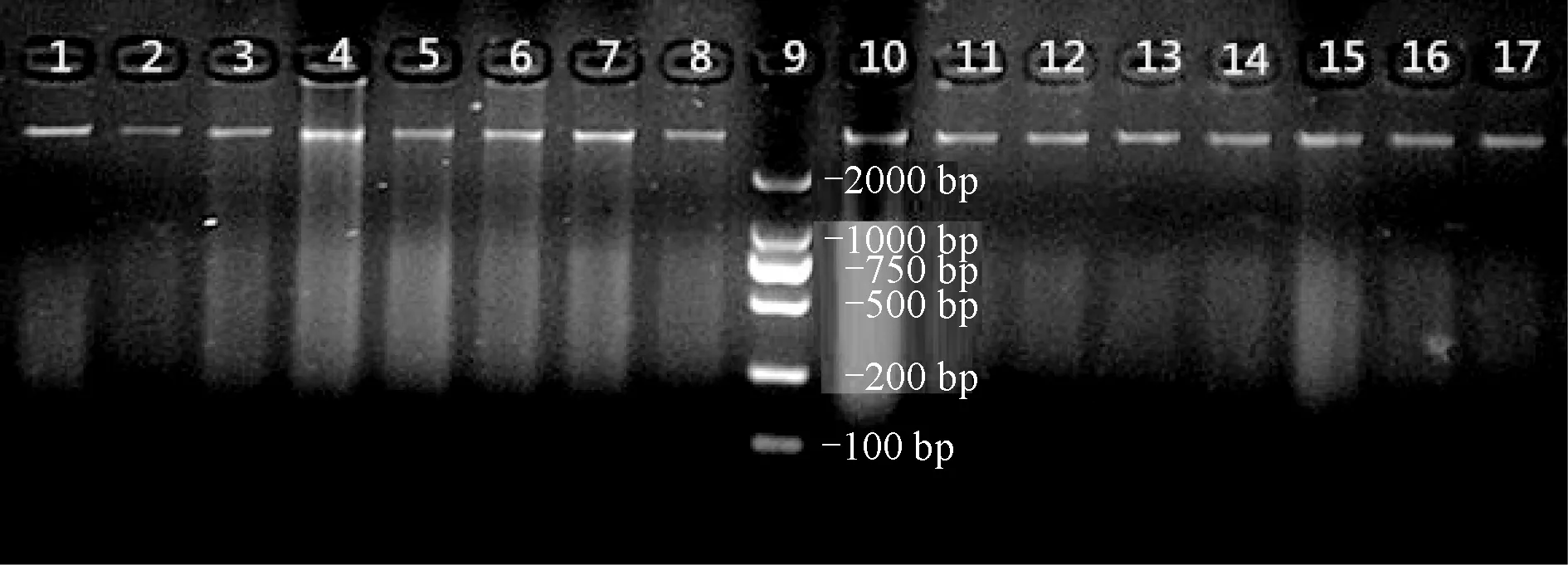
图1 部分紫扇贝、海湾扇贝及杂交一代,回交一代扇贝全基因组DNA提取结果
1~2:海湾扇贝,3~4:紫扇贝,5~6:海紫扇贝,7~8:紫海扇贝,9: DL 2000,10~11:紫海紫扇贝,12~13:紫海海扇贝,14~15:海紫紫扇贝,16~17:海紫海扇贝.
2.2 特异性引物的筛选及扩增
将设计的mtDNA-1至mtDNA-8等8对引物分别在海湾扇贝和紫扇贝中进行PCR扩增,在筛选阶段mtDNA-2至mtDNA-8在两种扇贝中均能扩增出大小相同的产物或均无扩增产物,无法起到特异性鉴定的作用。而引物mtDNA-1可以在紫扇贝中扩增出约460 bp的条带,在海湾扇贝中无扩增产物(图2),扩增的结果和预期大小相符,初步判断引物mtDNA-1可以待选为特异性引物,将其命名为mtDNA-Z,则筛选出的特异性引物为,左端序列mtDNA-Z-F:5′-TATGAGGTGTCCCCCAAGTC-3′,右端序列mtDNA-Z-R:5′-ACTGGCAGACAAACAAATCGT-3′。
2.3 特异引物扩增片段测序验证结果
扩增产物回收后的测序大小为463 bp,将其与紫扇贝线粒体DNA全序列用软件DNAMAN进行序列比对,测得序列与紫扇贝线粒体DNA的片段相似度为97.81%(图3)。从而排除了mtDNA-Z引物受核基因组影响的可能,确定为以紫扇贝线粒体DNA作为模板进行的扩增反应。
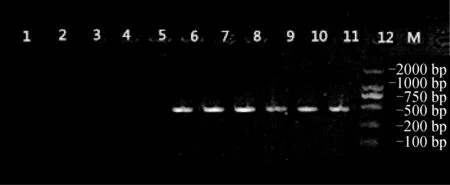
图2 部分紫扇贝、海湾扇贝PCR扩增的电泳结果

图3 测序比对结果
2.4 特异引物在杂交一代扇贝家系组合中的验证
将引物mtDNA-Z对杂交一代紫海扇贝、海紫扇贝进行PCR扩增,结果和预测结果相同(图4),在紫海扇贝中扩增出约460 bp的条带,而在海紫扇贝中无扩增条带出现,表明引物mtDNA-Z具有特异性。

图4 部分紫扇贝、海湾扇贝及杂交一代海紫扇贝、紫海扇贝的电泳结果
2.5 特异引物在其他杂交扇贝家系组合中的验证
将引物mtDNA-Z对其他杂交后代海紫×紫杂交扇贝、紫海×海杂交扇贝、紫海×紫杂交扇贝和海紫×海杂交扇贝进行PCR扩增,结果表明(图5),在紫海×紫杂交扇贝、紫海×海杂交扇贝中扩增出约460 bp的条带,而在海紫×紫杂交扇贝和海紫×海杂交扇贝中无扩增条带出现。上述结果进一步表明,引物mtDNA-Z具有紫扇贝特异性,从而验证了由其扩增出条带的个体为紫扇贝母本来源。
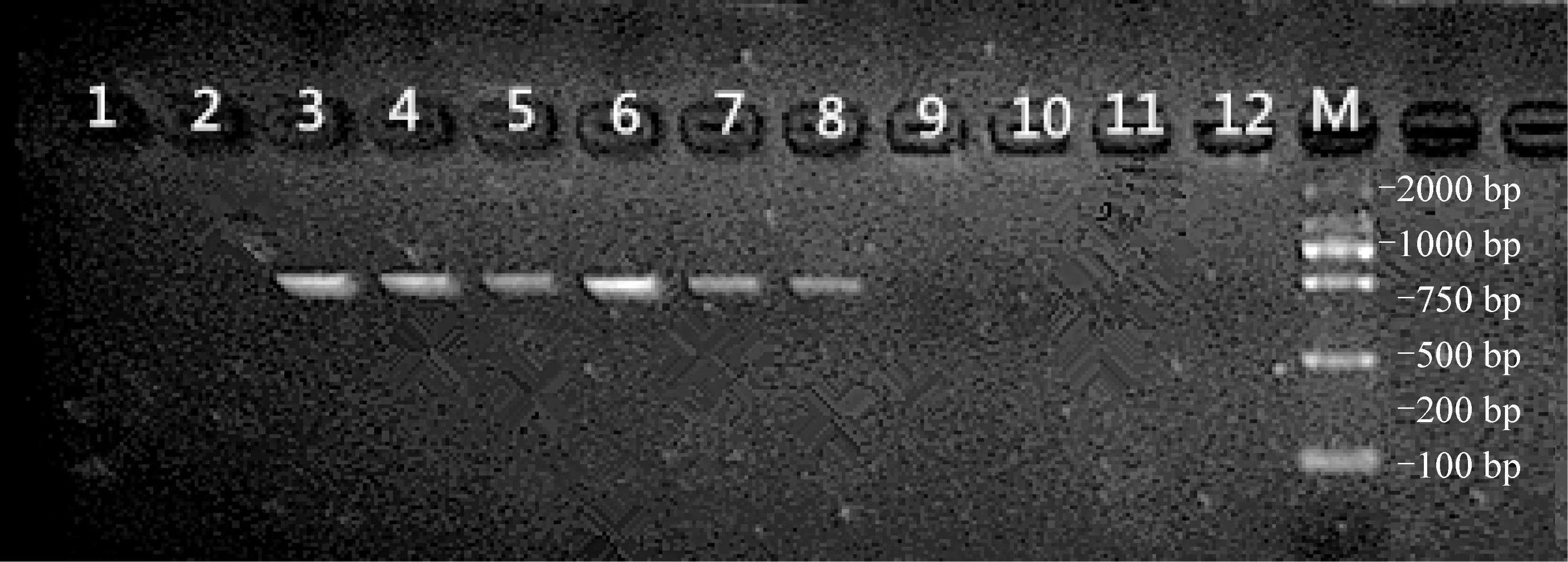
图5 部分海湾扇贝、紫扇贝及回交一代扇贝的电泳结果
1~2:海湾扇贝,3~4:紫扇贝,5~6:紫海紫扇贝,7~8:紫海海扇贝,9~10:海紫紫扇贝,11~12:海紫海扇贝,M:DL 2000.
3 讨 论
目前对扇贝种类的鉴别,主要通过形态学方面的性状(大小、壳色、放射肋、棘等)来进行[9],但是对杂交后代的鉴别,只通过扇贝的外形很难判断。为了使鉴定更加准确,目前往往采用分子生物学手段,从分子水平上研究物种的遗传结构特征,不仅可以了解群体遗传分化水平、物种起源与系统发生,同时也有利于遗传育种和濒危物种的保护。
线粒体DNA序列是目前应用于系统进化[10]、物种鉴定[11]、亲缘关系分析[12]等研究领域最广泛的分子标记之一[13],已经逐渐应用于海洋生物属间[14-15]、种间的分子系统学方面[16-19],在海洋双壳贝类的分子系统学及种群关系分析方面的研究也有所报道,但仅有少数研究将mtDNA应用在杂交种的鉴定方面[20-21]。线粒体是动物体内已知的唯一存在的核外遗传物质,利用其严格的母性遗传特点,可以进行杂交子代鉴定,通过鉴定分析可以准确得到其母本来源,为确保育种进程的顺利进行打下了坚实的基础。基于线粒体DNA的差异性而设计的引物可以排除核基因组DNA的影响,能够非常方便的解决微卫星等分子标记无法避开的杂交种都含有父母本核基因组的问题[22]。
本文在试验设计中参考筛选SNP位点的原理[23],并在 allele specific PCR方法[9]的基础上进行改进,即利用海湾扇贝和紫扇贝线粒体DNA上单个或多个碱基的差异性设计引物,既要保证PCR的正常扩增,又要使左右端引物的3′端都位于差异位点,这样可以使得以紫扇贝为母本的杂交后代可以扩增出目的条带,而在以海湾扇贝为母本的杂交后代中无法得到扩增产物,以此直接表现出特异性。本试验设计了可以鉴定海湾扇贝和紫扇贝杂交后代母本来源的特异性引物mtDNA-Z,确保mtDNA-Z引物不受核基因组的影响,并可保证准确快速的起到鉴定母本来源的作用,避免了高变异可能对引物广泛应用的影响。尽管该试验方法利用mtDNA标记,但不需要单独提取mtDNA进行鉴定,用常规提取的全基因组中的少量mtDNA,即可利用引物通过PCR扩增,电泳后就能够得到结果。本方法周期时间短,方法简便,可大批量进行,快速高效。
本方法也为以后设计鉴定引物提供了新思路,通过这种改进的特异性引物,可以在mtDNA上筛选位点用于分子标记,起到鉴定的作用。虽然mtDNA 变异率高,但有些保守序列可以承担标记基因的作用,为以后通过分子方法鉴别杂交扇贝提供了一种方法,在mtDNA上设计的特异性引物能够简单的分辨出母本的来源。运用本研究建立起来的方法,结合已有的SSR和ITS鉴定方法[3],可以准确鉴定出杂交扇贝的父母本来源,为进一步的海湾扇贝和紫扇贝杂交后代遗传背景的分析提供数据基础,为扇贝杂交育种筛选新品种提供理论依据。
[1] Zhang F S, He Y, Yang H S, et al. Bay scallop culture in China: status and challenges[G]//Status of Aquaculture in China, Hawaii: The Oceanic Institute, 2003:13-28.
[2] Gonzalez M L, Perez M C, Lopez D A. Breeding cycle of the northern scallop,Argopectenpurpuratus(Lamarck, 1819) in southern Chile[J]. Aquaculture Research,2002,33(11):847-852.
[3] Wang C D, Liu B Z, Li J Q, et al. Introduction of the Peruvian scallop and its hybridization with the bay scallop in China[J].Aquaculture,2011,310(3/4):380-387.
[4] Rollinson D,Kaukas A,Johnston D A, et al. Some molecular insights into schistosome evolution[J]. International Journal for Parasitology, 1997,27(1):11-28.
[5] Avise J C, Wollenberg K. Phylogenetics and the origin of species[J]. Proceedings of the National Academy of Sciences, 1997,94(15):7748-7755.
[6] Passamonti M, Ghiselli F, Milani L. Mitochondrial inheritance[J]. Brenners Encyclopedia of Genetics, 2013, 46(2):443-445.
[7] 王春德,刘保忠,李继强,等. 紫扇贝与海湾扇贝种间杂交的研究[J]. 海洋科学, 2009, 33(10):83-91.
[8] Liu J, Huang S M, Sun M Y, et al. An improved allele-specific PCR primer design method for SNP marker analysis and its application[J]. Plant Methods,2012, 8(1):34.
[9] 王师,包振民,张玲玲,等.应用PCR-RFLP技术鉴定区分中国沿海四种主要养殖贝类[J].食品科学,2006,27(7):210-214.
[10] Kumar R J, Tanya C H.Molecular markers and their applications in fisheries and aquaculture[J]. Advances in Bioscience and Biotechnology, 2010,1(4):281-291.
[11] Mugue N S, Barmintseva A E, Rastorguev S M, et al.Polymorphism of the mitochondrial DNA control region in eight sturgeon species and development of a system for DNA-based species identification[J]. Russian Journal of Genetics,2008,44(7):793-798.
[12] Ayyappan S, Jena J K, Gopalakrishnan A. Molecular tools for sustainable management of aquatic germplasm resources of India[J]. Agricultural Research, 2014,3(1):1-21.
[13] 李建华,王继文.动物线粒体DNA在进化遗传学研究中的应用[J].生物学通报, 2005, 40(2):5-7.
[14] 任岗. 12种石鲈科鱼类线粒体16S rRNA基因的部分序列分析[J].热带海洋学报, 2007, 26(3):48-52.
[15] 郭天慧.三疣梭子蟹线粒体DNA 16S rRNA和COⅠ基因片段序列的比较研究[J].中国海洋大学学报:自然科学版, 2004, 34(1):22-28.
[16] Miller A D, Murphy N P, Burridge C P, et al. Complete mitochondrial DNA sequences of the decapod crustaceansPseudocarcinusgigas, (Menippidae) andMacrobrachiumrosenbergii, (Palaemonidae)[J]. Marine Biotechnology, 2005, 7(4):339-349.
[17] 孟学平,申欣,赵娜娜,等.双壳类线粒体基因组结构分析[J].水产科学,2013,32(12):721-729.
[18] 李青,王波,郑风荣,等.星斑川鲽、黄盖鲽和石鲽线粒体基因Cytb和COⅠ片段序列的比较研究[J].水产科学,2016,35(6):625-632.
[19] 鲍相渤.皮氏蛾螺和水泡蛾螺线粒体基因组及核糖体ITS2的比较研究[J].水产科学,2016,35(6):686-692.
[20] 董迎辉,姚定余,林志华,等.浙江和广西两种文蛤的分子鉴定及形态特征分析[J].水产学报, 2011, 35(10):1505-1508.
[21] 陈海港,李伟,张新铖,等.基于线粒体COⅠ基因鉴别云斑尖塘鳢和线纹尖塘鳢的分子标记[J].基因组学与应用生物学, 2016,35(6):1388-1392.
[22] Kline M C, Hill C R, Decker A E, et al. STR sequence analysis for characterizing normal, variant, and null alleles[J]. Forensic Sci Int Genet, 2010,5(4):329-332.
[23] Wang H, Kim M K, Kwon W S, et al. Molecular authentication ofPanaxginsengand ginseng products using robust SNP markers in ribosomal external transcribed spacer region [J]. Journal of Pharmaceutical and Biomedical Analysis, 2011,55(5):972-976.
MethodsforMaternalParentageAnalysesinHybridsbetweenBayScallopandPeruvianScallop
LIU Fengqiao, LIU Bo, XU Dongxue, MA Bin, LIU Guilong, CHEN Yin, WANG Chunde
( College of Marine Science and Engineering, Qingdao Agricultural University, Qingdao 266109,China )
The successful hybridization between bay scallop(Argopectenirradians) and Peruvian scallop(A.purpuratus) provides a new way in stock improvement of the bay scallop. Due to the hermaphroditic nature of the two scallops, contamination by unwanted sperm or eggs occurs frequently and thus a reliable and rapid parentage test method is necessary for the success of the hybrid scallop breeding. In this study, primers were designed based on the sequences of mitochondria DNA of the bay scallop and the Peruvian scallop. Screening of these primers indicated that the specific primers (mtDNA-Z) were used to amplify a PCR product of 460 bp in the Peruvian scallop, but not in the bay scallop, and thus used in parentage test of the hybrids between the two scallops. Application of this method in the parentage tests in the hybrid F1 (A.irradians♀×A.purpuratus♂ andA.purpuratus♀ ×A.irradians♂) and the backcross lines [(A.irradians♀ ×A.purpuratus♂) ×A.purpuratus♂, (A.irradians♀ ×A.purpuratus♂) ×A.irradians♂, (A.purpuratus♀ ×A.irradians♂) ×A.purpuratus♂ and (A.purpuratus♀ ×A.irradians♂) ×A.irradians♂] proved to be reliable, simple and rapid.
Argopectenirradians;A.purpuratus; hybrid; mitochondria DNA; maternal parentage analyse
10.16378/j.cnki.1003-1111.2017.05.004
2016-09-22;
2016-12-29.
国家自然科学基金面上项目(31572618);山东省现代农业产业技术体系贝类创新团队建设项目(SDAIT-14-02);山东省农业重大应用技术创新项目(2215011).
刘凤巧(1989-),女,硕士研究生;研究方向:贝类遗传育种. E-mail:liufengqiao2014@163.com.通讯作者:王春德(1967-),男,教授;研究方向:海洋生物遗传育种.E-mail:chundewang2007@163.com.
S968.313
A
1003-1111(2017)05-0563-06
