新生隐球菌性脑膜炎患者外周血Th1/Th2及相关T淋巴细胞水平变化及意义
2017-12-15黄煌冼莹潘越峻张扣兴
黄煌 冼莹 潘越峻 张扣兴
(1.广州市第八人民医院重症医学科,广州 510060;2.中山大学附属第三医院重症医学科,广州 510630)
·论著·
新生隐球菌性脑膜炎患者外周血Th1/Th2及相关T淋巴细胞水平变化及意义
黄煌1冼莹2潘越峻1张扣兴2
(1.广州市第八人民医院重症医学科,广州 510060;2.中山大学附属第三医院重症医学科,广州 510630)
目的通过检测新生隐球菌性脑膜炎患者外周血中Th1及Th2 类细胞及NKT细胞、T细胞的分布比例,从患者水平进一步了解机体T辅助淋巴细胞及相关T淋巴细胞在新生隐球菌感染过程中的作用机制。方法收集新生隐球菌性脑膜炎/脑膜脑炎的16例患者 (HIV检测阴性)及作为对照组的10例正常健康人外周血标本,采用流式细胞技术检测标本中Th1及Th2类细胞及NKT细胞、γδT细胞的在外周血T淋巴细胞中的分布比例,并采用SPSS 11.0软件进行统计分析比较。结果隐脑患者 (接受诱导治疗前)Th1细胞在CD4+T淋巴细胞中所占比例为 (13.093±4.618)%,低于正常对照组的比例 (19.582±4.949)%,而Th2细胞所占比例为 (1.769±0.865)%,高于正常对照组的比例 (0.584±0.202)%,差异皆有统计学意义 (P<0.01);隐脑患者经诱导治疗好转后Th1细胞在CD4+T淋巴细胞中所占比例为 (16.069±1.516)%,较好转前的比例 (13.589±2.101)%增加,Th2细胞所占比例为 (1.499±0.274)%,较好转前的比例 (1.673±0.290)%下降,但差异皆无统计学意义 (P>0.05);隐脑患者 (接受诱导治疗前)NKT细胞在整体T淋巴细胞中所占比例为 (11.848±2.936)%,低于正常对照组的比例 (17.918±8.088)%,差异有统计学意义 (P<0.05),而隐脑患者的γδT细胞在整体T淋巴细胞中所占比例为 (9.166±3.989)%,与正常对照组的比例 (9.873±3.509)%对比差异无统计学意义 (P>0.05);隐脑患者经治疗好转后NKT细胞在T淋巴细胞中所占比例为 (14.806±1.513)%,较好转前比例 (11.830±1.350)%增加,γδT细胞所占比例为 (6.984±0.843)%,则较好转前比例 (8.094±2.037)%下降,但差异皆无统计学意义 (P>0.05)。结论新生隐球菌性脑膜炎患者存在Th1细胞减少,Th2细胞增加,及NKT细胞在T淋巴细胞中所占比例下降,其说明新生隐球菌性脑膜炎患者的细胞免疫功能明显低下;经治疗好转后的病例,Th1/Th2失衡状态改善,可能提示患者的细胞免疫功能恢复对疾病预后起重要作用。
新生隐球菌;感染;Th1/Th2;NKT;γδT
新生隐球菌性脑膜炎 (以下简称隐脑)是由新生隐球菌引起的中枢神经系统感染性疾病,是中枢神经系统最常见的真菌感染。近年来,由于广谱抗生素,肾上腺皮质激素,肿瘤化疗、放疗和器官移植后免疫抑制剂的长期广泛应用,以及艾滋病的流行,隐脑的患病率明显上升。在我国,隐脑大多散发,主要集中在非艾滋病的其他免疫功能缺陷人群中[1-2]。
国外研究表明T淋巴细胞介导的细胞免疫在抵御新生隐球菌的过程中具有重要的意义,其中,CD4+T细胞在此过程中起着核心作用,Th1及Th2细胞间的平衡状态能显著影响感染的结局[3-4]。Th1细胞及其分泌细胞因子主要引起细胞免疫,可上调机体抗新生隐球菌的各种免疫反应,而Th2细胞及其分泌细胞因子主要引起体液免疫,可下调与Th1细胞相关的各种免疫反应,因此,当Th1/Th2平衡失调,Th2细胞增加时,机体抵御新生隐球菌感染能力下降,导致易感性增加及感染后病情进一步发展。T细胞还存在其他亚群,其中包括自然杀伤T (NKT)细胞和γδT细胞,在各种细胞因子的调节下,NKT和γδT细胞能共同调节T辅助细胞介导的抗隐球菌免疫反应[5],NKT细胞能调节Th1/Th2平衡向Th1方向倾斜,在新生隐球菌感染中发挥保护作用,而γδT细胞则可抑制NKT细胞所介导的各种Th1细胞相关炎症反应,从而下调了机体抗新生隐球菌感染的能力。目前关于Th1/Th2平衡、NKT细胞、γδT细胞与新生隐球菌感染间的关系的研究多只限于动物实验水平,而对新生隐球菌感染患者组织或血液中NKT细胞、γδT细胞水平变化的研究国内外鲜有文献报道。
本研究通过流式细胞技术检测新生隐球菌性脑膜炎患者外周血中Th1及Th2类细胞及NKT细胞、γδT细胞的分布比例,探讨是否与正常对照人群存在差异性,其变化是否与病情的转归呈相关性,从患者水平进一步了解机体T淋巴细胞免疫在新生隐球菌感染过程中的作用机制。
1 材料与方法
1.1 资料
实验对象 收集2009年1月~2015年12月在中山大学附属第三医院及广州市第八人民医院住院并确诊为新生隐球菌性脑膜炎/脑膜脑炎患者的外周血标本16例。其中男性11例,女性5例;年龄28~71岁;所有患者入院前均无在外院行抗真菌治疗,无接受手术、化疗、放疗史,HIV抗体检测均阴性,无明确接触史。健康志愿者10例,来源于患者家属、门诊体检者及工作人员。所有患者及志愿者均知情同意。
诊断 ①有发热、头痛、呕吐和脑膜刺激征等中枢神经系统感染临床表现。②脑脊液 (CSF)墨汁染色涂片找到新生隐球菌和 (或)脑脊液新生隐球菌培养阳性。患者同时具备以上两点条件为确诊病例。
治疗 所有患者治疗方案首先联合使用两性霉素B (或两性霉素B脂质体)和氟胞嘧啶进行2周的诱导治疗,再使用氟康唑进行8~10周的清除治疗,而后可继续使用氟康唑进行6~12个月的维持治疗。
疗效评价 治愈标准为临床症状消失,每周1次连续3次脑脊液墨汁涂片及培养阴性;好转为临床症状明显改善,菌体计数减少,但涂片或培养未转阴;无效为临床症状、体征无明显改善,菌体无明显变化或患者死亡。
分组 本研究共入选隐脑患者16例,其中7例经抗真菌治疗后临床症状明显改善,脑脊液检查隐球菌体计数<10/mL,脑脊液常规及生化检查基本正常,达到病情好转标准。①按抗真菌治疗前的隐脑患者与健康志愿者将实验检测结果分为A0组及A1组。②按隐脑患者自身好转前后将检测结果分为分为B0组及B1组。
酶抗体及试剂 见表1。

表1 酶抗体及试剂
1.2 实验步骤
标本采集 受试者清晨空腹抽取静脉血4 mL,各取2 mL注入EDTA抗凝管及肝素钠抗凝管中,轻轻混匀后静置。
标本处理 Th1及Th2细胞因子 (IFN-γ、IL-4)样本制备:①从肝素钠抗凝管中取200 μL血液标本于试管中,用RPMI 1640等体积稀释,加入适量PMA工作液及Ionomycin、Monensin工作液,于培养箱培养4~6 h,加入各20 μL CD3单抗及CD8单抗,室温避光孵育,分成4管后标记,每管加入固定液,孵育后加PBS,离心,弃上清液,加入破膜及溶血液,同时各加入IFN-γ单抗、IL-4单抗及同型对照抗体,再次离心,弃上清液,重悬样本后予流式细胞仪检测,每个样本每次检测1×104个细胞。②NKT、γδT细胞样本制备:从EDTA抗凝管中各取100 μL血液样本加入到不同标记的流式管中,取20 μL CD3/16+56抗体及CD3+γδTCR抗体、同型对照试剂分别加入相应的流式管内,加入溶血素后避光反应,再离心及弃上清液后重悬样本,予流式细胞仪检测,每个样本每次检测1×104个细胞。
流式细胞仪检测 调节仪器补偿,采用Cellques软件获取分析细胞,以前向角 (FSC)和侧向角 (SSC)散射光散点图设门区分淋巴细胞,以CD3和CD8散点图设门区分Th细胞 (近似等于CD3+CD8-),以同型对照为阴性群,最终再以IFN-γ、IL-4的散点图表示Th1细胞和Th2细胞。以CD3散点图设门区分T淋巴细胞,以同型对照为阴性群,再以CD16+CD56、γδTCR散点图分别表示NKT、γδT细胞。
1.3 统计学分析
2 结 果
2.1 流式细胞仪检测散点图结果 (见图1~10)
2.2 患者、正常对照组结果分析
隐脑患者组 (治疗前)、正常对照组之间Th1/Th2细胞平衡状态比较 A0、A1两组IFN-γ、IL-4单抗阳性细胞各占CD3+CD8-细胞群 (近似等于CD4+T细胞)比例比较。如表2结果示A0组IFN-γ单抗阳性细胞所占比例较A1组低,差异有统计学意义 (P<0.01);A0组IL-4单抗阳性细胞所占比例较A1组高,差异有统计学意义 (P<0.01)。由以上结果可知经治疗前患者组Th1/Th2平衡状态失调Th1细胞在CD4+T淋巴细胞中所占比例减少,Th2细胞所占比例增加 (见表2)。
隐脑患者组好转前后Th1/Th2细胞分布比例比较 B0、B1两组IFN-γ、IL-4单抗阳性细胞各占CD3+CD8-细胞群比例比较。如表3结果示经治疗好转后隐脑患者IFN-γ单抗阳性细胞所占比例较治疗前有所增加,IL-4单抗阳性细胞所占比例较治疗前有所下降,但差异皆无统计学意义 (P>0.05)。
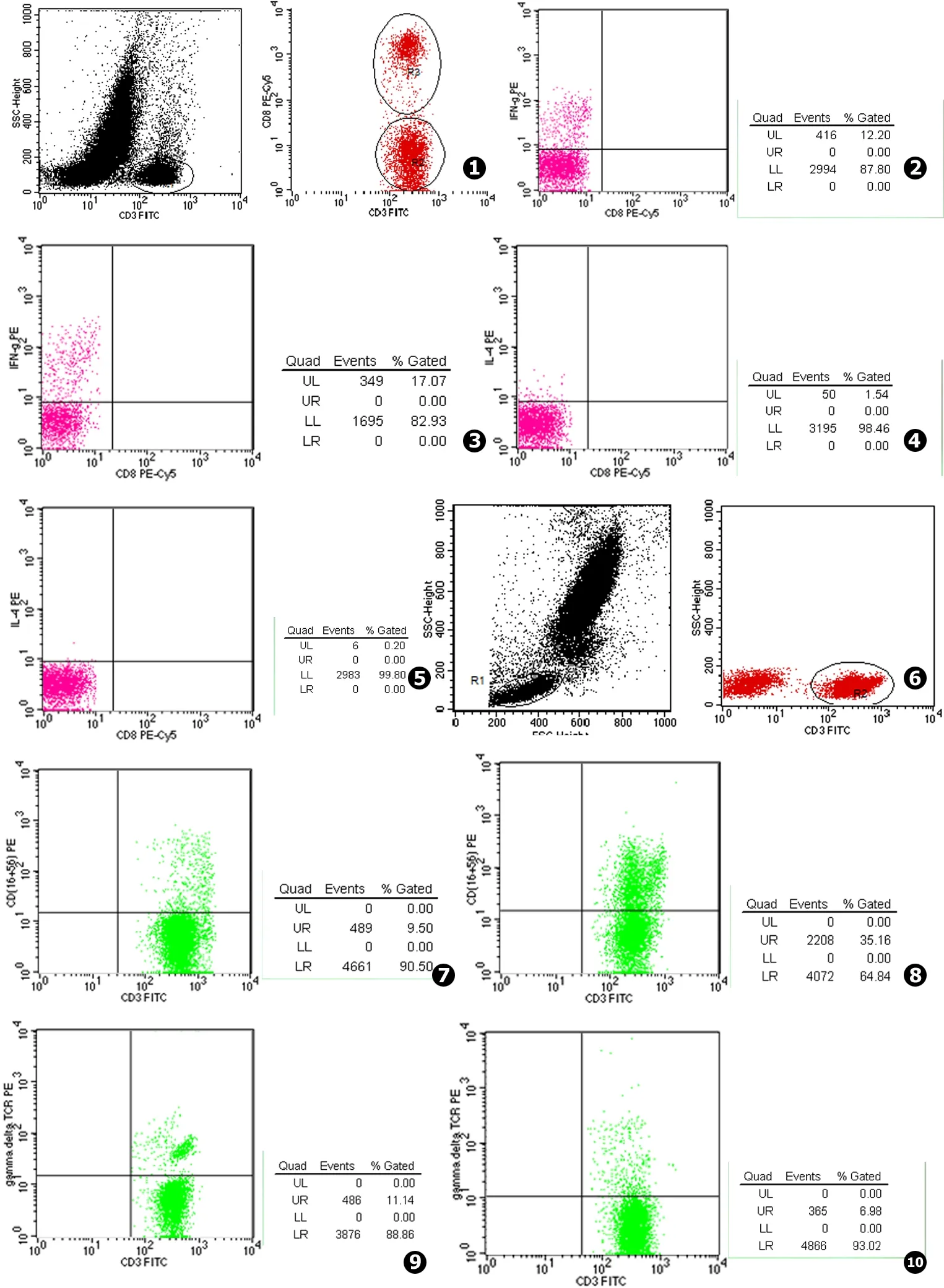
图1Th1/Th2 (IFN-γ/IL-4)检测图2隐脑患者IFN-γ检测图3正常健康人IFN-γ检测图4隐脑患者IL-4检测图5正常健康人IL-4检测图6NKT、γδT细胞检测图7隐脑患者NKT细胞检测图8正常健康人NKT检测图9隐脑患者γδT细胞检测图10正常健康人γδT检测
Fig.1Detection of Th1/Th2 (IFN-γ/IL-4) lymphocytesFig.2IFN-γ of patients with cryptococcal meningitisFig.3IFN-γ of healthy peopleFig.4IL-4 of patients with cryptococcal meningitisFig.5IL-4 of healthy peopleFig.6Detection of NKT,γδT lymphocytesFig.7NKT of patients with cryptococcal meningitisFig.8NKT of healthy peopleFig.9γδT of patients with cryptococcal meningitisFig.10γδT of healthy people
表2A组IFN-γ、IL-4单抗阳性细胞各占CD3+CD8-细胞群比例比较
Tab.2The proportions of Anti-IFN-γ and Anti-IL-4 cells in CD3+CD8-cells of group A

分组抗IFN⁃γ阳性细胞占CD3+CD8⁃细胞群比例(%)抗IL⁃4阳性细胞占CD3+CD8⁃细胞群比例(%)A013.093±4.6181.769±0.865A119.582±4.9490.584±0.202t⁃3.3934.229P值0.0020.000
表3B组IFN-γ、IL-4单抗阳性细胞各占CD3+CD8-细胞群比例比较
Tab.3The proportions of Anti-IFN-γ and Anti-IL-4 cells in CD3+CD8-cells of group B

分组抗IFN⁃γ阳性细胞占CD3+CD8⁃细胞群比例(%)抗IL⁃4阳性细胞占CD3+CD8⁃细胞群比例(%)B013.589±2.1011.673±0.290B116.069±1.5161.499±0.274t⁃0.9560.440P值0.3580.668
隐脑患者组 (治疗前)、正常对照组之间NKT、γδT细胞分布比例比较 A0、A1两组NKT、γδT细胞各占外周血T淋巴细胞比例比较。如表4结果示隐脑患者NKT细胞所占比例较正常对照人低,差异有统计学意义 (P<0.05);而两组γδT细胞分布比例比较,差异无统计学意义 (P>0.05)。
隐脑患者组好转前后NKT、γδT细胞分布比例比较 B0、B1两组NKT、γδT细胞各占外周血T淋巴细胞比例比较。如表5结果示经治疗好转后隐脑患者NKT细胞所占比例较治疗前有所增加,γδT细胞所占比例较治疗前有所下降,但差异皆无统计学意义 (P>0.05)。
3 讨 论
隐脑治疗困难,病死率高。在我国目前感染病例报道主要以HIV阴性人群为主,但其中相当部分患者发病前已经存在各种基础疾病,导致机体免疫功能缺陷,T辅助细胞 (CD4+T)、杀伤性T淋巴细胞 (CTL)等重要免疫功能细胞进行性减少。但近年也有研究表明无基础疾病而新生隐球菌病的发病人群中可能存在着未察觉的细胞免疫低下情况,如CD4+或CD8+淋巴细胞倒置[6]、淋巴细胞亚型分配不合理等[7]。目前认为T淋巴细胞介导的细胞免疫反应在抵御新生隐球菌感染过程中具有重要的意义,其作用机制一般认为与体内CD4+T的功能密切相关,其中Th1/Th2细胞间的平衡状态被认为是机体抵御隐球菌感染的核心机制[3-4]。
表4A组NKT、γδT细胞占外周血T淋巴细胞比例比较
Tab.4The proportions of NKT and γδT cells in T lymphocyte of peripheral blood of group A
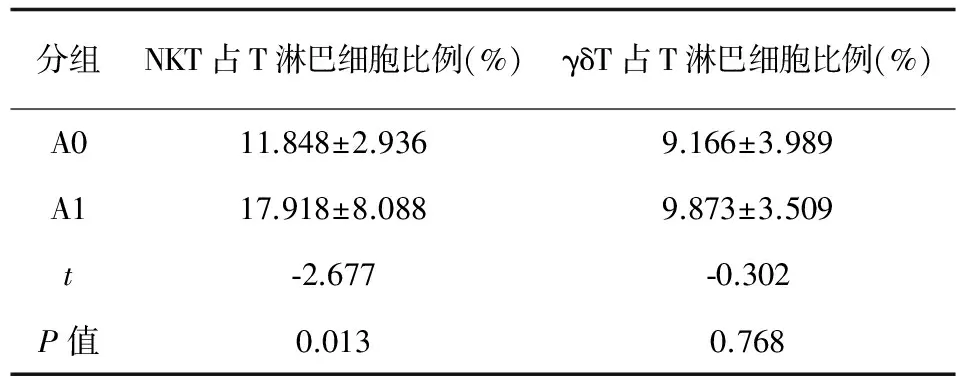
分组NKT占T淋巴细胞比例(%)γδT占T淋巴细胞比例(%)A011.848±2.9369.166±3.989A117.918±8.0889.873±3.509t⁃2.677⁃0.302P值0.0130.768
表5B组NKT、γδT细胞占外周血T淋巴细胞比例比较
Tab.5The proportions of NKT and γδT cells in T lymphocyte of peripheral blood of group B

分组NKT占T淋巴细胞比例(%)γδT占T淋巴细胞比例(%)B011.830±1.3508.094±2.037B114.806±1.5136.984±0.843t⁃1.4680.504P值0.1680.624
Th1/Th2类细胞因子与新生隐球菌感染的发生、发展、转归都有密切的关系。在生理条件下,机体Th1/ Th2 细胞的免疫功能处于动态平衡状态,如果该状态失衡,Th1类细胞因子减少,Th2类细胞因子占优势,则可导致机体抵御新生隐球菌的免疫功能减弱或者丧失,导致易感性增加[3]。本研究将未经抗真菌治疗隐脑患者及健康对照人群进行对比,发现在对CD4+T细胞进行刺激后,患者组IFN-γ表达较健康人低,而IL-4表达水平则较健康人高,其差异有统计学意义 (P<0.01),其结果表明隐脑患者Th1/Th2平衡状态失调,Th1细胞在CD4+T淋巴细胞中所占比例减少,Th2细胞所占比例增加。而在对经治疗好转前后的隐脑患者自身进行对比,可发现经治疗后好转组Th1细胞所占比例较治疗前增加,而Th2细胞所占比例则有所下降,但差异无统计学意义 (P>0.05),考虑可能与入选好转组病例数偏少有关。
最近发现T细胞还存在着其他亚群,其中NKT细胞及γδT细胞被认为能共同调节T辅助细胞介导的抗新生隐球菌免疫反应[5]。在对动物感染模型的实验中发现NKT和γδT细胞在新生隐球菌初始感染后可各自通过不同模式迅速在肺组织中聚集,而在使Vα14 NKT细胞合成障碍的基因敲除小鼠中,Th1细胞相关炎症反应及病原微生物的清除较对照小鼠明显减弱;在缺乏γδT细胞的小鼠中,机体对新生隐球菌感染的保护性炎症反应反而得到了增强。在对已经感染新生隐球菌小鼠注射NKT活化剂α-GalCer进行治疗,发现NKT细胞水平明显上调的同时,机体对组织中感染病原体的清除能力也同时得到了增强。
在上述的研究中,NKT、γδT细胞都被认为在机体抵抗新生隐球菌感染进程中起着重要的作用,但其结论都基于各种动物实验结果,目前国内外尚无隐球菌感染患者组织或血液中NKT、γδT细胞水平变化研究的报道。本研究将未经抗真菌治疗隐脑患者及健康对照人群进行对比,发现在未经治疗的患者组NKT在T淋巴细胞中的比例较健康人明显为低,其差异有统计学意义 (P<0.05),而γδT所占比例则与健康人无明显差别,经治疗好转后患者组NKT比例则较治疗前有所增加,γδT比例则有所下降,但其差异性皆无统计学意义 (P>0.05)。
通过本研究结果可知,新生隐球菌性脑膜炎/脑膜脑炎患者的Th1/Th2平衡状态失调,Th1细胞及其分泌细胞因子减少,Th2细胞及其分泌细胞因子增加,这不仅使机体对新生隐球菌易感性增加,并弱化了之后免疫系统针对隐球菌感染后的各项细胞免疫反应,导致病情进一步发展。而在经过抗真菌治疗,病情好转,Th1/Th2失衡状态同时亦有所改善,Th1细胞较治疗前回升,而Th2细胞水平则较前下降,平衡向Th1方向倾斜,这可能提示患者的细胞免疫功能恢复对疾病预后起重要作用。从实验结果同时可知,患者组的NKT细胞较正常人明显为低,因此无法产生足够的IFN-γ及IL-12作用于Th0细胞,使其向Th1方向分化,NKT细胞的减少亦无法激活正常数量的NK细胞,最终导致机体抗隐球菌感染的能力低下。由于固有免疫T细胞间可能存在着一种相互制约的关系使Th1及Th2类因子处于一种适当的平衡状态,而本实验结果提示患者组的γδT细胞与正常人并无明显差异,导致平衡向Th2方向倾斜,从而下调了机体抵御新生隐球菌感染能力。
虽然在动物实验中证实Th1类细胞因子减少可导致其对新生隐球菌易感,但由于无法预先检测隐脑患者患病前Th1及Th2类细胞因子及NKT、γδT细胞的分布比例,因此无法确定患病后其比例失调与患者本身存在免疫功能缺陷有关,还是由于隐球菌感染自身也可导致。目前也尚无分析感染前后Th1/Th2平衡状态变化的文献报道,因此,关于Th1/Th2平衡状态及NKT、γδT细胞如何影响新生隐球菌感染进程的相关研究仍有待进一步深入。
而如何人为介入,并安全有效地在Th1/Th2平衡失调的患者身上重新建立起有效的抵御隐球菌的保护屏障,或通过改变NKT细胞、γδT细胞的活化水平来增强隐球菌感染机体的免疫细胞 (如NK细胞、巨噬细胞等)对隐球菌的杀伤仍有待进一步实验的明确。目前关于通过改变Th1/Th2状态辅助治疗新生隐球菌感染的报道十分稀少,国外研究[8-10]通过增强严重联合免疫缺陷 (SCID)小鼠Th1类细胞的活性可增强抗真菌药物对中枢神经系统隐球菌病的治疗作用。部分临床医师认为在隐球菌病抗真菌治疗中使用免疫活性肽 (如胸腺肽,可促使Th1类细胞因子分泌增加,Th2类因子分泌减少)作为辅助治疗可取得更好的疗效,但目前尚无大样本的临床报道。而对感染小鼠注射NKT细胞活化剂α-Galcer,发现能增加Th1细胞及NK细胞所产生的IFN-γ,使Th1/Th2平衡向Th1方向倾斜,增强其免疫系统抵抗新生隐球菌感染的能力,显著减少感染组织中隐球菌的存活数[11]。以上研究皆提示在免疫缺陷患者感染性疾病 (包括新生隐球菌性脑膜炎)中,通过改变Th1/Th2平衡状态,适当引发Th1型炎症反应将是一种可能有效的治疗方法。
通过进一步加深对T辅助细胞及相关T淋巴细胞与新生隐球菌感染作用机制的了解,可为进一步弄清隐球菌病的发病机制及临床探讨预防和治疗隐球菌病途径,开发新的治疗方法或治疗药物提供理论依据,从而提高新生隐球菌病的防治水平。
[1] 顾菊林,温海,廖万清,等.隐球菌性脑膜炎患者临床免疫指标分析[J].临床皮肤科杂志,2003,32(2):72-73.
[2] 翁心华.隐球菌病[M].秦启贤编.临床真菌学.第1版.上海:复旦大学出版社,2001:346-363.
[3] Koguchi Y,Kawakami K.Cryptococcal infection and Th1-Th2 cytokine balance[J].Int Rev Immunol,2002,21(45):423-438.
[4] Snelgrove RJ,Edwards L,Williams AE,et al.In the absence of reactive oxygen species,T cells default to a Th1 phenotype and mediate protection against pulmonaryCryptococcusneoformansinfection[J].J Immunol,2006,177(8):5509-5516.
[5] Kawakami K.Regulation by innate immune T lymphocytes in the host defense against pulmonary infection withCryptococcusneoformans[J].Jpn J Infect Dis,2004,57 (4):137-145.
[6] Stockstill MT,Kaufman CA.Comparison of cryptococcal and tuberculous meningitis[J].Arch Neurol,1983,40(2):81-85.
[7] Sato Y,Osabe S,Kuno H,et al.Rapid diagnosis of cryptococcal meningitis by microscopic examination of centrifuged cerebrospinal fluid sediment[J].J Neurol Sci,1999,164(1):72-75.
[8] Clemons KV,Lutz JE,Stevens DA.Efficacy of recombinant gamma interferon for treatment of systemic cryptococcosis in SCID mice[J].Antimicrob Agents Chemother,2001,45(3):686-689.
[9] Retini C,Kozel TR,Pietrella D,et al.Interdependency of interleukin-10 and interleukin-12 in regulation of T2 cell differentiation and effector function of monocytes in response to stimulation withCryptococcusneoformans[J].Infect Immun,2011,69 (10):6064-6073.
[10] Clemons KV,Brummer E,Stevens DA.Cytokine treatment of central nervous system infection:efficacy of interleukin-12 alone and synergy with conventional antifungal therapy in experimental cryptococcosis[J].Antimicrob Agents Chemother,1994,38(3):460-464.
[11] Kawakami K,Kinjo Y,Yara,S,et al.Activation of Valpha14(+) natural killer T cells by alpha-galactosylceramide results in development of Th1 response and local host resistance in mice infected withCryptococcusneoformans[J].Infect Immun,2001,69(1):213-220.
TheproportionsofTh1/Th2andRelevantTlymphocytesinpatientswithcryptococcalmeningitisanditsclinicalsignificance
HUANG Huang1,XIAN Ying2,PAN Yue-jun1,ZHANG Kou-xing2
(1.GuangzhouEighthPeople'sHospital,Guangzhou510060,China;2.TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China)
ObjectiveThis study is to further understanding the mechanism of T helper cells in course ofC.neofermansinfection from patient's level through measuring the proportions of Th1 /Th2 cell factors and NKT cells,γδT cells in peripheral blood between normal adult and patients.Analyze whether the change presents relevance with the disease prognosis.MethodThe peripheral blood samples were collected from 16 patients with cryptococcal meningitis,and 10 healthy people.The proportions of Th1/Th2 cell factors and NKT cells,γδ T cells were analyzed by flow cytometry (FCM).Results1.The proportion of Th1 cells in CD4 +T lymphocyte of patients with cryptococcal meningitis before treatment was (13.093±4.618)%,less than that of healthy people (19.582±4.949)%,P<0.01.And the proportion of Th2 cells was (1.769±0.865)%,higher than that of healthy people (0.584±0.202)%,P<0.01.2.Patients who
treatment showed the increased levels of Th1 cells in CD4 +T lymphocyte (16.069±1.516)% which was higher than those in patients before treatment (13.589±2.101)%,P>0.05.The proportion of Th2 cells in the patients had received treatment was (1.499±0.274)%,less than those of patients before treatment (1.673±0.290)%,P>0.05.3.The proportion of NKT cells in T lymphocyte of patients with cryptococcal meningitis before treatment was (11.848±2.936)%,less than those of healthy people (17.918±8.088)%,P<0.05.No significant differences of proportions of γδT in T lymphocyte among patients before treatment and healthy people[(9.166±3.989)% vs (9.873±3.509)%],P>0.05.4.Patients who received treatment showed the increased levels of NKT cells in T lymphocyte (14.806±1.513)% which was higher than those in patients before treatment (11.830±1.350)%,P>0.05.The proportion of γδT cells in the patients who had received treatment was (6.984±0.843)%,less than those of patients before treatment (8.094±2.037)%,P>0.05.Conclutions1.The balance of Th1/Th2 falls towards Th2 and the decrease of the proportion of NKT cells among T lymphocytes in patients with cryptococcal meningitis.It suggests that the cell-mediated immunity of patients with cryptococcal meningitis is weakened.2.Once the patients get better after treatment,Th1/Th2 imbalance would be corrected in that the balance turned to Th1 direction.It suggests that the recovery of cell-mediated immunity may improve the prognosis of these disease.
Cryptococusneofermans;infections;Th1/Th2;NKT;γδT
[Chin J Mycol,2017,12(5):268-273]
R 519.4
A
1673-3827(2017)12-0268-06
黄煌,男 (汉族),硕士,主治医师.E-mail:gz8hhh@126.com
张扣兴,E-mail:kxz6210@tom.com
2016-09-09
[本文编辑] 卫凤莲
