人类免疫缺陷病毒阴性隐球菌性脑膜炎患者外周血淋巴细胞亚群分析
2017-12-15谢静葛瑛邱志峰张凯宇刘正印李太生
谢静 葛瑛 邱志峰 张凯宇 刘正印 李太生
(1.中国医学科学院 北京协和医学院 北京协和医院感染内科,北京 100730;2.中国医学科学院 临床免疫中心,北京 100730)
·论著·
人类免疫缺陷病毒阴性隐球菌性脑膜炎患者外周血淋巴细胞亚群分析
谢静1,2葛瑛1邱志峰1张凯宇1刘正印1,2李太生1,2
(1.中国医学科学院 北京协和医学院 北京协和医院感染内科,北京 100730;2.中国医学科学院 临床免疫中心,北京 100730)
目的分析人类免疫缺陷病毒 (Human immunodeficiency virus,HIV)阴性隐球菌性脑膜炎 (Cryptococcal meningitis,CM)患者外周血淋巴细胞亚群改变特点,深化对隐球菌病发病机制的认识。方法筛选HIV阴性CM患者31例和健康献血员21例进行淋巴细胞亚群分析,CM患者根据是否存在免疫抑制基础疾病分为两个亚组,比较3组研究对象淋巴细胞亚群中B、NK、CD4+T、CD8+T细胞亚群,CD4+T及CD8+T细胞的第二信号受体CD28表达比例及CD8+T细胞激活标记物HLA-DR、CD38的表达水平。结果有基础病CM组B、NK、CD4+T和CD8+T 4种亚群中位数依次为56×106/L、86×106/L、218×106/L、164×106/L,显著低于健康对照组的223×106/L、280×106/L、695×106/L、521×106/L (P值均<0.001),同时存在CD8+T细胞激活亚群比例较健康对照显著升高。无基础病CM患者上述4种细胞亚群中位数依次为128×106/L、128×106/L、567×106/L、527×106/L,除CD8+T细胞计数水平与健康对照相似以外,B (P=0.02)、NK (P=0.002)和CD4+T细胞 (P=0.03)计数均低于健康对照,其CD8+T细胞激活亚群比例与健康对照组相似。CD4+T和CD8+T细胞的CD28表达水平在3组间未见显著差异。结论HIV阴性CM患者,无论是否存在免疫抑制基础疾病,外周血B、NK及CD4+T 3种细胞计数可出现同时减少。
脑膜炎,隐球菌性;淋巴细胞亚群;CD4+T细胞
隐球菌性脑膜炎 (Cryptococcal meningitis,CM)是由新生隐球菌复合体 (Cryptococcusneoformans/C.gattiispecies complex)侵犯中枢神经系统引起的侵袭性真菌感染,起病隐匿,临床误诊率高,如不早期积极针对性治疗,可引起颅神经不可逆损害,甚至死亡。CM是发展中国家人类免疫缺陷病毒 (Human immunodeficiency virus,HIV)感染者最常见的中枢神经系统机会性感染[1],抗逆转录病毒治疗的广泛应用使HIV相关性CM发病率呈现降低趋势[2]。随着免疫抑制剂在器官移植、自身免疫病、肿瘤等疾病治疗中的应用,发生于HIV阴性但存在免疫功能抑制人群的CM逐渐增多[3]。更为值得注意的是,近年无器官移植、自身免疫病等明确免疫抑制基础疾病的CM病例也时有报道[4-5]。因此,HIV阴性CM的发病机制和诊疗策略引起研究者们重视。
CM的发生、发展和转归与患者免疫功能状态密切相关。但目前关于HIV阴性CM的研究多集中于流行病学与临床特征分析[5-8],对免疫功能的评估仅有少数报道[9-10]。以往曾将临床未见明确免疫抑制基础疾病的CM患者称为近似免疫正常患者 (apparently immunocompetent patients)[11],但已有学者发现这部分患者存在固有免疫的甘露糖结合凝集素的基因遗传缺陷[12],因此“近似免疫正常患者”的免疫是否正常需要更多研究来提供证据。通过流式细胞术分析淋巴细胞表型能够定量检测各个细胞亚群,为评估机体免疫功能状态提供重要信息。本研究对HIV阴性CM患者淋巴细胞亚群进行分析,首先比较了B、NK、CD4+T和CD8+T 4种细胞的比例及计数,然后分析了T细胞第二信号受体CD28的表达比例、以及CD8+T细胞激活亚群比例的改变,旨在深化对发病机制的认识,为临床诊治提供帮助。
1 对象与方法
1.1 研究对象
2000年1月~2015年12月在我院诊治的HIV阴性CM且进行过淋巴细胞亚群检测的患者。根据是否存在免疫抑制状态及免疫缺陷基础疾病分为两个亚组:存在基础病组和无基础病组。免疫抑制基础病包括肿瘤化疗后、自身免疫病接受激素或免疫抑制剂治疗、糖尿病、肝硬化、慢性肾病透析、及其他疾病需要接受免疫抑制剂治疗。CM诊断基于如下脑脊液检查:墨汁染色镜检阳性,隐球菌培养阳性或荚膜多糖抗原滴度>1∶8。健康对照为自我院健康医学部招募的健康献血员。研究方案通过我院伦理委员会审批。
1.2 外周血淋巴细胞亚群检测
所检测亚群包括:B细胞 (CD3-CD19+)、NK细胞(CD3-CD16/56+)、CD4+T细胞(CD3+CD4+)、CD8+T细胞(CD3+CD8+T)、CD4+T和CD8+T细胞的第二信号受体CD28表达比例(CD28+CD4+T/CD4+T,CD28+CD8+T/CD8+T)、CD8+T细胞的HLA-DR、CD38表达比例(HLA-DR+CD8+T/CD8+T,CD38+CD8+T/CD8+T)。对CM患者淋巴细胞亚群的检测均在抗真菌治疗前进行。所用荧光抗体及同型对照均购自美国Becton Dickinson公司。用乙二胺四乙酸三钾抗凝真空采血管采集外周静脉血。取流式检测管,向其中加入荧光抗体组合,再加入100 μL抗凝全血,混匀后室温避光孵育15 min,加入500 μL溶血素,室温溶血15 min。加入2 mL磷酸缓冲液,1 500 r/min,5 min,洗涤2次。加入500 μL固定液重悬细胞,经FACSCanto Ⅱ型流式细胞仪 (美国Becton Dickinson公司)上机测定,获取淋巴细胞亚群比例,再根据同期外周血常规检测淋巴细胞绝对计数计算得出淋巴细胞亚群的绝对计数。
1.3 统计学分析
使用SPSS 19.0软件包进行统计分析。变量以M(P25,P75)表示。采用非参数统计检验,首先采用Kruskal-WallisH检验进行3组独立样本比较,存在显著差异的变量再采用Mann-WhitneyU检验进行两两组间比较,以P<0.05为差异有显著性。
2 结 果
2.1 研究对象一般资料
CM患者共31例。其中有基础疾病组16例,男女各8例,年龄 (40±16)岁,包括自身免疫性疾病7例、糖尿病3例、慢性乙型肝炎/肝硬化3例,天疱疮、尿崩症及淋巴结结核各1例。无基础病组15例,男10例,女5例,年龄 (42±17)岁。健康献血员21例,男14例,女7例,年龄 (44±7)岁。3组研究对象在年龄、性别构成比方面均未见显著差异。
2.2 白细胞和淋巴细胞
如表1所示,白细胞计数在有基础病CM患者组最低,中位数为4 145×106/L,显著低于无基础病组的7 340×106/L (P=0.02),与健康对照的5 850×106/L相比存在降低趋势但差异无统计学意义,无基础病组的白细胞计数水平与健康对照相似。淋巴细胞计数在有基础病组最低,其中位数仅为552×106/L,显著低于健康对照 (1 949×106/L,P<0.001)和无基础病CM组 (1 487×106/L,P<0.001),后两组的淋巴细胞计数差异无统计学意义 (P=0.08)。
表1健康对照、有免疫抑制基础病CM和无免疫抑制基础病CM 3组外周血淋巴细胞亚群比例及计数[M(P25,P75)]
Tab.1Peripheral lymphocyte subsets in healthy donors and cryptococcal meningitis patients with or without immunocompromised comorbidities[M(P25,P75)]
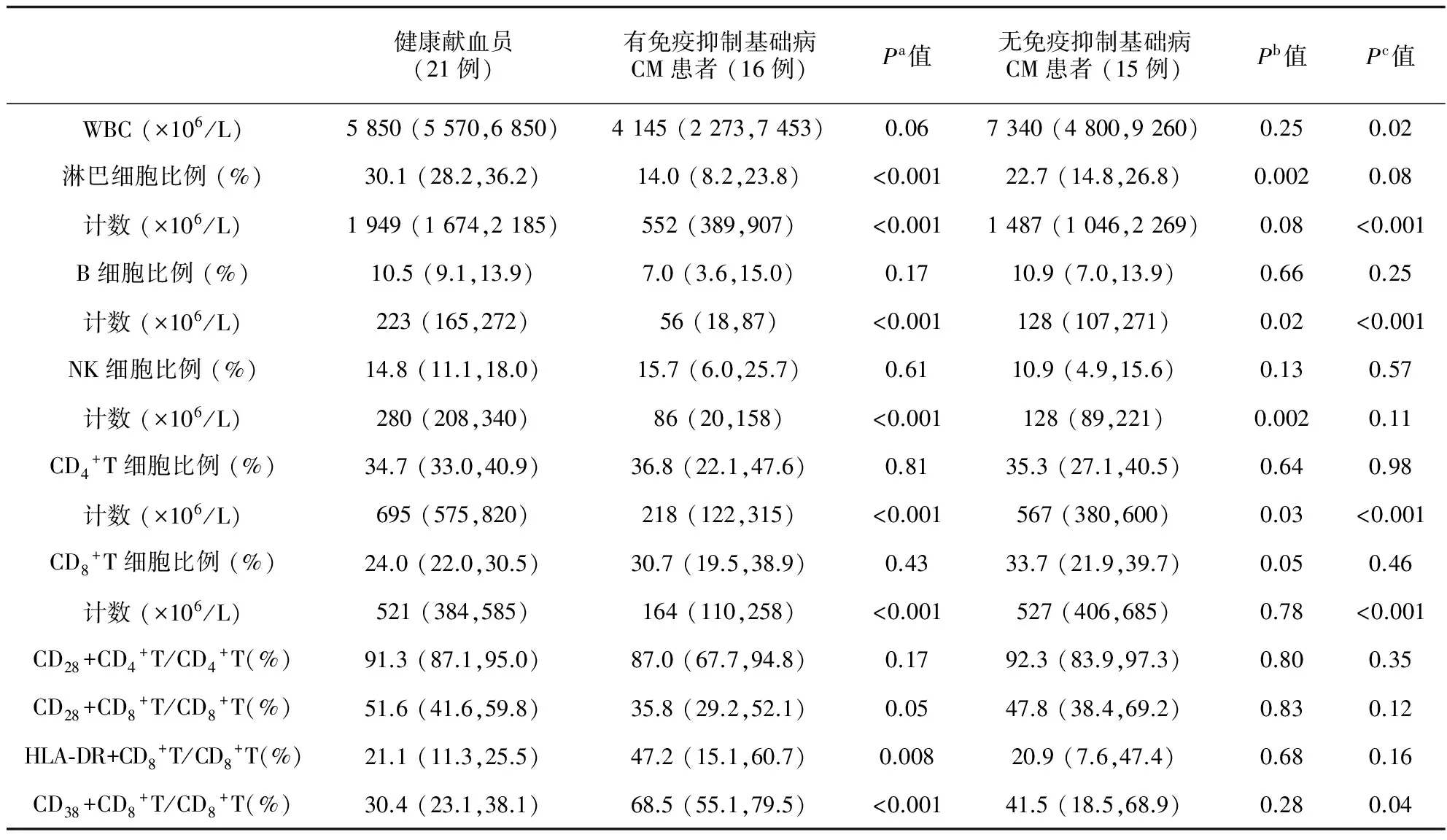
健康献血员(21例)有免疫抑制基础病CM患者(16例)Pa值无免疫抑制基础病CM患者(15例)Pb值Pc值WBC(×106/L)5850(5570,6850)4145(2273,7453)0.067340(4800,9260)0.250.02淋巴细胞比例(%)30.1(28.2,36.2)14.0(8.2,23.8)<0.00122.7(14.8,26.8)0.0020.08计数(×106/L)1949(1674,2185)552(389,907)<0.0011487(1046,2269)0.08<0.001B细胞比例(%)10.5(9.1,13.9)7.0(3.6,15.0)0.1710.9(7.0,13.9)0.660.25计数(×106/L)223(165,272)56(18,87)<0.001128(107,271)0.02<0.001NK细胞比例(%)14.8(11.1,18.0)15.7(6.0,25.7)0.6110.9(4.9,15.6)0.130.57计数(×106/L)280(208,340)86(20,158)<0.001128(89,221)0.0020.11CD4+T细胞比例(%)34.7(33.0,40.9)36.8(22.1,47.6)0.8135.3(27.1,40.5)0.640.98计数(×106/L)695(575,820)218(122,315)<0.001567(380,600)0.03<0.001CD8+T细胞比例(%)24.0(22.0,30.5)30.7(19.5,38.9)0.4333.7(21.9,39.7)0.050.46计数(×106/L)521(384,585)164(110,258)<0.001527(406,685)0.78<0.001CD28+CD4+T/CD4+T(%)91.3(87.1,95.0)87.0(67.7,94.8)0.1792.3(83.9,97.3)0.800.35CD28+CD8+T/CD8+T(%)51.6(41.6,59.8)35.8(29.2,52.1)0.0547.8(38.4,69.2)0.830.12HLA⁃DR+CD8+T/CD8+T(%)21.1(11.3,25.5)47.2(15.1,60.7)0.00820.9(7.6,47.4)0.680.16CD38+CD8+T/CD8+T(%)30.4(23.1,38.1)68.5(55.1,79.5)<0.00141.5(18.5,68.9)0.280.04
注:Pa.存在免疫抑制基础病的CM患者和健康对照比较;Pb.无免疫抑制基础病的CM患者和健康对照比较;Pc.CM患者两组间比较
2.3 B、NK、CD4+T和CD8+T细胞亚群
如表1和图1A所示,淋巴细胞中B、NK、CD4+T和CD8+T 4种细胞亚群所占比例在3组间均未见显著差异。绝对计数方面,有基础病CM组B、NK、CD4+T和CD8+T 4种亚群中位数依次为56×106/L、86×106/L、218×106/L、164×106/L,显著低于健康对照组的223×106/L、280×106/L、695×106/L、521×106/L (P值均<0.001)。无基础病CM患者上述4种细胞亚群中位数依次为128×106/L、128×106/L、567×106/L、527×106/L,除CD8+T细胞计数水平与健康对照相似以外,B (P=0.02)、NK (P=0.002)和CD4+T细胞 (P=0.03)计数均低于健康对照。CM两个亚组之间比较,除NK细胞外 (P=0.11),有基础病组B、CD4+T和CD8+T细胞计数均显著低于无基础病组 (P值均<0.001)。从CD4+T细胞计数构成比分布来看 (见图1B),有基础病组16例患者的CD4+T细胞计数全部低于500×106/L,CD4+T细胞计数从低到高的患者例数分布依次为:<100×106/L 3例、(100~200)×106/L 4例,(200~500)×106/L 9例。无基础病组CD4+T细胞计数:<100×106/L 1例,(200~400)×106/L 5例,>500×106/L 9例 (占60%)。
2.4 CD4+T和CD8+T细胞第二信号受体CD28表达比例
如表1和图2A所示,有基础病CM组CD4+T和CD8+T细胞的CD28表达比例中位数分别为87.0%和35.8%,该比例在无基础病CM组分别为92.3%和47.8%,在健康对照为91.3%和51.6%。CD4+T和CD8+T细胞的CD28表达水平在3组间未见显著差异。
2.5 CD8+T细胞激活标记物HLA-DR和CD38表达比例
如表1和图2B所示,CD8+T细胞的HLA-DR表达比例差异仅见于有基础病CM组和健康对照两组 (中位数47.2% vs 21.1%,P=0.008),无基础病CM组和健康对照 (P=0.68)以及两个CM组之间 (P=0.16)均未见显著差异。CD8+T细胞的CD38表达比例中位数在有基础病CM组为68.5%,显著高于无基础病CM组的41.5% (P=0.04)和健康对照的30.4% (P<0.001)。
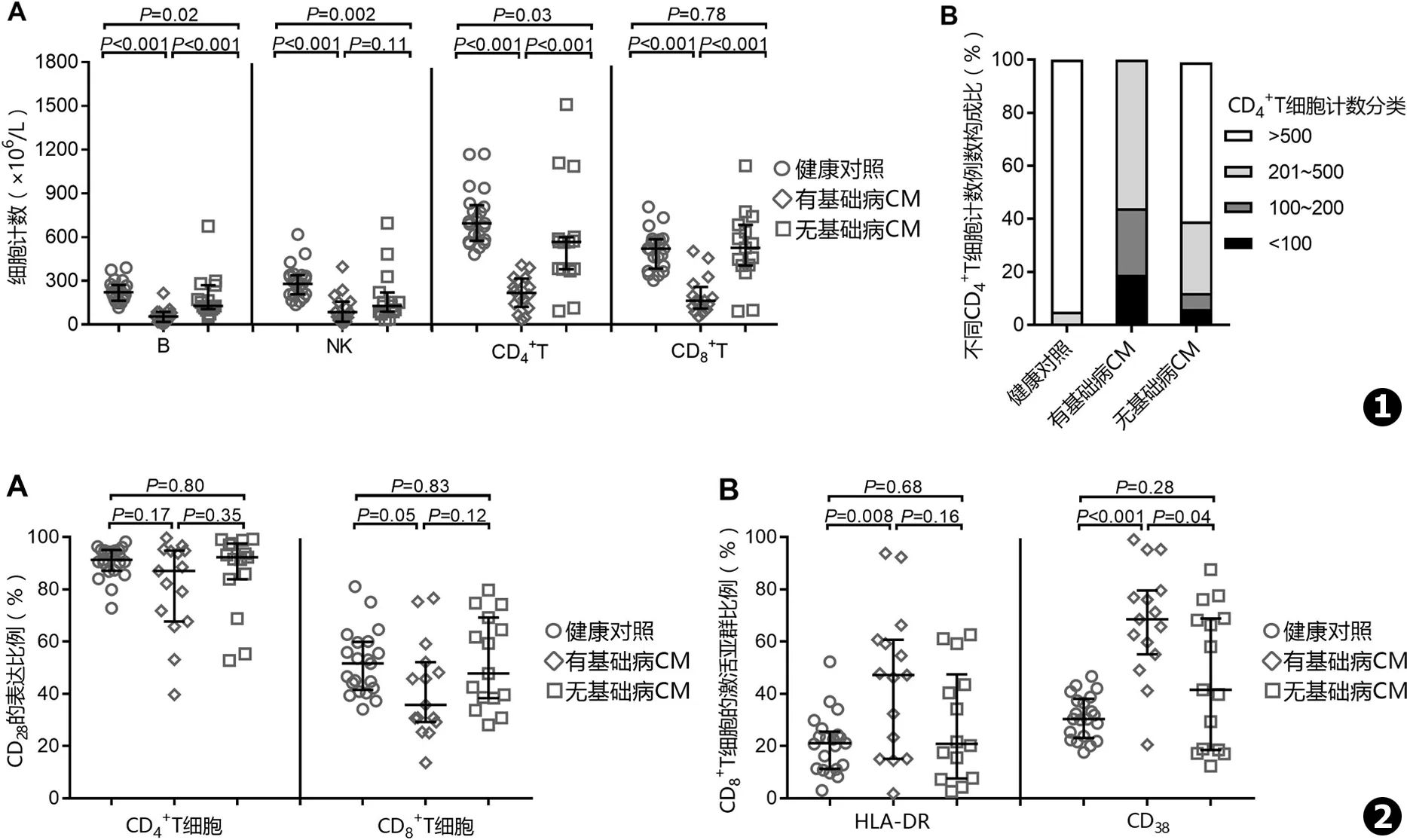
图1外周血B、NK、CD4+T、CD8+T细胞亚群绝对计数 (A)和不同CD4+T细胞计数例数构成比 (B)在健康对照、有免疫抑制基础病CM和有基础病CM 3组的比较图2CD4+T、CD8+T细胞第二信号受体CD28表达比例 (A)和CD8+T细胞激活亚群比例 (B)在健康对照、有免疫抑制基础病CM和有基础病CM 3组的比较
Fig.1Peripheral B,NK,CD4+T and CD8+T cells counts (A),proportions of patients with different CD4+T cell count levels (B) in healthy donors and cryptococcal meningitis patients with or without immunocompromised comorbiditiesFig.2CD28expression on CD4+T and CD8+T cells (A),activation markers (HLA-DR and CD38) on CD8+T cells (B) in healthy donors and cryptococcal meningitis patients with or without immunocompromised comorbidities
3 讨 论
本研究提示,存在免疫抑制基础疾病的CM患者外周血淋巴细胞亚群改变以B、NK、CD4+T和CD8+T细胞4种亚群计数同时显著降低为主要特点,伴有CD8+T细胞激活水平明显升高。虽然部分CM患者临床上未发现其存在明确免疫抑制基础疾病,但外周血B、NK及CD4+T 3种细胞同时降低,而CD8+T细胞计数水平与健康对照类似,而且其激活标记物HLA-DR、CD38的表达比例也无显著改变。
细胞免疫应答是机体控制隐球菌感染的主要免疫效应机制,因此隐球菌病最常见于T细胞功能抑制/缺陷人群。外周血CD4+T细胞计数是目前临床最常用的细胞免疫功能评价指标。HIV相关性CM主要发生于CD4+T细胞计数低于100×106/L的患者[13],抗逆转录病毒治疗后CD4+T细胞计数增加到200×106/L以上并持续6个月可停止抗真菌药的维持治疗[14]。而本研究中两组HIV阴性CM患者CD4+T细胞计数虽然均显著低于健康对照组,但构成比各有特点。有基础病组16例CM患者虽然CD4+T细胞计数全部低于500×106/L,但其中56%高于200×106/L。而无基础病组有60%的患者CD4+T细胞计数高于500×106/L。总体来看,与HIV相关性CM相比,HIV阴性CM患者CD4+T细胞计数相对较高,尤其是不存在免疫抑制基础疾病的患者中有相当比例CD4+T细胞计数高于500×106/L,而这一CD4+T细胞计数水平在HIV感染者通常被认为是不容易发生机会性感染的人群。造成HIV阳性和阴性人群CM患者CD4+T细胞计数水平差异的原因目前未知。一个可能的原因推测与细胞功能有关,细胞数量不低但其功能缺陷也会导致免疫应答缺陷无法有效控制感染。本研究中CD4+T和CD8+T细胞的CD28表达水平在3组研究对象间未见显著差异。CD28是T细胞第二信号受体,CD28阴性的T细胞无法被活化、呈无能 (anergy)状态,CD28可被认为是反应T细胞功能的指标之一。因此,从细胞因子产生、增殖能力等方面探讨CM患者细胞免疫功能是将来值得深入研究的方向。
免疫激活是免疫系统启动免疫防御机制的正常过程,HLA-DR和CD38是目前应用较多的两种激活标记物。HLA-DR是主要组织相容抗原复合体 (MHC)Ⅱ类分子,表达于细胞表面参与活化信号转导和抗原肽提成[15]。CD38属于Ⅱ型单链类跨膜糖蛋白,参与淋巴细胞的活化信号转导、分化和增殖的调节等,淋巴细胞前体高表达CD38,随着细胞分化成熟CD38表达降低,当出现抗原刺激时,活化的淋巴细胞重新高表达CD38[16]。本研究中虽然基础病CM组CD8+T细胞激活水平明显升高,但不能除外其基础病本身引起淋巴细胞亚群改变[17-18],尤其是结合无基础病CM组CD8+T细胞的HLA-DR、CD38表达比例与健康对照相比无显著变化,更加合理的推测是:中枢神经系统的隐球菌感染可能不会对外周血CD8+T细胞的HLA-DR、CD38表达造成影响,对中枢神经系统的激活指标进行直接检测会提供更加有力的证据[10]。
B和NK细胞分别是体液免疫和固有免疫的效应细胞。B和NK细胞计数降低是本组CM患者淋巴细胞亚群改变的另一特点。这与国外研究结果不同。美国的研究显示,与健康对照相比,无免疫抑制基础病的CM患者外周血B和NK细胞计数无显著改变[10]。上述差异的原因目前未知,值得未来做进一步研究。
本研究为观察性研究,不同研究对象的淋巴细胞亚群改变特点与疾病之间的关系只能得出存在相关性的结论,无法推论出因果关系。存在基础疾病的CM患者,需要综合考虑基础病本身和免疫抑制剂等治疗手段对淋巴细胞亚群造成的影响,因此这一组病例淋巴细胞亚群的改变是多种因素共同作用的结果。无基础疾病的CM患者,不能除外存在罕见免疫缺陷病的情况[13],囿于临床诊疗手段的局限性,目前无法逐一排除。本研究对患者淋巴细胞亚群的检测均在抗真菌治疗前进行,未能观察治疗前后的淋巴细胞亚群变化。基于本次横断面研究的结果,CM患者抗真菌治疗前后多个时间点淋巴细胞亚群变化的纵向队列研究是未来值得探讨的内容。
本研究对HIV阴性CM患者淋巴细胞亚群的分析表明,无论是否存在免疫抑制基础疾病,外周血B、NK及CD4+T 3种细胞计数可表现出同时减少。这一结果提示,CM患者淋巴细胞亚群的动态改变及其与抗真菌治疗疗效的相关性是未来值得深入研究的方向。近年流行病学研究发现,我国隐球菌病患者中不存在器官移植、自身免疫病等明确免疫抑制基础疾病的比例可高达60%以上,这一比例明显高于欧洲和北美等地区[13,19],未来需要重视对这部分患者CM的发病机制、治疗及预后研究。
[1] Bowen LN,Smith B,Reich D,et al.HIV-associated opportunistic CNS infections:pathophysiology,diagnosis and treatment[J].Nat Rev Neurol,2016,12(11):662-674.
[2] Bamba S,Lortholary O,Sawadogo A,et al.Decreasing incidence of cryptococcal meningitis in West Africa in the era of highly active antiretroviral therapy[J].AIDS,2012,26(8):1039-1041.
[3] Pappas PG,Perfect JR,Cloud GA,et al.Cryptococcosis in human immunodeficiency virus-negative patients in the era of effective azole therapy[J].Clin Infect Dis,2001,33(5):690-699.
[4] Chau TT,Mai NH,Phu NH,et al.A prospective descriptive study of cryptococcal meningitis in HIV uninfected patients in Vietnam-high prevalence ofCryptococcusneoformansvargrubiiin the absence of underlying disease[J].BMC Infect Dis,2010,10:199.
[5] Tan ZR,Long XY,Li GL,et al.Spectrum of neuroimaging findings in cryptococcal meningitis in immunocompetent patients in China-A series of 18 cases[J].J Neurol Sci,2016,368:132-137.
[6] 刘加,方文捷,洪南,等.免疫正常人群隐球菌性脑膜炎临床分析[J].中国真菌学杂志,2016,11(2):99-102.
[7] 林苏,张彦亮,邵凌云,等.隐球菌性脑膜炎并发颅神经损伤的危险因素及预后因素分析[J].中华传染病杂志,2013,31(3):155-159.
[8] 刘正印,王爱霞,李太生,等.隐球菌性脑膜炎26 例临床分析[J].中华内科杂志,2002,41(8):541-543.
[9] Xu L,Huang Q,Lin JR,et al.Clinical immunophenotype at disease onset in previously healthy patients with cryptococcal meningitis[J].Medicine (Baltimore),2016,95(6):e2744.
[10] Panackal AA,Wuest SC,Lin YC,et al.Paradoxical immune responses in Non-HIV cryptococcal meningitis[J].PLoS Pathog 2015,11(5):e1004884.
[11] Chen J,Varma A,Diaz MR,et al.Cryptococcusneoformansstrains and infection in apparently immunocompetent patients,China[J].Emerg Infect Dis,2008,14(5):755-762.
[12] 朱利平,翁心华.非艾滋病相关隐球菌脑膜炎的新认识[J].临床内科杂志,2011,28(8):521-523.
[13] Williamson PR,Jarvis JN,Panackal AA,et al.Cryptococcal meningitis:epidemiology,immunology,diagnosis and therapy[J].Nat Rev Neurol,2017,13(1):13-24.
[14] 中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南第三版(2015版)[J].中华临床感染病杂志,2015,8(5):385-401.
[15] Corneau A,Cosma A,Even S,et al.Comprehensive mass cytometry analysis of cell cycle,activation,and coinhibitory receptors expression in CD4T cells from healthy and HIV-infected individuals[J].Cytometry B Clin Cytom,2017,92(1):21-32.
[16] Quarona V,Zaccarello G,Chillemi A,et al.CD38and CD157:a long journey from activation markers to multifunctional molecules[J].Cytometry B Clin Cytom,2013,84(4):207-217.
[17] Bijl M,Horst G,Limburg PC,et al.Fas expression on peripheral blood lymphocytes in systemic lupus erythematosus (SLE):relation to lymphocyte activation and disease activity[J].Lupus,2001,10(12):866-872.
[18] Cao W,Qiu ZF,Li TS.Parallel decline of CD8+CD38+lymphocytes and viremia in treated hepatitis B patients[J].World J Gastroenterol,2011,17(17):2191-2198.
[19] Fang W,Fa Z,Liao W.Epidemiology ofCryptococcusand cryptococcosis in China[J].Fungal Genet Biol,2015,78:7-15.
ImmunophenotypeofperipherallymphocytesinHIV-negativepatientswithcryptococcalmeningitis
XIE Jing1,2,GE Ying1,QIU Zhi-feng1,ZHANG Kai-yu1,LIU Zheng-yin1,2,LI Tai-sheng1,2
(1.DepartmentofInfectiousDiseases,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege,ChineseAcademyofMedicalSciences,Beijing100730,China;2.ClinicalImmunologyCenter,ChineseAcademyofMedicalSciences,Beijing100730,China)
ObjectiveTo find if immunophenotypic features of peripheral lymphocytes was associated with risk of cryptococcal meningitis (CM) in HIV-negative individuals.MethodsA total of 31 CM patients treated at a tertiary hospital in Beijing,China were included.They were divided into immunocompromised comorbidity group (n=16) and apparently immunocompetent group (n=15).Twenty-one healthy donors were included as control group.Lymphocyte subsets including B,NK,CD4+T,and CD8+T cells,CD28expression on T cells,and activation markers (HLA-DR and CD38) on CD8+T cells were determined by flow cytometry and compared among the three groups.ResultsCompared with healthy donors,immunocompromised comorbidity group had dramatically decreased median B cell (223 vs.56/μL),NK cell (280 vs.86/μL),CD4+T cell (695 vs.218/μL),and CD8+T cell (521 vs.164/μL) counts (Pvalues for all four subsets<0.001).Proportions of activated CD8+T cells were significantly increased in immunocompromised patients than that in healthy control.Except for CD8+T cell counts (527/μL),the median B cell (128/μL,P=0.02),NK cell (128/μL,P=0.002) and CD4+T cell (567/μL,P=0.03) were moderately reduced in the apparently immunocompetent group than those in the healthy donors.The levels of HLA-DR and CD38on CD8+T cells in the apparently immunocompetent group were similar with the healthy donors.CD28expression on CD4+T and CD8+T cells did not differ among the three groups.ConclusionsThe immunophenotype of CM patients with im-munocompromised comorbidity was characterized by generalized decreased B,NK,CD4+T,and CD8+T cells.Mild-to-moderate reduce in B cell,NK cell and CD4+T cell counts were observed in apparently immunocompetent patients.
cryptococcal meningitis;lymphocyte subsets;CD4+T cell
[Chin J Mycol,2017,12(5):262-267]
R 519.4
A
1673-3827(2017)12-0262-06
国家科技支撑计划课题 (2014BAI07B06),北京协和医院中青年科研基金 (pumch-2016-2.3)
谢静,女 (汉族),博士,助理研究员.E-mail:xiejing@pumch.cn
葛瑛,E-mail:geyingpumch@126.com
2017-03-24
[本文编辑] 施 慧
