3种微孢子虫在我国西南部分地区腹泻患者中的流行情况调查
2017-12-15邱璐瑶平静李文道丁嵩涛刘含登
邱璐瑶 平静 李文道 丁嵩涛 刘含登
(1.重庆医科大学基础医学实验中心,重庆 400331;2.重庆医科大学儿科学院,重庆 400331)
·论著·
3种微孢子虫在我国西南部分地区腹泻患者中的流行情况调查
邱璐瑶1,2平静1,2李文道1,2丁嵩涛1刘含登1
(1.重庆医科大学基础医学实验中心,重庆 400331;2.重庆医科大学儿科学院,重庆 400331)
目的调查毕氏肠道微孢子虫 (Enterocytozoonbieneusi)、肠炎微孢子虫 (Encephalitozoonintestinalis)和兔脑炎微孢子虫 (Encephalitozooncuniculi)在我国西南地区的流行情况。方法收集了124份西南地区腹泻患者的粪便,通过显微镜镜检、PCR检测等手段,进行微孢子虫的分离与鉴定。结果毕氏肠道微孢子虫和肠炎微孢子虫的检出率较高,分别为7.26% (9/124)和3.23% (4/124),兔脑炎微孢子虫的检出率为0。结论西南地区腹泻患者有感染微孢子虫的情况,感染类型多为毕氏肠道微孢子虫和肠炎微孢子虫。
微孢子虫;腹泻患者;感染;人畜共患;PCR检测
微孢子虫 (microsporidia)是一类专性细胞内寄生的真核微生物,目前学术界将其归于真菌一类,广泛寄生于无脊椎动物如蜜蜂、蚕和包括人在内的几乎所有种类的脊椎动物中[1]。目前已经报道的微孢子虫有160个属,约1 300种,其中8个属中的14个虫种可以感染人[2]。毕氏肠道微孢子虫 (Enterocytozoonbieneusi)和脑炎微孢子虫属 (Encephalitozoon)微孢子虫是感染人和动物最常见的病原体,具有人畜交叉感染的特性,感染者最典型的症状是腹泻。据Anane等[3]研究表明,阿苯达唑对脑炎微孢子虫有效,但对毕氏肠道微孢子虫 (E.bieneusi)无明显作用,而氟马西尼对二者均有效。
1985年,人类第一次在艾滋病患者身上发现毕氏肠道微孢子虫的感染[4],迄今为止,已发现一百多种能够同时感染人和动物的基因型[5]。目前已报道的基因型主要分为动物传染性基因型亚群 (Group 1)和宿主特异性基因型亚群 (Group2-5)。前者主要感染人,后者的宿主多为家畜和野生动物。值得一提的是,Group2中的部分基因型能够同时感染人和动物[6]。研究表明,毕氏肠道微孢子虫不但可以导致免疫功能缺陷者长期的致死性腹泻,还能够导致免疫功能正常者剧烈的自限性腹泻[4]。其主要通过粪口途径传播[7],几乎可以感染所有动物,尤其是哺乳动物和鸟类。脑炎微孢子虫中主要有3种类型可以感染人,即兔脑炎微孢子虫 (Encephalitozooncuniculi)、肠炎微孢子虫 (Encephalitozoonintestinalis)和海伦脑炎微孢子虫 (Encephalitozoonhellem)[8]。
近年来,基于ITS 序列的分型方法已广泛用于微孢子虫病的流行病学研究[9]。尽管已在许多不同种类的动物身上检测到微孢子虫,但对于微孢子虫感染人的研究仍然不够,我国更是鲜有报道,目前我们对于微孢子虫的传播过程并不完全清楚,因此对微孢子虫的感染现状进行调查很有必要。为此研究者收集了分别来自重庆市和四川省自贡市的粪便样本,检测毕氏肠道微孢子虫 (Enterocytozoonbieneusi)、肠炎微孢子虫 (Encephalitozoonintestinalis)和兔脑炎微孢子虫 (Encephalitozooncuniculi)这3种微孢子虫的感染情况,报告如下。
1 材料和方法
1.1 材料
腹泻患者的粪便来源于四川省自贡市和重庆市,重庆地区32份粪便样本全部来自儿童,四川地区92份粪便样本有43份来自儿童,35份来自55岁以上的老年人,14份来自其他年龄段。粪便基因组提取试剂盒为QIAamp Fast DNA Stool Mini Kit (50),货号为51604,购买于重庆韵博科技公司;PCR试剂为TaKaRa TaqTM,型号R001AM;依据肠道微孢子虫核苷酸注释数据库 (http://microsporidiadb.org/micro/),利用primer 5.0软件,分别设计一对特异性引物,引物名称序列以及目的条带长度见表1,引物合成于上海英骏公司 (Invitrogen)。
1.2 方法

表1 用于PCR检测的引物序列
显微镜镜检 粪便中微孢子虫的显微镜下检测采用改良三色法[10]完成,具体过程为将6.0 g铬变素2R,0.5 g苯胺蓝,0.7 g磷钨酸溶解于3 mL冰醋酸中,室温下放置30 min后,加入100 mL蒸馏水,再加入1.0 mol/L HCl调节pH至2.5。用甲醛固定涂片后,用上述混匀液在37℃下染色30 min后,用酸醇 (4.5 mL乙酸和995.5 mL的95%酒精混合)冲洗10 s,用95%的酒精洗脱10 s并将玻片脱水干燥。在95%的酒精中孵化2次,1次5 min,然后在100%的酒精中孵化10 min,再用二甲苯孵化5 min,封片,镜下观察 (×1 000)。
感染肠道微孢子虫的分离 粪便匀浆经灭菌双蒸水于2 000 r/min离心10 min,直至上清液澄清为止;弃上清,用灭菌双蒸水悬浮微孢子虫,500 r/min离心10 min;吸取上清液移至另一离心管中,2 000 r/min离心10 min,弃上清液;用双蒸水重新悬浮微孢子虫,500 r/min离心10min,如仍有沉淀,则继续用双蒸水重悬离心,直至无沉淀为止;最后,3 000 r/min离心10 min,收集沉淀物。
全基因组DNA的提取 利用粪便基因组提取试剂盒[QIAamp Fast DNA Stool Mini Kit (50)]进行全基因组提取,操作方法为取1.5 mL的EP管1支,加入200 μL稀便,1 mL InhibitEx Buffer,25 μL蛋白酶K,涡轮混匀15 s。55℃水浴14~16 h后,取出EP管涡轮振荡1 min,14 000 r/min离心1 min。另取1支新的1.5 mL EP管,向其中加入200 μL离心后的上清液,15 μL蛋白酶K,200 μL AL Buffer,涡轮混匀1 min后70℃水浴10 min。取出水浴锅中的EP管,加入200 μL无水乙醇,涡轮混匀1 min。小心移取600 μL所得溶解产物到QIAamp离心柱,14 000 r/min离心1 min后将QIAamp离心柱移至1个新的2 mL收集管中,加入500 μL缓冲液AW1,14 000 r/min离心1 min后,将QIAamp离心柱移1个至新的2 mL收集管中,加入500 μL缓冲液AW2,14 000 r/min离心3 min。然后将收集管中滤液倒去,14 000 r/min离心3 min。将QIAamp离心柱转移到一支新的1.5 mL EP管,移取200 μL缓冲液ATE至柱上,室温孵化1 min后,14 000 r/min洗提DNA,所得基因组产物储存于-20℃冰箱备用。
目的序列的PCR扩增 PCR反应体系:基因组DNA加入2 μL,10×PCR buffer 5 μL,MgCl2(25 mmol/mL)6 μL,dNTP (2.5 mmol/mL)8 μL,正反向引物 (10 μmol/L)各5 μL,Taq酶 (5 U/μL)0.25 μL,ddH2O 18.75 μL,总体系50 μL。阴性对照不加基因组DNA,以ddH2O补齐到50 μL。
PCR反应条件为:94℃预变性5 min,94℃变性30 s,退火1 min (不同引物退火温度见表1),72℃延伸2 min,30个循环后72℃延伸10 min。
反应结束后,取扩增样品9 μL,用琼脂糖凝胶电泳分析扩增结果,用DL-2000 DNA marker判断扩增结果,对检测阳性结果样品冷冻保存,以备以后分析使用。
2 结 果
采用改良三色法[10],对收集到的所有粪便样本进行检测,可见虫体呈现明亮粉色,通常可见后液泡以及孢子的中心对角出现粉色条纹[10](见图1),共有9例镜检发现微孢子虫阳性。
利用粪便基因组提取试剂盒[QIAamp Fast DNA Stool Mini Kit (50)]进行全基因组提取,提到的部分基因组以及PCR检测结果如图2。
本研究共调查124名腹泻患者 (四川92人、重庆32人),其中男性66人,女性58人。对所得的124份基因组样本进行6对不同引物的PCR检测,其中EBIEF1-F/EBIEF1-R这对引物的总检出率7.26% (9/124),儿童的检出率为8.00% (6/75),老年人的检出率为8.57% (3/35);EI set 3F/EI set 3R这对引物总检出率为3.23% (4/124),儿童的检出率为4.00% (3/75),老年人的检出率为2.86% (1/35);而引物Culi S/A未检测出阳性 (见表2、表3)。
3 讨 论
作为一类专性细胞内寄生的病原微生物,微孢子虫广泛流行于世界各地,而目前尚无针对微孢子虫的特异性药物,阿苯达唑、氟马西尼等虽有一定效用,但其副作用亦不容忽视[3],所以对微孢子虫进行更深入的研究是很有必要的。
本研究结果显示,毕氏肠道微孢子虫 (E.bieneusi)的检出率最高 (7.26%,见表2),肠炎微孢子虫 (E.intestinalis)的检出率次之 (3.23%,见表2),据现有使用EBIEF1-F/EBIEF1-R这对引物检测毕氏肠道微孢子虫的相关报道来看,猪的粪便中毕氏肠道微孢子虫的检出率高达30.5%[11],牛的检出率为17.5%[12],山羊的检出率为28.8%,绵羊更是高达42.8%[13]。相较其他宿主,如鸟类和野生动物,猪、牛、羊等家畜较为常见,与人类的接触更为密切,分布范围也更广,人畜交叉感染的几率也相应增加,如通过被污染的水等途径传播[14]。有理由认为毕氏肠道微孢子虫所对应的宿主,地域分布更广,与人类接触机会较大,亦或者环境适应性更好,生存能力更强,所以检出率更大。对于E.cuniculi保守区域的引物没有扩增出特异性条带这一情况,我们认为这是因为本次实验所用的粪便样本并无感染兔脑炎微孢子虫的情况,故而并未扩增出特异性条带。相较毕氏肠道微孢子虫和肠炎微孢子虫而言,人感染兔脑炎微孢子虫的情况确实更为少见,所以Culi S/A这对引物未扩增出特异性条带也属于正常情况[15]。
重庆地区的样本来自某儿童专科医院,而四川地区的样本来自一家综合型医院,故样本不同年龄组的人数分布存在差异。对于不同年龄组的检出率,儿童组和老年组的检出率较高,而14~55岁的青壮年检出率为0 (见表3),或是由于儿童和老年人的免疫力较青壮年弱,更容易被感染。
由于本次实验的粪便样本主要来自城区,考虑到微孢子虫人畜交叉感染的特性,我们猜测传染源主要是家养宠物,如猫、犬等的粪便处理不当而污染家庭用水以及食物,但若要确认是否为上述原因有待进一步调查研究。
随着经济的发展,畜牧业行业也日渐发展壮大,微孢子虫对其的影响越来越深。感染它的动物会在短时间内传染整个养殖场内的动物,致使大部分经济类动物长期腹泻,给养殖场带来无可挽回的经济损失。并且人和动物会交叉感染,对于养宠物的人来说,这是个潜在的安全隐患。并且近年来我国的HIV感染人数急剧增加,而AIDS患者的腹泻有30%~50%都与毕氏肠道微孢子虫有关,无论是在经济效益还是人类自身安全方面,此类病原微生物的致病作用都应当引起我们足够的重视。

图1从腹泻粪便样本中分离到的多株微孢子虫 (箭头所示为微孢子虫孢子;×1 000)图2基因组与PCR产物部分电泳结果 ( A.粪便基因组;B.使用引物EI set 3F/3R得到的PCR产物 (E.intestinalis);C.使用引物EBIEF1-F/R得到的PCR产物 (E.bieneusi);DNA marker.DL-2000)
Fig.1Microsporidia separated from diarrheal stool specimens.The arrows indicated spores of microsporidia (×1 000)Fig.2Some electrophoretic patterns of genome and PCR products (A.DNA extraction;B.PCR product acquired by using primers EBIEF1-F/R (E.intestinalis);C.PCR product acquired by using primers EI set 3F/3R (E.bieneusi);DNA Marker.DL-2000)
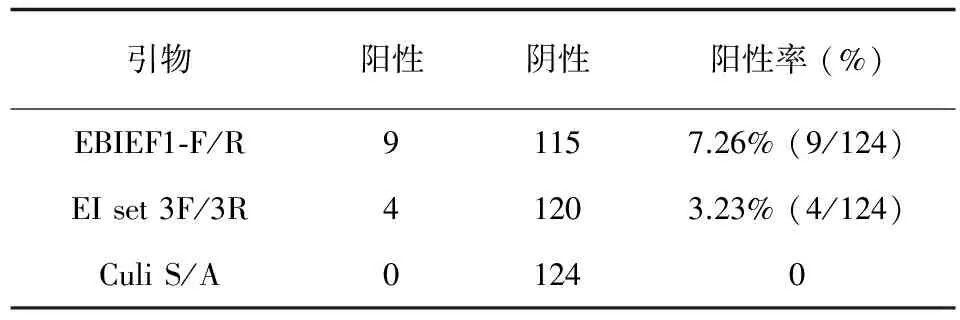
表2 不同引物琼脂糖凝胶电泳检测结果
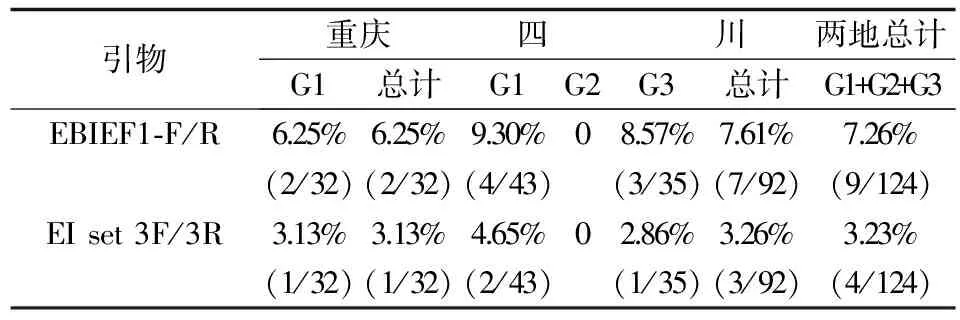
表3 毕氏肠道微孢子虫和肠炎微孢子虫的检出率分析
注:G1.年龄<14岁,G2.年龄14~55岁,G3.年龄>55岁
[1] Mirjalali H,Mirhendi H,Meamar AR,et al.Genotyping and molecular analysis ofEnterocytozoonbieneusiisolated from immunocompromised patients in Iran[J].Infect Genet Evol,2015,36:244-249.
[2] Didier ES,Weiss LM.Microsporidiosis:current status[J].Curr Opin Infect Dis,2006,19(5):485-492.
[3] Anane S,Attouchi H.Microsporidiosis:epidemiology,clinical data and therapy[J].Gastroenterol Clin Biol,2010,34(8-9):450-464.
[4] Santín M,Fayer R.Microsporidiosis:Enterocytozoonbieneusiin domesticated and wild animals[J].Res Vet Sci,2011,90(3):363-371.
[5] Widmer G,Akiyoshi D E.Host-specific segregation of ribosomal nucleotide sequence diversity in the microsporidianEnterocytozoonbieneusi[J].Infect Genet Evol,2010,10(1):122-128.
[6] Karim MR,Wang R,Dong H,et al.Genetic polymorphism and zoonotic potential ofEnterocytozoonbieneusifrom nonhuman primates in China[J].Appl Environ Microbiol,2014,80(6):1893-1898.
[7] Yue D,Ma J,Li F,et al.Occurrence ofEnterocytozoonbieneusiin donkeys (Equus asinus) in China:apublic health concern[J].Front Microbiol,2017,8:565.
[8] Mathis A,Weber R,Deplazes P.Zoonotic potential of the microsporidia[J].Clin Microbiol Rev,2005,18(3):423-445.
[9] Santín M,Fayer R.Enterocytozoonbieneusigenotype nomenclature based on the internal transcribed spacer sequence:a consensus[J].J Eukaryot Microbiol,2009,56(1):34-38.
[10] Didier ES,Orenstein JM,Aldras A,et al.Comparison of three staining methods for detecting microsporidia in fluids[J].J Clin Microbiol,1995,33(12):3138-3145.
[11] Buckholt MA,Lee JH,Tzipori S.Prevalence ofEnterocytozoonbieneusiin swine:an 18-month survey at a slaughterhouse in Massachusetts[J].Appl Environ Microbiol,2002,68(5):2595-2599.
[12] da Silva Fiuza VR,Lopes CW,de Oliveira FC,et al.New findings ofEnterocytozoonbieneusiin beef and dairy cattle in Brazil[J].Vet Parasitol,2016,216:46-51.
[13] Shi K,Li M,Wang X,et al.Molecular survey ofEnterocytozoonbieneusiin sheep and goats in China[J].Parasit Vectors,2016,9(1):23.
[14] Cotte L,Rabodonirina M,Chapuis F,et al.Waterborne outbreak of intestinal microsporidiosis in persons with and without human immunodeficiency virus infection[J].J Infect Dis,1999,180(6):2003-2008.
[15] Anuar TS,Almekhlafi HM,Salleh FM,et al.New insights of microsporidial infection among asymptomatic aboriginal population in Malaysia[J].Plos One,2013,8(8):e71870.
InvestigationoftheprevalenceofEnterocytozoonbieneusi,EncephalitozoonintestinalisandEncephalitozooncuniculiamongdiarrhealpatientsinthesouthwestofChina
QIU Lu-yao1,2,PING Jing1,2,LI Wen-dao1,2,DING Song-tao1,LIU Han-deng1
(1.CenterofBasicMedicalExperiment,ChongqingMedicalUniversity,Chongqing401331,China;2.CollegeofPediatrics,ChongqingMedicalUniversity,Chongqing401331,China)
ObjectiveTo investigate the prevalence ofEnterocytozoonbieneusi,EncephalitozoonintestinalisandEncephalitozooncuniculiamong diarrheal patients in the southwest of China.MethodsA total of 124 fecal specimens from patients with diarrhea syndrome were collected.The specimens were stained by modified trichrome (weber) and were examined under microscopy.The extracted DNA samples were evaluated by PCR amplification.ResultsThe prevalence ofE.bieneusiwas 7.26% (9/124),and that ofE.intestinaliswas 3.23% (4/124),withE.cuniculiall negative.ConclusionThe infection of microsporidia did exist in the southwest of China,and the most common types in this area wereE.bieneusiandE.intestinalis.
microsporidia;diarrheal patients;infection;zoonotic;PCR amplification
[Chin J Mycol,2017,12(5):257-261]
R 519.8
A
1673-3827(2017)12-0257-05
重庆市教委科学技术研究项目 (KJ1600202);重庆医科大学大学生科研与创新实验项目 (201619)
邱璐瑶,女 (汉族),本科在读.E-mail:AprilQiu@stu.cqmu.edu.cn
刘含登,E-mail:hdliu@cqmu.edu.cn
2017-05-24
[本文编辑] 卫凤莲
