HPLC测定小米中非法添加姜黄素及不确定度分析
2017-12-13李卓张亚锋李荣董曼曼贾寒冰
李卓,张亚锋,李荣,董曼曼,贾寒冰
(西安市食品药品检验所,陕西西安710054)
HPLC测定小米中非法添加姜黄素及不确定度分析
李卓,张亚锋,李荣,董曼曼,贾寒冰
(西安市食品药品检验所,陕西西安710054)
采用高效液相色谱法(HPLC)对小米中非法染色姜黄素进行定性定量测定,并对其不确定度进行分析。以乙腈-4%冰乙酸(45+55)为流动相,流速1.0 mL/min,经C18柱分析,检测波长425 nm。采用外标法定量,姜黄素在0.585 μg/mL~4.88 μg/mL范围内线性关系良好,相关系数r2=0.999 9,平均回收率92%,检出限为0.08 mg/kg,整个试验的合成不确定度为1.937%,扩展不确定度为X=(7.15±0.29)mg/kg;k=2。本方法操作简单,重复性好,检出限低,可用于小米中姜黄素非法染色的测定。
高效液相色谱法(HPLC);姜黄素;小米;不确定度
姜黄素是从姜科姜黄属植物姜黄、莪术等根茎中提取的一种有效成分,是一种二酮、二羟基,带有共轭苯环和双键结构的天然黄色素[1]。在GB 2760-2014《食品安全国家标准食品添加剂使用标准》中规定姜黄和姜黄素可作为着色剂在部分食品中添加并有相应的限量要求,但在小米中没有明确规定[2],应不得使用。但有些不法商贩为了掩盖陈小米或小米轻度发霉现象,将小米漂洗后加入姜黄粉或姜黄素进行再加工,使色暗的陈小米变得颜色鲜黄诱人,充当新小米进行售卖,长期食用这种小米对人体健康有害无益。现姜黄素检测方法主要有高效液相色谱法[3-5]、液质联用法[6]、薄层色谱法[7]等,尚未有小米非法染色姜黄素的检测方法。
本文通过优化检测波长、流动相、样品提取等检测条件,建立了一种小米中非法染色姜黄素的高效液相色谱测定方法,做了方法学考察,并采用JJF 1059.1-2012《测量不确定度评定与表示》[8]对试验过程中的不确定度分量进行了分析,找出影响结果的因素,为结果准确性,可靠性提供真实、有效的依据。
1 材料与方法
1.1 材料与试剂
小米:市售;姜黄素(批号0823-9802):中国食品药品检定院;甲醇为色谱纯;其他试剂均为分析纯。
1.2 仪器与设备
Ulimate 3000型高效液相色谱仪(配DAD检测器):美国Thermo公司;MS105电子分析天平、ME204E电子分析天平:瑞士Mettler公司。
1.3 试验方法
1.3.1 标准溶液配制
准确称取1.95 mg姜黄素标准品于10 mL棕色容量瓶中,用甲醇溶解并定容,配制成195 μg/mL姜黄素标准储备溶液。移取1 mL姜黄素标准储备溶液于10 mL容量瓶,用甲醇定容,制成姜黄素标准中间溶液。再移取 0.3、0.5、1、2、2.5 mL 姜黄素标准中间液于10 mL容量瓶,用甲醇定容,制成0.585、0.975、1.95、3.90、4.88 μg/mL 系列标准工作溶液。
1.3.2 样品制备
称取粉碎均匀的样品5.00 g于100 mL具塞三角瓶中,精密加入甲醇20 mL,超声提取10 min,放置至室温,摇匀后,用0.45 μm有机系滤膜过滤于棕色样品瓶中,待测。
1.3.3 色谱条件
流动相:乙腈+4%冰乙酸=45+55;色谱柱:Agela,C184.6 mm×250 mm,5 μm;柱温:30 ℃;流速:1.0 mL/min;检测波长:425 nm;进样体积:10 μL。
1.4 结果计算

式中:X为姜黄素的含量,mg/kg;C为由标准曲线得到样品溶液中姜黄素的浓度,μg/mL;m为样品的质量,g;V 为甲醇加入体积,mL。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 检测波长的选择
姜黄素光谱图见图1。

图1 姜黄素光谱图Fig.1 Spectrum of curcumin
如图1所示,采用二极管阵列检测器在190 nm~800 nm波长下对姜黄素标准品溶液进行扫描,结果显示姜黄素在425 nm处有最大吸收峰,为了使其灵敏度最佳,选择425 nm为检测波长。
2.1.2 流动相的选择
姜黄素具有两个羟基,羟基氢易解离,在流动相中加入一定量酸可以抑制姜黄素的解离,以改善其在C18柱中的保留及峰型。本试验比较了乙腈-水、乙腈-1%磷酸、乙腈-0.1%冰乙酸、乙腈-4%冰乙酸4个体系的流动相,结果表明,在乙腈-水、乙腈-1%磷酸、乙腈-0.1%冰乙酸流动相体系下,姜黄素目标峰都有不同程度的拖尾现象,而以乙腈-4%冰乙酸体系为流动相,目标峰峰型对称效果好,故选择乙腈-4%冰乙酸为流动相。图2、图3为姜黄素标准品及样品溶液色谱图。
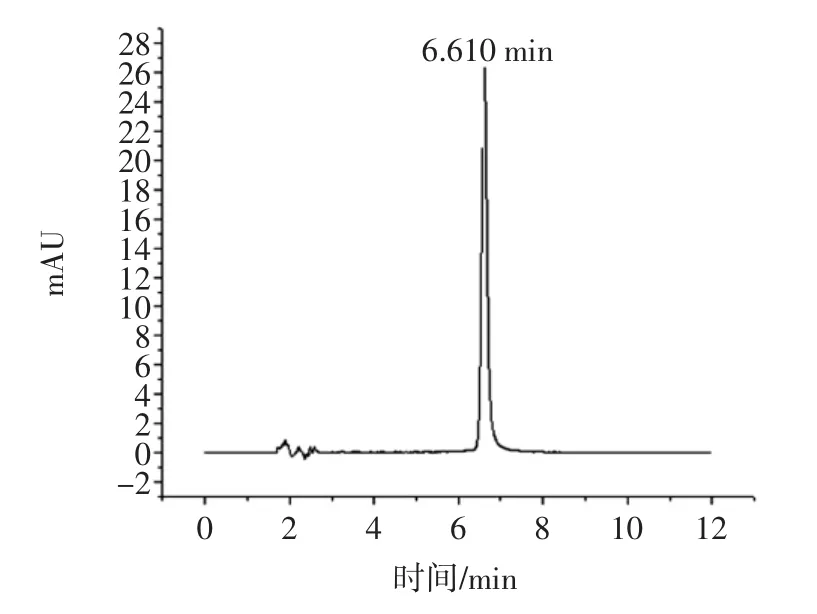
图2 姜黄素标准品色谱图Fig.2 Chromatogram of curcumin

图3 样品中姜黄素色谱图Fig.3 Chromatogram of sample
2.1.3 提取溶剂的选择
姜黄素极性较小,不溶于水,易溶于甲醇、乙醇、冰乙酸等试剂中[9]。本试验比较了甲醇、无水乙醇、乙酸乙酯、冰乙酸、70%冰乙酸5种提取溶剂,结果如图4。
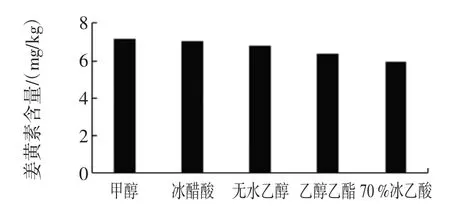
图4 不同溶剂提取率Fig.4 Different solvent extraction rate
由图4可知,提取率由大至小依次为:甲醇>冰醋酸>无水乙醇>乙酸乙酯>70%冰醋酸,甲醇的提取率最高,故选择甲醇为提取溶剂。
2.2 方法学考察
2.2.1 标准曲线的绘制
取1.3.1项下姜黄素系列标准工作溶液在本试验所选色谱条件下测定,以姜黄素质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,回归方程为y=0.890 7x-0.029 4,相关系数为r2=0.999 9,结果表明,姜黄素在0.585 μg/mL~4.88 μg/mL范围内具有良好的线性关系。
2.2.2 回收率与重复性
取阴性小米样品,分别添加了3个水平浓度,每个水平添加3个平行,按照本试验的方法测定姜黄素质量浓度,加标回收率及其相对标准偏差见表1。由结果可以看出,该方法具有良好的准确性和精密度。
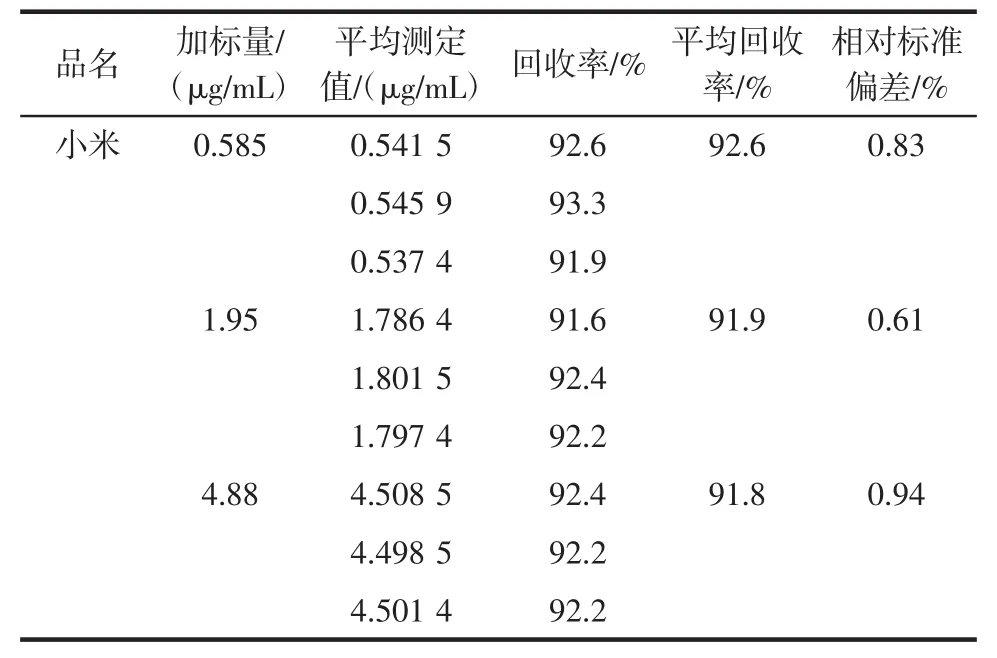
表1 回收率及其相对标准偏差Table 1 Recovery and relative standard deviation
2.2.3 稳定性
由于姜黄素分子结构中含有共轭双键,易在光与热作用下发生氧化降解[10],故应将提取溶液过滤后贮存于棕色样品瓶中,在室温下放置 0、3、6、12、24、48 h进行测定,结果发现姜黄素在0~24 h内比较稳定,24 h时后有小幅度下降,说明处理好的样品应尽快测定,不宜放置过久。
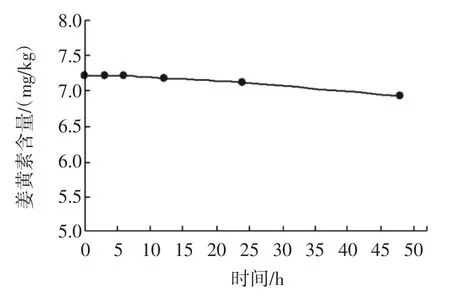
图5 姜黄素稳定性Fig.5 Stability of curcumin
2.2.4 检出限与定量限
在本试验所选色谱条件下,用空白样品溶液稀释姜黄素标准溶液至10倍信噪比、3倍信噪比,结果10S/N时姜黄素质量浓度为0.06 μg/mL,3S/N时姜黄素质量浓度为0.02 μg/mL,经计算,姜黄素定量限为0.24 mg/kg,检出限为 0.08 mg/kg。
2.3 不确定度分析
2.3.1 A类不确定度
2.3.1.1 样品的重复性引入的不确定度
在重复条件下,对样品进行了6次测定,含量分别是 7.15、7.20、7.22、7.13、7.22、7.20 mg/kg, 平 均 值 为7.19 mg/kg,则由样品重复性引入的相对不确定度为:
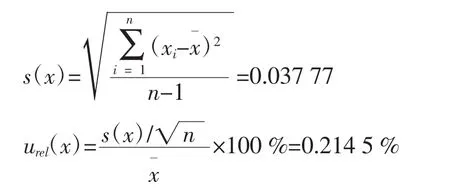
2.3.1.2 最小二乘法拟合标准曲线求样品浓度引入的不确定度
采用了5个水平的姜黄素标准溶液,分别进行1次测定,以相应的峰面积与标准溶液质量浓度用最小二乘法进行拟合,结果如表2。

表2 最小二乘法拟合标准曲线数据Table 2 Uncertainty resulting from least square curve fitting
拟合曲线求样品溶液中姜黄素引入的相对标准不确定度为:

式中:s为残余标准差s=0.023 372;Scc为标准溶液质量浓度残差和Scc=13.910 93;C为样品溶液的质量浓度C=1.786 4;为标准工作溶液的平均质量浓度=2.458;a为回归方程斜率a=0.890 7;N为样品平行测定次数N=2;n为标准溶液测定次数n=5。
2.3.2 B类不确定度
2.3.2.1 标准物质引入的不确定度
由于标准物质信息中并未给出不确定度,故暂忽略不计。
2.3.2.2 标准物质称量引入的不确定度
由检定证书查得,该电子天平在0≤m≤50 g范围示值误差为为±0.03 mg,称取标准品1.95 mg,按矩形分布,则由称量引入的相对标准不确定度为:
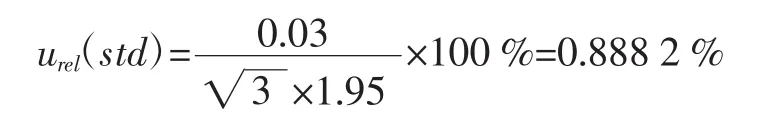
2.3.2.3 标准物质定容及稀释过程引入的不确定度
按照1.3.1配制标准工作溶液引入的不确定度主要包括移液管、容量瓶以及温度效应。其中移液管和容量瓶根据JJG 196-2006《常用玻璃量器检定规程》[12],按矩形分布计算。温度效应由于温度变化引起液体体积变化明显大于容量瓶体积的变化,所以温度变化带来的不确定度只考虑液体体积带来的不确定度,已知甲醇的体积膨胀系数为1.2×10-3,实验室室温在±2℃之间变动,按照矩形分布计算,引入的相对标准不确定度如表3。
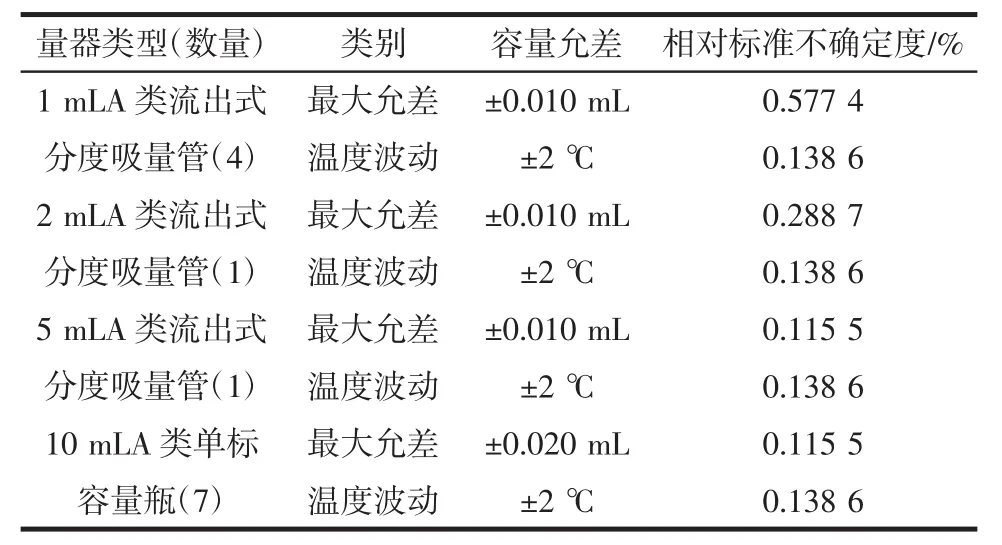
表3 标准溶液稀释过程引入的相对不确定度Table 3 Uncertainty during standard solution dilution
由表3中数据合成,配制姜黄素标准溶液引入的相对标准不确定度如下:

2.3.2.4 样品称量引入的不确定度
由检定证书查得,该电子天平在0≤m≤50 g范围示值误差为±0.000 1 g,称取样品5.00 g,按矩形分布,则由样品称量引入的相对标准不确定度为:

2.3.2.5 样品提取剂加入量引入的不确定度
样品中精密加入甲醇20 mL,与2.3.2.2同理,20 mL A类单标吸量管容量允差为±0.030 mL,温度在±2℃之间变动,引入的相对标准不确定度为:

2.3.3 合成标准不确定度及扩展不确定度的计算
3 结论
本文建立了HPLC测定小米中非法染色姜黄素的方法,优化了色谱条件,方法操作简单,且具有较好的准确度和重复性,可为非法添加物质测定提供一定参考。另外,对该方法进行了不确定度分析,分析了各个影响结果的分量,发现在不确定因素5个分量中,对结果影响最大的主要为标准溶液的配制和标准工作溶液曲线拟合求浓度。针对这些不确定度因素,在实际检测过程中可通过选择适当量器、增加标准溶液和样品的测定次数、增大标准物质称量等措施减小测量结果的不确定度,提高测量结果的可信度。
[1]蔡小明.反相高效液相色谱法测定肉松制品中姜黄素的含量[J].广州化学,2014,39(3):7-10
[2]中华人民共和国国家卫生和计划生育委员会.GB 2760-2014食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2014
[3]单胜艳,张丹,王春茹,等.高效液相色谱法测定保健品中姜黄素含量的研究[J].饮料工业,2014,17(2):24-26
[4]孙鹏尧,李丹丹,牟德华.HPLC法测定姜黄根茎及姜黄素饮料中姜黄素类化合物的含量[J].食品工业科技,2016,37(21):313-316
[5]方恩华,陈璐平,吴茗梅,等.高效液相色谱法检测果冻中姜黄素类化合物[J].食品安全质量检测学报,2015,6(12):4980-4984
[6]李占彬,杨昌彪,谭红,等.高效液相色谱仪串联三重四级杆质谱法快速测定姜茶中的姜黄素[J].分析仪器,2014(2):65-68
[7]徐仲溪,王坤波.姜黄素的高效薄层色谱法[J].食品科学,2004,25(6):156-159
[8]中华人民共和国国家质量监督检验检疫总局.JJF 1059.1-2012测量不确定度评定与表示[S].北京:中国标准出版社,2012
[9]刘莉,赵振东,刘志荣,等.不同溶剂对姜黄中姜黄素化合物提取率的比较[J].湖北中医药大学学报,2016,18(1):33-35
[10]万红,赵轶,韩刚,等.不同条件下姜黄素稳定性的研究[J].中国医学创新,2009,6(16):17-18
[11]中华人民共和国国家质量监督检验检疫总局.JJF 196-2006常用玻璃量器检定规程[S].北京:中国计量出版社,2006
Detection of Curcumin Illegally Added in Millet by HPLC and Uncertainty Analysis
LI Zhuo,ZHANG Ya-feng,LI Rong,DONG Man-man,JIA Han-bing
(Xi'an Institute for Food and Drug Control,Xi'an 710054,Shaanxi,China)
High performance liquid chromatography(HPLC)was used to qualitatively and quantitatively determine curcumin in millet and its uncertainty was analyzed.Acetonitrile-4%acetic acid(45+55)solution was used as the mobile phase,and 1.0 mL/min as the flow rate,and C18as the analysis column.Good linear relationship was obtained in the concentration range of 0.585 μg/mL-4.88 μg/mL of curumin,with correlation coefficient of 0.999 9.Under the optimized conditions,the average recoveries were 92%.The limit of detection(S/N=3)of curcumin was 0.08 mg/kg.The combined uncertaincy was 1.937%and the expanded uncertainty was X=(7.15±0.29)mg/kg;k=2.The method was sample,reproducible,low detection limit,and can be used to determine the illegal staining of curcumin in millet.
high performance liquid chromatography(HPLC);curcumin;millet;uncertainty
10.3969/j.issn.1005-6521.2017.24.034
李卓(1984—),女(汉),工程师,硕士研究生,主要从事食品安全检测方向。
2017-04-06
