不同浓度牛乳铁蛋白对成骨细胞与破骨细胞共培养的影响
2017-12-13刘猛樊凤娇石璞洁涂茂林于翠平杜明
刘猛,樊凤娇,石璞洁,涂茂林,于翠平,杜明,,*
(1.哈尔滨工业大学化学与化工学院,黑龙江哈尔滨150090;2.大连工业大学食品学院,辽宁大连116034)
不同浓度牛乳铁蛋白对成骨细胞与破骨细胞共培养的影响
刘猛1,樊凤娇1,石璞洁1,涂茂林1,于翠平2,杜明1,2,*
(1.哈尔滨工业大学化学与化工学院,黑龙江哈尔滨150090;2.大连工业大学食品学院,辽宁大连116034)
研究证实牛乳铁蛋白具有成骨活性功能,既能刺激成骨细胞增殖,也能诱导破骨细胞凋亡。骨骼的生长发育是一动态平衡的生物过程,是通过成骨细胞诱导的骨生成和破骨细胞诱导的骨吸收所调节的。采用成骨细胞MC3T3-E1细胞与破骨前体细胞RAW264.7细胞1∶1的比例直接接触的共培养方式,研究不同浓度(20、100、500μg/mL)的牛乳铁蛋白对共培养中成骨细胞和破骨细胞活性以及破骨细胞骨吸收功能的影响。首先,通过碱性磷酸酶(ALP)活性检测试剂盒检测共培养上清中的ALP活性,发现低浓度的牛乳铁蛋白能够抑制成骨细胞的ALP活性,而中高浓度的牛乳铁蛋白能够显著地促进成骨细胞的ALP活性。利用TRAP活性检测试剂盒及ELISA检测试剂盒,则发现低中浓度的牛乳铁蛋白能够促进破骨细胞的TRAP活性,而高浓度的牛乳铁蛋白能够显著地抑制破骨细胞的TRAP活性和共培养体系RANKL/OPG的比值。最后,通过骨吸收陷窝实验,证实了中高浓度组的牛乳铁蛋白能够显著地抑制破骨细胞的骨吸收功能。结果表明了高浓度的牛乳铁蛋白在共培养体系中不仅能够促进成骨细胞的活性,并且对破骨细胞具有抑制活性及功能的作用。
牛乳铁蛋白;成骨细胞;破骨细胞;共培养
乳铁蛋白的分子量大小约为78 kDa[1-2],其一级结构组成是由约700个氨基酸组成[3]的单一的多肽链结构,并且不同种类的乳铁蛋白其组成氨基酸序列却具有极高的同源性。乳铁蛋白作为一种功能性糖蛋白[4],具有多种生物学活性,乳铁蛋白可以促进铁吸收,具有抗炎[5]和镇痛的作用[6],并且在抑菌和调节机体免疫力等方面也具有生物功能活性。目前已经报道了,牛乳铁蛋白既能刺激成骨细胞增殖,也能诱导破骨细胞凋亡[7-8]。目前的研究证实了,骨骼的生长发育是一个动态平衡的生物过程,主要是通过成骨细胞诱导的骨生成和破骨细胞诱导的骨吸收所共同调节的[9]。骨组织经历不断重塑以确保其结构完整性得到保持,如果这种机制遭到破坏,很有可能产生骨丢失导致如骨质疏松症和溶骨性疾病等问题[10]。
破骨细胞的分化和骨吸收功能主要是由激素、细胞因子和生长因子直接作用于破骨细胞或间接通过周围细胞所调控的[11]。其中由成骨细胞产生的细胞因子,包括核因子κB受体活化因子配体(receptor activator of the NF-κB ligand,RANKL)对于诱导破骨细胞形成,融合,激活和存活至关重要。另一种细胞因子骨保护素(osteoprotegerin,OPG)通过抑制RANKL与其受体核因子κB受体活化因子(receptor activator of the NF-κB,RANK)的结合而作为诱饵受体[12]。所以,RANKL/OPG的比例是起到决定破骨细胞形成和破骨细胞活性的关键因素[13-14]。随着组织工程技术的发展,并且可以逐渐用于实际应用[15-16],共培养中使用成骨细胞和破骨细胞传统上用于确定两种细胞类型之间的关系[17-18]。鉴于牛乳铁蛋白的成骨活性功能,我们有兴趣知道它在骨重塑中发挥的作用,特别是在破骨细胞吸收活动中,在这项研究中,我们调查牛乳铁蛋白对共培养中成骨细胞和破骨细胞活性以及破骨细胞骨吸收功能的影响。目前已经报道了可以采用直接将成骨细胞与破骨前体细胞共培养的方式,通过成骨细胞所分泌的细胞因子来促进破骨细胞的分化形成,从而获得成骨细胞和破骨细胞的共培养体系[19-20]。因此,本研究采用了将种属来源一致的成骨细胞MC3T3-E1细胞与破骨前体细胞RAW264.7细胞以1∶1的比例进行共培养,同时添加能够支持成骨细胞和破骨细胞共同生长的培养基[21-22]。
1 材料与方法
1.1 材料、试剂与仪器
牛乳铁蛋白(>94%)、TRAP染色试剂盒、Corning Osteo Assay surface 24孔人工骨板:美国Sigma公司;α-MEM、胰蛋白酶(0.25%)/EDTA(0.02%)消化液、青霉素链霉素混合抗生素溶液:美国Hyclone公司;胎牛血清、D-MEM培养基:美国Gibco公司。
倒置式生物显微镜:日本Nikon公司;Zeiss Axiovert 200显微镜:德国Zeiss公司;Eon型酶标仪:美国BioTek公司;HEPA class 100型细胞培养箱:美国Thermo公司。
1.2 方法
1.2.1 细胞培养
对于成骨细胞,在含有1%抗生素(10 mg/mL链霉素B和10 000 U/mL青霉素G)和10%胎牛血清的α-MEM中培养来源于新生小鼠颅骨的MC3T3-E1细胞。对于破骨前体细胞,将RAW264.7细胞培养在DMEM培养基中(含有10%胎牛血清,10 mg/mL链霉素和10 000 U/mL青霉素)。在37℃,5%CO2饱和湿度的培养箱条件下培养。培养液在汇合前每隔一天更换一次,使用胰蛋白酶(0.25%)/EDTA(0.02%)消化液传代细胞。成骨细胞:破骨前体细胞以1∶1细胞(MC3T3-E1细胞:RAW264.7细胞)的比例共培养。
1.2.2 实验分组
样品分组:样品分3组,分别为牛乳铁蛋白低质量浓度组(20 μg/mL)、牛乳铁蛋白中质量浓度组(100 μg/mL)和牛乳铁蛋白高质量浓度组(500 μg/mL)。
1.2.3 抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色观察破骨细胞
调整MC3T3-E1细胞和RAW264.7细胞浓度以1×104个/孔接种到预先放置有无菌细胞爬片的六孔板中,每孔各加入1 mL细胞悬液,置于37℃,5%CO2饱和湿度的培养箱内进行培养。待细胞贴壁后弃去培养液,并添加新鲜培养基,每2天更换新鲜培养基1次。共培养 5、7、9、11、13、15 天后,取出细胞爬片后,按照试剂盒说明书固定细胞后进行TRAP染色,并将TRAP阳性多核细胞(3个或3个以上)计数为破骨细胞,使用Zeiss Axiovert 200显微镜观察并拍摄显微照片[23]。
1.2.4 TRAP活性检测
按照1.2.3中方法共培养,每2天更换新鲜培养基一次并添加不同浓度的牛乳铁蛋白,选择共培养11天后,收集细胞培养液上清,1 000 r/min离心10 min去除细胞沉淀后,进行TRAP活性检测。按照TRAP活性试剂盒说明书操作,依次加入检测缓冲液、显色底物和培养基上清,充分混匀后37℃下孵育30 min,取出加入终止液终止其反应,置于405 nm处测定其吸光度[24]。
1.2.5 碱性性磷酸酶(Alkaline Phosphatase,ALP)活性检测
按照1.2.4中方法获得培养基上清,进行ALP活性检测。按照ALP活性试剂盒说明书操作,依次加入检测缓冲液、显色底物和培养基上清,充分混匀后37℃下孵育30 min,取出加入终止液终止其反应,置于405 nm处测定其吸光度[24]。
1.2.6 骨吸收实验
调整MC3T3-E1细胞和RAW264.7细胞浓度各以500个/孔接种到Corning Osteo Assay surface 24孔人工骨板上,两种细胞每孔各加入0.5 mL细胞悬液,置于37℃,5%CO2饱和湿度的培养箱内进行培养。细胞贴壁后弃去培养液,并添加新鲜培养基及不同浓度的牛乳铁蛋白,每3天更换新鲜培养基一次同时补加不同浓度的牛乳铁蛋白样品。选择培养11天后,用5%的次氯酸盐溶液将细胞从人工骨板的底部洗掉,蒸馏水清洗2次,待骨板干燥后,使用Zeiss Axiovert 200显微镜拍摄,利用Image J软件计算吸收面积的百分比[25]。
1.2.7 ELISA法检测RANKL/OPG
按照1.2.4中方法获得培养基上清,采用ELISA法分别测定RANKL与OPG的含量,按照试剂盒说明书操作进行,然后计算RANKL/OPG的比值[26]。
1.2.8 统计学及绘图
数据采用Origin 8.0软件进行计算绘图。采用SPSS 17.0统计软件,one-way ANOVA进行显著性检验。数据以±s表示,p<0.05为显著性差异。
2 结果与讨论
2.1 共培养体系在倒置显微镜下的观察结果
本试验采用成骨细胞MC3T3-E1细胞与破骨前体细胞RAW264.7细胞1∶1的比例直接接触的共培养方式,如图1所示。

图1 共培养体系在倒置显微镜下的观察结果Fig.1 Observation of phase contrast microscope for co-cultured system
显微镜下观察贴壁生长的细胞,共培养1天后,MC3T3-E1细胞形成单层覆盖,形状多为长梭形和三角形,并且有2~3个突起,细胞质饱满,清晰透亮;RAW264.7细胞则多为单个核细胞,形状多为圆形和椭圆形。共培养5天后,发现细胞已经在细胞培养瓶中铺满了整个底面,两种细胞分层明显,破骨细胞数量少于成骨细胞,并且位于成骨细胞之上,体积跟刚贴壁时相比明显增大;部分的成骨细胞有3~4个突起,并且相互连接汇合,结构似星形,显示出较好的贴壁性;可以观察到单核细胞开始融合的现象,并且可见腊肠型等形态不规则破骨细胞形成,并且有伪足伸出,出现了多个体积较大的多核细胞。而且随着共培养时间的增加,破骨细胞的数量逐渐增多,并且细胞直径也逐渐增大。但是,在共培养时间达到15天后,出现了衰退的迹象。
2.2 TRAP染色观察与破骨细胞计数
共培养细胞进行TRAP染色后,于显微镜下观察分析破骨细胞并且计数,结果如图2与图3所示。
共培养5天可见TRAP阳性细胞形成,显微镜下可以观察到见大量染为浅色的成骨细胞,而破骨细胞数量极少且细胞质呈现深色。共培养9天后,RAW264.7细胞的体积逐渐变大,并且有伪足伸出,出现了多个体积较大的多核细胞(3个或3个以上),TRAP活性部位表现出深色颗粒(TRAP阳性的特征)变得明显。随着共培养时间的增加,TRAP阳性多核细胞数目和细胞核数目逐渐增加,并且细胞直径也有所增加。共培养15天后,破骨细胞数量有减少趋势,细胞边缘变得模糊不清,部分细胞更是表现出了崩解的现象。
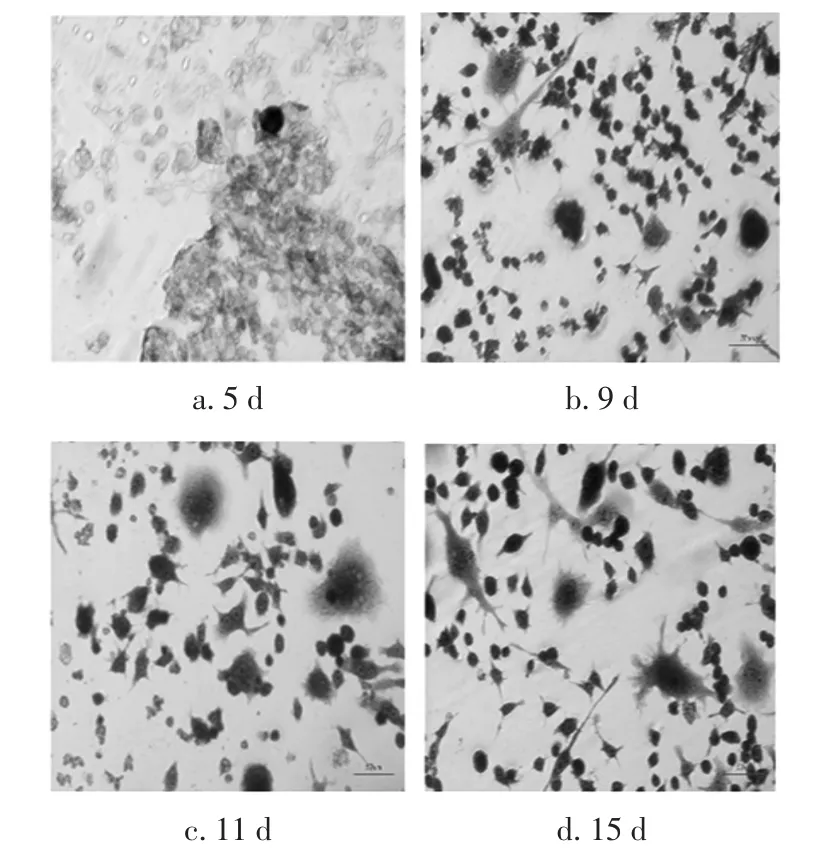
图2 共培养体系的TRAP染色Fig.2 TRAP staining for co-cultured system

图3 共培养体系的TRAP阳性细胞计数Fig.3 TRAP-positive large multinucleated cells counting for cocultured system
2.3 不同浓度的牛乳铁蛋白对共培养体系中破骨细胞活性的影响
当在共培养体系中加入不同浓度的牛乳铁蛋白(20、100、500 μg/mL)时,选择共培养 11 天后,发现了共培养体系中破骨细胞的TRAP活性与空白组相比,表现出先升高后降低的趋势。20 μg/mL和100 μg/mL组分别升高至对照组的约187.8%和168.9%,而500 μg/mL组则降低至至对照组的约25.6%,如图4所示。
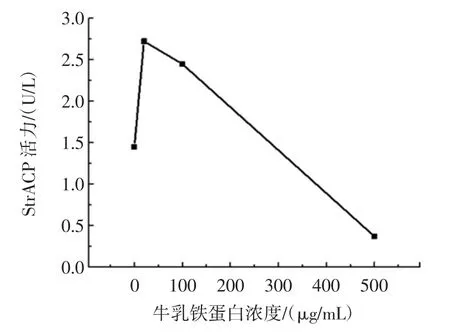
图4 牛乳铁蛋白对破骨细胞活性的影响Fig.4 Effects of bovine lactoferrin on TRAP activity of osteoclast for co-cultured system
在共培养体系里,破骨细胞形成的过程中,主要是由成骨细胞提供RANKL给破骨细胞前体,这些结果说明了在低浓度的牛乳铁蛋白存在时,来自成骨细胞的RANKL对TRAP活性的贡献是相当大的,表现在破骨细胞的TRAP与空白组相比显著升高,另外又由于牛乳铁蛋白能够抑制破骨细胞的形成,所以造成了随着牛乳铁蛋白的浓度的升高,共培养体系中破骨细胞的TRAP活性逐渐降低,而在500 μg/mL时,牛乳铁蛋白的作用超过了RANKL,导致破骨细胞的TRAP与空白组相比显著降低。
2.4 不同浓度的牛乳铁蛋白对共培养体系中成骨细胞活性的影响
当在共培养体系中加入不同浓度的牛乳铁蛋白(20、100、500 μg/mL)时,选择共培养 11 天后,发现了成骨细胞的TRAP活性与空白组相比,表现出先降低后升高的趋势,其中100 μg/mL牛乳铁蛋白组表现出最强的促进作用。100 μg/mL和500 μg/mL组分别升高至对照组的约145.3%和101.1%,而20 μg/mL组则降低至至对照组的约69.4%,如图5所示。
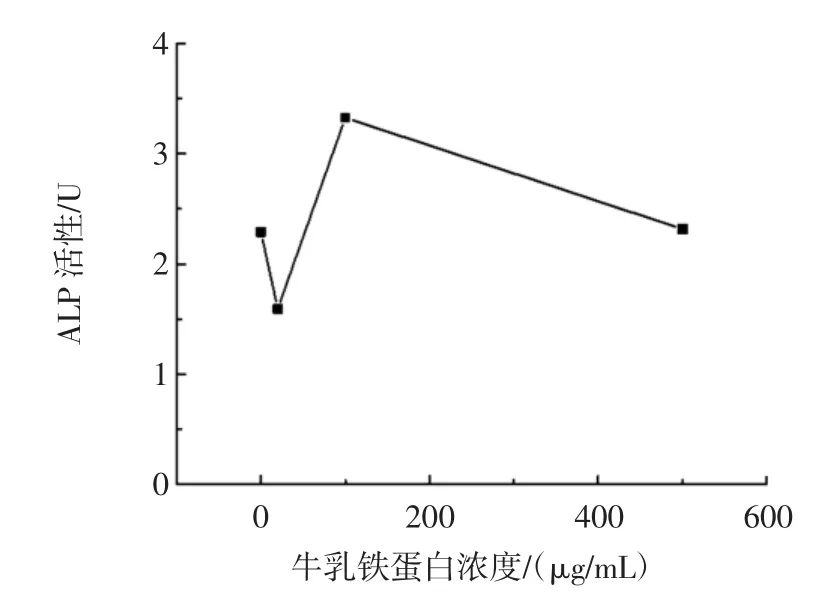
图5 牛乳铁蛋白对成骨细胞活性的影响Fig.5 Effects of bovine lactoferrin on ALP activity of osteoblasts for co-cultured system
这些结果说明了在低浓度的牛乳铁蛋白存在时,由于成骨细胞分泌的RANKL能够促进破骨细胞的形成,而牛乳铁蛋白又能够抑制破骨细胞的形成,为了平衡这种作用,表现出了与空白组抑制了成骨细胞的活性。而随着牛乳铁蛋白的浓度的升高,破骨细胞的TRAP活性逐渐降低,牛乳铁蛋白促对成骨细胞的促进作用又占了主导作用,表现在提高了ALP的活性,并且100 μg/mL的牛乳铁蛋白组对于成骨细胞的活性具有最高的促进作用。
2.5 牛乳铁蛋白对成骨细胞:破骨细胞共培养骨吸收的影响
采用将MC3T3-E1细胞与胞RAW264.7细胞以1∶1的比例直接接触的方式直接接种到人工骨板上进行共培养,并在共培养体系中加入不同浓度的牛乳铁蛋白(20、100、500 μg/mL)时,选择共培养 11 天后,测定不同浓度的牛乳铁蛋白对共培养体系中破骨细胞的骨吸收功能。人工骨板被破骨细胞吸收后会形成骨吸收陷窝,而颜色深的区域则表示未被破骨细胞吸收,如图6所示。
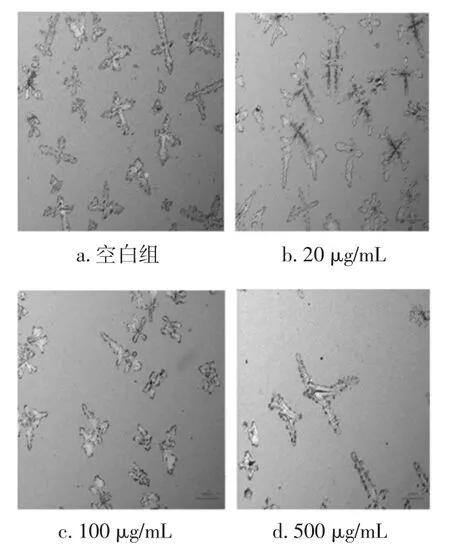
图6 乳铁蛋白对破骨细胞骨吸收的影响Fig.6 Effects of bovine lactoferrin on bone resorption of osteoclasts for co-cultured system
经过不同浓度的牛乳铁蛋白(20、100、500 μg/mL)处理后,与空白组相比,骨吸收凹陷部位面积表现出先升高后降低的趋势,而且500 μg/mL组存在较多颜色较浅的骨吸收区域,是由于少量功能不佳的破骨细胞产生的。通过定量分析结果表明,浓度为20、100、500 μg/mL的牛乳铁蛋白与对照组相比的百分比,分别约为111.2%、66.9%、45.1%,这些数据表明了中高浓度的牛乳铁蛋白均对共培养体系中破骨细胞的功能也有一定的抑制作用。
2.6 牛乳铁蛋白对共培养体系RANKL/OPG的影响
当在共培养体系中加入不同浓度的牛乳铁蛋白(20、100、500 μg/mL)时,共培养 11 天后,发现了共培养体系中RANKL/OPG与空白组相比,表现出先升高后降低的趋势。20 μg/mL和100 μg/mL组分别升高至对照组的约105.5%和102.6%,而500 μg/mL组则降低至至对照组的约87.0%,如图7所示。
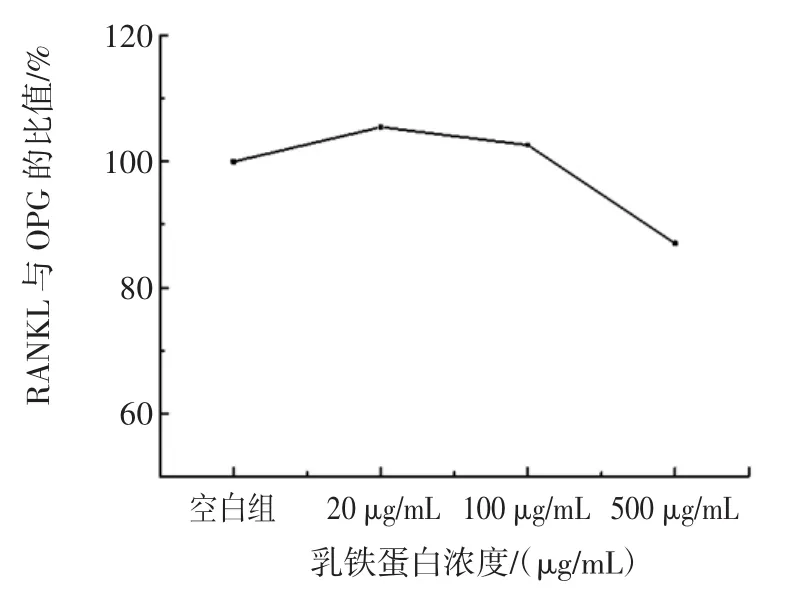
图7 乳铁蛋白对共培养体系RANKL/OPG的影响Fig.7 Effects of bovine lactoferrin on RANKL/OPG for cocultured system
由于已经证实了牛乳铁蛋白能够抑制成骨细胞的RANKL mRNA的表达,并促进OPG mRNA的表达,从而降低RANKL/OPG的比值。这些结果说明了在共培养体系中,低中浓度组的牛乳铁蛋白没有降低RANKL/OPG的比值,而高浓度组的牛乳铁蛋白则能够显著降低RANKL/OPG的比值,从而降低共培养体系中破骨细胞的形成和活性,影响了骨的吸收。
3 结论
本试验通过采用种属来源一致的成骨细胞MC3T3-E1细胞与破骨前体细胞RAW264.7细胞以1∶1的比例直接接触的共培养方式,研究了浓度为20、100、500 μg/mL的牛乳铁蛋白对共培养体系中成骨细胞与破骨细胞活性以及破骨细胞骨吸收功能的影响。对于成骨细胞,发现了低浓度的牛乳铁蛋白能够抑制成骨细胞的ALP活性,而中高浓度的牛乳铁蛋白能够显著地促进成骨细胞的ALP活性。对于破骨细胞,则发现了低中浓度的牛乳铁蛋白能够促进破骨细胞的TRAP活性,而高浓度的牛乳铁蛋白能够显著地抑制破骨细胞的TRAP活性和RANKL/OPG的比值。另外中高浓度组的牛乳铁蛋白能够显著地抑制破骨细胞的骨吸收功能。综上所述,我们证明了高浓度的牛乳铁蛋白在共培养体系中不仅能够促进成骨细胞的活性,并且对破骨细胞具有抑制活性及功能的作用,这对于牛乳铁蛋白应用到骨代谢疾病及骨组织工程领域奠定了理论基础。
[1]Baker E,Baker H.Molecular Structure,Binding Properties and Dynamics of Lactoferrin[J].Cellular and Molecular Life Sciences:CMLS,2005,62(22):2531-2539
[2]Moore S A,Anderson B F,Groom C R,et al.Three-Dimensional Structure of Diferric Bovine Lactoferrin at 2.8 Å Resolution[J].Journal of Molecular Biology,1997,274(2):222-236
[3]Kawakami A,Hirayama K,Kawakami F,et al.Purification and Biochemical Characterization of a Fibroblast Growth Factor-Binding Protein (FGF-BP)from the Lactoferrin Fraction of Bovine Milk[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2006,1760(3):421-431
[4]桑亚新,王向红,孙纪录,等.乳铁蛋白及其生理功能研究进展[J].河北农业大学学报,2003(z1):154-156
[5]Legrand D,Elass E,Pierce A,et al.Lactoferrin and Host Defence:An Overview of Its Immuno-Modulating and Anti-Inflammatory Properties[J].Biometals,2004,17(3):225-229
[6]Hayashida K-i,Takeuchi T,Shimizu H,et al.Novel Function of Bovine Milk-Derived Lactoferrin on Antinociception Mediated by Μ-Opioid Receptor in the Rat Spinal Cord[J].Brain Research,2003,965(1):239-245
[7]Toba Y,Takada Y,Yamamura J,et al.Milk Basic Protein:A Novel Protective Function of Milk against Osteoporosis[J].Bone,2000,27(3):403-408
[8]Kruger M,Poulsen R,Schollum L,et al.A Comparison between Acidic and Basic Protein Fractions from Whey or Milk for Reduction of Bone Loss in the Ovariectomised Rat[J].International Dairy Journal,2006,16(10):1149-1156
[9]Nijweide P J,Burger E H,Feyen J.Cells of Bone:Proliferation,Differentiation,and Hormonal Regulation[J].Physiological reviews,1986,66(4):855-886
[10]Raisz L G.Physiology and Pathophysiology of Bone Remodeling[J].Clinical Chemistry,1999,45(8):1353-1358
[11]Gay C V,Weber J A.Regulation of Differentiated Osteoclasts[J].Critical ReviewsTMin Eukaryotic Gene Expression,2000,10,213-230
[12]Hofbauer L C,Heufelder A E.Role of Receptor Activator of Nuclear Factor-κB Ligand and Osteoprotegerin in Bone Cell Biology[J].Journal of Molecular Medicine,2001,79(5):243-253
[13]Hofbauer L C,Khosla S,Dunstan C R,et al.The Roles of Osteoprotegerin and Osteoprotegerin Ligand in the Paracrine Regulation of Bone Resorption[J].Journal of Bone and Mineral Research,2000,15(1):2-12
[14]Lorget F,Clough J,Oliveira M,et al.Lactoferrin Reduces in vitro Osteoclast Differentiation and Resorbing Activity[J].Biochemical and Biophysical Research Communications,2002,296(2):261-266
[15]Burmeister B,Domaschke H,Gelinsky M,et al.Co-Culture of Osteoblasts and Osteoclasts on Resorb-Able Mineralised Collagen Scaffolds:Establishment of an in vitro Model of Bone Remodeling[J].European Cells and Materials,2003,5:18-19
[16]Han D,Zhang Q.An Essential Requirement for Osteoclasts in RefinedBone-Like Tissue Reconstruction in vitro[J].Medical Hypotheses,2006,67(1):75-78
[17]Jimi E,Nakamura I,Amano H,et al.Osteoclast Function Is Activated by Osteoblastic Cells through a Mechanism Involving Cell-to-Cell Contact[J].Endocrinology,1996,137(8):2187-2190
[18]Nicolin V,Baldini G,Bareggi R,et al.Morphological Features of OsteoclastsDerivedfromaCo-CultureSystem[J].Journal of Molecular Histology,2006,37(3/4):171-177
[19]廖乃顺,陈文列,黄云梅,等.成骨细胞与破骨细胞共培养及其应用研究进展[J].中国骨伤,2013(4):349-353
[20]鲁秀敏,陈林,苏楠,等.小鼠成骨细胞和破骨细胞共培养模型的建立[J].中国骨质疏松杂志,2008,14(3):159-163
[21]Jones G,Marshall M,El Haj A,et al.The Use of Osteoblast/Osteoclast Co-Cultures on PLLA,Silk and Dentin Scaffolds[B].Tissue Eng 2007,13(7):1765-1766
[22]Jones G L,Motta A,Marshall M J,et al.Osteoblast:Osteoclast Co-Cultures on Silk Fibroin,Chitosan and Plla Films[J].Biomaterials,2009,30(29):5376-5384
[23]Gan K,Yang L,Xu L,et al.Iguratimod(T-614)Suppresses Rankl-Induced Osteoclast Differentiation and Migration in Raw264.7 Cells Via NF-κB and Mapk Pathways[J].International Immunopharmacology,2016,35:294-300
[24]Honma M,Ikebuchi Y,Kariya Y,et al.Rankl Subcellular Trafficking and Regulatory Mechanisms in Osteocytes[J].Journal of Bone and Mineral Research,2013,28(9):1936-1949
[25]Boeyens J C,Deepak V,Chua W-H,et al.Effects of Ω3-and Ω6-Polyunsaturated Fatty Acids on Rankl-Induced Osteoclast Differentiation of Raw264.7 Cells:A Comparative in vitro Study[J].Nutrients,2014,6(7):2584-2601
[26]Bostanci N,I˙lgenli T,Emingil G,et al.Gingival Crevicular Fluid Levels of RANKL and OPG in Periodontal Diseases:Implications of Their Relative Ratio[J].Journal of Clinical Periodontology,2007,34(5):370-376
Effects of Different Concentrations of Bovine Lactoferrin on Osteoblast/Osteoclast Co-cultures
LIU Meng1,FAN Feng-jiao1,SHI Pu-jie1,TU Mao-lin1,YU Cui-ping2,DU Ming1,2,*
(1.School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150090,Heilongjiang,China;2.School of Food Science and Technology,Dalian Polytechnic University,Dalian 116034,Liaoning,China)
The osteogenic activity of bovine lactoferrin has been proved that bovine lactoferrin could promote proliferation and differentiation of osteoblasts and inhibit apoptosis of osteoclast.The growth and development of bones depended on the balance between bone resorption and bone formation.Osteoblasts and osteoclasts were associated with bone formation and bone resorption,respectively.The effects of different concentrations of bovine lactoferrin (20,100,500 μg/mL)on the osteoblast and osteoclast activity and bone resorptive activity of osteoclast were studied by co-cultures of MC3T3-E1 cells and RAW264.7 cells (used at a ratio of 1:1)in this paper.Alkaline Phosphatase(ALP)activity was detected by ALP activity Assay Kit.The result showed that low concentrations of bovine lactoferrin inhibited ALP activity of osteoblasts,whereas middle and high concentrations of bovine lactoferrin could significantly promote ALP activity.By tartrate resistant acid phosphatase(TRAP)activity Assay Kit and the ELISA kits,it was found that low and middle concentration of bovine lactoferrin could promote the TRAP activity of osteoclasts,while high concentrations of bovine lactoferrin could sig nificantly inhibit the TRAP activity and the ratio of receptor activator of the NF-κB ligand (RANKL)and os-teoprotegerin(OPG).Bone resorptive activity of osteoclast as evaluated on bone-mimetic plates was significantly inhibited by middle and high concentration of bovine lactoferrin.In general,these results indicated that high concentrations of bovine lactoferrin could not only promote osteoblasts activity,but also inhibit steoclasts activity and function in co-culture system.
bovine lactoferrin;osteoblast;osteoclasts;co-culture
10.3969/j.issn.1005-6521.2017.24.001
国家自然科学基金资助项目(31371805、31101316)
刘猛(1988—),男(汉),博士研究生,研究方向:食品科学。
*通信作者:杜明(1977—),男(汉),教授,博士,研究方向:食品科学。
2017-10-23
