壳寡糖对爆震伤致小鼠急性肺损伤保护作用研究
2017-12-13柳云恩佟昌慈张玉彪丛培芳史秀云金红旭侯明晓
柳云恩, 佟昌慈, 张玉彪, 施 琳, 刘 颖, 丛培芳, 史秀云, 佟 周, 毛 舜, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
·论 著·
壳寡糖对爆震伤致小鼠急性肺损伤保护作用研究
柳云恩, 佟昌慈, 张玉彪, 施 琳, 刘 颖, 丛培芳, 史秀云, 佟 周, 毛 舜, 金红旭, 侯明晓
沈阳军区总医院 急诊医学部 全军重症(战)创伤救治中心实验室辽宁省重症创伤和器官保护重点实验室,辽宁 沈阳 110016
目的探讨壳寡糖对爆震伤致小鼠急性肺损伤(ALI)保护作用,并阐明其可能的作用机制。方法将30只昆明小鼠随机分为对照组、ALI组和ALI+壳寡糖组,检测肺干/湿重比变化;HE染色观察肺组织病理改变;ELISA检测血清炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-4、IL-6和IL-10的变化;Western blot、Real time PCR和免疫荧光检测炎症相关因子和通路相关蛋白DDAH1、ADMA和p38的表达。结果与ALI组相比,壳寡糖可以显著降低爆震伤导致的肺干/湿重比、炎症细胞浸润和炎症相关因子TNF-α、IL-1β、IL-4、IL-6和IL-10表达,升高抑炎因子IL-10表达,差异均有统计学意义(P<0.05);壳寡糖显著提高爆震伤导致的肺组织DDAH1蛋白表达,降低ADMA和p38蛋白表达,差异均有统计学意义(P<0.05)。结论壳寡糖对爆震伤导致的小鼠ALI有保护作用,其可能通过抑制DDAH1表达,促进ADMA,进而激活MAPK通路来实现。
爆震伤; 壳寡糖; 炎症; 急性肺损伤; DDAH1
肺爆震伤病情重,临床救治困难,是爆炸现场伤员早期死亡的主要原因之一[1]。爆炸瞬间产生的冲击波和高能碎片造成肺组织原发性损伤,促进内源性炎症介质释放,进而转变为继发性损伤,这是一种复合性致命伤[2]。多种发病机制如能量代谢障碍、氧化应激、谷氨酸毒性和炎症反应等参与肺爆震伤的发生发展过程[3-4]。其中,炎症反应尤为关键,几乎所有爆震伤造成的组织损伤中均有炎症反应参与。肺爆震伤发生后,机体单核巨噬细胞系统会释放大量的炎性因子如白细胞介素(intertenkin,IL)-1β、IL-6、IL-8和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,这些炎症因子在急性肺损伤(acute lung injury,ALI)的发展过程中起着重要的推进作用[5]。同时,这些炎症介质还会减弱呼吸功能,造成肺组织纤维化,甚至导致心力衰竭[6-9]。当前,与交通肇事伤、高处坠落伤和职业伤等相比,爆震伤已经成为当今青壮年病死率上升的重要原因之一,造成了严重生命损害,消耗更多的医疗资源[10]。目前,爆震伤患者只能接受常规抗炎及机械辅助治疗,无针对性治疗及保护类药物。因此,对爆震伤的合理救治不仅是当前医学研究的热点,更是社会安全稳定发展的迫切需要。
研究发现,壳寡糖具有抑制肿瘤生长,抑制炎症反应,增强骨强度,抗细菌,抗疟疾,抗真菌等作用,其生物活性与壳聚糖的分子量(molecular weight,MW)及脱乙酰度(deacetylation,DA)有关。Park等[11]利用小鼠模型确定壳寡糖MW范围为1.5~5.5 kDa时可有效抑制S180固体瘤及U14肿瘤的生长。Azuma等[12]评价了不同MW(42~135 kDa)及DA(2%~61%)的壳聚糖对膀胱癌细胞的杀伤作用,不同DA壳聚糖均对癌细胞具有杀伤作用,且随着DA上升,细胞杀伤作用更显著。研究表明,壳聚糖具有加速伤口愈合、抗炎症和激活B、T淋巴细胞的作用[13]。小鼠实验证明,壳聚糖能够显著增强细胞和体液免疫功能,激活巨噬细胞的肿瘤杀伤活性和IL-1的形成[14]。研究发现,壳聚糖对鼠巨噬细胞起到激活作用,能够有效地提高NO、IL-1和TNF-α的分泌[15]。Peluso等[16]发现,当壳聚糖的含量在0.05%~0.10%时,可以显著增加鼠巨噬细胞NO含量和iNOS表达,提示壳聚糖增强机体免疫功能可能与促进NO分泌和iNOS表达有关。然而,壳聚糖对爆震伤致ALI是否发挥保护作用,其调节ALI的分子机制如何,尚不清楚。本研究旨在阐明壳寡糖对爆震伤致小鼠ALI是否有保护作用,并探讨其可能的作用机制。现报道如下。
1 对象与方法
1.1 研究对象 30只健康雄性昆明小鼠,体质量25~30 g,周龄6~8周,购自沈阳军区总医院实验动物中心,于沈阳军区总医院动物实验中心饲养,食物及水由动物实验中心提供。壳寡糖由中国科学研究院沈阳金属研究所提供。壳寡糖的聚合度为2~15,平均分子量为100 kDa,90%去乙酰化。
1.2 研究方法
1.2.1 实验分组 将30只小鼠随机分成对照组、ALI组和ALI+壳寡糖组,每组各10只。实验前7 d,ALI+壳寡糖组小鼠通过灌胃给予壳寡糖80 mg/(kg·d),对照组和ALI组给予同等剂量的生理盐水。
1.2.2 动物模型建立 采用自主设计研发的高仿真爆震伤模拟装置,建立爆震伤致小鼠ALI模型。装置设计如下:下方为空气压缩装置,长度约为100 cm,周径约30 cm,将16层厚度约为0.8 μm铝薄置于中间层。通过空气压缩装置使空气压缩,当达到一定压力时爆破产生冲击波。将小鼠称重后进行麻醉,麻醉后的小鼠放于保护罩内保护小鼠其他部位只显露胸部,随后将保护罩内的小鼠固定于装置的网状部位。通电后,记录铝膜爆破的时间及下方空气压缩装置内压力和上方压力传感器所记录的超压波压力,本实验的瞬时冲击波超压为(321±24)PSI。
1.2.3 肺干/湿重比 处死小鼠后取肺组织,滤纸吸干组织表面水分,在分析天平上称质量,记录肺的湿重。放入60℃干燥箱烘干72 h至恒重,记录肺干重,计算干/湿重比。
1.2.4 HE染色 将切片放入二甲苯Ⅰ中脱蜡10 min;再放入二甲苯Ⅱ中脱蜡5 min。逐级脱水:无水乙醇Ⅰ 2~3 min,无水乙醇Ⅱ 2~3 min,95%乙醇2~3 min,自来水冲洗2 min;苏木精染液5~10 min,自来水冲洗2 min,1%盐酸乙醇分化20 s,自来水洗5 min、返蓝;伊红染液90 s,自来水洗40 s,95%乙醇Ⅰ 10 s,95%乙醇Ⅱ 10 s,无水乙醇Ⅰ 2~3 min,无水乙醇Ⅱ 2~3 min,二甲苯Ⅰ 2 min,二甲苯Ⅱ 2 min。中性树胶封片,镜检。
1.2.5 ELISA检测 利用ELISA试剂盒(Cloud-Clone Company,USA)测定血清TNF-α、IL-1β、IL-4、IL-6和IL-10水平。将标准溶液100 μl或100 μl稀释样品加入到反应板中混合,然后在37℃温育30 min。洗板后,每孔加入100 μl检测液(含一抗),37℃孵育2 h。洗板后,每孔加入100 μl的HRP标记的二抗,37℃培养30 min。平板洗涤后,加入50 μl染色溶液A和50 μl染色溶液B,在暗室中温育15 min。加入50 μl等分的终止缓冲液以终止反应。用酶标仪(Bio-Rad,美国)在450 nm处测量光密度值,用标准曲线计算每个样品的浓度。
1.2.6 RT-PCR 检测 使用Trizol试剂(美国Invitrogen公司)提取总RNA,使用SYBR Premix Ex Taq(日本TaKaRa公司)和Mx3000P仪器(美国Sigma公司)进行RT-PCR。使用Stratagene Mx3000P软件分析mRNA表达,采用比较阈值循环方法将靶基因的mRNA表达标准化为对照甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)。
1.2.7 Western blot检测 将蛋白质样品加入相应的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)凝胶样品缓冲液中,变性5 min,然后进行SDS-聚丙烯酰胺凝胶电泳,然后转移到膜上。用PBST在室温下将膜封闭在磷酸盐缓冲盐水中1 h,用PBST洗涤3次,用核因子κB(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)、TNF-α、IL-1β、IL-4、IL-6、IL-10、DDAH1、ADMA和p38(美国Sigma)后,洗涤印迹与偶联至过氧化物酶(美国Sigma)的山羊抗小鼠IgG温育。使用ECL检测试剂盒(美国Bio-Rad)通过化学发光染色检测抗体结合。使用Bandscan 5.0软件通过光密度测定法定量各条带的密度。
1.2.8 免疫荧光染色 将肺组织切片用二甲苯脱蜡,梯度乙醇脱水,用0.1% Triton X-100处理30 min,每次用PBS洗涤3次,每次5 min。用5%牛血清白蛋白和10%山羊血清分别封闭样品30 min后添加第一抗体,在湿盒中于4℃冰箱过夜孵育,并用荧光二抗染色。最后,观察样品染色情况并用显微镜拍照。
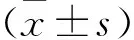
2 结果
2.1 壳寡糖对爆震伤致小鼠肺干/湿重比与组织病理改变的影响 与对照组比较,ALI组小鼠肺干/湿重比明显降低,差异有统计学意义(P<0.05,图1)。病理组织学检查结果表明,与对照组比较,ALI组肺组织可见大量的炎症细胞浸润,肺泡间隔显著增厚;壳寡糖可以有效抑制爆震伤导致的炎症细胞浸润,减轻肺泡壁增厚。

图1 各组小鼠肺干/湿重比比较(与对照组比较,①P<0.05;与ALI组比较,②P<0.05)
2.2 壳寡糖对爆震伤小鼠血清炎症因子表达的影响 与对照组比较,ALI组小鼠血清促炎症因子TNF-α、IL-1β、IL-4和IL-6表达显著升高,而抑炎因子IL-10表达显著降低,差异有统计学意义(P<0.05)。与ALI组比较,ALI+壳寡糖组显著降低了TNF-α、IL-1β、IL-4、IL-6及IL-10表达,提高IL-10表达,差异均有统计学意义(P<0.05)。见图2。
2.3 壳寡糖对爆震伤小鼠肺组织炎症因子表达的影响 RT-PCR结果发现,与对照组比较,ALI组NF-κB、TNF-α、IL-1β、IL-4及IL-6的mRNA表达显著升高,IL-10的mRNA表达显著降低,差异有统计学意义(P<0.05)。与ALI组比较,ALI+壳寡糖组显著降低促炎症因子NF-κB、TNF-α、IL-1β、IL-4和IL-6的mRNA表达,显著提高抑炎因子IL-10的mRNA表达,差异有统计学意义(P<0.05)。见图3。
2.4 壳寡糖对爆震伤小鼠肺组织炎症蛋白的影响 Western blot结果发现,与对照组比较,ALI组NF-κB、TNF-α、IL-1β、IL-4及IL-6蛋白表达显著升高,IL-10蛋白表达显著降低(P<0.05);与ALI组相比,ALI+壳寡糖组显著降低NF-κB、TNF-α、IL-1β、IL-4及IL-6蛋白表达,促进IL-10蛋白表达,差异有统计学意义(P<0.05)。见图4。

图2 各组小鼠血清炎症因子表达比较(a.TNF-α;b.IL-1β;c.IL-4;d.IL-6;e.IL-10;与对照组比较,①P<0.05;与ALI组比较,②P<0.05)
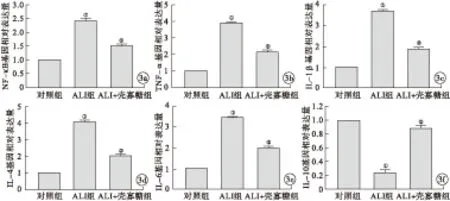
图3 各组小鼠肺组织炎症因子表达比较(a.NF-κB;b.TNF-α;c.IL-1β;d.IL-4;e.IL-6;f.IL-10;与对照组比较,①P<0.05;与ALI组比较,②P<0.05)

图4 各组小鼠肺组织炎症蛋白表达比较
2.5 壳寡糖对爆震伤小鼠炎症通路蛋白影响 RT-PCR和Western blot结果发现,与对照组比较,ALI组DDAH1的mRNA表达降低,ADMA和p38的mRNA表达增高;与ALI组比较,ALI+壳寡糖组DDAH1的mRNA表达显著提高,ADMA和p38的mRNA表达降低,差异均有统计学意义(P<0.05,5a~5d)。免疫荧光结果发现,与对照组比较,ALI组DDAH1蛋白表达显著降低,ADMA和p38蛋白表达显著增高;与ALI组比较,壳寡糖显著提高DDAH1蛋白表达,降低ADMA和p38蛋白表达,差异均有统计学意义(P<0.05,5e-5f)。

图5 壳寡糖对炎症通路蛋白表达的影响(a.Western blot检测各组mRNA表达;b.各组DDAH1的mRNA表达;c.各组ADMA的mRNA表达;d.各组p38的mRNA表达;e.各组DDAN1蛋白表达;f.各组p38蛋白表达;与对照组比较,①P<0.05;与ALI组比较,②P<0.05)
3 讨论
促炎和抗炎细胞因子在败血症、肺炎、休克、胰腺炎等导致的ALI 中均发挥重要作用[17],表明细胞因子可促进肺或全身炎症反应。ALI 既是全身炎性反应在肺部的表现,也是机体正常炎性反应过度的结果。本研究发现,壳寡糖可有效恢复肺干/湿重比,抑制爆震伤导致的肺组织损伤程度加重,降低血清和肺组织炎症因子TNF-α、IL-1β、IL-4和IL-6表达,提高抑炎因子IL-10的表达。在炎症反应中,促炎性介质(IL-1β、TNF-α、IL-6、IL-8)和抗炎性介质(IL-1ra、IL-10、IL-13)处于平衡、失衡相互对立统一的变化之中。TNF-α是ALI 发展中重要的细胞因子,可激活内皮细胞活化,导致肺水肿发生[18]。TNF-α 作为细胞反应中的初始因子,在亚细胞水平上激发级联反应或瀑布效应,上调TNF-α和IL-6等多种炎症因子表达。IL-1β是由活化的巨噬细胞分泌的细胞因子,ALI 早期血浆、组织和水肿液中IL-1β表达水平均升高,其与TNF-α有协同作用。IL-6是单核细胞在TNF-α和IL-6诱导下产生的细胞因子,也由活化的巨噬细胞和内皮细胞产生。IL-6通过诱导急性期蛋白合成,催化和放大炎症反应和毒性作用,造成组织细胞损害。ALI/呼吸窘迫综合征(acute respiratory distress sydrome,ARDS) 患者血浆和组织中IL-6和IL-8呈高水平表达,常提示患者预后不良,且病死率较高[19]。ARDS病死患者肺组织IL-6和IL-8水平通常较高,IL-8水平与肺顺应性呈负相关,与SOFA评分呈正相关[20]。IL-10 通过抑制Th1分化和中性粒细胞活性,抑制NF-κB活性,发挥抗炎作用。多中心研究表明,血浆IL-10水平升高与患者预后呈正相关[21-22]。本研究发现,壳寡糖显著抑制爆震伤诱导的炎症因子NF-κB、TNF-α、IL-1β、IL-4和IL-6高表达,同时,促进IL-10表达,提示壳寡糖对爆震伤导致的炎症反应有较好的保护作用,通过抑制促炎因子的表达,提高抑炎因子的表达发挥抗炎活性。
p38是一类丝裂原激活的蛋白激酶,对于各种应激反应如细胞因子、紫外线照射、热休克和冲击等发生应答,并参与细胞分化、凋亡和自噬。现代研究发现,创伤后患者体内丝裂原激活的蛋白酶(p38MAPK)的激活以及TNF-α和IL-6的表达水平都迅速上调,且都与创伤程度呈正相关。而且TNF-α、IL-1可以激活p38通路,使之进一步产生级联效应。研究发现,抑制p38可以缓解自身免疫病并治疗炎症,因此,关于p38的抑制已被开发并投入临床研究[23-24]。ADMA和DDAH1是近年来心肺方面疾病研究的热点,其与哮喘、各类型休克以及肿瘤等疾病相关[25-28]。研究发现,较低的L-arginine/ADMA比值与肺功能下降有关[29]。在本研究模型成功后12 h,ALI组DDAH1表达降低,ADMA和p38的表达增高,壳寡糖可有效恢复DDAH1的表达,抑制ADMA和p38的表达。说明壳寡糖可以通过p38以及DDAH1和ADMA相关细胞信号通路缓解肺爆震伤引起的炎症反应,保护肺功能,减轻肺部损伤。
总之,壳寡糖对爆震伤导致的小鼠ALI有保护作用,其可能通过抑制DDAH1表达,促进ADMA,进而激活MAPK通路实现。
[1] Singleton JA,Gibb IE,Bull AM,et al.Primary blast lung injury prevalence and fatal injuries from explosions:insights from postmortem computed tomographic analysis of 121 improvised explosive device fatalities[J].J Trauma Acute Care Sur,2013,75(2):269-274.
[2] Chai JK,Cai JH,Deng HP,et al.Role of neutrophil elastase in lung injury induced by burn-blast combined injury in rats[J].Burns,2013,39(4):745-753.
[3] Fan J,Li Y,Levy RM,et al.Hemorrhagic shock induces NAD(P)H oxidase activation in neutrophils:role of HMGB1-TLR4 signaling[J].J Immunol,2007,178(10):6573-6580.
[4] Kimura T,Nojiri T,Hosoda H,et al.C-type natriuretic peptide attenuates lipopolysaccharide-induced acute lung injury in mice[J].J Surg Res,2015,194(2):631-637.
[5] Severgnini M,Takahashi S,Rozo LM,et al.Activation of the stat pathway in acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2004,286(6):1282-1292.
[6] Arora S,Clarke K,Srinivasan V,et al.Effect of nesiritide on renal function in patients admitted for decompensated heart failure[J].QJM,2007,100(11):699-706.
[7] Kumar PA,Hu Y,Yamamoto Y,et al.Distal airway stem cells yield alveoli in vitro and during lung regeneration following h1n1 influenza infection[J].Cell,2011,147(3):525-538.
[8] Imai Y,Kuba K,Neely GG,et al.Identification of oxidative stress and toll-like receptor 4 signaling as a key pathway of acute lung injury[J].Cell,2008,133(2):235-249.
[9] Kolb M,Margetts PJ,Anthony DC,et al.Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis[J].J Clin Invest,2001,107(12):1529-1536.
[10] Aharonson-Daniel L,Peleg K;ITG.The epidemiology of terrorism casualties[J].Scand J Surg,2005,94(3):185-190.
[11] Park JK,Chung MJ,Choi HN,et al.Effects of the molecular weight and the degree of deacetylation of chitosan oligosaccharides on antitumor activity[J].Int J Mol Sci,2011,12(1):266-277.
[12] Azuma K,Osaki T,Minami S,et al.Anticancer and anti-inflammatory properties of chitin and chitosan oligosaccharides[J].J Funct Biomater,2015,6(1):33-49.
[13] Seferian PG,Martinez ML.Immune stimulating activity of two new chitosan containing adjuvant formulations[J].Vaccine,2000,19(6):661-668.
[14] Chou TC,Fu E,Shen EC.Chitosan inhibits prostaglandin E2 formation and cyclooxygenase-2 induction in lipopolysaccharide-treated RAW 264.7 macrophages[J].Biochem Biophys Res Commun,2003,308(2):403-407.
[15] Zaharoff DA,Rogers CJ,Hance KW,et al.Chitosan solution enhances both humoral and cell-mediated immune responses to subcutaneous vaccination[J].Vaccine,2007,25(11):2085-2094.
[16] Peluso G,Petillo O,Ranieri M,et al.Chitosan-mediated stimulation of macrophage function[J].Biomaterials,1994,15(15):1215-1220.
[17] Goodman RB,Pugin J,Lee JS,et al.Cytokine-mediated inflammation in acute lung injury[J].Cytokine Growth Factor Rev,2003,14(6):523-535.
[18] Yang G,Hamacher J,Gorshkov B,et al.The dual role of tnf in pulmonary edema[J].J Cardiovasc Dis Res,2010,1(1):29-36.
[19] Mc Clintock D,Zhuo H,Wickersham N,et al.Biomarkers of inflammation,coagulation and fibrinolysis predict mortality in acute lung injury[J].Crit Care,2008,12(2):R41.
[20] Lin WC,Lin CF,Chen CL,et al.Prediction of outcome in patients with acute respiratory distress syndrome by bronchoalveolar lavage inflammatory mediators[J].Exp Biol Med,2010,235(1):57-65.
[21] Hiroshima Y,Hsu K,Tedla N,et al.S100a8 induces il-10 and protects against acute lung injury[J].Open J Immunol,2014,192(6):2800-2811.
[22] Foroughi F,Amirzargar A,Ahmadpoor P,et al.Increased levels of CD4(+) and CD8(+) T cells expressing CCR1 in patients developing allograft dysfunction;a cohort study[J].Transpl Immunol,2016,38:67-74.
[23] Goldstein DM,Gabriel T.Pathway to the clinic:inhibition of p38 map kinase.A review of ten chemotypes selected for development[J].Curr Top Med Chem,2005,5(10):1017-1029.
[24] Hill RJ,Dabbagh K,Phippard D,et al.Pamapimod,a novel p38 mitogen-activated protein kinase inhibitor:Preclinical analysis of efficacy and selectivity[J].J Pharmacol Exp Ther,2008,327(3):610-619.
[25] Scott JA,North ML,Rafii M,et al.Asymmetric dimethylarginine is increased in asthma[J].Am J Respir Crit Care Med,2011,184(7):779-785.
[26] Di Gangi IM,Pirillo P,Carraro S,et al.Online trapping and enrichment ultra performance liquid chromatography-tandem mass spectrometry method for sensitive measurement of “arginine-asymmetric dimethylarginine cycle” biomarkers in human exhaled breath condensate[J].Anal Chim Acta,2012,754:67-74.
[27] Carraro S,Giordano G,Piacentini G,et al.Asymmetric dimethylarginine in exhaled breath condensate and serum of children with asthma[J].Chest,2013,144(2):405-410.
[28] Holguin F,Comhair SA,Hazen SL,et al.An association between l-arginine/asymmetric dimethyl arginine balance,obesity,and the age of asthma onset phenotype[J].Am J Respir Crit Care Med,2013,187(2):153-159.
[29] Lu M,Lawrence DA,Marsters S,et al.Opposing unfolded-protein-response signals converge on death receptor 5 to control apoptosis[J].Science,2014,345(6192):98-101.
Protectiveeffectandmechanismofchitosanoligosaccharideonblastinjury-inducedacutelunginjury
LIU Yun-en,TONG Cang-ci,ZHANG Yu-biao,SHI Lin,LIU Ying,CONG Pei-fang,SHI Xiu-yun,TONG Zhou,MAO Shun,JIN Hong-xu,HOU Ming-xiao
(Department of Emergency Medicine,Laboratory of PLA Wound and Trauma Center,The General Hospital of Shenyang Military Command,Shenyang 110016,China)
ObjectiveTo investigate the protective effect and the possible molecular mechanisms of chitosan oligosaccharide(COS)on acute lung injury(ALI)caused by blast injury.MethodsThirty mice were randomly divided into the control,ALI and ALI + COS groups.The dry/wet lung weight ratio changes were detected;using HE staining to observe the pathological changes of lung tissue;using ELISA to measure the changes of serum inflammatory factors including TNF-α,IL-1β,IL-4,IL-6 and IL-10;using Western blot,Real time PCR and immunofluorescence staining to detect inflammatory correlation factors and pathway related proteins DDAH1,ADMA and p38 expression.ResultsCompared to ALI group,COS treatment caused a significant reduction of dry/wet lung weight ratio,inflammatory cell infiltration and expression levels of serum inflammatory factors including TNF-α,IL-1β,IL-4,IL-6 and IL-10,and increased the expression of the inhibitory factor IL-10(P﹤0.05);COS significantly increased dimethylarginine dimethylaminohydrolase 1(DDAH1)protein expression,and reduced ADMA and p38 protein expression (P﹤0.05).ConclusionCOS has protective effects on blast injury-induced ALI,possibly by promoting DDAH1 expression and inhibiting ADMA and mitogen-activated protein kinase pathways.
Blast injury; Chitosan oligosaccharide; Inflammation; Acute lung injury; DDAH1
总后卫生部重大新上项目(AWS14L008);全军十二五面上延续项目(CSY13J003);辽宁省科技厅面上项目(20170540947)
柳云恩(1979-),男,辽宁葫芦岛人,主治医师,博士
侯明晓,E-mail:houmingxiao188@163.com;金红旭,E-mail:hongxuj@126.com
2095-5561(2017)06-0360-07DOI∶10.16048/j.issn.2095-5561.2017.06.11
2017-09-15
