辛伐他汀对缺氧黑素瘤细胞A375增殖凋亡及迁移的影响
2017-12-12李娟李立
李娟 李立
450012郑州市妇幼保健院皮肤科(李娟);郑州市第二人民医院皮肤科(李立)
辛伐他汀对缺氧黑素瘤细胞A375增殖凋亡及迁移的影响
李娟 李立
450012郑州市妇幼保健院皮肤科(李娟);郑州市第二人民医院皮肤科(李立)
目的 探讨辛伐他汀对缺氧黑素瘤细胞A375增殖、凋亡、迁移调控的分子机制。方法在常氧或缺氧环境下体外培养A375细胞,细胞分为辛伐他汀处理的辛伐他汀组与二甲基亚砜处理的对照组,通过CCK-8细胞计数试剂盒检测细胞活力,Annexin V/PI凋亡实验检测细胞凋亡,插入式细胞培养皿transwell迁移实验检测细胞迁移。RT-PCR法、Western印迹法检测辛伐他汀组与对照组细胞低氧诱导因子(HIF)-1α、生存素、细胞周期素依赖性蛋白激酶抑制因子(P27),以及沉默缺氧A375细胞的HIF-1α后的生存素、p27 mRNA与蛋白表达水平。结果 常氧或缺氧环境下,辛伐他汀组与对照组A375细胞增殖活力、凋亡细胞比例、细胞迁移数组间差异均有统计学意义(F值95.84、37.22、177.5,均P <0.001),缺氧对照组A375细胞的增殖活力(1.391±0.129)、细胞迁移数(322.550±26.226)均高于常氧对照组(0.807±0.049、125.583±17.256)、缺氧辛伐他汀组(0.685±0.417、115.167±12.050)(P<0.001);缺氧对照组细胞凋亡比例(6.167%±2.714%)均低于常氧对照组(11.833%±2.483%)、缺氧辛伐他汀组(17.833%±2.714%)(P<0.01)。缺氧辛伐他汀组HIF-1α mRNA与蛋白水平、生存素mRNA与蛋白水平均低于对照组(P<0.05);P27 mRNA与蛋白水平均高于对照组(P<0.05)。沉默缺氧A375细胞中HIF-1α后,生存素mRNA与蛋白水平均低于对照组(t值为5.346、8.281,P < 0.05),P27 mRNA与蛋白水平高于对照组(t值为31.37、9.954,P < 0.01)。结论辛伐他汀可抑制缺氧A375细胞的增殖及迁移,促进凋亡,其机制可能与HIF通路有关。
黑素瘤;细胞系,肿瘤;缺氧;细胞增殖;细胞凋亡;细胞迁移分析;生存素;低氧诱导因子;辛伐他汀
黑素瘤是恶性程度最高的皮肤肿瘤,发病率低,但死亡率高[1]。黑素瘤细胞过度增殖导致氧供需失衡,局部组织存在缺氧。研究显示,缺氧可诱导黑素瘤细胞(A375)增殖,增强迁移能力[2-3],是患者预后不良的独立危险因素[4]。低氧诱导因子(HIF)信号通路在肿瘤血管生成、肿瘤细胞增殖及迁移中发挥了重要作用[2,5]。研究发现,他汀类药物可以通过调控线粒体功能、氧化应激反应、诱导血红素合酶1[6]、黑素浓集激素Ⅰ类相关蛋白A[7]等参与肿瘤细胞增殖、迁移的调控。本研究旨在明确缺氧环境下黑素瘤的生长和迁移能力的变化,探讨他汀类药物对缺氧黑素瘤的增殖、凋亡、迁移的调控作用。
材料和方法
一、试剂和仪器
辛伐他汀(美国Sigma-Aldrich公司)储存浓度为10 g/L,采用二甲基亚砜(DMSO)配制。转染试剂盒(Lipofectanmol/Line 2000)(美国 Thermo Fisher Scientific公司);HIF-1α抗体(美国Novus公司);生存素(survivin)及细胞周期素依赖性蛋白激酶抑制因子(P27)抗体(美国Proteintech公司);ECL化学发光试剂盒(美国Advansta公司);CCK-8试剂盒(日本同仁公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司)。
二、细胞培养
A375细胞系购于ATCC公司,采用含有10%胎牛血清的DMEM培养基(美国Gibco公司)培养。常氧组细胞于5%CO2培养箱中培养,缺氧组细胞于5%CO2、5%O2、90%N2的缺氧培养箱中培养。
三、细胞活力检测
将A375细胞以1×104/ml的密度接种于96孔细胞培养板内,每孔加入100 μl细胞悬液,分别给予0.25、0.5、1、2、4、8 μmol/L辛伐他汀(辛伐他汀组)及DMSO(对照组)干预,置于常氧或缺氧培养箱48 h后,磷酸盐缓冲液(PBS)洗涤细胞,更换新鲜培养基,每孔加入10 μl染色液CCK-8,常氧培养箱内孵育3~4 h。酶标仪测定每孔在450 nmol/L处的吸光度(A值),记录并分析。
四、细胞凋亡实验
将A375细胞接种于6孔板中,采用含0.5%血清的低血清培养基培养细胞诱导细胞凋亡,分别给予辛伐他汀及DMSO干预,置于常氧或缺氧培养箱48 h后,收集细胞,PBS 洗涤,加入400 μl结合缓冲液重悬细胞,先加入5 μl Annexin-V-FITC荧光探针混匀,室温避光5 ~ 10 min,再加入5 μl PI核酸染料,流式细胞仪检测荧光。分析各组晚期凋亡(Annexin-V及PI阳性)细胞比例。
五、细胞迁移实验
采用transwell小室进行细胞迁移实验。A375细胞长至90%融合时,去血清培养24 h同步化细胞。在transwell小室下室中加入500 μl 15%血清DMEM培养基,上室加入100 μl的1×104/ml细胞悬液(无血清DMEM培养基),分别给予辛伐他汀及DMSO处理,置于常氧或缺氧培养箱8 h后,PBS漂洗,多聚甲醛固定,结晶紫染色,倒置显微镜下观察,每个小室随机选择8个视野数细胞数。
六、沉默A375细胞中HIF-1α
委托广州锐博生物有限公司合成针对HIF-1α基因的小干扰RNA(si-HIF)及阴性对照si-NC。Si-HIF的序列,正向引物:5′-UGCUCUUUGUGGUUGGAUC UA-3′,反向引物:5′-ACGAGAAACACCAACCUAGA U-3′。接种1×105个缺氧环境下的A375细胞至细胞培养板,采用无双抗培养基,按照Lipofectamine 2000说明书将siRNA以20 nmol/L终浓度转染至A375细胞内,转染48~72 h后提取总蛋白,用于本研究后续实验。
七、检测A375细胞mRNA表达
依照Total RNA提取试剂说明书提取各组A375细胞RNA。合成cDNA,所得反转录产物采用ABI 7500型实时荧光定量PCR扩增,HIF-1α正向引物:5′-ATGAAGTGTACCCTAACTAGC CG-3′,反向引物:5′-GCTTGAGTTTCAACCCAGACATA-3;P27正向引物:5′-TTGCGCAATTAGGTTTTTCC-3′,反向引物:5′-AAAGGAATTCAAGCCCTTCC-3′;生存素正向引物:5′-TGCCCCGACGTTGCC-3′,反向引物:5′-CAGTTCTTGAATGTAGAGATGCGGT-3′;内 参 照GAPDH正向引物:5′-GAAGGTGAAGGTCGGAGTC-3′,反向引物:5′-GAAGATGGTGATGGGATTTC-3′。引物由生工生物工程(上海)股份有限公司合成。根据如下公式计算mRNA的相对表达量,△Ct=C(t)目标 -C(t)GAPDH,△△C(t)=2-△C(t)。
八、免疫印迹实验
用蛋白裂解液提取各处理组的A375细胞总蛋白,制作聚丙烯酰胺凝胶(SDS-PAGE),采用BCA蛋白测定法检测蛋白浓度,根据浓度计算上样量,加入5×SDS上样缓冲液,混匀后煮沸10 min。蛋白电泳,使用聚偏二氟乙烯膜转膜,5%脱脂牛奶加入Tween的Tris-Hcl缓冲盐溶液(TBST)混合液封闭,加入相应的一抗4℃孵育过夜,二抗室温孵育1 h,ECL化学发光试剂盒显影,Image J图像处理软件分析目的条带的灰度值。
九、统计学方法
使用GraphPad Prism 5.0分析数据并绘制统计图。两组间均数比较采用t检验;多组间比较采用双因素方差分析,组间多重比较采用Bonferroni检验;半抑制浓度(IC50)采用非线性回归拟合计算;计量资料采用±s表示,所有独立的实验重复3次取均值。以P<0.05为差异有统计学意义。
结 果
一、不同浓度辛伐他汀对缺氧A375细胞增殖的影响
辛伐他汀浓度分别0.25、0.50、1.00、2.00、4.00、8.00 μmol/L时,A375细胞增殖抑制率分别为15.038%、22.535%、45.614%、58.186%、84.262%、84.815%,半抑制浓度(IC50)为1.3 μmol/L,故本研究后续实验采用1.3 μmol/L作为辛伐他汀的处理浓度,且常氧联合1.3 μmol/L辛伐他汀处理A375细胞时,细胞活力(0.662±0.018)与常氧对照组(0.812±0.032)比较,差异无统计学意义(t=2.027,P=0.08)。
二、缺氧与辛伐他汀对A375细胞增殖的影响
常氧环境与缺氧环境下,对照组与辛伐他汀组的A375细胞增殖活力差异有统计学意义(P<0.001),缺氧辛伐他汀组与缺氧对照组A375细胞增殖活力均高于常氧组(P<0.001),缺氧辛伐他汀组低于缺氧对照组(t=17.88,P<0.001)。见表1。
表1 辛伐他汀对缺氧诱导的A375细胞增殖、凋亡及迁移的影响(±s)
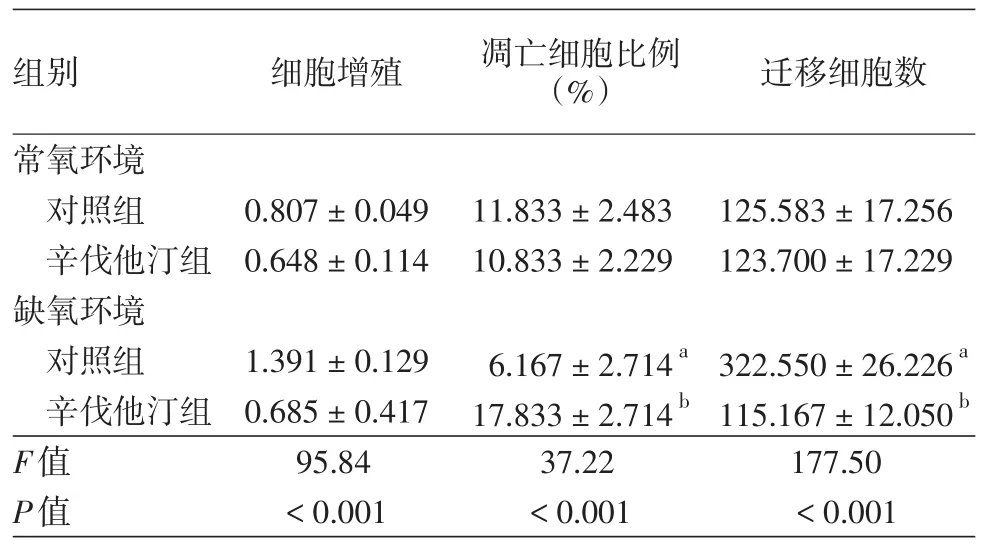
表1 辛伐他汀对缺氧诱导的A375细胞增殖、凋亡及迁移的影响(±s)
注:n=3。a与常氧对照组比较,P<0.01;b与缺氧对照组比较,P<0.001
三、辛伐他汀对缺氧诱导A375细胞凋亡与迁移的影响
细胞凋亡实验结果显示,A375细胞凋亡细胞比例组间差异有统计学意义(P<0.001),缺氧对照组低于常氧对照组、缺氧辛伐他汀组(t值分别为3.860、7.946,P < 0.001)。细胞迁移实验结果显示,A375细胞迁移数组间差异有统计学意义(P<0.001),缺氧对照组高于常氧对照组、缺氧联合辛伐他汀组(t值分别为18.06、19.01,P < 0.001)。见表1。
四、辛伐他汀调控缺氧A375细胞增殖凋亡的机制研究
缺氧环境下,辛伐他汀组HIF-1α mRNA水平与蛋白水平、生存素mRNA水平与蛋白水平均低于对照组,P27 mRNA水平与蛋白水平高于对照组,差异均有统计学意义(P<0.05或<0.01)。见表2,图1。
沉默缺氧A375细胞中HIF-1α后,生存素mRNA与蛋白表达低于对照组,P27 mRNA与蛋白表达高于对照组(P<0.01),差异均有统计学意义(P<0.05或<0.01)。见表3,图1。
讨 论
黑素瘤过度增殖导致局部组织缺氧,缺氧可以通过上调血管内皮生长因子(VEGF)、白细胞介素8(IL-8)、基质金属蛋白酶2(MMP2)等诱导黑素瘤细胞选择性突变,发生表型转化,使细胞适应缺氧环境,促进黑素瘤细胞增殖及迁移。HIF信号通路参与了缺氧对黑素瘤细胞的调控。常氧环境中,正常细胞及组织中HIF-1α被迅速降解几乎检测不到,而28%的黑素瘤组织可表达HIF-1α[8]。HIF-1α通过调控细胞周期蛋白水平、线粒体凋亡途径等参与细胞的增殖、凋亡[9]。生存素作为凋亡蛋白抑制因子家族成员之一,可以在98%(62/63)的黑素瘤患者中检出,且组织标本中生存素的mRNA水平与接受术后黑素瘤疫苗Canvaxin的患者的生存期成负相关[10]。P27是细胞周期素依赖性蛋白激酶抑制因子,参与调控细胞G0至S期转换。研究显示,P27的水平与肿瘤浸润厚度负相 关[11],是晚期转移黑素瘤患者预后的独立预测因子[12]。常氧环境中,他汀类药物可以通过凋亡依赖途径作为化疗药物的增敏剂发挥抗肿瘤作用[13]。他汀类药物可以通过触发一个“自分泌环”放大外源性途径诱导细胞凋亡[14]。辛伐他汀可以通过诱导G1期停滞抑制肿瘤细胞增殖,其机制可能通过上调P27的表达而实现[15]。近期研究发现脂溶性他汀类药物对常氧B16.F10小鼠黑素瘤细胞的细胞毒性作用可能通过抑制HIF-1α的表达和抗氧化防御机制实现[16]。
表2 缺氧环境下辛伐他汀对A375细胞低氧诱导因子(HIF)-1α、生存素、细胞周期素依赖性蛋白激酶抑制因子(P27)的mRNA及蛋白表达的影响(±s)
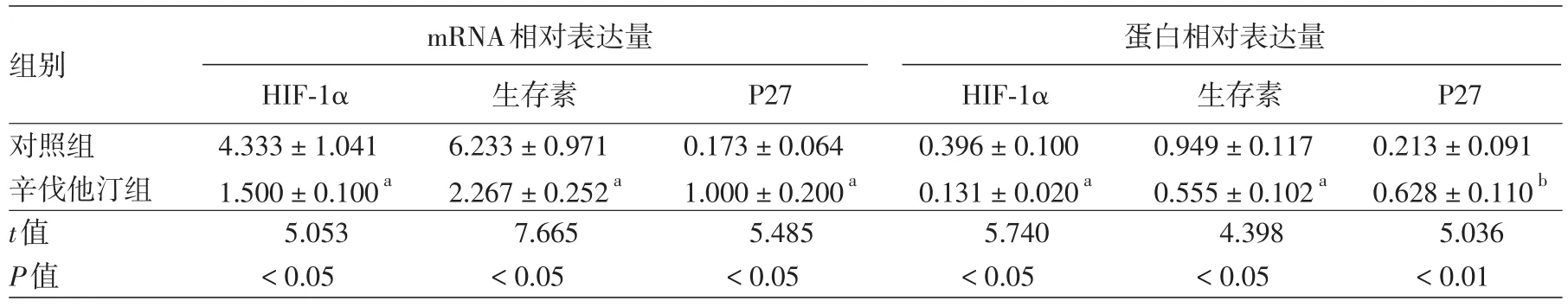
表2 缺氧环境下辛伐他汀对A375细胞低氧诱导因子(HIF)-1α、生存素、细胞周期素依赖性蛋白激酶抑制因子(P27)的mRNA及蛋白表达的影响(±s)
注:n=3。a与对照组比较差异有统计学意义,P<0.05;b与对照组比较差异有统计学意义,P<0.01
表3 缺氧环境下A375细胞沉默HIF-1α对生存素、P27的mRNA及蛋白表达的影响(±s)

表3 缺氧环境下A375细胞沉默HIF-1α对生存素、P27的mRNA及蛋白表达的影响(±s)
注:n=3。si-NC:阴性对照小干扰RNA;si-HIF:针对HIF-1α的小干扰RNA;a与si-NC组比较差异有统计学意义(P<0.05);b与si-NC组比较差异有统计学意义(P<0.01)
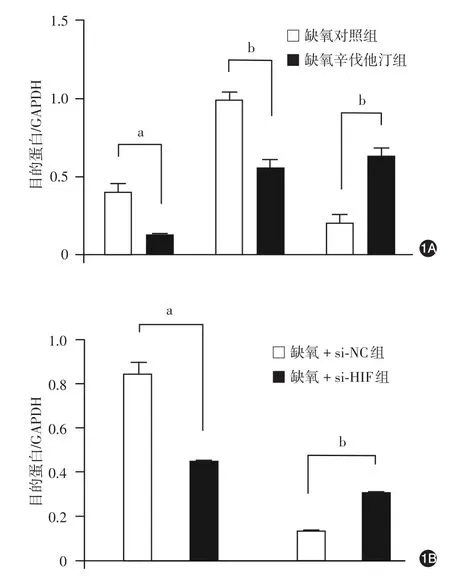
图1 缺氧环境下A375细胞低氧诱导因子(HIF)-1α、生存素、细胞周期素依赖性蛋白激酶抑制因子(P27)的mRNA及蛋白的表达 1A:缺氧及辛伐他汀对A375细胞HIF-1α、生存素、P27的蛋白表达的影响;1B:缺氧A375细胞沉默HIF-1α对生存素、P27的蛋白表达的影响;si-NC:对照小干扰RNA;si-HIF:针对HIF-1α的小干扰RNA;a:P <0.05;b:P < 0.001
本研究通过检测缺氧环境下人黑素瘤细胞A375细胞的增殖、凋亡及迁移能力,明确了缺氧促进黑素瘤细胞增殖及迁移、抑制凋亡的作用,证实了缺氧是黑素瘤生长和转移的重要诱导因素。同时,使用辛伐他汀干预缺氧A375细胞,可以逆转缺氧对A375细胞的促生长和迁移作用。沉默缺氧黑素瘤细胞HIF-1α之后,生存素表达下降,P27增加,提示生存素及P27可能是HIF-1α的下游靶蛋白。辛伐他汀可以抑制缺氧黑素瘤细胞HIF-1α的表达,从而下调生存素、上调P27,提示辛伐他汀通过HIF-1α信号通路发挥抑制缺氧黑素瘤细胞增殖、促进凋亡的作用。
[1]Miller AJ,Mihm MC Jr.Melanoma[J].N Engl J Med,2006,355(1):51-65.DOI:10.1056/NEJMra052166.
[2]Bedogni B,Powell MB.Hypoxia,melanocytes and mela-nomasurvival and tumor development in the permissive microenvironmol/Lent of the skin[J].Pigment Cell Melanoma Res,2009,22(2):166-174.DOI:10.1111/j.1755-148X.2009.00553.x.
[3]Huber R,Meier B,Otsuka A,et al.Tumour hypoxia promotes melanoma growth and metastasis via High Mobility Group Box-1 and M2-like macrophages[J].Sci Rep,2016,6:29914.DOI:10.1038/srep29914.
[4]Lartigau E,Randrianarivelo H,Avril MF,et al.Intratumoral oxygen tension in metastatic melanoma[J].Melanoma Res,1997,7(5):400-406.DOI:10.1097/00008390-199710000-00006.
[5]Hanna SC,Krishnan B,Bailey ST,et al.HIF1α and HIF2α independently activate SRC to promote melanoma metastases[J].J Clin Invest,2013,123(5):2078-2093.DOI:10.1172/JCI66715.
[6]Ivanov VN,Hei TK.Regulation of apoptosis in human melanoma and neuroblastoma cells by statins,sodium arsenite and TRAIL:a role of combined treatment versus monotherapy[J].Apoptosis,2011,16(12):1268-1284.DOI:10.1007/s10495-011-0649-2.
[7]Pich C,Teiti I,Rochaix P,et al.Statins Reduce Melanoma Development and Metastasis through MICA Overexpres-sion[J].Front Immunol,2013,4:62.DOI:10.3389/fimmu.2013.00062.
[8]Sandru A,Voinea S,Panaitescu E,et al.Survival rates of patients with metastatic malignant melanoma[J].J Med Life,2014,7(4):572-576.
[9]Giatromanolaki A,Sivridis E,Kouskoukis C,et al.Hypoxiainducible factors 1alpha and 2alpha are related to vascular endothelial growth factor expression and a poorer prognosis in nodular malignant melanomas of the skin[J].Melanoma Res,2003,13(5):493-501.DOI:10.1097/01.cmr.0000056268.56735.4c.
[10]Goda N,Dozier SJ,Johnson RS.HIF-1 in cell cycle regulation,apoptosis,and tumor progression[J].Antioxid Redox Signal,2003,5(4):467-473.DOI:10.1089/152308603768295212.
[11]Takeuchi H,Morton DL,Elashoff D,et al.Survivin expression by metastatic melanoma predicts poor disease outcome in patients receiving adjuvant polyvalent vaccine[J].Int J Cancer,2005,117(6):1032-1038.DOI:10.1002/ijc.21267.
[12]Flørenes VA,Maelandsmo GM,Kerbel RS,et al.Protein expression of the cell-cycle inhibitor p27Kip1 in malignant melanoma:inverse correlation with disease-free survival[J].Am J Pathol,1998,153(1):305-312.DOI:10.1016/S0002-9440(10)65572-1.
[13]Chen G,Cheng Y,Zhang Z,et al.Prognostic significance of cytoplasmic p27 expression in human melanoma[J].Cancer Epidemiol Biomarkers Prev,2011,20(10):2212-2221.DOI:10.1158/1055-9965.EPI-11-0472.
[14]Feleszko W,Młynarczuk I,Olszewska D,et al.Lovastatin potentiates antitumor activity of doxorubicin in murine melanoma via an apoptosis-dependent mechanism[J].Int J Cancer,2002,100(1):111-118.DOI:10.1002/ijc.10440.
[15]Minichsdorfer C,Hohenegger M.Autocrine amplification loop in statin-induced apoptosis of human melanoma cells[J].Br J Pharmacol,2009,157(7):1278-1290.DOI:10.1111/j.1476-5381.2009.00298.x.
[16]Saito A,Saito N,Mol W,et al.Simvastatin inhibits growth via apoptosis and the induction of cell cycle arrest in human melanoma cells[J].Melanoma Res,2008,18(2):85-94.DOI:10.1097/CMR.0b013e3282f60097.
Effect of simvastatin on the proliferation,apoptosis and migration of hypoxic A375 melanoma cells
Li Juan,Li Li
Department of Dermatology,Women&infants Hospital of Zhengzhou,Zhengzhou 450012,China(Li J);Department of Dermatology,Zhengzhou Second Hospital,Zhengzhou 450006,China(Li L)
Li Juan,Email:l1984210@163.com
Objective To evaluate the regulatory effect of simvastatin on the proliferation,apoptosis and migration of hypoxic A375 melanoma cells,and to explore their molecular mechanisms.Methods Under normoxic or hypoxic culture conditions,A375 cells were treated with 0.25,0.5,1,2,4,8 μmol/L simvastatin(simvastatin groups)and dimethyl sulfoxide(DMSO,control group)separately for 48 hours.Cell counting kit-8(CCK-8)assay,Transwell assay using immersion culture system and flow cytometry using annexin-V/propidium iodide(PI)staining were conducted to assess the proliferative and migratory activities and apoptosis of A375 cells,respectively.RT-PCR and Western blot analysis were performed to measure the mRNA and protein expression of hypoxia-inducible factor 1α(HIF-1α),survivin and cyclin-dependent kinase inhibitor p27 in the simvastatin groups and control group,as well as in the HIF-1α-silenced hypoxic A375 cells.Results Under normoxic or hypoxic culture conditions,there were significant differences in the proliferative activities of A375 cells,proportion of apoptotic cells and number of migrating cells between the simvastatin groups and control groups(F=95.84,37.22 and 177.5 respectively,P <0.001).The hypoxic control group showed significantly higher cellular proliferative activity(1.391 ± 0.129)and higher number of migrating cells(322.550 ± 26.226)compared with the normoxic control group(0.807±0.049,125.583±17.256 respectively,both P<0.001)and hypoxia+simvastatin group(0.685±0.417,115.167±12.050 respectively,both P<0.001),but significantly lower proportion of apoptotic cells(6.167% ±2.714%)compared with the normoxic control group(11.833% ±2.483%,P <0.01)and hypoxia+simvastatin group(17.833% ±2.714%,P <0.01).Under the hypoxic condition,the simvastatin group showed significantly lower mRNA and protein expression of HIF-1α and survivin compared with the control group(all P < 0.05),but significantly higher mRNA and protein expression of P27 compared with the control group(both P < 0.05).Under the hypoxic condition,HIF-1αsilenced A375 cells showed significantly decreased mRNA and protein expression of survivin(t=5.346 and 8.281 respectively,both P < 0.05),but significantly increased mRNA and protein expression of p27(t=31.37 and 9.954 respectively,both P < 0.01)compared with the unsilenced cells.Conclusion Simvastatin can inhibit the proliferation and migration of hypoxic A375 cells,and promote their apoptosis,likely by activating the HIF signaling pathway.
Melanoma;Cell line,tumor;Anoxia;Cell proliferation;Apoptosis;Cell migration assays;Survivin;Hypoxia inducible factor;Simvastatin
李娟,Email:l1984210@163.com
10.3760/cma.j.issn.0412-4030.2017.10.009
2016-10-31)
(本文编辑:朱思维 颜艳)
