基于通过型固相萃取-高效液相色谱-串联质谱法同时测定水产品中的氯霉素和红霉素
2017-12-11柯庆青李诗言郑重莺贝亦江王鼎南
柯庆青,李诗言,周 凡,郑重莺,贝亦江,王鼎南,王 扬*
基于通过型固相萃取-高效液相色谱-串联质谱法同时测定水产品中的氯霉素和红霉素
柯庆青,李诗言,周 凡,郑重莺,贝亦江,王鼎南,王 扬*
(浙江省水产质量检测中心,浙江 杭州 310023)
建立通过型固相萃取-高效液相色谱-串联质谱同时快速测定水产品中氯霉素和红霉素的分析方法。样品通过乙腈提取,Oasis PRiME HLB小柱一步法净化,采用高效液相色谱-串联质谱仪多反应监测扫描模式检测和同位素内标定量。检测水产品中的氯霉素和红霉素定量限分别为0.1 μg/kg和0.5 μg/kg。不同水产品(鱼、虾和蟹)在3 个添加水平的平均回收率在86.7%~102.6%之间,相对标准偏差小于5%(n=6)。本方法简单易行、灵敏度较高,在日常检测方面存在一定优势。
固相萃取;高效液相色谱-串联质谱;水产品;氯霉素;红霉素
水产品种类繁多,营养丰富,广受消费者喜爱。近些年来,随着养殖规模的不断扩大,水产养殖病害日益严重。盲目用药、使用人药、过量用药等滥用药物现象比较普遍,这易造成养殖环境的恶化污染,也可能引起药物在水产品体内的残留,进而影响到食用者的身体健康。氯霉素是一种广谱抑菌抗生素,曾长期在国内外广泛应用于水产养殖业的细菌性疾病治疗。氯霉素对人体的造血功能有一定的毒副作用,可以引发再生障碍性贫血,血小板减少等[1]。红霉素是一种大环内酯类抗生素,对支原体、葡萄球菌、链球菌和各种革兰氏阳性菌均有较强的抑制作用,因而被广泛用于畜牧业中疾病的防治[2]。食用水产品中的氯霉素和红霉素可以通过食物链在人体内累积,从而威胁人类健康[3-4]。欧盟等许多国家和地区已经禁止氯霉素的使用并规定了红霉素在可食性动物组织中的最大残留量。我国NY 5070—2002《无公害食品 水产品中渔药残留限量》中规定水产品中不得检出氯霉素;农业部235号公告《动物性食品中兽药最高残留限量》规定动物性食品中不得检出氯霉素,红霉素最高残留限量为200 μg/kg。因此建立一种灵敏、高效、选择性好的分析方法用于检测水产品中氯霉素和红霉素具有重要的现实意义。
目前氯霉素残留常见的检测方法有液相色谱法[5-6]、液相色谱-串联质谱法[7-14]、气相色谱法[15-17]、气相色谱-串联质谱法[18]、酶联免疫法[19-20];红霉素的检测方法有分子印迹液相色谱法[2]、液相色谱荧光法[21]、高效液相色谱-串联质谱法[22-24]。其中,气相色谱法和气相色谱-串联质谱法需要衍生化,前处理复杂;酶联免疫法结果易出现假阳性,因此只能作为筛选方法;液相色谱法由于只靠保留时间定性,抗干扰能力较弱,易出现假阳性。液相色谱-串联质谱法具有定性能力强、选择性好、灵敏度高等优点。目前水产品中红霉素和氯霉素的测定主要采用的国家标准方法就是基于固相萃取法净化的液相色谱-质谱联用法,其中氯霉素的测定方法为农业部781号公告—2—2006《动物源食品中氯霉素残留量的测定 高效液相色谱-串联质谱法》[25],红霉素的测定方法为GB 29684—2013《水产品中红霉素残留量的测定 液相色谱-串联质谱法》[26]。近年来,高效液相色谱-串联质谱法在兽药残留分析中得到了广泛应用,但同时测定水产品中氯霉素和红霉素残留量少见报道。在我国水产品质量安全检测项目中,常常会同时对氯霉素和红霉素的药物残留进行监测,因此,使用一种方法快速、简易地测定水产品中氯霉素和红霉素残留量就显得十分重要。
已有的氯霉素和红霉素的净化手段有正己烷脱脂法[24]以及固相萃取法[1,23,25-27]等。正己烷脱脂法虽然方法简单但基质效应较大;国标方法和很多检测方法采用的传统的固相萃取法则需要有机试剂提取,溶剂转化后才能上样还需活化,淋洗、洗脱等,步骤较为繁琐,同时吸附再脱附的步骤可能会致使回收率降低。本研究前处理采用Oasis PRiME HLB小柱一步法净化,前处理简单,并且基质效应较小、灵敏度较高,能得到较为满意的效果。Oasis PRiME HLB是在Oasis HLB技术基础上开发出的新一代反相固相萃取吸附剂,可以有效地吸附样品中的脂肪和磷脂,较以往固相萃取剂具有更简单、更快速、更洁净的优势[28-29]。本实验样品可以在用有机相提取后,无需溶剂转换,一步法直接通过Oasis PRiME HLB柱收集,无需淋洗、洗脱,用同一种前处理方法可以同时检测氯霉素和红霉素,缩短了检测的时间、节约了成本。将本方法与现有国标方法比较,本方法具有前处理简单、快速、使用试剂耗材少、回收率高等优点,同时灵敏度也能满足日常检测需求,适合于实验室大批量检测。
1 材料与方法
1.1 材料与试剂
所有鲫鱼、对虾、梭子蟹样品均来自2015年浙江省水产质量检测中心监督抽查任务,所有样品均取肌肉部分,绞碎均质后,-20 ℃冷冻保存,待检测。
氯霉素标准品(纯度98.5%)、红霉素标准品(纯度97.0%)、氘代氯霉素标准品、红霉素-13C标准品(纯度91.5%) 德国Dr. Ehrenstorfer公司;乙腈、甲醇、乙酸乙酯和正己烷(均为色谱纯) 美国Tedia公司;乙酸(色谱纯) 美国ROE Scientific Inc公司;其他试剂均为分析纯。
1.2 仪器与设备
API4000型四极杆串联质谱仪 美国AB公司;高效液相色谱仪 美国Agilent公司;2202S型电子天平 德国赛多利斯有限公司;Centrifuge 5427R高速冷冻离心机德国Eppendorf公司;RE-2000B型旋转蒸发仪 上海亚荣生化仪器厂;N-EVAP112水浴式氮吹浓缩仪 美国Oranomation Aassociates Inc公司;Oasis PRiME HLB固相萃取小柱(6 mL/200 mg) 美国Waters公司。
1.3 方法
1.3.1 样品提取
准确称取均质后的样品2.50 g于15 mL带盖聚乙烯离心管中,加入400 ng/mL氯霉素内标和200 ng/mL红霉素内标50 μL,加入8 mL乙腈,旋涡均匀1 min后,振荡10 min,5 000 r/min离心5 min后取上清液于另一干净10 mL带盖离心管中,向提取液中加入2 mL超纯水混合均匀。
1.3.2 样品净化
向Oasis PRiME HLB固相萃取小柱中加入提取液,保持每秒1 滴的流速,收集所有的流出液在40 ℃条件下氮气吹干,用流动相乙腈-水(45∶55,V/V)定容至1 mL,旋涡充分溶解后加入1 mL正己烷,快速旋涡1 min后,4 ℃、14 000 r/min离心10 min,弃去正己烷层后过0.22 μm微孔滤膜,上机测试。
1.3.3 样品测试
将内标和不同体积的混合标准工作液混匀,吹干后用流动相定容至1 mL,配制成一系列质量浓度的标准曲线和样品在同一条件下进行测定,记录保留时间和峰面积,内标法定量,用Mass Hunter工作站对数据进行分析处理。
1.3.4 仪器分析条件
1.3.4.1 高效液相色谱条件
Waters Eclipse plus C18色谱柱(2.1 mm×150 mm,5 μm);柱温:30 ℃;流动相:乙腈-0.02%乙酸溶液(45∶55,V/V);流速:250 μL/min;进样量:20 μL。
1.3.4.2 质谱条件
电喷雾离子源,多反应监测。
红霉素:正离子扫描,电喷雾电压:5 000 V;气帘气压力:10 psi;雾化器压力:40 psi;辅助气压力:45 psi;去簇电压:60 V;碰撞入口电压:10 V;碰撞室出口电压:13 V;离子源汽化温度:500 ℃。红霉素及红霉素内标物的母离子、子离子及其碰撞能量见表1。
氯霉素:负离子扫描,电喷雾电压:-4 500 V;气帘气压力:20 psi;雾化器压力:50 psi;辅助气压力:35 psi;去簇电压:-50 V;碰撞入口电压:-10 V;碰撞室出口电压:-10 V;离子源汽化温度:500 ℃。氯霉素及氯霉素内标物的母离子、子离子及其碰撞能量见表1。
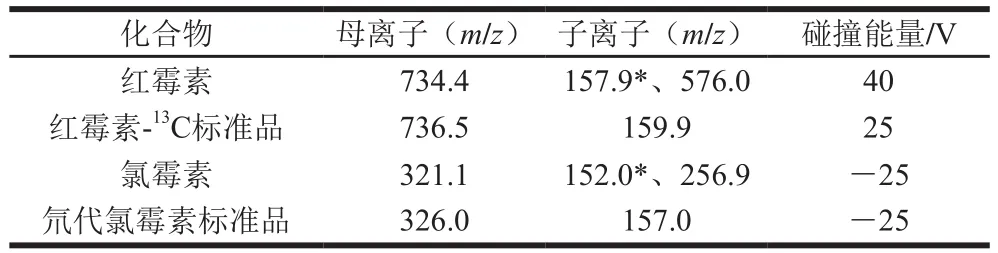
表1 氯霉素和红霉素及相应内标物质谱参数Table 1 Mass spectral parameters for the analysis of chloramphenicol,erythromycin and their corresponding internal standards
2 结果与分析
2.1 质谱参数与色谱条件优化
2.1.1 质谱参数的优化
在电喷雾离子源下,分别对质量浓度为1 μg/mL的氯霉素和红霉素标准溶液做负离子和正离子进行一级质谱扫描得到响应最佳准分子离子峰,再对准分子离子峰进行二级质谱分析,得到子离子的质量数,采用多反应监测优化碰撞能等参数使得子离子响应最佳。根据欧盟2002/657/EC决议中有关质谱分析方法必须不少于4 个识别点的规定[30],为氯霉素和红霉素分别选取质谱响应最佳的两对多反应监测离子对及相应的参数作为最终的质谱采集参数。
2.1.2 色谱流动相的选择
本实验采用同一色谱条件对红霉素和氯霉素进行检测,这样可以在不用换流动相和色谱柱的情况下,同时提交两种质谱方法实现红霉素和氯霉素的同时检测。红霉素用正源检测,一定酸度的流动相可以提高红霉素峰的响应和改善峰形,但红霉素在酸性条件下不稳定、易分解;氯霉素用负源检测,用酸性流动相则会影响峰的强度和峰形。因此需要选择合适酸度的流动相同时满足红霉素和氯霉素的检测。分别选用乙腈和不同体积分数的乙酸溶液(0%、0.01%、0.02%、0.05%、0.1%)作为流动相对氯霉素和红霉素进行分析。结果表明,纯水时红霉素峰形较差且响应较低,随着乙酸体积分数的增加,红霉素的响应逐渐增强,峰形变好;氯霉素则随着酸度的增加,峰形和响应逐渐变差,0.05%乙酸溶液作为流动相时则氯霉素在低体积分数时峰较差,用0.1%乙酸溶液作流动相时氯霉素则响应不稳定且出现峰拖尾的现象,综合以上情况考虑使用0.02%的乙酸溶液作为流动相进行上机检测,能够同时保证氯霉素和红霉素具有较好的峰形和响应。乙腈和0.02%的乙酸溶液作为流动相时氯霉素和红霉素的标准品色谱图、空白鱼肉样品色谱图和鱼肉样品加标色谱图见图1。
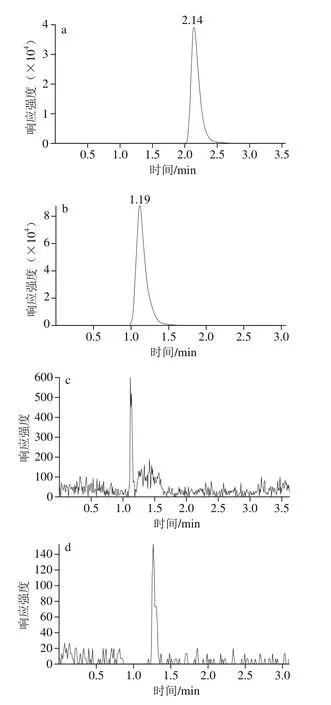
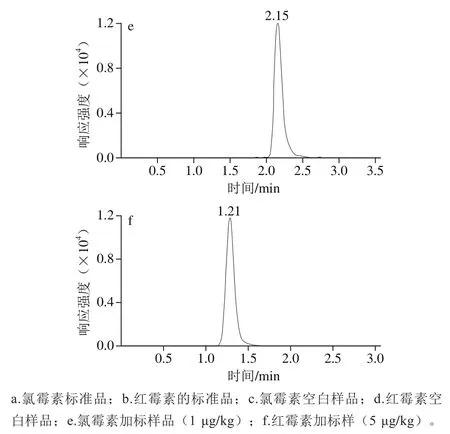
图1 样品多反应监测色谱图Fig. 1 MRM chromatograms of samples
2.2 预处理方法优化
2.2.1 提取试剂的选择
本实验首先考察乙腈、乙酸乙酯、甲醇3 种常用提取试剂对目标化合物的提取情况。结果表明,乙腈对红霉素、氯霉素均有较好的提取效果,乙酸乙酯和甲醇则分别对红霉素和氯霉素的提取效果不佳,加标绝对回收率偏低。乙腈作为提取溶剂既能保证目标化合物的提取效率,又可以减少引入强极性杂质和类弱极性杂质,还能起到沉淀蛋白的作用,减少基质效应,因此本研究选择乙腈作为提取剂。本实验还考察了乙腈和水的混合溶液对目标化合物的提取效果,结果表明,纯乙腈的提取效率最高,随着提取剂中水比例的增大,提取效率不断降低,因此本实验采用纯乙腈作为提取试剂。
2.2.2 净化方法的优化
水产品成分比较复杂,基质中含有大量的脂肪、蛋白质、色素等成分干扰检测。本研究采用Oasis PRiME HLB小柱一步净化,高体积分数有机相提取液上样,直接收集,通过保留样品基质中的杂质流出目标物的方式实现样品溶液的净化,无需活化、平衡和洗脱。Oasis PRiME HLB固相萃取小柱可以有效去除脂肪、磷脂、部分色素等杂质干扰而且步骤简单,大大提高了预处理的效率。同时,在实验过程中发现在纯乙腈提取液中加入一定比例的水时通过Oasis PRiME HLB固相萃取小柱时去除脂质杂质的效果更佳。相对于水溶液,脂肪和磷脂在乙腈中的溶解性更强,纯乙腈提取液上样会有部分磷脂或者脂肪溶出,不能完全吸附在柱子上,导致基质效应变大;而提取液乙腈体积分数太低则会有部分药物保留在柱上,导致药物损失。本实验通过加标比较绝对回收率的形式,比较了上样提取液中乙腈体积分数分别为100%、90%、80%、70%和60%时通过固相萃取小柱时的净化效果(图2)。综合比较,本实验选择了80%乙腈溶液上样,此时去杂质净化效果更好,氯霉素和红霉素的绝对回收率最高。固相萃取小柱净化后的样品经氮气吹干用流动相复溶,加入正己烷进一步去除脂肪和色素。通过冷冻离心,在低温下蛋白质变性沉淀,色素和脂肪在水相中的溶解度降低,转移到正己烷层,离心去除正己烷层达到更佳的净化效果。

图2 提取液中乙腈体积分数对净化效果的影响Fig. 2 Effect of acetonitrile concentration on purification efficiency
2.3 线性范围、检出限与定量限
移取一定体积的氯霉素和红霉素内标和标准溶液,混匀后氮气吹干,流动相定容至1 mL,配成氯霉素质量浓度分别为0.25、0.5、1、5、10、30 ng/mL,红霉素质量浓度为1.25、2.5、5、25、50、250 ng/mL的标准溶液。以目标物色谱峰的峰面积为纵坐标,化合物的质量浓度为横坐标绘制标准曲线。结果表明:氯霉素在质量浓度为0.25~30 ng/mL,红霉素在质量浓度为1.25~250 ng/mL范围内呈线性,线性回归方程和相关系数如表2所示。根据检出限大于等于3 倍信噪比,定量限大于等于10 倍信噪比的计算方法,得出氯霉素的方法检出限为0.05 μg/kg,定量限为0.1 μg/kg;红霉素的方法检出限为0.2 μg/kg,定量限为0.5 μg/kg。
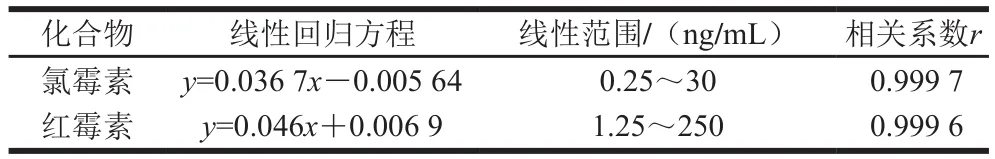
表2 鱼肉中氯霉素和红霉素的回归方程、线性范围和相关系数Table 2 Regression equations, correlation coefficients and linear ranges of chloramphenicol and erythromycin in fish meat
2.4 回收率和精密度实验结果
为了考察本实验的可行性,向鲫鱼、对虾、梭子蟹和脂肪含量较高的养殖大黄鱼空白样品中添加3 个水平的红霉素和氯霉素混合标准溶液,每组做6 个平行,按照上述前处理方法和仪器条件进行测定,回收率和精密度结果见表3。不同水产品(鱼、虾和蟹)在3 个添加水平的平均回收率在86.7%~102.6%之间,相对标准偏差小于5%。

表3 氯霉素和红霉素在水产品中的平均加标回收率和精密度结果(n=6)Table 3 Average recoveries and relative standard deviations for chloramphenicol and erythromycin in spiked aquatic products (n= 6)
2.5 和国标方法比较
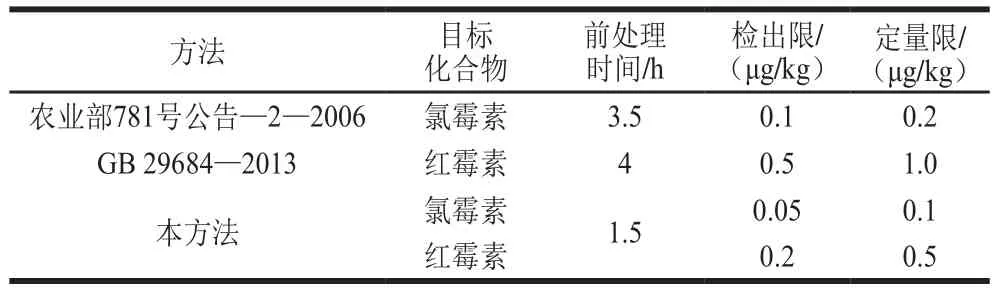
表4 本实验方法与国标方法比较Table 4 Comparison of the method developed in this study with the Chinese national standard method
为考察本方法的可行性,通过在空白鱼肉样品加标的方式将本方法与国标方法进行比较,结果见表4。在实际工作中检测方法除了满足灵敏度要求外,还要考虑检测成本和效率问题。国标以及现有的大多数红霉素和氯霉素的检测方法通常是大体积有机试剂提取,经过旋转蒸干后溶剂转换,经固相萃取小柱三步法净化,需要花费较多的时间和试剂。相比国标方法,本方法前处理只需小体积有机溶剂提取,直接通过固相萃取一步法净化,简单易于操作,且能同时实现红霉素和氯霉素的定量检测,提高检测效率,降低检测成本,灵敏度满足水产品中药物残留检测要求,适合实验室大批量检测。
2.6 实际样品测定和实验室间比对
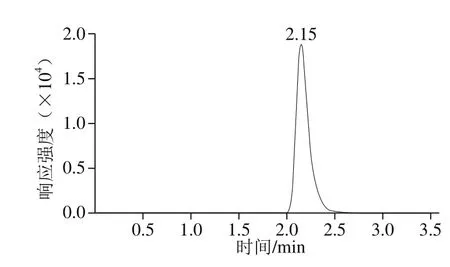
图3 氯霉素阳性样品色谱图Fig. 3 Chromatogram of chloramphenicol positive sample
用本实验方法对50 批次不同种类的水产品进行检测,其中1批次黄鳝样品检出氯霉素,含量为0.899 μg/kg(图3),其余样品均未检出,质控样品的回收率等指标均达到分析要求,表明结果准确可靠。同时,本方法检测了阳性鱼肉冻干粉中氯霉素的含量,实验结果与6 家实验室(均采用国标方法进行氯霉素检测)进行比对,结果相对标准偏差小于15%。
3 结 论
本研究基于高效液相色谱-串联质谱技术建立了快速测定水产品中的氯霉素和红霉素的检测方法。本方法简单易行,灵敏度满足日常检测要求。相比国标方法,该方法缩短分析时间,减少有机试剂用量,是一种高效率低成本的检测方法。本方法还验证了在鱼、虾、蟹等不同种类的水产品基质中检测的可行性,适用于实验室大批量样品快速检测。
[1] 万译文, 邓克国, 刘丽, 等. 高效液相色谱-串联质谱法同时测定水产品中氯霉素、甲砜霉素和氟甲砜霉素的残留量[J]. 分析实验室,2013, 32(5): 84-87.
[2] 宋彬, 李进义, 荆涛, 等. 分子印迹固相萃取-高效液相色谱法测定猪肉中红霉素残留[J]. 色谱, 2014, 32(10): 1111-1116. DOI:10.3724/SP.J.1123.2014.06025.
[3] HAN J, WANG Y, YU C L, et al. Extraction and determination of chloramphenicol in feed water, milk, and honey samples using an ionic liquid/sodium citrate aqueous two-phase system coupled with highperformance liquid chromatography[J]. Analytical and Bioanalytical Chemistry, 2011, 399(3)∶ 1295-1304. DOI∶10.1007/s00216-010-4376-2.
[4] LEAL C, CODONY R, COMPANO R, et al. Determiation of macrolide antibiotics by liqiud chromatography[J]. Journal of Chromatography A, 2001, 910(2)∶ 285-290.
[5] 彭莉, 岳秀英. 高效液相色谱法测定牛奶中的氯霉素残留[J]. 中国兽药杂志, 2002, 36(8): 23-24.
[6] 何方奕, 李铁纯, 李学程, 等. 固相萃取-高效液相色谱法测定鸡肉中氯霉素的残留[J]. 食品科学, 2006, 27(12): 629-630. DOI:10.3321/j.issn:1002-6630.2006.12.159.
[7] 李红权, 孙良娟, 伍志强, 等. 高效液相色谱串联质谱法同时测定饲料中氯霉素、甲砜霉素与氟甲砜霉素残留[J]. 分析测试学报, 2012,32(11): 1396-1400. DOI:10.3969/j.issn.1004-4957.2012.11.009.
[8] VERZEGNASS L, ROYER D, MOTTIER P, et al. Analysis of chloramphenicolin honeys of different geographical origin by liquid chromatography coupled to electrospray inoization tandem mass spectrometry[J]. Food Additives Contaminants, 2003, 20(4): 335-342.DOI:10.1080/0265203031000122003.
[9] 田文礼, 彭文君, 韩胜明, 等. 液相色谱-串联三重四极杆质谱测定蜂蜜中的氯霉素残留[J]. 食品科学, 2009, 30(14): 285-287.DOI:10.3321/j.issn:1002-6630.2009.14.063.
[10] 杨总, 李秀琴, 王娟, 等. 同位素稀释液相色谱-串联质谱法准确测定猪肉中的氯霉素[J]. 色谱, 2011, 29(9): 927-931. DOI:10.3724/SP.J.1123.2011.00927.
[11] SHERIDAN R, POLICASTRO B, THOMAS S, et al. Analysis and occurrence of 14 sulfonamide antibacterials and chloramphenicol in honey by solid-phase extraction followed by LC/MS/MS analysis[J].Journal of Agricultural and Food Chemistry, 2008, 56(10): 3509-3516.DOI:10.1021/jf800293m.
[12] 谢守新, 林海丹, 秦燕, 等. 液相色谱-电喷雾串联质谱内标法测定水产品中氯霉素药物残留[J]. 中国卫生检验杂志, 2006, 16(11): 1298-1300. DOI:10.3969/j.issn.1004-8685.2006.11.008.
[13] 彭涛, 李淑娟, 储晓刚, 等. 高效液相色谱/串联质谱法同时测定虾中氯霉素、甲砜霉素和氟甲砜霉素残留量[J]. 分析化学, 2005, 33(4):463-466. DOI:10.3321/j.issn:0253-3820.2005.04.007.
[14] 谢世红, 谢世涛, 银旭红, 等. 高效液相-串联质谱法同时测定水产品中孔雀石绿和氯霉素残留量[J]. 水产养殖, 2013, 34(10): 8-12.DOI:10.3969/j.issn.1004-2091.2013.10.003.
[15] PFENNING A P, ROYBAL J E, RUPP H S, et al. Simultaneous determination residues of chloramphenicol, florfenicol,florfenicolamine, and thiamphenicol in shrimp tissue by gas chromatography with electron capture detection[J]. Journal of AOAC International, 2000, 83(1): 26-30.
[16] DING S Y, SHEN J Z, ZHANG S X, et al. Determination of chloramphenicol residue in fish and shrimp tissues by gas chromatography with a microcell electron capture detector[J]. Journal of AOAC International, 2005, 88(1): 57-60.
[17] 胡红美, 郭远明, 雷科, 等. 分散固相萃取净化-气相色谱法测定水产品中氯霉素和氟苯尼考[J]. 食品科学, 2014, 35(8): 231-235.DOI:10.7506/spkx1002-6630-201408046.
[18] 高洁. 气相色谱-串联质谱法同时测定肉制品中氯霉素、甲砜霉素残留[J]. 中国酿造, 2014, 33(8): 153-155. DOI:10.11882/j.issn.0254-5071.2014.08.035.
[19] 谭慧, 麦琦. 酶联免疫分析法测定水产品中氯霉素残留量[J]. 中国卫生检验杂志, 2010, 20(7): 1649-1650.
[20] 张胜帮, 董士华, 刘继东, 等. 酶联免疫检测法测定水产品中残留氯霉素的研究[J]. 中国食品学报, 2006, 6(5): 133-136. DOI:10.3969/j.issn.1009-7848.2006.05.027.
[21] 惠芸华, 蔡友琼, 沈晓盛, 等. 高效液相色谱法测定水产品中的红霉素残留量[J]. 分析试验室, 2009, 28(11): 33-36. DOI:10.3969/j.issn.1000-0720.2009.11.009.
[22] 张晓燕, 郑定钊, 袁芳, 等. 高效液相色谱-串联质谱法测定蜂蜜中的红霉素及其代谢物[J]. 分析测试学报, 2013, 32(9): 1131-1134.DOI:10.3969/j.issn.1004-4957.2013.09.019.
[23] 于慧娟, 蔡友琼, 惠芸华, 等. 高效液相色谱-电喷雾串联质谱法测定水产品中红霉素的残留[J]. 分析化学, 2009, 37(1): 91-94.DOI:10.3321/j.issn:0253-3820.2009.01.018.
[24] 于慧娟, 马兵, 惠芸华, 等. 高效液相色谱-串联质谱法测定水产品中红霉素的残留[J]. 分析试验室, 2009, 28(3): 51-54. DOI:10.3969/j.issn.1000-0720.2009.03.013.
[25] 卫生部. 动物源食品中氯霉素残留量的测定高效液相色谱-串联质谱法: 农业部第781号公告—2—2006[S]. 北京: 中国标准出版社,2006.
[26] 卫生部. 水产品中红霉素残留量的测定液相色谱串联质谱法: GB 29684—2013[S]. 北京: 中国标准出版社, 2013.
[27] 瞿进文, 吴洁珊, 蔡勤仁, 等. 液相色谱-电喷雾串联质谱法测定鱼肉中氯霉素含量[J]. 理化检验: 化学分册, 2005, 41(11): 799-801.DOI:10.3321/j.issn:1001-4020.2005.11.003.
[28] TIAN H, WANG J Q, ZHANG Y D, et al. Quantitative multiresidue analysis of antibiotics in milk and milk powder by ultra performance liquid chromatography coupled to tandem quadrupole mass spectrometry[J]. Journal of Chromatography B, 2016, 1033: 172-179.DOI:10.1016/j.jchromb.2016.08.023.
[29] 李小平, 王立, 潘胜东, 等. 基于PRiME-通过型固相萃取净化模式快速检测豆芽中4 种植物生长调节剂[J]. 中国卫生检验杂志, 2016,26(11): 1542-1545.
[30] European Commission. Commission Decision 2002/657/EC of 12 August 2002 Implementing Council Directive 96/23/EC Concern Performance of Analytical Methods and the Interpretation of Results[S]. Offical Journal of the European Commission, 2002.
Simultaneous Determination of Chloramphenicol and Erythromycin Residues in Aquatic Products by High Performance Liquid Chromatography-Tandem Mass Spectrometry with Oasis PRiME HLB Solid Phase Extraction Cleanup
KE Qingqing, LI Shiyan, ZHOU Fan, ZHENG Chongying, BEI Yijiang, WANG Dingnan, WANG Yang*
(Aquatic Products Quality Inspection Center of Zhejiang Province, Hangzhou 310023, China)
A rapid method was developed for the simultaneous determination of chloramphenicol and erythromycin residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry with solid phase extraction(SPE). Samples were extracted with acetonitrile and the extract was then purified by an Oasis PRiME HLB SPE cartridge.The analytes were detected in the multi-reaction monitoring (MRM) mode and quantified by the isotope internal standard method. The limits of quantification (LOQ) for chloramphenicol and erythromycin were 0.1 and 0.5 μg/kg, respectively.The average recoveries of the 2 analytes ranged from 86.7% to 102.6% with relative standard deviations of less than 5% in aquatic products (fish, shrimp and crab) at three spiked levels (n = 6). This proposed method was advantageous in routine detection of antibiotic residues in aquatic products for its simplicity and high sensibility.
solid phase extraction; high performance liquid chromatography-tandem mass spectrometry; aquatic products;chloramphenicol; erythromycin
DOI∶10.7506/spkx1002-6630-201724039
O657.63
A
1002-6630(2017)24-0241-06
柯庆青, 李诗言, 周凡, 等. 基于通过型固相萃取-高效液相色谱-串联质谱法同时测定水产品中的氯霉素和红霉素[J]. 食品科学, 2017, 38(24)∶ 241-246. DOI∶10.7506/spkx1002-6630-201724039. http∶//www.spkx.net.cn
KE Qingqing, LI Shiyan, ZHOU Fan, et al. Simultaneous determination of chloramphenicol and erythromycin residues in aquatic products by high performance liquid chromatography-tandem mass spectrometry with Oasis PRiME HLB solid phase extraction cleanup[J]. Food Science, 2017, 38(24)∶ 241-246. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724039. http∶//www.spkx.net.cn
2016-12-05
浙江省2013年农业标准化研究项目
柯庆青(1988—),女,助理工程师,硕士,研究方向为水产品质量与安全。E-mail:kqqgogo@163.com
*通信作者:王扬(1973—),女,高级工程师,硕士,研究方向为水产品质量与安全。E-mail:wangyangruanfeng@163.com
