超高效液相色谱-四极杆/静电场轨道离子阱质谱测定植物提取物中的7 种合成色素
2017-12-11朱振宝张亚莉孔祥虹
朱振宝,张亚莉,贾 玮,孔祥虹,何 强
超高效液相色谱-四极杆/静电场轨道离子阱质谱测定植物提取物中的7 种合成色素
朱振宝1,张亚莉2,贾 玮1,孔祥虹2,何 强2
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.陕西省出入境检验检疫分析中心食品实验室,陕西 西安 710068)
基于高分辨质谱,建立植物提取物中7 种合成色素的快速检测方法。样品经超纯水提取,采用聚酰胺固相萃取小柱净化,以C18色谱柱为分析柱,乙腈和5 mmol/L乙酸铵溶液作为流动相,经超高效液相色谱进行梯度洗脱分离,利用四极杆静电场轨道离子阱质谱测定。结果表明:在10~500 μg/mL范围内,7 种限用及禁用合成色素线性关系良好,相关系数(r2)均大于0.99。通过加标验证实验,在0.05、0.1、0.5 mg/kg 3 个加标水平下,该方法的检出限可达到0.001 2~0.052 mg/kg,加样回收率为60.8%~91.8%,相对标准偏差为2.1%~6.5%。通过实际样品检测,结果表明本方法样品处理过程简单,分析时间短,准确可靠,灵敏度高,适用于植物提取物中合成色素的快速筛查及确证。
植物提取物;合成色素;超高效液相色谱-四极杆/静电场轨道离子阱质谱;高分辨质谱
植物提取物是以天然植物为原料,通过物理或化学提取、纯化等工艺,选择性的获取、富集植物中有效成分而形成的生物制品[1-3]。在经济利益驱使下,一些不法企业在食品等产品中添加合成色素染色以使产品外观鲜艳、以次充好、吸引消费者从而提高价格。由于合成色素中砷、铅、铜、苯酚、苯胺、乙醚、氯化物和硫酸盐等会对人体造成不同程度的伤害[4],长期摄入添加合成色素的食品,可能引发癌症[5-7],因此合成色素的滥用也成为影响植物提取物出口的安全问题之一[8]。由于植物提取物基质复杂,GB 2760—2014《食品添加剂使用标准》[9]中的检测方法不适合植物提取物,并且关于植物提取物中合成着色剂的限量并没有明确规定,相关法律法规还不完善,因此亟需建立快速、简便、灵敏度高的植物提取物中合成色素的筛查和检测方法。
目前合成色素检测主要有高效液相色谱(high performance liquid chromatography,HPLC)法[10-12]和液相色谱-质谱(liquid chromatography-mass spectrography,LC-MS)联用法[13-16],这2 种传统方法对目标化合物的定性必须要有相应的标准品。超高效液相色谱/四极杆-静电场轨道离子阱质谱(ultra high performance liquid chromatography/quadrupole-electrostatic field orbital ion trap mass spectra,UPLC-Q-Orbitrap)将高选择性的四极杆与轨道离子阱高分辨准确质量数测量技术有机结合,能进行目标物和非目标物的高通量筛选[17-18],而且能对目标物进行多级质谱分析,能够在没有标准品的情况下通过精确质量数对未知物进行快速筛查与结果确认[19]。由于具有样品前处理净化能力要求低、高效、方便等优点,UPLC-Q-Orbitrap技术在快速筛查方面得到了广泛应用[20]。如黎永乐等[21]利用液相色谱/线性离子阱-静电场轨道阱高分辨质谱技术建立了葡萄酒中合成色素的快速筛查方法,该方法可在无标准物质的情况下对葡萄酒中的15 种合成色素进行筛查检测。目前,相关报道该技术可应用于食品中农药残留的筛查及定量分析[22-25]、保健食品中非法添加药物的筛查和测定[26-27]等领域。
本研究采用聚酰胺固相萃取小柱净化,UPLC-QOrbitrap测定,构建了植物提取物中7 种合成色素的快速筛查方法,使用精确质量数及二级质谱对目标化合物进行筛选与确证,能够快速分析植物提取物中7 种限用及禁用合成色素。针对现有国标方法不适合基质复杂的植物提取物的检测等实际问题,建立了不需要标准品,能够快速筛查样品中是否含有限用及禁用色素,通过实际植物提取物样品检测,验证了方法的可靠性,本方法可为植物提取物的质量控制提供技术依据。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈(均为色谱级) 美国TEDIA公司;氨水、乙酸铵及其他试剂均为分析纯。
标准品:红色2G(CAS:3734-67-6)、柠檬黄(CAS:1934-21-0)、胭脂红(CAS:1390-65-4)、诱惑红(CAS:25956-17-6)、日落黄(CAS:2783-94-0)、亮蓝(CAS:3844-45-9)、苋菜红(CAS:915-67-3),以上试剂纯度大于98%,均购自德国Dr.Ehrenstorfer公司。
材料:纳豆、樱桃、甜菜、万寿菊、黑加仑、大豆、肉桂、芒果等植物提取物均购于西安本地公司。
1.2 仪器与设备
Q-Exactive超高效液相-四极杆/静电场轨道阱高分辨质谱联用仪 美国Thermo Fisher公司;AllegraTMX-22R高速离心机 德国Beckman公司;VORTEX GENIUS3涡旋混合器、振荡器 德国IKA公司;Advantage-10/Elix Milli-Q超纯水器 美国Millipore公司;Turbo Vap®LV氮吹浓缩仪 美国Caliper公司;Anpelclean PA聚酰胺固相萃取小柱(3 mL,500 mg;使用前依次用5 mL甲醇、5 mL水活化) 美国Agilent公司。
1.3 方法
1.3.1 样品前处理
1.3.1.1 提取
精确称取(3±0.01)g植物提取物于15 mL具塞离心管中,加入10.0 mL超纯水溶解后,振荡提取30 min,3 900 r/min离心5 min,取上清液转移至另一个15 mL离心管中,残渣再加入5 mL水溶解,重复上述操作,合并2 次上清液,待净化。
1.3.1.2 净化
准确移取上述提取液5.0 mL,转移至已活化的聚酰胺固相萃取柱中,待样品液全部流出后,先用3 mL甲醇-甲酸-水(1∶2∶5,V/V)淋洗,再用3 mL水淋洗小柱,弃去淋洗液,然后依次用5 mL甲醇和5 mL含体积分数10%氨水-甲醇溶液洗脱,收集洗脱液,40 ℃氮气吹至近干,残渣用1.0 mL超纯水溶解定容,过0.22 μm水系滤膜,上机分析测定。
1.3.2 测定条件优化
1.3.2.1 超高效液相色谱条件
色谱柱的选择:研究不同的色谱柱对7 种水溶性合成色素的分离效果。具体规格:柱1为Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),柱2为Waters Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),柱3为Waters Acquity UPLC BEH Shield RP18色谱柱(100 mm×2.1 mm,1.7 μm),柱4为Waters CORTECSTMUPLC C18色谱柱(100 mm×2.1 mm,1.6 μm),柱5为Waters Acquity UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm)。使用50 ng/mL标准溶液在各规格色谱柱上进样分离得到色谱图。
流动相选择:采用水-乙腈、水-甲醇、体积分数0.1%甲酸溶液-乙腈、体积分数0.1%甲酸溶液-甲醇、乙腈-5 mmol/L乙酸铵溶液、甲醇-5 mmol/L乙酸铵溶液作为流动相,研究不同流动相对7 种水溶性合成色素分离效果及灵敏度的影响。
提取溶剂的选择:综合考虑7 种合成色素的理化性质,胭脂红、日落黄和诱惑红是强极性着色剂,分别研究了超纯水、体积分数20%氨水、无水乙醇-氨水-水(7∶2∶1,V/V)作为提取剂对7 种限用合成色素的提取效果。向阴性样品中添加50 μg/g标准品,进行加标回收率实验。
色谱条件:色谱柱:Waters AcquityTMUPLC BEH Shield RP18柱(100 mm×2.1 mm,1.7 μm);流动相A为乙腈,流动相B为5 mmol/L乙酸铵溶液。梯度洗脱条件:0~1.0 min,5% A;1.0~3.0 min,5%~100% A;3.0~5.0 min,100% A;5.0~5.5 min,100%~5% A;5.5~6.0 min,5% A。柱温35 ℃,流速0.3 mL/min,进样量10 μL。
1.3.2.2 固相萃取方法优化
固相萃取柱的选择:本实验比较了HLB(Bond Elut HLB,500 mg,3 mL)、C18(Bond Elut C18,500 mg,3 mL)和聚酰胺固相萃取小柱(Anpelclean PA,3 mL,500 mg)。
淋洗液及洗脱液的选择:采用聚酰胺固相萃取小柱为净化柱,用不同的淋洗液及洗脱液对净化方式进行优化。根据7 种水溶性合成色素的理化性质,本实验采取了6 种方案,以空白樱桃提取物为样品,添加标准溶液浓度为50 μg/g,进行回收率测定。
1.3.3 质谱条件

表1 7 种合成色素的质谱信息Table 1 Mass parameters for the 7 artificial dyes
电喷雾离子源,质量分析器为Orbitrap,扫描模式采用负离子扫描模式,数据依赖性扫描Full MS-dd MS2,喷雾电压2.8 kV;质量扫描范围m/z 200~900;毛细管温度350 ℃;鞘气(氮气)与辅助气流速分别为4.09 L/min和5.08 L/min,辅助气温度320 ℃;全扫描和二级扫描分辨率分别为70 000和17 500。7 种水溶性限用合成色素的具体质谱参数见表1。
1.3.4 基质效应计算
本实验采用相对响应值法消除基质效应。基质效应采用以下公式计算:

式中:A为在纯溶剂中目标化合物的响应值;B为样品中添加的相同含量合成色素的响应值。
2 结果与分析
2.1 质谱条件优化
利用UPLC-Q-Orbitrap对7 种目标化合物的混合标准物进行负离子全扫描,得到一级全扫描质谱图,以各化合物的分子离子峰[M-nNa+mH](n-m)-理论精确质量数提取色谱图,图1为阴性纳豆提取物中添加7 种水溶性合成色素的总离子流色谱图(添加水平50 μg/mL)。7 种合成色素的相对质量标准偏差小于4×10-6,符合高分辨要求[17],二级扫描采用数据依赖性扫描,采集待测化合物的二级质谱图进行进一步定性(图2)。
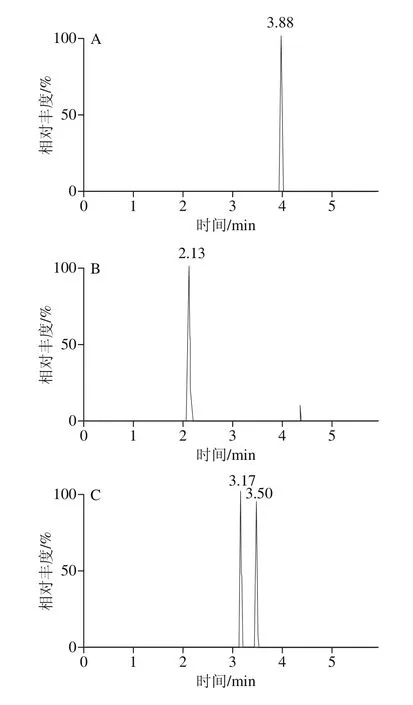
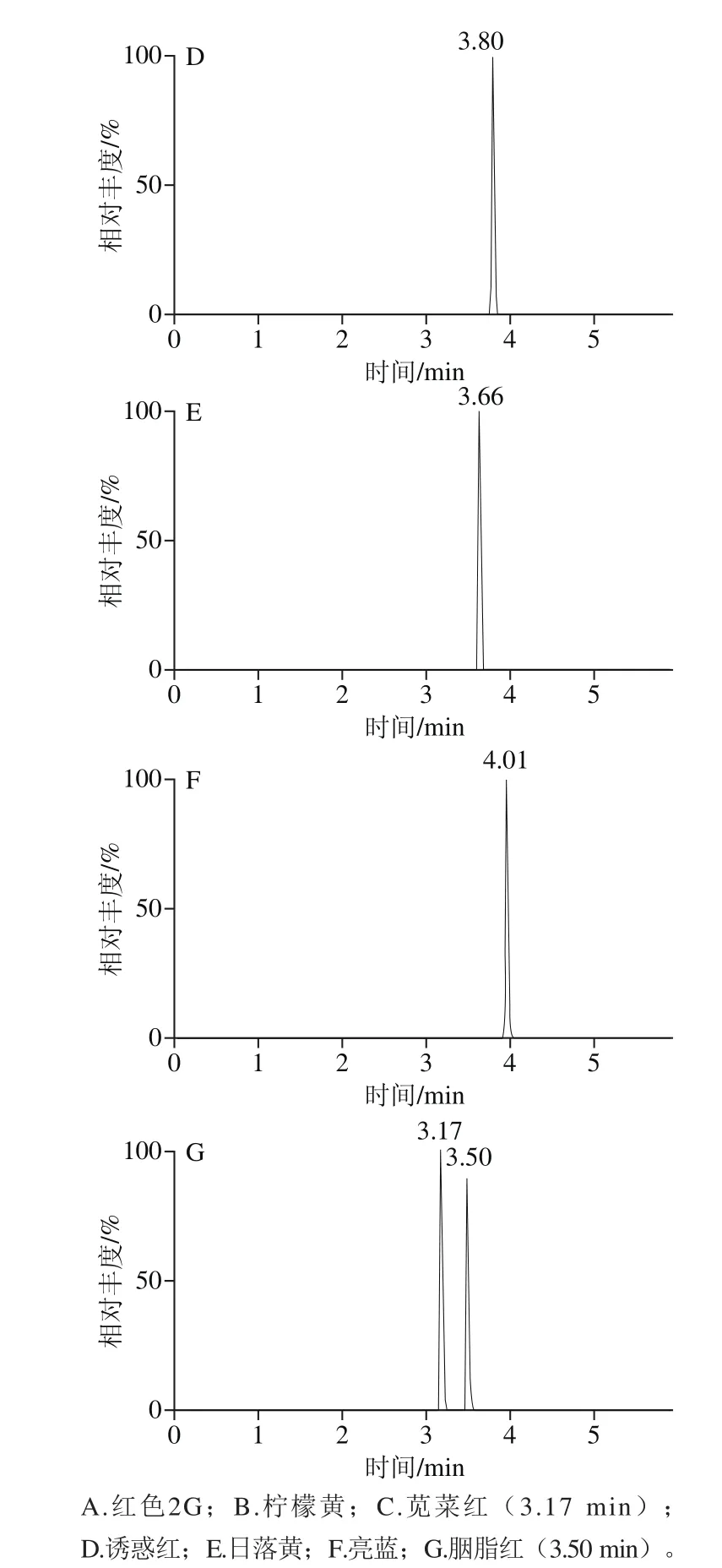
图1 阴性纳豆提取物中添加7 种合成色素标准品的一级全扫描质谱图Fig. 1 Full-scan mass spectra of 7 artificial dye standards

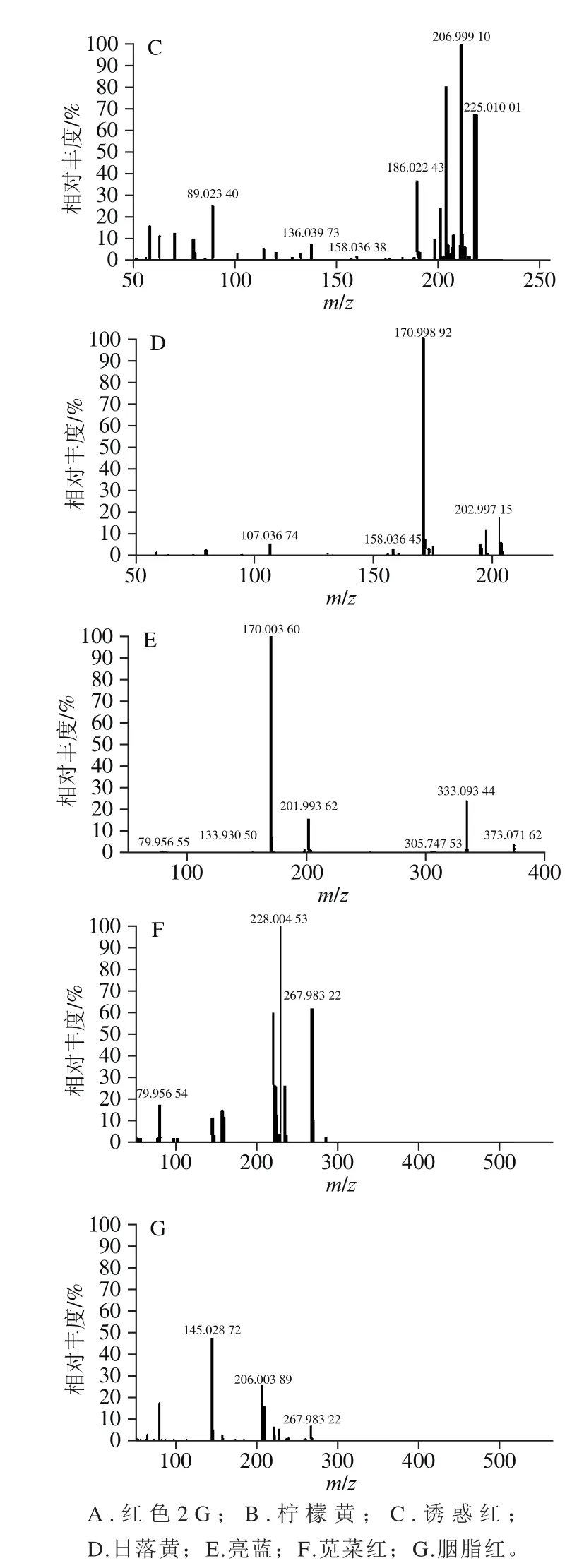
图2 7 种合成色素标准品的二级质谱图Fig. 2 MS2 spectra of 7 artificial dye standards
2.2 色谱条件优化结果
2.2.1 色谱柱选择
色谱分离实验结果表明:对于柱2,柠檬黄洗脱峰的响应过低,柱5所有峰形较宽,且柠檬黄出峰过早(为0.68 min)。柱4与柱1的效果相差不大,且所有峰的峰形和分离效果均不及柱3理想。柱3所有目标峰的响应高,洗脱峰形对称、尖锐,且分离效果好,可能BEH Shield RP18的C18键合相内嵌极性官能团,对高水相具有良好的分离效果,因此后续实验选用Waters Acquity UPLC BEH Shield RP18色谱柱(100 mm×2.1 mm,1.7 μm)。
2.2.2 流动相选择
不同流动相实验结果发现:当水相为体积分数0.1%甲酸溶液时,柠檬黄、胭脂红及亮蓝不出峰,其他峰的峰形不对称且响应低;水相为超纯水时,整体响应较低,柠檬黄和亮蓝峰形较为理想,酸性红峰不对称,胭脂红不出峰;水相为5 mmol/L乙酸铵溶液,除柠檬黄外其他目标化合物在有机相为甲醇和乙腈的流动相中分离度及峰形、响应相近,柠檬黄在以乙腈-乙酸铵(5 mmol/L)溶液为流动相时,峰形尖锐且不拖尾,以甲醇-乙酸铵(5 mmol/L)溶液为流动相时,峰出现明显拖尾现象。向阴性样品纳豆提取物中添加50 μg/mL混合标准物质作为基质标准,分别以乙腈-0.1%甲酸溶液和乙腈-5 mmol/L乙酸铵溶液作流动相,结果发现,以甲醇作为有机相噪音较乙腈要高,且以乙腈作为有机相能够明显降低基线漂移。因此本实验最终选择乙腈-5 mmol/L乙酸铵水溶液作为流动相。
2.2.3 提取溶剂的选择
不同提取溶剂实验结果表明:采用体积分数20%氨水和无水乙醇-氨水-水(7∶2∶1,V/V)作为提取剂时,回收率整体偏低,其中柠檬黄回收率低于20%,原因可能是柠檬黄适合用偏酸性溶剂提取;采用水作为提取溶剂,7 种水溶性合成色素回收率均比较理想,分别达到:胭脂红63%,苋菜红65.3%,日落黄83.8%,亮蓝70.0%,红色2G 70.2%,柠檬黄62.7%,诱惑红66.5%。故本实验选取超纯水作为样品提取溶剂。
2.3 固相萃取方法优化
2.3.1 固相萃取柱的选择
由于固相萃取技术具有操作简便、溶剂消耗低、样品用量少、回收率高的优点,被广泛应用于食品色素检测的净化方法[28-29]。结果发现,柠檬黄、胭脂红、苋菜红在HLB固相萃取小柱上回收率均低于10%;C18固相萃取小柱只对亮蓝的回收率较为理想(65.0%),其他6 种色素回收率均低于15%。选择聚酰胺固相萃取小柱作净化柱,除干扰效果好,样品回收率均高于85%,因此选择其作为净化柱。
2.3.2 淋洗液及洗脱液的选择
结果表明,当淋洗液为酸化水溶液时,能避免柠檬黄和亮蓝的流失,在酸化水溶液中加一定比例的有机溶液甲醇可使得杂质去除更为干净,且不影响各目标化合物在聚酰胺小柱上的保留,因此实验选择3 mL甲醇-甲酸-水(1∶2∶5,V/V)和3 mL水为淋洗溶液。
采用甲醇、体积分数10%甲酸-甲醇溶液、体积分数10%氨水-甲醇溶液作为洗脱溶液进行洗脱实验,结果发现,甲醇不能将目标化合物全部洗脱下来,体积分数10%甲酸-甲醇溶液不具有洗脱能力,当甲醇和体积分数10%氨水-甲醇溶液结合使用,能将7 种水溶性合成色素都洗脱下来。因此本实验选择甲醇和体积分数10%氨水-甲醇溶液作为洗脱溶剂,进一步对洗脱溶剂的体积进行优化,最终确定体积分数甲醇和10%氨水-甲醇溶液的优化体积分别为6 mL。
2.3.3 基质效应的考察结果
由于植物提取物基质复杂[30],选择响应值法进行基质效应的考察。结果发现,柠檬黄(肉桂提取物中基质效应50%、黑加仑提取物50%)、亮蓝(纳豆提取物中基质效应70%、黑加仑提取物60%)和红色2G(肉桂提取物中基质效应115%、甜菜根70%)中基质效应比较大,其他水溶性合成色素的基质效应均较小。因此本实验中采用基质匹配标准溶液作为标准,进行外标法定量。
2.4 方法学验证结果
2.4.1 线性范围和检出限
选取不同基质的空白样品,按上述方法进行样品前处理,提取空白基质液分别配制10、20、50、100、200、500 μg/mL不同质量浓度的混合标准溶液,进样检测,绘制基质标准曲线。从表2可看出,在10~500 μg/mL的线性范围内7 种水溶性合成色素的相关系数(r2)大于0.99;方法的检出限(RSN≥3)为0.001 2~0.052 mg/kg。
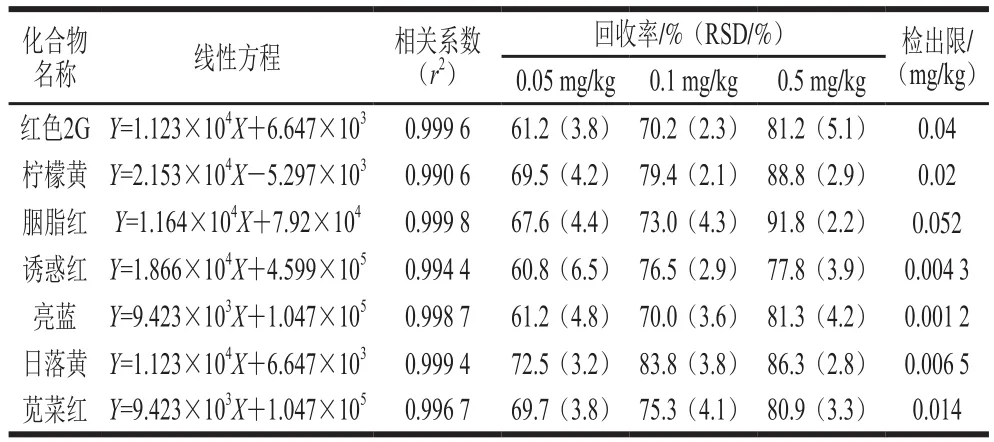
表2 7 种合成色素线性回归方程、相关系数、检出限及纳豆提取物中的回收率和RSD结果(n= 6)Table 2 Linearity regression equations, correlation coefficient, LODs,recoveries and precision (RSD) of the 7 artificial dyes at three spiked levels from natto extract (n= 6)
2.4.2 回收率与精密度
将7种混合标准物质添加到阴性纳豆提取物的样品液中,添加水平为0.05、0.1、0.5 mg/kg的溶液,平行实验6 次,加样回收率及RSD结果见表2。从表2可看出,7种水溶性合成色素的回收率均在60.8%~91.8%范围内,RSD为2.1%~6.5%。
2.5 方法适用性及实际样品检测结果
选取纳豆、樱桃、甜菜、万寿菊、黑加仑、大豆、肉桂、芒果等植物提取物对构建的检测方法进行验证。按相同方法处理样品,添加水平为0.1 mg/kg,回收率均在63.4%~139.0%范围内,RSD为2.5%~16.7%。
应用所建立的方法分别对市场采购的10 批次植物提取物进行检测,对随机抽取的10 种植物提取物按本方法进行快速筛查,除万寿菊、黑加仑、蔓越橘提取物外,其他植物提取物均检出含有禁用及限用合成色素。
3 结 论
本实验基于UPLC-Q-Orbitrap建立了植物提取物中7 种水溶性合成色素的快速筛查和定量分析方法。由于目前缺乏植物提取物中限用及禁用合成色素的国家检测标准,通过高选择性的四极杆与轨道离子阱高分辨准确质量数测量技术有机结合,能够降低基质干扰,具有较高的定性定量能力,通过加标验证,在0.05、0.1、0.5 mg/kg 3 个加标水平下,样品中7 种限用及禁用合成色素加样回收率在60.8%~91.8%范围内,RSD为2.1%~6.5%。本方法应用于10 批次样品的测定具有良好的重现性,能够满足植物提取物中限用及禁用合成色素的快速筛查与定量分析,可以为生产和监管部门提供方法参考。
[1] 刘开, 孔祥虹, 何强, 等. GC-MS/MS法测定8 种植物提取物中15 种拟除虫菊酯类农药的残留量[J]. 分析实验室, 2014, 33(8): 930-935.DOI:10.13595/j.issn1000-0720.2014.0219.
[2] SIGURDSON G T, TANG P P, GIUSTI M M. Natural colorants:food colorants from natural sources[J]. Annual Review of Food Science and Technology, 2017(8): 261-280. DOI:10.1146/annurevfood-030216-025923.
[3] KHAN M I. Plant betalains: safety, antioxidant activity, clinical efficacy, and bioavailability[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2): 316-330. DOI:10.1111/1541-4337.12185.
[4] OPLATOWSKA-STACHOWIAK M, ELLIOTT C T. Food colors:existing and emerging food safety concerns[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(3): 524-548. DOI:10.1080/1040 8398.2014.889652.
[5] 程盛华, 丁丽, 林玲, 等. 反向高效液相色谱同时测定10 种食品添加剂[J]. 食品科学, 2008, 29(6): 376-381. DOI:10.3321/j.issn:1002-6630.2008.06.083.
[6] YAMJALA K, NAINAR M S, RAMISETTI N R. Methods for the analysis of azo dyes employed in food industry: a review[J]. Food Chemistry, 2016, 192: 813-824. DOI:10.1016/j.foodchem.2015.07.085.
[7] ESMAEILI S, ASHRAFI-KOOSHK M R, KHALEDIAN K, et al.Degradation products of the artificial azo dye, allura red, inhibit esterase activity of carbonic anhydrase Ⅱ: a basic in vitro study on the food safety of the colorant in terms of enzyme inhibition[J]. Food Chemistry, 2016, 213: 494-504. DOI:10.1016/j.foodchem.2016.06.078.
[8] STACHOVA I, LHOTSKA I, SOLICH P, et al. Determination of green,blue and yellow artificial food colorants and their abuse in herb-coloured green Easter beers on tap[J]. Food Additives & Contaminants: Part A,2016, 33(7): 1139-1146. DOI:10.1080/19440049.2016.1200198.
[9] 国家卫生和计划生育委员会. 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014.
[10] 毛希琴, 李春玲, 任国杰, 等. 高效液相色谱法同时检测化妆品中38 种限用着色剂[J]. 色谱, 2015, 33(3): 282-290. DOI:10.3724/SP.J.1123.2014.11017.
[11] 赵飞, 高广慧, 那海秋, 等. 固相萃取-高效液相色谱-可变波长检测法同时测定调味品中甜味剂和人工合成色素[J]. 色谱, 2013, 31(5):490-493. DOI:10.3724/SP.J.1123.2012.112012.
[12] 邵仕萍, 奚星林, 陈洁贞, 等. 饮料和糖果中 5 种非法添加色素的检测[J]. 食品科学, 2011, 32(4): 189-192.
[13] 钱晓燕, 刘海山, 朱晓雨, 等. 固相萃取/超高效液相色谱-串联质谱法测定化妆品中12 种合成着色剂[J]. 分析测试学报, 2014(5): 527-532. DOI:10.3969/j.issn.1004-4957.2014.05.006.
[14] 伊雄海, 邓晓军, 杨惠琴, 等. 液相色谱-串联质谱法检测食品中的多种易滥用着色剂[J]. 色谱, 2011, 29(11): 1062-1069. DOI:10.3724/SP.J.1123.2011.01062.
[15] 凌云, 储晓刚, 孙利, 等. 香肠中红色2G的HPLC法及UPLC-MS/MS检测[J]. 食品科学, 2011, 32(8): 231-234.
[16] MARTIN F, OBERSON J M, MESCHIARI M, et al. Determination of 18 water-soluble artificial dyes by LC-MS in selected Matrices[J]. Food Chemistry, 2016, 197: 1249-1255. DOI:10.1016/j.foodchem.2015.11.067.
[17] WANG J, CHOW W, CHANG J, et al. Ultrahigh-performance liquid chromatography electrospray ionization Q-Orbitrap mass spectrometry for the analysis of 451 pesticide residues in fruits and vegetables:method development and validation[J]. Journal of Agricultural and Food Chemistry, 2014, 62(42): 10375-10391. DOI:10.1021/jf503778c.
[18] WANG J, CHOW W, LEUG D, et al. Application of ultrahighperformance liquid chromatography and electrospray ionization quadrupole orbitrap high-resolution mass spectrometry for determination of 166 pesticides in fruits and vegetables[J]. Journal of Agricultural and Food Chemistry, 2012, 60(49): 12088-12104.DOI:10.1021/jf303939s.
[19] KAUFMANN A. Combining UHPLC and high-resolution MS: a viable approach for the analysis of complex samples[J]. Trends in Analytical Chemistry, 2014, 63: 113-128. DOI:10.1016/j.trac.2014.06.025.
[20] SHI F, GUO C, GONG L, et al. Application of a high-resolution benchtop quadrupole-orbitrap mass spectrometry for the rapid screening, confirmation and quantification of illegal adulterated phosphodiesterase-5 inhibitors in herbal medicines and dietary supplements[J]. Journal of Chromatography A, 2014, 1344: 91-98.DOI:10.1016/j.chroma.2013.12.030.
[21] 黎永乐, 郑彦婕, 熊岑, 等. 液相色谱/线性离子阱-静电轨道阱高分辨质谱法快速筛查葡萄酒中的合成色素[J]. 色谱, 2013, 31(8): 729-733. DOI:10.3724/SP.J.1123.2013.01019.
[22] 陈达炜, 高洁, 吕冰, 等. 超高液相色谱-高分辨质谱法快速筛查土豆中的多种农药残留[J]. 分析化学, 2014, 42(4): 579-584.DOI:10.3724/SP.J.1096.2014-30989.
[23] 吴斌, 丁涛, 柳菡, 等. 高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速检测6 种农产品中96 种农药的残留量[J]. 色谱, 2012,30(12): 1246-1252. DOI:10.3724/SP.J.1123.2012.07014.
[24] JIA W, CHU X, LING Y, et al. High-throughput screening of pesticide and veterinary drug residues in baby food by liquid chromatography coupled to quadrupole Orbitrap mass spectrometry[J].Journal of Chromatography A, 2014, 1347: 122-128. DOI:10.1016/j.chroma.2014.04.081.
[25] FARRE M, PICQ Y, BARCELQ D. Application of ultrahigh pressure liquid chromatography linear ion-trap orbitrap to qualitative and quantitative assessment of pesticide residues[J].Journal of Chromatography A, 2014, 1328: 66-79. DOI:10.1016/j.chroma.2013.12.082.
[26] 杜彦山, 李强, 吴春敏, 等. 超高液相色谱-四极杆/静电场轨道阱高分辨质谱快速筛查及定量分析保健品中11 种非法添加降糖药物[J].色谱, 2015, 33(4): 371-376. DOI:10.3724/SP.J.1123.2014.11020.
[27] 芦丽, 宫旭, 谭力. 高效液相色谱-离子阱质谱法快速筛查改善睡眠类保健食品中非法添加的24 种镇静催眠药[J]. 色谱, 2015, 33(3):260-266. DOI:10.3724/SP.J.1123.2014.11001.
[28] BRUGGEMANN L, MORGENSTERN P, WENNRICH R.Comparison of international standards concerning the capability of detection for analytical methods[J]. Accreditation and Quality Assurance, 2010, 15(2): 99-104. DOI:10.1007/s00769-009-0589-5.
[29] JIA W, CHU X, LING Y, et al. Simultaneous determination of dyes in wines by HPLC coupled to quadrupole orbitrap mass spectrometry[J].Journal of Separation Science, 2014, 37(7): 782-791. DOI:10.1002/jssc.201301374.
[30] FRENICH A G, ROMERO-GONZALEZ R, AGUILER-LUIZ M.Comprehensive analysis of toxics (pesticides, veterinary drugs and mycotoxins) in food by UHPLC-MS[J]. Trends in Analytical Chemistry, 2014, 63: 158-169. DOI:10.1016/j.trac.2014.06.020.
Determination of 7 Artificial Dyes in Plant Extracts by Ultra-Performance Liquid Chromatography-Quadrupole/Electrostatic Field Orbit Trap High-Resolution Mass Spectrometry
ZHU Zhenbao1, ZHANG Yali2, JIA Wei1, KONG Xianghong2, HE Qiang2
(1. School of Food Science and Bioengineering, Shaanxi University of Science and Technology, Xi’an 710021, China;2. Food Inspection Center of Shaanxi Entry-Exit Inspection and Quarantine Bureau, Xi’an 710068, China)
A rapid method was presented for the determination of 7 artificial dyes in plant extracts by ultra-performance liquid chromatography-electrospray ionization quadrupole orbitrap high-resolution mass spectrometry (UPLC-Q-Orbitrap-MS). Samples were extracted with water, and the extract was cleaned up on a polyamide solid phase extraction (SPE) column and separated by UPLC on a C18column using a mobile phase consisting of 5 mmol/L ammonium acetate-acetonitrile with gradient elution. Data were collected by ESI Q-Orbitrap MS. The results showed that good linearity was observed in the concentration range from 10 to 500 μg/mL for all 7 artificial dyes, with correlation coefficients (r2) greater than 0.99. The limits of detection (LODs) ranged from 0.001 2 to 0.052 mg/kg. The average recoveries were in the range from 60.8% to 91.8% at 3 spiked levels with relative standards deviation (RSDs) between 2.1% and 6.5%. This method proved to be simple,time saving, accurate, reliable and sensitive and thus can be used for the fast screening and confirmation of artificial dyes in plant extracts.
plant extracts; artificial dyes; ultra-performance liquid chromatography-quadrupole/electrostatic field orbit trap mass spectrometry; high-resolution mass spectrometry
10.7506/spkx1002-6630-201724031
TS255.4
A
1002-6630(2017)24-0196-06
朱振宝, 张亚莉, 贾玮, 等. 超高效液相色谱-四极杆/静电场轨道离子阱质谱测定植物提取物中的7 种合成色素[J]. 食品科学, 2017, 38(24)∶ 196-201. DOI∶10.7506/spkx1002-6630-201724031. http∶//www.spkx.net.cn
ZHU Zhenbao, ZHANG Yali, JIA Wei, et al. Determination of 7 artificial dyes in plant extracts by ultra-performance liquid chromatography-quadrupole/electrostatic field orbit trap high-resolution mass spectrometry[J]. Food Science, 2017, 38(24)∶196-201. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724031. http∶//www.spkx.net.cn
2017-02-24
国家自然科学基金面上项目(31671888);陕西省自然科学基金面上项目(2015JM3085)
朱振宝(1971—),男,副教授,博士,主要从事食品功能因子研究。E-mail:zhuzhenbao@sust.edu.cn
