双齿围沙蚕抗凝血肽的制备及其抗血栓作用
2017-12-11郑媛媛丁国芳杨最素余方苗贾盈露吴宗泽
郑媛媛,丁国芳,2,*,杨最素,余方苗,贾盈露,吴宗泽,陈 锐
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品重点工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
双齿围沙蚕抗凝血肽的制备及其抗血栓作用
郑媛媛1,丁国芳1,2,*,杨最素1,余方苗1,贾盈露1,吴宗泽1,陈 锐1
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品重点工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
目的:探讨双齿围沙蚕抗凝血肽(anticoagulant peptides from Perinereis aibuhitensis,PAAP)的制备及其抗血栓作用。方法:以抗凝活力为检测指标,筛选最佳酶对沙蚕进行酶解。酶解产物经超滤、阴离子交换层析、凝胶过滤层析和反相高效液相色谱法分离纯化,得到具有最强抗凝活力的沙蚕寡肽,将此肽命名为PAAP并测定其急性毒性作用。采用角叉菜胶所致的小鼠尾部血栓形成实验、三氯化铁所致的大鼠动脉血栓形成实验及二磷酸腺苷(adenonisine disphosphate,ADP)诱导的血小板聚集实验,研究PAAP的抗血栓作用。结果:选取碱性蛋白酶作为最佳酶对沙蚕进行酶解,经过分离纯化后得到一条氨基酸序列:脯氨酸-缬氨酸-谷氨酸-精氨酸-赖氨酸(Pro-Val-Glu-Arg-Lys)。经测定,该寡肽的体外抗凝活力可达(1 320.0±20.3)U/g。PAAP的最大耐受量为11.0 g/(kg·d)且未出现小鼠异常及死亡现象,体内实验表明PAAP对小鼠尾部血栓的形成、大鼠动脉血栓的形成及ADP诱导的血小板聚集均有明显抑制作用。结论:从双齿围沙蚕中提取出的抗凝肽PAAP具有抗血栓作用。
双齿围沙蚕;抗凝血肽;碱性蛋白酶;分离纯化;抗血栓
血栓形成是缺血性心脏病、缺血性中风及静脉栓塞常见的病理学基础,严重危害人类健康且近年来还有渐增之势[1-3]。抑制血小板的聚集与释放、抑制凝血酶系统、激活抗凝血酶及纤溶酶系统均可抑制血栓的形成[4]。双齿围沙蚕(Perinereis aibuhitensis)隶属于动物界、环节动物门、多毛纲、游行多毛目、沙蚕科,俗称海蜈蚣,与陆地生物蚯蚓具有很近的亲缘关系。从蚯蚓体内获得的蚯激酶已被证明能够有效溶解血栓,改善微循环,加强心、脑血管侧支循环,蚯激酶的成功开发使科研工作者将目光转向沙蚕[5]。国内外学者先后从沙蚕中提取出具有溶栓活性的丝氨酸类纤溶酶[6],但通过酶解的方法从沙蚕体内提取抗凝成分以抑制体内血栓,鲜见报道。本实验从舟山朱家尖地区的双齿围沙蚕中分离纯化获得具有抗凝活力的沙蚕寡肽,并探讨其对实验性血栓形成及血小板聚集率的影响。
1 材料与方法
1.1 动物、材料与试剂
健康雄性清洁级ICR小鼠,体质量(20±2)g,年龄4~5 周;健康雄性清洁级SD大鼠,体质量(140±10)g,年龄4~5 周,购于浙江省医学科学院,动物生产许可证号:SCXK(浙)2014-0001。
双齿围沙蚕购自浙江舟山朱家尖,并由浙江海洋大学赵盛龙教授进行种类鉴定。
胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶 中国亚太恒信公司;纤维蛋白原、凝血酶、角叉菜胶、二磷酸腺苷(adenonisine disphosphate,ADP) 美国Sigma公司;阿司匹林肠溶片 拜耳医药保健有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Cogentu Scale超滤系统 德国默克密理博公司;AKTA purifier UPC 100快速蛋白液相色谱系统 美国GE Healthcare公司;ALPHA1-4冷冻干燥机 德国Christ公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦公司;752FC紫外分光光度计 上海光谱仪器有限公司;CF16RXⅡ低温离心机 日本日立公司;LG-PABER-1半自动凝血分析仪 北京世帝科学仪器有限公司。
1.3 方法
1.3.1 原料制备
将新鲜双齿围沙蚕用清水清洗数次,沥干后称质量,高速组织捣碎机匀浆,加3 倍体积预冷的磷酸盐缓冲液(0.02 mol/L,pH 7.0),4 ℃静置2 h以上。8 000 r/min离心15 min,收集上清液。上清液用医用脱脂棉过滤出去脂肪组织及其他不溶物,分装,-20 ℃冻存备用[7],此为沙蚕抗凝血肽(anticoagulant peptides from Perinereis aibuhitensis,PAAP)原料。
1.3.2 最佳酶选择
将预处理好的PAAP原料按湿质量3 倍加水。选用碱性蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶作供选酶。参考不同酶的使用说明书,按照蛋白酶各自的最适作用温度和pH值(碱性蛋白酶45.0 ℃、pH 10.0,中性蛋白酶45.0 ℃、pH 7.0,胃蛋白酶37.0 ℃、pH 2.0,木瓜蛋白酶60.0 ℃、pH 6.0,胰蛋白酶37.0 ℃、pH 8.0),参考本实验室前期研究及预实验,选择加酶量1 500 U/g,反应时间5 h,料液质量比1∶3对PAAP原料进行酶解。酶解完毕后,100 ℃灭酶10 min,过滤后冷冻干燥。进行抗凝活力测定,选出抗凝活力最高的酶作为最佳酶。
1.3.3 抗凝活力的测定
依据钟超[8]的方法和《中国药典》(2010版)[9],精密取样品粉末(过3号筛)1 g,精密加入质量分数0.9%氯化钠溶液5 mL,充分搅拌,浸提30 min,并时时振摇,于10 000 r/min离心10 min。精密量取上清液100 μL,置于试管(8 mm×38 mm)中,加入含质量分数0.5%牛纤维蛋白原的Tris-HCl缓冲液200 μL,摇匀,于(37.0±0.5)℃水浴中温浸5 min,滴加12 U/mL的凝血酶溶液,每1 min滴加1 次,每次5 µL,边滴加边轻轻摇匀,直至凝固。按照公式(1)计算抗凝活力。

式中:U为抗凝活力/(U/g);c为凝血酶浓度/(U/mL);ρ为样品液质量浓度/(g/mL);V1为消耗凝血酶体积/μL;V2为样品液体积/μL。
1.3.4 PAAP的分离纯化
1.3.4.1 超滤分离
取在最佳酶的最优酶解条件下酶解的上清液,用截留分子质量分别为8、5、3 kD的超滤膜进行超滤,将各分子段超滤获得的酶解液经冷冻干燥后进行抗凝活力测定,筛选出对抗凝活力最高分子段的超滤组分并进行冻干备用,并按照1.3.3节的方法进行抗凝活力测定。
1.3.4.2 快速琼脂糖凝胶阴离子交换层析分离纯化
将1.3.4.1节获得的抗凝活性最优组分的样品离心过滤后上样,上样质量浓度为0.1 g/mL,样体积为柱体积的1%。洗脱过程:预先用0.02 mol/L Tris-HCl平衡缓冲液(pH 7.4)充分平衡阴离子交换柱3~5 个柱体积,然后上样。上样后用平衡缓冲液将穿透峰洗脱至接近基线,随后,采用线性梯度洗脱方式进行洗脱,使NaCl浓度由0 mol/L上升至1 mol/L,按峰收集流出液的液体。检测波长为280 nm,流速为1.5 mL/min,每管收集2 min,将各个洗脱峰冻干后备用,并按照1.3.3节的方法进行抗凝活力测定。
1.3.4.3 葡聚糖凝胶G-25层析分离纯化
将1.3.4.2节得到抗凝活性最优组分,用蒸馏水配制为0.1 g/mL的溶液,过滤后进行上样,上样体积为柱体积的1%。洗脱过程:以蒸馏水作为洗脱液,将凝胶柱进行平衡洗脱;调节恒流泵流速为1.1 mL/min,每管收集3.5 min,收集各峰的洗脱液,280 nm波长处检测其吸光度。将各个洗脱峰冻干后备用,并按照1.3.3节的方法进行抗凝活力测定。
1.3.4.4 RP-HPLC分离纯化
上样样品为1.3.4.3节经凝胶过滤层析得到的样品,利用反相(reversed-phase,RP)-HPLC法进行进一步纯化。色谱条件:色谱柱为Zorbax SB-C18(4.6 nm×250 mm,5 μm);进样体积为100 μL;流动相A为超纯水(含0.06%三氟乙酸),流动相B为乙腈(含0.05%三氟乙酸),流动相A洗脱4 min,0%~100%流动相B梯度洗脱25 min,100%流动相B洗脱6 min;流速为0.8 mL/min;紫外检测波长280 nm。收集洗脱峰并进行冻干后备用,并按照1.3.3节的方法进行抗凝活力测定。
1.3.4.5 目标肽的氨基酸序列测定
委托北京亿谱生物科技有限公司,采用N末端降解检测法进行测定。
1.3.5 PAAP的急性毒理学实验
雄性ICR小鼠20 只,体质量(20±2)g,24 h禁食不禁水,将小鼠分为实验组与空白组。实验组采用国标中最大耐受剂量(maximum tolerated dose,MTD)法[10],根据PAAP的溶解性及其在注射器中的可流动性为指标[11],确定其最高使用质量浓度为550 mg/mL,按0.2 mL/10 g灌胃7 d,每天2 次,故实验组最终累计给予的最大沙蚕抗凝肽的剂量为11.0 g/(kg·d)。对照组灌胃同等体积的生理盐水。记录小鼠体质量、外观、食欲、活动行为、死亡等不良反应情况。7 d后称质量处死,解剖观察。
1.3.6 PAAP对小鼠尾部血栓形成的影响
1.3.6.1 小鼠分组及造模
40 只雄性ICR小鼠随机分为5 组,每组8 只,分别为模型组、阳性对照组(阿司匹林100 mg/kg)、PAAP低剂量组(50 mg/kg)、PAAP中剂量组(100 mg/kg)和PAAP高剂量组(200 mg/kg)[12-16]。小鼠预防性灌胃给药14 d,模型组给予等量生理盐水,造模前24 h禁食不禁水,在第14天末,给药1 h后参考文献[17]造模,腹腔注射0.2%角叉菜胶,注射量为50 mg/kg(由生理盐水配制),15 ℃过夜。
1.3.6.2 小鼠尾部血栓长度的计算
用游标卡尺分别测定在注射角叉菜胶24、48 h和72 h后小鼠的尾部血栓总长及未形成血栓的长度,小鼠尾部血栓形成长度为小鼠尾部总长与未形成血栓长度之差。
1.3.7 PAAP对大鼠颈动脉血栓形成的影响
1.3.7.1 大鼠颈动脉血栓模型的建立
雄性SD大鼠40 只,随机分为5 组,每组8 只,分别为模型组、阳性对照组(阿司匹林100 mg/kg)、PAAP低剂量组(50 mg/kg)、PAAP中剂量组(100 mg/kg)、PAAP高剂量组(200 mg/kg)[18-20]。预防性灌胃给药14 d,模型组给予等量生理盐水,造模前24 h禁食不禁水,于末次给药1 h后,腹腔注射10%水合氯醛麻醉。参照Kurz等[21]的方法改良制作颈总动脉血栓模型,灭菌器材沿颈中线纵向切开颈部皮肤,钝性分离左侧颈动脉1 cm,在颈动脉与周围组织间放一塑料保鲜膜,用于保护血管周围组织,用吸有20 μL 35% FeCl3溶液的滤纸片(1 cm×1 cm)环形包裹颈动脉,模型组用等量生理盐水滤纸包裹,30 min后去除滤纸片。
1.3.7.2 血栓质量及其抑制率的测定
大鼠取血后,精确截取滤纸环抱处血管,吸干血管中残留血液,电子天平称其质量m1,取出血栓后再称血管质量m2,m1-m2即为1 cm血管段内血栓质量m。按公式(2)计算各组抑制率[22]。
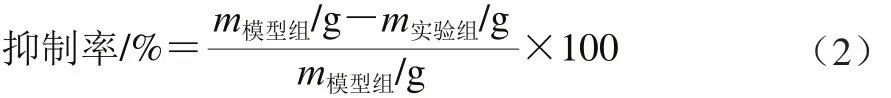
式中:m模型组为模型组血栓质量/g;m实验组为实验组血栓质量/g。
1.3.8 PAAP对大鼠体内血小板聚集率的影响
雄性SD大鼠40 只,随机分为5 组,每组8 只,分别为模型组、阳性对照组(阿司匹林100 mg/kg)、PAAP低剂量组(50 mg/kg)、PAAP中剂量组(100 mg/kg)和PAAP高剂量组(200 mg/kg)。预防性灌胃给药14 d,模型组给予等量生理盐水,造模前24 h禁食不禁水,于末次给药1 h后,腹腔注射10%水合氯醛麻醉,腹主动脉取血。转入装有抗凝剂(枸橼酸钠质量比1∶9)的采血管中,于1 000 r/min离心10 min,取上清液为富血小板血浆(platelet rich plasma,PRP)。余下血液于3 500 r/min继续离心15 min,取上清液即为贫血小板血浆(platelet poor plasma,PPP)[23-24]。使用半自动凝血仪测定血小板聚集率。
1.4 数据统计与分析
用SPSS 19软件进行统计分析,结果以 ±s表示,采用单因素分析进行比较。
2 结果与分析
2.1 最佳酶的选择

表1 5 种蛋白酶酶解液的抗凝活力Table 1 Comparison of antithrombotic activity of hydrolysates produced with fi ve different proteases
由表1可知,在最适酶解条件下,碱性蛋白酶的酶解效果最好,抗凝活力达到了(69.0±2.3)U/g,胃蛋白酶次之。故选定碱性蛋白酶为本实验最佳酶。
2.2 PAAP的分离纯化结果
2.2.1 超滤分离纯化结果

图1 酶解液的不同超滤截留组分抗凝活力Fig. 1 Antithrombotic activity of ultraf i ltration fractions from PAAP
取各个不同分子质量范围冻干样品测定抗凝活力,由图1可知,分子质量≤3 kD的酶解物抗凝活力最高,为(84.0±2.3)U/g,故选定该分子质量范围的酶解物进行下步分离纯化。
2.2.2 快速琼脂糖凝胶阴离子交换层析分离纯化结果
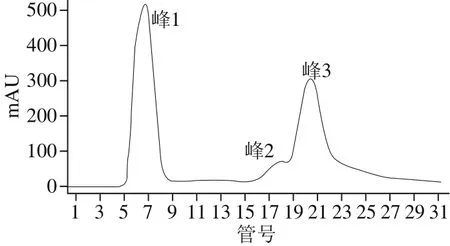
图2 快速琼脂糖凝胶阴离子交换层析洗脱曲线Fig. 2 Elution curve of PAAP using Sepharose fast fl owion exchange chromatography
取分子质量≤3 kD的酶解液进一步分离纯化,于280 nm波长处出现3 个峰,即峰1、峰2和峰3(图2)。收集各峰组分,冷冻干燥后测定抗凝活力(图3),峰3组分具有最高的抗凝活力,为(900±51)U/g,故选择峰3对应的组分进行下一步分离纯化。

图3 洗脱峰样品抗凝活力Fig. 3 Antithrombotic activity of elution peaks obtained from ion exchange chromatography
2.2.3 葡聚糖凝胶G-25层析分离纯化结果

图 4 葡聚糖凝胶G-25层析洗脱曲线Fig. 4 Elution curve of fraction Ⅲ on Sephadex G-25 column
取2.2.2节中峰3冻干样品进行凝胶过滤层析分离并在280 nm波长处检测吸光度,结果如图4所示,为单一峰,收集此峰组分并冻干备用。
2.2.4 RP-HPLC分离纯化及氨基酸序列测定结果
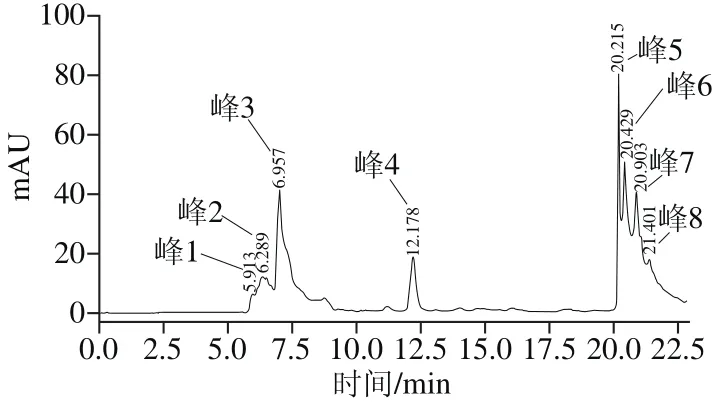
图5 葡聚糖凝胶G-25洗脱峰的RP-HPLC分离纯化结果Fig. 5 Elution curve of purif i ed fraction Ⅲ using RP-HPLC
G-25洗脱峰冻干样品经RP-HPLC色谱柱洗脱纯化,共得到8 个单峰(图5),由于峰1、8组分产率不高,多次收集后仍然很少,因此未进一步收集,收集其他6 个峰组分并测定抗凝活力。其中峰4组分具有最高抗凝活力,将峰4组分继续经RP-HPLC色谱柱洗脱纯化,得到1 个单峰(图6),收集最高峰组分并将其命名为PAAP。经检测该目标肽的氨基酸序列为Pro-Val-Glu-Arg-Lys(脯氨酸-缬氨酸-谷氨酸-精氨酸-赖氨酸),分子质量为627.7 D。将该物质进行质谱分析,所得分子质量大小与该氨基酸序列的大小一致(图7)。经测定,PAAP的体外抗凝活力为(1 320.0±20.3)U/g。
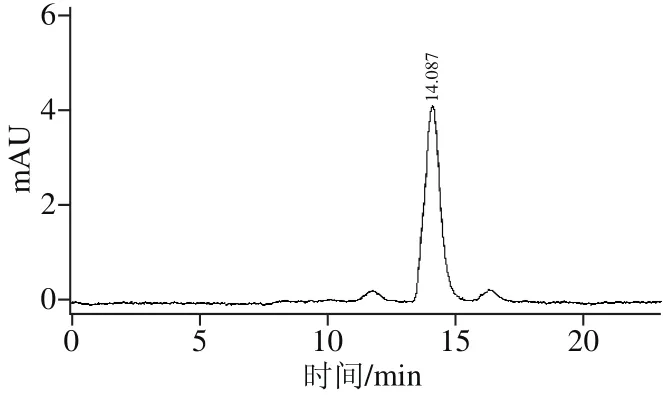
图6 4号峰的RP-HPLC分离纯化结果Fig. 6 Elution curve of peak 4 from fraction Ⅲ further using RP-HPLC

图7 PAAP的质谱图Fig. 7 Mass spectrum of PAAP
2.3 急性毒理学实验结果
给予小鼠PAAP后,实验中各组小鼠活动正常、反应灵敏、皮毛光泽、进食和饮水等活动正常,精神状态良好且未出现死亡。解剖后发现,心、肺、肝、肾、胃和肠等器官肉眼观察均无异常。实验期间,PAAP实验组体质量和对照组相比较,实验组体质量涨幅相对明显(表2),有统计学意义(p<0.05)。可见,PAAP的摄入没有诱使受试小鼠产生食欲不振等现象,不影响小鼠的正常生长发育,使用安全,基本无毒。

表2 急性毒理学实验小鼠体质量变化Table 2 Changes in body weights in mice during acute PAAP toxicity trials g
2.4 PAAP对体内血栓的影响
2.4.1 PAAP对不同时间角叉菜胶诱导小鼠尾部血栓长度的影响
由表3可知,小鼠注射角叉菜胶后,各组均形成明显尾部血栓,随着处理时间的延长,各组的尾部血栓长度均有不同程度的缩短。造模24 h时,高、中剂量组与模型组差异显著,尾部血栓长度明显较短(p<0.05)。48 h及72 h时,PAAP各组均与模型组有显著差异(p<0.05)。阳性对照组与模型组差异不显著(P>0.05)。结果表明PAAP可有效减轻小鼠尾部血栓的形成,不但可以抑制血栓发展,同时对已形成的血栓有一定的溶解作用,且有量效关系。
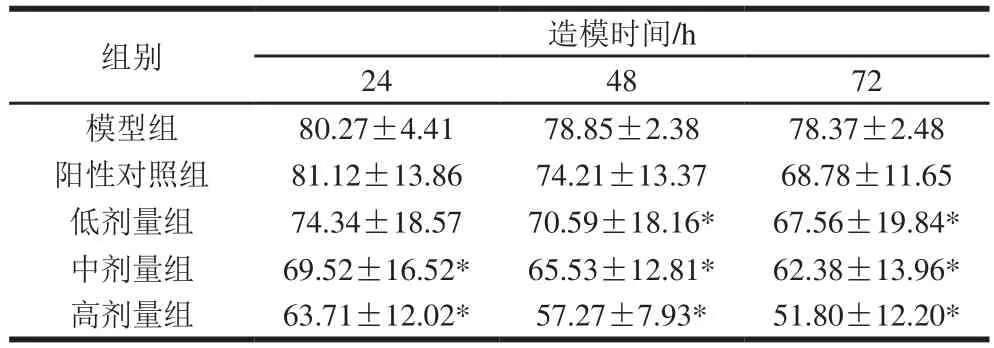
表3 实验小鼠造模24、48 h和72 h尾部血栓长度Table 3 The length of black tail at 24, 48 and 72 h after tail thrombosis model establishment
2.4.2 PAAP对大鼠颈动脉血栓的影响

表4 PAAP对大鼠颈动脉血栓生成量的影响Table 4 Effect of PAAP on carotid arterial thrombosis
由表4可知,阳性对照组与PAAP组均可减轻血栓质量。与模型组相比,PAAP中、高剂量大鼠的血栓质量显著下降(p<0.05)。与阳性对照组相比,PAAP高剂量大鼠的血栓质量也有所下降,表明PAAP能够降低血栓质量且有量效关系。
2.5 PAAP对大鼠体内血小板聚集率的影响
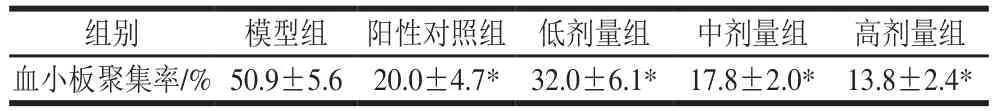
表5 PAAP对大鼠体内血小板聚集的影响Table 5 Effect of PAAP on platelet aggregation in rats
由表5可知,与模型组相比,阳性对照组和PAAP各剂量组对ADP诱导的血小板聚集有非常显著的抑制作用(p<0.05),且随着PAAP给药剂量的增加,抑制作用逐渐增强。
3 讨 论
本研究以碱性蛋白酶、中性蛋白酶、胃蛋白酶、木瓜蛋白酶和胰蛋白酶作为供选酶来酶解双齿围沙蚕,以体外抗凝活力为检测指标,筛选出碱性蛋白酶为最佳酶解沙蚕酶,在此酶解基础上进一步分离纯化。首先,酶解液经超滤截留具有最高抗凝活力的分子段(分子质量≤3 kD),接着利用快速琼脂糖凝胶阴离子交换层析筛选出活性最高组分(峰3),并利用葡聚糖凝胶G-25层析对峰3进行纯化获得单一峰,收集此峰并利用RPHPLC进行分离纯化。最后,将纯化后的样品进行氨基酸序列测定,其氨基酸序列为Pro-Val-Glu-Arg-Lys,将该寡肽命名为PAAP。
血栓的形成是缺血性心脑血管疾病及血栓栓塞性疾病的主要病理过程,与疾病的发生、发展密切相关。因此,抑制血小板聚集、抑制血栓的形成对心脑血管系统疾病及其他血栓栓塞性疾病的防治均有重要意义[25]。本研究通过小鼠尾部血栓形成实验、大鼠动脉血栓形成实验及血小板聚集实验,对PAAP的抗血栓作用进行了初步探讨。
角叉菜胶是从红藻类海草中提炼出来的亲水性胶体,是一种较强的致炎因子[26],可用于制备多种组织炎症模型。胡三觉等[17]发现可用其制作小鼠尾部血栓形成模型,此种静脉血栓形成是由局部炎症与内皮细胞的损坏所引起的混合型血栓,可依据皮肤颜色的显著变化,从体表直接测量血栓的形成范围与程度,观察其发展全过程,具有简便、直观、无创伤等优点。实验中发现,注射角叉菜胶后期,部分小鼠会出现断尾现象,为准确测量尾部血栓长度,在实验过程中选择测量未形成血栓的长度,用尾部总长度减去未形成血栓长度,即为小鼠尾部血栓长度,发现PAAP能够显著降低小鼠尾部形成血栓长度(p<0.05),对角叉菜胶所致的小鼠尾部血栓具有一定的抑制作用。
Lockyer等[27]发现利用FeCl3外敷可使血管内膜损伤,胶原暴露,引起血小板黏附、聚集和释放活化等,导致内源性凝血系统激活,在动脉损伤的区域形成复合性血栓,与人类血栓性疾病的发病机制相似且制作方法简单、容易控制、重复性好[28],因而在国内外研究中被广泛使用[29-31]。本实验选用此模型来评价PAAP抑制血栓形成的作用,研究结果显示,PAAP各剂量组均能延长FeCl3诱导的大鼠颈总动脉血栓形成时间,且中、高剂量作用效果明显(p<0.05),表明PAAP具有抑制动脉血栓形成的作用。
血小板聚集诱导剂主要包括ADP、凝血酶、胶原、血栓烷A2、肾上腺素和血清素等。各种诱导剂诱导血小板活化的能力不尽相同,凝血酶、胶原和血栓烷A2都是强诱导剂,ADP属中等强度的血小板聚集诱导剂[32-34],其诱导的血小板活化的信号通路是血小板聚集过程中最为重要的信号通路[23],因此本实验选择ADP诱导的血小板聚集进行研究,结果显示,PAAP能够有效抑制由ADP诱导的大鼠血小板聚集。
4 结 论
实验使用碱性蛋白酶酶解双齿围沙蚕,经分离纯化后,所获得的寡肽(PAAP)氨基酸序列为Pro-Val-Glu-Arg-Lys,体外抗凝活力达到(1 320.0±20.3)U/g。急性毒性实验结果显示,PAAP的最大耐受量为11.0 g/(kg·d),实验中未出现小鼠异常及死亡现象,提示该样品使用安全。PAAP可明显抑制角叉菜胶诱导的小鼠尾部血栓及FeCl3引起的大鼠颈动脉血栓(p<0.05),同时对ADP诱导的血小板聚集也具有抑制作用。
[1] XIN M, REN L, SUN Y, et al. Anticoagulant and antithrombotic activities of low-molecular-weight propylene glycol alginate sodium sulfate (PSS)[J]. European Journal of Medicinal Chemistry, 2016, 114:33-40.
[2] WANG Chaoyun, ZHANG Dale, LI Guisheng. Neuroprotective effects of safflor yellow B on brain ischemic injury[J]. Experimental Brain Research, 2007, 177(4): 533-539.
[3] THOMPSON R J, ZHOU N, MACVICAR B A. Ischemia opens neuronal gap junction hemichannels[J]. Science, 2006, 312: 924-927.
[4] 杨晓君, 穆合塔尔, 包晓玮, 等. 红花黄色素与双亚酸的抗血栓作用[J].食品科学, 2013, 34(3): 264-266.
[5] 姜光域, 钱冬萌, 宋旭霞, 等. 双齿围沙蚕消化道D2菌株胞外蛋白酶的制备及其抗肿瘤活性的初步探讨[C]//华东六省一市生物化学与分子生物学会2010年学术交流会论文集. 南昌: 中国生物化学与分子生物学会, 2010: 109.
[6] 郭秋平, 洪新雨, 张连芝, 等. 日本刺沙蚕纤溶酶体内降纤作用与体外溶栓作用研究[J]. 中风与神经疾病杂志, 2010, 27(10): 890-893.
[7] 李奇, 王昭, 洪敏. 一组新的沙蚕蛋白酶同工酶的分离纯化与鉴定[J]. 中国生物化学与分子生物学报, 2008, 24(4): 358-364.DOI:10.3969/j.issn.1007-7626.2008.04.010.
[8] 钟超. 菲牛蛭抗凝血肽的酶法制备及其活性研究[D]. 广州: 华南理工大学, 2012: 21.
[9] 药典编委会. 中华人民共和国药典(2010一部)[S]. 北京: 化学工业出版社, 2010: 78.
[10] 中国疾病预防控制中心营养与食品安全所. 急性毒性试验:GB 15193.3—2003[S]. 北京: 中国标准出版社, 2003: 22.
[11] 张鸣镝, 赵会燕, 刘静波, 等. 玉米胚芽抗氧化肽的急性毒性和致突变性[J]. 食品科学, 2014, 35(13): 228-231. DOI:10.7506/spkx1002-6630-201413044.
[12] 滕洪明, 吕东泽, 戴淑芳, 等. 萱藻多糖的制备及抗凝血抗血栓活性研究[J]. 中国海洋药物, 2012, 31(1): 25-28. DOI:10.13400/j.cnki.cjmd.2012.01.007.
[13] 殷文哲, 曹烨骏, 丛峰松. Nattozimes~(TM)对大鼠尾部血栓形成的影响[J]. 食品科学, 2011, 32(13): 306-309.
[14] 沈明花, 彭瀛, 宋晓琳. 金针菇发酵液的溶栓作用研究[J]. 食品科学,2012, 33(17): 246-248.
[15] 高建, 徐先祥, 徐先俊, 等. 黄芪总皂苷抗血栓形成作用实验研究[J].中成药, 2002(2): 40-42.
[16] 李小东, 王成涛, 赵磊, 等. 纤溶豆豉的制备及其对小鼠溶栓效果的评价[J]. 食品科学, 2012, 33(3): 228-231.
[17] 胡三觉, 田巧莲, 顾建文, 等. 一种新的体内血栓形成动物模型[J].第四军医大学学报, 1993(1): 69.
[18] 厍文波, 甘露, 安晓晶, 等. 玫瑰精油抗血栓形成作用[J]. 食品科学,2011, 32(11): 270-272.
[19] 聂牧, 王云, 郭守东, 等. 板栗多糖抗动脉血栓形成的作用[J]. 食品科学, 2015, 36(11): 187-190. DOI:10.7506/spkx1002-6630-201511036.
[20] 郝旭亮. 罗布麻总黄酮抗血栓作用物质基础及抗人脐静脉血管内皮细胞凋亡作用机理研究[D]. 太原: 山西医科大学, 2009: 15.
[21] KURZ K D, MAIN B W, SANDUSKY G E. Rat model of arterial thrombosis induced by ferric chloride[J]. Thrombosis Research, 1990,60(4): 269-280.
[22] 张文将. 血府逐瘀汤抗动脉血栓形成及其作用机制的实验研究[D].长沙: 湖南中医药大学, 2014: 4.
[23] 熊天琴, 陈元元, 李红侠, 等. 毛冬青皂苷B3的抗血栓作用研究[J].中草药, 2012, 43(9): 1785-1788.
[24] 魏伟. 药理实验方法学[M]. 北京: 人民卫生出版社, 2010: 1065-1069.
[25] 张旭静, 王素春, 郭吉平, 等. 复方丹参CO2超临界萃取液抗大鼠血栓形成的实验研究[J]. 中国现代应用药学, 2007, 24(1): 14-16.
[26] KOCHER L, ANTON F, REEH P W, et al. The effect of carrageenaninduced inflammation on the sensitivity of unmyelinated skin nociceptors in the rat[J]. Pain, 1987, 29(3): 363-373.
[27] LOCKYER S, KAMBAYASHI J. Demonstration of flow and plateletdependency in a ferric chloride-induced model of thrombosis[J].Journal of Cardiovasc Pharmacol, 1999, 33(5): 718-725.
[28] 郭朝锋, 穆玉明. 三氯化铁动物血栓模型方法学及其应用研究进展[J].中华实用诊断与治疗杂志, 2010, 24(6): 537-539.
[29] BARR J D, CHAUHAN A K, SCHAEFFER G V, et al. Red blood cells mediate the onset of thrombosis in the ferric chloride murine model[J]. Blood, 2013, 121(18): 3733-3741.
[30] ECKLY A, HECHLER B, FREUND M, et al. Mechanism underlying FeCl3-induced arterial thrombosis[J]. Journal of Thrombosis &Haemostasis, 2011, 9(4): 779-789.
[31] XIAN X, DING Y, ZHANG L, et al. Enhanced atherothrombotic formation after oxidative injury by FeCl3to the common carotid artery in severe combined hyperlipidemic mice[J]. Biochemical and Biophysical Research Communications, 2009, 385(4): 563-569.
[32] 厍文波, 甘露, 安晓晶, 等. 玫瑰精油抗血栓形成作用[J]. 食品科学,2011, 32(11): 270-272.
[33] 余晋林. 血小板功能评估、诊断和治疗[M]. 北京: 科学出版社, 2008: 3-4.
[34] 杨雨, 左建, 李家明, 等. 苯丙烯酰胺类化合物的设计、合成及抗血小板聚集活性[J]. 药学学报, 2017, 52(1): 120-125. DOI:10.16438/j.0513-4870.2016-1049.
Enzymatic Preparation and Antithrombotic Activity of Anticoagulant Peptides from Perinereis aibuhitensis
ZHENG Yuanyuan1, DING Guofang1,2,*, YANG Zuisu1, YU Fangmiao1, JIA Yinglu1, WU Zongze1, CHEN Rui1
(1. Engineering Research Centers of Marineorganisms Medical Products, School of Food and Medicine, Zhejiang Ocean University,Zhoushan 316022, China; 2. Marine Fisheries Research Institute of Zhejiang Province, Zhoushan 316021, China)
The present study was intended to investigate the enzymatic preparation and antithrombotic activity of anticoagulant peptides from Perinereis aibuhitensis (PAAP). The optimum enzyme was determined based on anticoagulant activity. Ultraf i ltration, anion-exchange chromatography, gel chromatography and reversed phase high-performance liquid chromatography were used sequentially to separate and purify peptides with the strongest anticoagulant activity from the protein hydrolysate of Perinereis aibuhitensis, named as PAAP. Then, the acute toxicity of PAAP was determined. Furthermore, the antithrombotic activity of PAAP was observed by carrageenan-induced tail thrombosis in mice, FeCl3-induced arterial thrombosis in rats and platelet aggregation induced by adenosine diphosphate (ADP). Alkaline protease was selected as the optimal protease to digest Perinereis aibuhitensis. An anticoagulant peptide was then obtained after separation and purif i cation, and identif i ed as Pro-Val-Glu-Arg-Lys. The anticoagulant activity of PAAP could reach up to (1 320.0 ± 20.3) U/g. The maximum tolerance dose of PAAP was 11.0 g/(kg·d) without the occurrence of abnormality and death in mice. The in vivo experiments also showed that PAAP could prevent the formation of carrageenan-induced tail thrombosis in mice, FeCl3-induced arterial thrombosis in rats and platelet aggregation induced by ADP. Thus PAAP has an antithrombotic effect.
Perinereis aibuhitensis; anticoagulant peptides; alkaline protease; separation and purif i cation; antithrombosis
10.7506/spkx1002-6630-201723027
R282.77
A
1002-6630(2017)23-0171-07
郑媛媛, 丁国芳, 杨最素, 等. 双齿围沙蚕抗凝血肽的制备及其抗血栓作用[J]. 食品科学, 2017, 38(23): 171-177.
DOI:10.7506/spkx1002-6630-201723027. http://www.spkx.net.cn
2016-09-13
国家自然科学基金青年科学基金项目(81001393);2015年度国家星火计划项目(2015GA700044);
国家海洋局重大计划项目(2015862);浙江省科技厅重大科技专项计划项目(2013C03036);
浙江省自然科学基金项目(LS15H30001);浙江省自然科学基金青年资金项目(LQ16H300001);舟山市公益类科技项目(2015C31012)
郑媛媛(1990—),女,硕士,研究方向为海洋药物、海洋功能食品。E-mail:337132216@qq.com
*通信作者:丁国芳(1958—),男,教授,学士,研究方向为海洋药物、海洋功能食品。E-mail:dinggf2007@163.com
ZHENG Yuanyuan, DING Guofang, YANG Zuisu, et al. Enzymatic preparation and antithrombotic activity of anticoagulant peptides from Perinereis aibuhitensis[J]. Food Science, 2017, 38(23): 171-177. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201723027. http://www.spkx.net.cn
