超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响
2017-12-11陈立夫张里明张荣杰胡秋辉
陈立夫,裴 斐,张里明,张荣杰,李 静,方 勇,胡秋辉*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响
陈立夫,裴 斐,张里明,张荣杰,李 静,方 勇,胡秋辉*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
为了在生产高品质冷冻干燥产品的同时进一步降低干燥过程中的能耗与成本,选取双孢蘑菇为研究对象,以冷冻和冷冻干燥过程中双孢蘑菇的共晶点、共熔点、冻干温度及冻干产品的质构、微观结构、色泽和营养品质为考察指标,研究普通渗透和超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响。结果表明,与新鲜样品相比,经超声辅助渗透处理45 min后,样品冷冻时间和冷冻干燥时间分别缩短了21.24%和28.62%,并且其冻干产品的可滴定酸、总蛋白质以及多酚等营养物质的保留率高于普通渗透120 min处理组。此外,与普通渗透120 min处理组相比,超声辅助渗透45 min处理组冻干样品复水比、硬度更高,其微观结构更加接近于未经渗透处理的冻干样品。
双孢蘑菇;超声辅助渗透;冷冻干燥;营养品质;微观结构
双孢蘑菇(Agaricus bisporus)是目前世界上栽培面积最广、最受消费者喜爱的食用菌之一[1]。双孢蘑菇的营养价值高,其中蛋白质、多酚类物质和功能性多糖含量较高[2]。但由于双孢蘑菇水分含量高,呼吸作用强,新陈代谢旺盛且极易受到微生物的侵染,在常温环境下保质期一般只有3~4 d,在运输贮藏过程中极易发生腐烂变质[3]。
真空冷冻干燥是有效延长果蔬货架期的加工方式之一,能最大限度保持食品感官品质和营养价值[4]。目前,已有刘玉环[5]、黄劲松[6]、黄凡[7]等对双孢蘑菇冷冻干燥进行研究,其结果都表明与其他干燥方式相比,冷冻干燥能有效保留双孢蘑菇色泽、微观结构、风味物质以及营养成分;但能耗高、干燥周期长等问题制约了其工业化的发展[8]。为进一步提升食品的冷冻干燥效率,降低干燥成本,可以在保证产品品质的同时对干燥前物料进行预脱水处理。其中,超声辅助渗透脱水是指在一定的温度下,将物料放入高渗透压的溶液中,由于细胞膜半透性,使物料去除一部分水,同时超声辅助技术产生的一系列挤压和膨胀的“海绵效应”能提高渗透脱水过程中物质的交换效率[9-10]。此外,超声的“空穴效应”会引起物料组织产生一些微小的孔道,加快物质传递速率,从而有效地减少食品水分含量,降低干燥成本和能耗[11]。
有关超声辅助渗透处理联合干燥提高果蔬干燥效率和改善产品品质方面报道较多。如Azoubel等[12]研究了超声渗透辅助热风干燥木瓜的干燥效率和品质,结果表明超声辅助渗透处理提高了木瓜热风干燥速率,并且其类胡萝卜素保留率提高了40%;Dehghannya等[13]研究了超声渗透辅助热风干燥对李子品质的影响,结果表明超声辅助渗透处理缩短了20%的热风干燥时间;Amami等[14]研究了超声渗透辅助对流干燥对草莓品质的影响,结果表明超声渗透前处理提高了草莓对流干燥的干燥速率和干燥系数,缩短了干燥时间。这些研究均证实了超声渗透能够显著提高干燥速率。然而,关于超声辅助渗透前处理冷冻干燥双孢蘑菇的研究鲜见相关报道。
本实验研究超声辅助渗透处理对冷冻干燥双孢蘑菇的冷冻干燥速率和产品品质的影响,为今后双孢蘑菇冷冻干燥工业化提供依据。
1 材料与方法
1.1 材料与试剂
双孢蘑菇购于南京苏果超市,去根、清洗,切成5 mm厚的双孢蘑菇片。
蔗糖、硫酸、盐酸、苯酚、酚酞、硫酸钾、五水合硫酸铜、戊二醛(均为分析纯)、石英砂 国药集团化学试剂有限公司。
1.2 仪器与设备
AL1043电子天平 瑞士梅特勒-托利多仪器有限公司;1024型蘑菇切片器 德国Westmark公司;TA-XT2i质构仪 英国Stable Micro Systems公司;HH-6数显恒温水浴锅 江苏国华电器有限公司;TM3000扫描电子显微镜 日本日立公司;GYX515便携式色差仪上海嘉标测试仪器有限公司;FreeZone 12 L真空冷冻干燥机 美国Labconco公司;SB25-12DTDN超声波清洗机 宁波新芝生物科技股份有限公司;722S可见分光光度计 上海精密科学仪器有限公司;DSC8000差示扫描量热仪 美国PerkinElmer股份有限公司;Kjeflex K-360凯氏定氮仪 瑞士Büchi公司;DT-8891E电热偶深圳华盛昌机械实业有限公司。
1.3 方法
1.3.1 渗透脱水
通过预实验表明,双孢蘑菇在30 ℃、质量分数50%蔗糖溶液中经超声渗透45 min后与普通渗透120 min后的湿基水分含量分别为(79.09±0.40)%、(80.83±1.28)%,没有显著差异(P>0.05)。因此在实验设计过程中,选择质量分数50%的蔗糖溶液为渗透液,渗透温度30 ℃,固液质量比1∶10,对双孢蘑菇进行普通渗透45、120 min和超声渗透45 min的实验,分别记为OD-45 min、OD-120 min和OUD-45 min。渗透脱水结束后,将3 组渗透处理后样品用蒸馏水冲洗10 s,再用滤纸拭去表面水分待用。
1.3.2 冷冻干燥
将渗透处理后的样品分别在-20 ℃条件下预冻1 h(预冻阶段),再放置在冻干机的干燥室内进行冷冻干燥(干燥阶段),其中真空压力为100 Pa,加热板温度为40 ℃,冷阱温度为-80 ℃。样品冷冻干燥直至其湿基水分含量小于5%。
1.3.3 冷冻干燥过程样品温度测定
将电热偶的温度传感探头插入样品中心,每10 s测定一次其内部温度,最后将收集的数据通过电脑进行处理。实验平行测定3 次。
1.3.4 共晶点和共熔点的测定
将新鲜样品以及渗透后的样品,切成30 mg的小块状,放入差示扫描量热仪特制的铝盒并压片密封。测定的条件为:在20 ℃下平衡1 min,然后以2 ℃/min的速率下降至-20 ℃,再以2 ℃/min的速率升温至20 ℃,氮气的流速为20 mL/min。
1.3.5 色泽的测定
将冷冻干燥后的样品用便携式色差仪进行色泽测定。每个样品随机选5 个点进行测定,结果由L值、a值和b值表示。其中L值代表明暗度,a值代表红绿色,b值代表黄蓝色,实验平行测定5 次。
1.3.6 平均体积密度的测定
将冷冻干燥后的样品用电子天平称取质量,再采用石英砂置换法测定样品体积。体积密度计算如式(1)所示,实验平行测定5 次。

式中:m为样品质量/g;V为样品体积/mL。
1.3.7 复水比的测定
复水比的测定参照Doymaz[15]的方法,将冷冻干燥后的样品浸没于70 ℃蒸馏水中10 min,分别称量浸没前后的样品质量,再通过式(2)计算出其复水比,实验平行测定5 次。

式中:mr为样品复水后质量/g,md为样品复水前质量/g。
1.3.8 微观结构观察
将冻干后的双孢蘑菇切成5 mm×1 mm×1 mm长方体,在扫描电子显微镜下观察冷冻干燥后的样品微观结构。
1.3.9 质构特性测定
将冷冻干燥后的样品放在TA-XT2i质构仪上进行质构特性的测定。采用三点支架破碎法:将两侧可调节支架的距离调整为2 cm,将待测样品置于两支架上,再由上支架进行下压直至样品破碎,以测定样品相应的物性参数。其测定程序为:测试前速率和测试速率均为1 mm/s,测试后速率为10 mm/s,触发力为5 g。在测试过程中,硬度以上支架挤压样品至破碎时所需的最大的力表示,脆度以上支架挤压样品至破碎时上支架移动的距离表示,距离与样品脆度呈反比。
1.3.10 双孢蘑菇总蛋白质、总糖、总酚和可滴定酸含量的测定
采用凯氏定氮法对不同处理组冻干样品蛋白质含量进行测定。用电子天平准确称取0.2 g样品,转移到消化管中,再称取5.0 g硫酸钾- 硫酸铜混合型催化剂(9∶1,m/m),最后加入10 mL浓硫酸。盖上涤气盖,放在消化器上消化150 min。消化完毕后,室温冷却30 min,再放入全自动凯氏定氮仪进行测定。
采用苯酚-硫酸法对不同处理组冻干样品总糖含量进行测定。用电子天平准确称取0.25 g样品,转移至250 mL锥形瓶中,加入50 mL蒸馏水和15 mL浓硫酸,置于100 ℃水浴中冷凝回流水解3 h。过滤并定容至250 mL,为待测液。吸取0.2 mL待测液,依次加入0.8 mL蒸馏水、1.0 mL质量分数5%苯酚溶液,再快速加入5.0 mL浓硫酸,静置反应10 min,再在30 ℃水浴锅中反应20 min,取适量反应液在490 nm波长处测量吸光度。
采用分光光度法对不同处理组冻干样品总酚含量进行测定。将双孢蘑菇冷冻干燥粉过40 目筛后,用电子天平准确称取0.1 g,加入2.5 mL 60%乙醇提取液,用超声提取法进行提取,在60 ℃、超声功率为300 W条件下,每破碎5 s,间歇8 s,总共提取30 min。在25 ℃、12 000 r/min条件下离心10 min,取上清液,用体积分数60%乙醇定容至2.5 mL,待测。具体过程参照南京建成生物工程研究所植物总酚试剂盒说明书进行。
参照李翠丽等[16]的方法对不同处理组冻干样品可滴定酸含量进行测定。用电子天平准确称取双孢蘑菇冻干粉0.5 g,并定容至100 mL,过滤后取20 mL滤液,加入2 滴酚酞,用0.1 mol/L NaOH溶液滴定至pH 8.1~8.3为终点。
1.4 数据分析
实验数据通过SPSS 18软件进行分析,ANOVA程序用于方差分析,当p<0.05时认为平均值间有显著性差异,最小显著差异法用于数据多重比较分析,结果以表示。
2 结果与分析
2.1 不同渗透处理对冻干双孢蘑菇共晶点、共熔点和焓变的影响

表1 不同渗透处理对冷冻干燥双孢蘑菇共晶点、共熔点和ΔH的影响Table 1 Effect of different osmotic pretreatments on eutectic point,melting point and ΔH of freeze-dried Agaricus bisporus
共晶点、共熔点是指物料中水分完全冻结或者冰熔化时的温度[17]。表1为不同渗透处理后双孢蘑菇的共晶点、共熔点及焓变(ΔH)。从渗透后双孢蘑菇的升温和降温阶段可以看出,新鲜组样品的共晶点(-7.79 ℃)和共熔点(4.28 ℃)显著高于其他渗透处理组(p<0.05)。这可能是由于溶质蔗糖的进入会抑制冰晶的形成,从而导致其共晶点和共熔点下降[18]。且UOD-45 min处理组(-11.07、3.43 ℃)、OD-45 min处理组(-11.14、3.54 ℃)和OD-120 min处理组(-11.29、3.51 ℃)3组的共晶点之间以及共熔点之间没有显著差异(P>0.05)。这说明3组渗透处理均显著降低了样品的共晶点和共熔点(p<0.05),但可能渗透程度差异小,并未导致样品共晶点和共熔点的变化差异。从表1可以看出,UOD-45 min处理组样品结晶和熔化时的ΔH(-200.10、190.93 J/g)与OD-120 min处理组ΔH(-200.18、193.81 J/g)没有显著性差异(P>0.05),但都与OD-45 min处理组的ΔH(-218.30、213.35 J/g)差异显著(p<0.05);新鲜组的ΔH(-247.64、245.82 J/g)与渗透组有显著差异(p<0.05)。这可能是渗透作用使样品的水分减少,释放的能量也减少,导致在冷冻干燥过程中ΔH下降[19],同时由预实验结果得知UOD-45 min处理组与OD-120 min处理组样品水分含量没有显著性差异(P>0.05),但都显著小于OD-45 min处理组(p<0.05),因此OD-45 min处理组样品ΔH大于OD-120 min处理组及UOD-45 min处理组样品。
2.2 不同渗透处理对双孢蘑菇冷冻干燥过程的影响

图1 不同前处理后双孢蘑菇冷冻干燥过程中的温度变化曲线Fig. 1 Effect of different osmotic pretreatments on freeze-drying curve of Agaricus bisporus
如图1所示,预冻与干燥耗时最短的均为OD-120 min处理组(37.36 min、5.68 h),其次为UOD-45 min处理组(39.74 min、5.96 h)和OD-45 min处理组(42.60 min、6.31 h),新鲜组样品耗时最长(50.46 min、8.35 h)。这可能是由于渗透脱水降低了物料的水分含量,从而显著降低了冷冻干燥时间。由之前的预实验得出OD-120 min处理组与UOD-45 min处理组样品的水分含量没有显著差异(p<0.05),且显著低于OD-45 min处理组和新鲜组;而相比于UOD-45 min处理组,OD-120 min处理组样品由于渗透时间过长,会造成细胞的破损[20],使双孢蘑菇皱缩,体积变小,从而导致OD-120 min处理组在冷冻和冷冻干燥过程中耗时最短。
2.3 不同渗透处理对冷冻干燥双孢蘑菇色泽、平均体积密度和复水比的影响

表2 不同渗透处理对冷冻干燥双孢蘑菇色泽、平均体积密度和复水比的影响Table 2 Effect of different osmotic pretreatment on L, a and b values,rehydration ratio and average density of freeze-dried Agaricus bisporus
从表2可知,新鲜组冻干样品的L值(93.70)显著高于其他渗透处理组(p<0.05);其中,UOD-45 min处理组(91.27)和OD-45 min处理组(91.63)的L值没有显著差异(P>0.05),但均显著高于OD-120 min处理组(87.90)(p<0.05)。然而,不同处理组样品的b值与L值呈相反的趋势;此外,UOD-45 min和OD-45 min处理组冻干样品a值与新鲜组没有显著差异(P>0.05),但均显著小于OD-120 min处理组(p<0.05)。这可能是由于渗透作用导致细胞破损,加速了褐变[21],从而导致L值下降,a值、b值上升,而OD-120 min处理组渗透时间最长,其得到的冻干样品的L值、a值和b值与新鲜组冻干样品相比变化最大。
OD-120 min处理组的冻干样品的平均体积密度(0.32 g/mL)显著大于其他3 组冻干样品(p<0.05),这可能是在质量分数50%的蔗糖渗透液中,长时间渗透导致双孢蘑菇细胞结构破损严重,致使冷冻干燥后体积皱缩,所以平均体积密度大;此外,新鲜组(0.16 g/mL)和OD-45 min处理组(0.17 g/mL)冻干样品平均体积密度没有显著差异(P>0.05),但显著小于UOD-45 min处理组(p<0.05)。这可能是由于超声效应提高了物质交换效率,超声渗透处理组固形物增加速率大,使在相同渗透时间下,UOD-45 min处理组固形物积累量大于OD-45 min处理组,所以UOD-45 min处理组冻干样品平均体积密度大[22]。而通过复水比的结果来看,UOD-45 min处理组的样品复水比(2.82)显著高于其他3 组冻干样品(p<0.05),这可能是超声的“空穴效应”导致植物组织上形成许多微小的孔道[23],这不仅可以增加渗透过程物质交换的效率,同时在复水过程中,水分子亦可以通过微小孔道进入细胞,加速复水过程。而新鲜组、OD-45 min、OD-120 min处理组冻干样品复水比没有显著差异(P>0.05),这说明普通渗透并未影响冻干产品的复水比。
2.4 不同渗透处理对冷冻干燥双孢蘑菇微观结构的影响
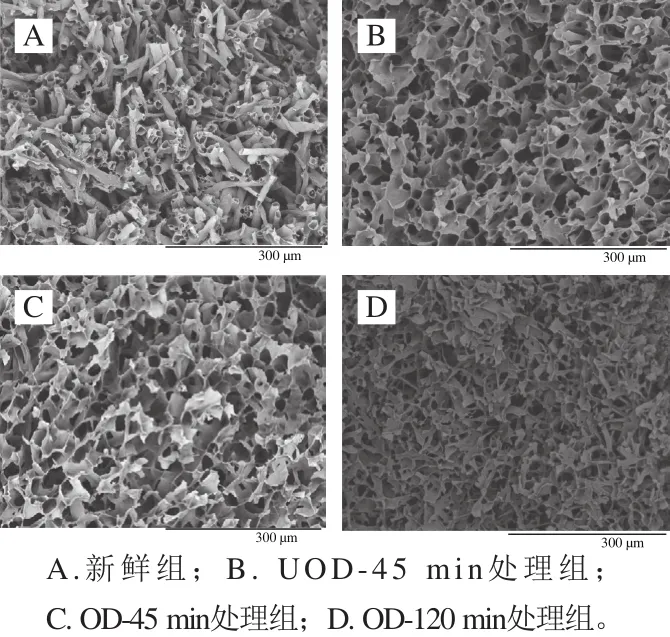
图2 不同渗透处理对冷冻干燥双孢蘑菇超微结构的影响(×300)Fig. 2 Effects of different osmotic pretreatment on scanning electron micrograph of freeze-dried Agaricus bisporus (× 300)
从图2明显看出,新鲜组冻干样品具有更加完整的疏孔结构,而渗透脱水组的冻干样品疏孔结构出现了一定的破损,这说明了渗透脱水过程对双孢蘑菇孔状结构会造成一定的损伤,这可能是在所使用的蔗糖渗透溶液中,双孢蘑菇细胞膜两侧渗透压过大,细胞结构发生了坍塌现象。除新鲜组之外,OD-45 min处理组和UOD-45 min处理组的冻干样品内部孔状结构较为相似,OD-120 min处理组的内部结构坍塌最严重,这与Fernandes等[24]研究结果相似;同时由预实验结果得知,UOD-45 min处理组与OD-120 min处理组冻干样品水分含量没有显著性差异,这说明超声的“海绵效应”不仅有利于水分传递,而且对细胞造成的破坏很小[25]。同时在质量分数50%蔗糖渗透液中,渗透时间越长,双孢蘑菇细胞结构坍塌越严重,导致OD-120 min处理组孔状结构最差。
2.5 不同渗透处理对冷冻干燥双孢蘑菇质构特性的影响

表3 不同渗透处理对冷冻干燥双孢蘑菇质构特性的影响Table 3 Effects of different osmotic pretreatments on texture properties of freeze-dried Agaricus bisporus
由表3可知,新鲜组冻干样品的硬度(280.04 g)显著小于其他渗透组(p<0.05),这与Zou Kejian等[26]的实验结果相似。这可能是由于溶质(蔗糖)大量进入双孢蘑菇内部后,与水分子交互作用,造成孔隙度降低、组织结构变硬,从而导致渗透处理组冻干样品硬度显著大于新鲜组样品[27]。此外,随着干燥的进行,双孢蘑菇的水分含量逐渐减少,蔗糖含量逐渐增加,直至结晶析出,最后在双孢蘑菇表面形成致密的晶体结构,这也可能造成硬度的上升。除此之外,3 个渗透处理组样品相互之间的硬度都存在显著差异(p<0.05),其中UOD-45 min处理组(441.76 g)最大,OD-45 min处理组(403.23 g)次之,OD-120 min处理组(332.50 g)最低。这可能是相比于OD-45 min处理组,超声渗透的“空穴效应”有利于UOD-45 min处理组渗透成分的交换,导致UOD-45 min处理组的固形物增量大于OD-45 min处理组;而OD-120 min处理组可能是由于在渗透液中渗透时间过长,细胞结构破损,从而导致硬度的下降。由于距离与脆度数值成反比,通过脆度的结果来看,新鲜组冻干样品的脆度(0.83 mm)最低,UOD-45 min处理组(0.28 mm)和OD-45 min处理组(0.28 mm)次之,OD-120 min处理组(0.13 mm)最高。其中UOD-45 min处理组和OD-45 min处理组的脆度没有显著差异(P>0.0 5),但显著小于O D-1 2 0 m i n处理组(p<0.05),且显著大于新鲜组样品(p<0.05),这可能是固形物的增加导致冻干样品结构变坚固以及弹性损失,造成渗透处理组冻干样品脆度大于新鲜组[27]。
2.6 不同渗透处理对冷冻干燥双孢蘑菇营养品质的影响
由表4可知,新鲜组的总糖含量(309.17 mg/g)显著低于其他渗透组(p<0.05)。这是由于在渗透过程中,由于细胞膜内外渗透压差,蔗糖会进入到样品细胞中,进而渗透脱水处理组冻干样品的总糖含量上升。UOD-45 min处理组冻干样品的总糖含量(415.17 mg/g)显著低于OD-120 min处理组(436.86 mg/g)(p<0.05),但是显著高于OD-45 min处理组(397.22 mg/g)(p<0.05)。这可能是超声的“海绵效应”促进了物质交换,加快了蔗糖传递速率,因此在相同的时间下,UOD-45 min处理组的冻干样品总糖含量大于OD-45 min处理组[28];而OD-120 min处理组冻干样品总糖含量显著大于UOD-45 min处理组和OD-45 min处理组(p<0.05),这是因为其渗透时间要远长于其他两组,固形物增加量也更大。

表4 不同渗透处理对冷冻干燥双孢蘑菇营养品质的影响Table 4 Effects of different osmotic pretreatments on nutritional quality of freeze-dried Agaricus bisporus
新鲜组冻干样品的可滴定酸、总蛋白质以及总酚含量均显著高于渗透脱水处理组(p<0.05)。UOD-45 min处理组的可滴定酸、总蛋白质以及总酚含量与OD-45 min处理组没有显著差异(P>0.05),但均显著高于OD-120 min处理组。这可能是由于渗透脱水过程中物质交换,导致部分可滴定酸、总蛋白质以及酚类物质在渗透脱水过程中流失[29];尽管超声会引起细胞壁上形成许多微小的孔道,加速物质的传递,但由于可滴定酸、总蛋白质以及酚类等物质的分子质量大,不利于其通过微小的孔道[30],从而导致UOD-45 min处理组和OD-45 min处理组的冻干样品可滴定酸、总蛋白质以及总酚含量大于OD-120 min处理组冻干样品。
3 结 论
综上所述,超声辅助渗透处理相比于未渗透处理组的预冻时间缩短了21.24%,干燥时间缩短了28.62%。与OD-120 min处理组冻干样品相比,UOD-45 min处理组冻干样品的色泽更接近新鲜组样品。同时,UOD-45 min处理组冻干样品的复水比(2.82)与硬度(441.76 g)最大,脆度显著大于新鲜组冻干样品,且UOD-45 min处理组冻干样品微观结构更接近新鲜组的冻干样品。此外,UOD-45 min处理组冻干样品可滴定酸、总蛋白质以及总酚类营养物质保留效果显著高于OD-120 min处理组。因此,UOD-45 min处理对双孢蘑菇的干燥效率和干燥品质起到了显著提升效果。该研究为超声辅助渗透前处理冷冻干燥进一步工业化应用以及深度开发提供了理论依据。
[1] WALTON K, WALKER R, IOANNIDES C. Effect of baking and freeze-drying on the direct and indirect mutagenicity of extracts from the edible mushroom Agaricus bisporus[J]. Food and Chemical Toxicology, 1998, 36(4): 315-320. DOI:10.1016/S0278-6915(97)00161-0.
[2] MATTILA P, KÖNKÖ K, EUROLA M, et al. Contents of vitamins,mineral elements, and some phenolic compounds in cultivated mushrooms[J]. Journal of Agricultural and Food Chemistry, 2001,49(5): 2343-2348. DOI:10.1021/jf001525d.
[3] JIANG T J, ZHENG X L, LI J R, et al. Integrated application of nitric oxide and modif i ed atmosphere packaging to improve quality retention of button mushroom (Agaricus bisporus)[J]. Food Chemistry, 2011,126(4): 1693-1699. DOI:10.1016/j.foodchem.2010.12.060.
[4] 季阿敏, 杨梅梅, 张庆钢, 等. 真空冷冻干燥工艺中沙棘果共晶点测定与分析[J]. 哈尔滨商业大学学报(自然科学版), 2008, 24(6): 752-754.
[5] 刘玉环, 刘志芳, 王治江, 等. 不同干燥方式对双孢蘑菇干制品质量的影响[J]. 食品科技, 2011, 36(10): 71-74; 78.
[6] 黄劲松, 杜先锋, 董明, 等. 干燥方式对双孢蘑菇品质影响的研究[J].食品工业科技, 2007(1): 113-114; 131.
[7] 黄凡, 刘莹, 张晶晶, 等. 热风干燥制作双孢蘑菇粉工艺[J]. 食品科学, 2013, 34(10): 58-61.
[8] VODA A, HOMAN N, WITEK M, et al. The impact of freeze-drying on microstructure and rehydration properties of carrot[J]. Food Research International, 2012, 49(2): 687-693. DOI:10.1016/j.foodres.2012.08.019.
[9] RASTOGI N K, RAGHAVARAO K S M S, NIRANJAN K, et al.Recent developments in osmotic dehydration: methods to enhance mass transfer[J]. Trends in Food Science & Technology, 2002, 13(2):48-59. DOI:10.1016/S0924-2244(02)00032-8.
[10] STOJANOVIC J, SILVA J L. Influence of osmotic concentration,continuous high frequency ultrasound and dehydration on antioxidants, colour and chemical properties of rabbiteye blueberries[J]. Food Chemistry, 2007, 101(3): 898-906. DOI:10.1016/j.foodchem.2006.02.044.
[11] CÁRCEL J A, BENEDITO J, ROSSELLÓ C, et al. Influence of ultrasound intensity on mass transfer in apple immersed in a sucrose solution[J]. Journal of Food Engineering, 2007, 78(2): 472-479.DOI:10.1016/j.jfoodeng.2005.10.018.
[12] AZOUBEL P M, DA ROCHA AMORIMM, OLIVEIRA S S B, et al.Improvement of water transport and carotenoid retention during drying of papaya by applying ultrasonic osmotic pretreatment[J]. Food Engineering Reviews, 2015, 7(2): 185-192. DOI:10.1007/s12393-015-9120-4.
[13] DEHGHANNYA J, GORBANI R, GHANBARZADEH B. Effect of ultrasound-assisted osmotic dehydration pretreatment on drying kinetics and effective moisture diffusivity of mirabelle plum[J].Journal of Food Processing and Preservation, 2015, 39(6): 2710-2717.DOI:10.1111/jfpp.12521.
[14] AMAMI E, KHEZAMI W, MEZRIGUI S, et al. Effect of ultrasoundassisted osmotic dehydration pretreatment on the convective drying of strawberry[J]. Ultrasonics Sonochemistry, 2016, 36: 286.DOI:10.1016/j.ultsonch.2016.12.007.
[15] DOYMAZ I. Effect of citric acid and blanching pre-treatments on drying and rehydration of amasya red apples[J]. Food and Bioproducts Processing, 2010, 88(2/3): 124-132. DOI:10.1016/j.fbp.2009.09.003.
[16] 李翠丽, 冀晓龙, 许芳溢, 等. 干燥方式对梨枣粉品质特性的影响[J].中国食品学报, 2014, 14(12): 121-127.
[17] 李晓英. 真空冷冻干燥工艺中茶树菇共晶点共融点的测定[J]. 食品研究与开发, 2013, 34(14): 88-90.
[18] 赵金红. 渗透脱水-冻结与玻璃化贮藏对芒果品质的影响及动力学模拟[D]. 北京: 中国农业大学, 2014: 19.
[19] 赵金红, 胡锐, 刘冰, 等. 渗透脱水前处理对芒果冻结速率和品质的影响[J]. 农业机械学报, 2014, 45(2): 220-227.
[20] DENG Y, ZHAO Y Y. Effects of pulsed-vacuum and ultrasound on the osmodehydration kinetics and microstructure of apples (Fuji)[J].Journal of Food Engineering, 2008, 85(1): 84-93. DOI:10.1016/j.jfoodeng.2007.07.016.
[21] RINCON A, KERR W L. Inf l uence of osmotic dehydration, ripeness and frozen storage on physicochemical properties of mango[J].Journal of Food Processing and Preservation, 2010, 34(5): 887-903.DOI:10.1111/j.1745-4549.2009.00404.x.
[22] 董红星, 相玉琳, 王树盛, 等. 超声场强化胡萝卜渗透脱水质量传递的研究[J]. 农产品加工(学刊), 2007(5): 35-38.
[23] RODRIGUES S, FERNANDES F A N. Use of ultrasound as pretreatment for dehydration of melons[J]. Drying Technology, 2007,25(10): 1791-1796. DOI:10.1080/07373930701595409.
[24] FERNANDES F A N, GALLÃO M I, RODRIGUES S. Effect of osmotic dehydration and ultrasound pre-treatment on cell structure:melon dehydration[J]. LWT-Food Science and Technology, 2008,41(4): 604-610. DOI:10.1016/j.lwt.2007.05.007.
[25] ZDUNEK A, BEDNARCZYK J. Effect of mannitol treatment on ultrasound emission during texture profile analysis of potato and apple tissue[J]. Journal of Texture Studies, 2006, 37(3): 339-359.DOI:10.1111/j.1745-4603.2006.00055.x.
[26] ZOU Kejian, TENG Jianwen, HUANG Li, et al. Effect of osmotic pretreatment on quality of mango chips by explosion puffing drying[J]. LWT-Food Science and Technology, 2013, 51(1): 253-259.DOI:10.1016/j.lwt.2012.11.005.
[27] 张鹏飞. 桃片渗透脱水及联合干燥技术研究[D]. 北京: 中国农业科学院, 2016: 13.
[28] NOWACKA M, TYLEWICZ U, LAGHI L, et al. Effect of ultrasound treatment on the water state in kiwifruit during osmotic dehydration[J]. Food Chemistry, 2014, 144(2): 18-25. DOI:10.1016/j.foodchem.2013.05.129.
[29] LENART A. Osmo-convective drying of fruits and vegetables:technology and application[J]. Drying Technology, 1996, 14(2): 391-413. DOI:10.1080/07373939608917104.
[30] FERNANDES F A N, RODRIGUES S. Application of ultrasound and ultrasound-assisted osmotic dehydration in drying of fruits[J]. Drying Technology, 2008, 26(12): 1509-1516.DOI:10.1080/07373930802412256.
Effect of Ultrasound-Assisted Osmotic Pretreatment on Freeze-Drying Eff i ciency and Quality of Agaricus bisporus
CHEN Lifu, PEI Fei, ZHANG Liming, ZHANG Rongjie, LI Jing, FANG Yong, HU Qiuhui*
(Key Laboratory of Grains and Oils Quality Control and Processing, Collaborative Innovation Center for Modern Grain Circulation and Safety,College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
In order to produce high-quality freeze-dried products and simultaneously reduce energy consumption for cost saving during the freeze drying process, the effect of osmotic dehydration (OD) and ultrasound-assisted osmotic dehydration(UOD) pretreatment on the eutectic point, melting point and temperature of Agaricus bisporus during freezing and freeze-drying and the texture, microstructure, color and nutritional quality of freeze-dried product were investigated. The results showed that 45 min UOD treatment, compared to the fresh treatment, reduced freezing time by 21.24% and freezedrying time by 28.62%. Moreover, this treatment retained more titratable acids, proteins and polyphenols than did 120 min OD treatment. Meanwhile, the hardness and rehydration ratio of 45 min UOD treatment were higher than those of 120 min OD treatment, and its microstructure was more similar to that of fresh samples.
Agaricus bisporus; ultrasound-assisted osmotic pretreatment; freeze-drying; nutrition quality; microstructure
10.7506/spkx1002-6630-201723002
TS255.1
A
1002-6630(2017)23-0008-06
陈立夫, 裴斐, 张里明, 等. 超声辅助渗透处理对冷冻干燥双孢蘑菇冻干效率和品质的影响[J]. 食品科学, 2017, 38(23):8-13.
10.7506/spkx1002-6630-201723002. http://www.spkx.net.cn
CHEN Lifu, PEI Fei, ZHANG Liming, et al. Effect of ultrasound-assisted osmotic pretreatment on freeze-drying eff i ciency and quality of Agaricus bisporus[J]. Food Science, 2017, 38(23): 8-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723002. http://www.spkx.net.cn
2017-06-07
国家自然科学基金青年科学基金项目(31601482);江苏省自然科学基金青年基金项目(BK20150986);江苏省高校自然科学研究面上项目(15KJB550007);江苏高校优势学科建设工程资助项目(PAPD)
陈立夫(1992—),男,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:clf051050@163.com
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为食品营养与化学。E-mail:qiuhuihu@njue.edu.cn
