磁共振波谱及扩散加权成像在糖尿病患者脑损伤评估中的应用
2017-12-11黄晶晶陈爱华赵云
黄晶晶,陈爱华,赵云
(1三峡大学医学院,湖北宜昌443002;2宜昌市第一人民医院)
磁共振波谱及扩散加权成像在糖尿病患者脑损伤评估中的应用
黄晶晶1,陈爱华2,赵云1
(1三峡大学医学院,湖北宜昌443002;2宜昌市第一人民医院)
目的探讨磁共振波谱(MRS)及扩散加权成像(DWI)评估糖尿病患者脑损伤的价值。方法选择单纯2型糖尿病患者30例(糖尿病组)及同期体检健康者30例(对照组),均行3.0T MR常规扫描及MRS、DWI,测量双侧半卵圆中心的ADC值、eADC值、N-乙酰天门冬氨酸与肌酸比值 (NAA/Cr)、胆碱复合物与肌酸比值(Cho/Cr)及N-乙酰天门冬氨酸与胆碱复合物比值(NAA/Cho),并分析糖尿病组各指标的相关性。结果糖尿病组双侧半卵圆中心ADC值、左侧半卵圆中心Cho/Cr均高于对照组,双侧半卵圆中心eADC值、NAA/Cr与NAA/Cho均低于对照组(P均<0.05)。两组右侧半卵圆中心Cho/Cr比较无统计学差异(P>0.05)。糖尿病组双侧半卵圆中心ADC值、eADC值与NAA/Cr、Cho/Cr、NAA/Cho均无显著相关性(P均>0.05)。结论MRS及DWI 可有效显示糖尿病患者脑部功能区的代谢状况及脑组织水分子改变,其相关参数改变可为糖尿病患者脑损伤评估提供量化依据。
糖尿病;磁共振波谱;扩散加权成像;脑白质;代谢
我国糖尿病发病率以每年0.1%的速度递增,预测2030年全球糖尿病发病率将超过4%[1]。国内研究调查显示,我国成人糖尿病发病率接近11.6%[2]。糖尿病患者容易发生脑血管疾病,其致残率及致死率均较高。磁共振成像(MRI)技术能发现脑部细微结构和功能改变,对早期发现并评估脑损伤具有重要意义。磁共振波谱(MRS)是测定活体内某一特定组织区域化学成分的惟一的无损伤技术,是在MRI基础上发展而来的新型功能分析诊断方法。扩散加权成像(DWI)是近年来兴起的一种功能成像技术,能从分子水平反映组织水分子变化,同时能够检测出与组织含水量有关的早期形态学和生理学改变。MRS及DWI检查可无创、敏感地显示早期脑白质微结构改变,但其在糖尿病患者脑损伤评估中的应用价值报道较少。为此,我们进行了如下研究。
1 资料与方法
1.1 临床资料 选择2016年3月~2017年3月宜昌市第一人民医院内分泌科收治的单纯2型糖尿病患者30例作为糖尿病组,男15例、女15例,年龄41~63岁,受教育年限9~12年,糖尿病病程2~10年。均符合2010年美国糖尿病学会(ADA)2型糖尿病诊断标准。排除标准:①合并影响认知功能的精神及神经疾病等;②肝、肾功能不全及冠心病、脑血管意外(脑出血或脑梗塞)、肿瘤、外伤、感染或有中枢神经系统障碍体征(失语、偏瘫、偏深感觉障碍)等;③酒精依赖以及其他精神疾病相关药物滥用;④糖尿病急性代谢并发症、曾有严重低血糖发作及酮症酸中毒;⑤左利手。选择同期体检健康者30例作为对照组,男15例、女15例,年龄41~63岁,受教育年限9~12年,均为右利手。两组性别、年龄和受教育年限均具有可比性。本研究通过伦理委员会审核,受试者均签署知情同意书。
1.2 MRS及DWI检查 使用GE 3.0T超导磁共振成像系统及配套8通道头颈线圈,扫描序列包括横轴位T1加权像、T2加权像、FLAIR序列、DWI序列及MRS序列。DWI序列扫描时间为56 s,TR=4 000 ms,TE=MIN,矩阵128×130,视野(FOV)=24×18,层厚5 mm,层间距0 mm,b值取1 000 s/mm2。MRS采集选用二维多体素点分析法(PRESS)序列,TR=1 000 ms,TE=144 ms,Phase16,NEX=1,采集次数128次,采集时间为5分28秒。扫描范围从枕骨大孔至颅顶。扫描后排除受试者头颅平扫图像上比较明显的结构及图像异常(如脑肿瘤、脑梗塞等),以及某些发育变异(如透明隔囊肿和大枕大池等),还有其他原因造成的不同程度的伪影。 图像处理: 将数据传至AW4.6后处理工作站Functool 9.4.05,感兴趣区(ROI)在DWI序列横轴位进行定位,所选层面为侧脑室上方半卵圆中心层面,选取ROI为2个对称性区域,均为方形,大小56.3 mm2。所有ROI设置由一名有经验的放射科医师独立进行,取平均值后进一步分析,分别得出左、右侧半卵圆中心的N-乙酰天门冬氨酸与肌酸比值 (NAA/Cr)、胆碱复合物与肌酸比值(Cho/Cr)及N-乙酰天门冬氨酸与胆碱复合物比值(NAA/Cho)。在同一后处理工作站,由同一名医师设置ROI测量,选取的ROI尽可能与MRS选取的面积大小、位置一致,测得ADC值、eADC值。
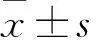
2 结果
2.1 两组双侧半卵圆中心MRS及DWI相关指标比较 见表1。
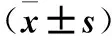
表1 两组双侧半卵圆中心MRS及DWI相关指标比较
注:与对照组比较,*P<0.05。
2.2 MRS及DWI指标的关系 糖尿病组双侧半卵圆中心ADC值、eADC值与NAA/Cr、Cho/Cr、NAA/Cho均无显著相关性(P均>0.05)。
3 讨论
糖尿病患者易发生脑血管疾病的机制可能为:①慢性持续性高血糖使线粒体产生大量活性氧(ROS),其所诱导的氧化应激反应导致线粒体功能受损[3]和中枢神经细胞凋亡[4];高血糖导致血管内皮功能和血小板功能障碍,血液黏稠度增加,血管变狭窄、甚至阻塞,最终发展为腔隙性脑梗死或脑卒中[5]。②长时间缺乏胰岛素使得神经纤维发生脱髓鞘改变。③胆固醇代谢异常使突触和神经元功能受损,从而发生神经系统退行性改变[6]。④糖尿病患者脑组织内β淀粉样蛋白(Aβ)沉积和异常过度磷酸化的干数管结合蛋白(Tau)增多;Aβ沉积可引起炎性因子激活,神经元缺损,导致中枢整合功能异常;Tau异常过度磷酸化后,与微管结合能力降低,导致微管结构易被破坏,引起突触丢失,神经元功能受损[7]。陈志晔等[8]DWI分析结果显示,2型糖尿病患者双侧大脑局部脑实质ADC值均升高,认为糖尿病脑皮层改变与灰质内髓鞘、神经突触和胰岛素受体功能缺失有关。相关研究表明,脑皮层ADC值升高反映脱髓鞘和轴突损失[9]。eADC值即指数化表观弥散系数,与ADC值呈负相关,其可消除“T2透射效应”的干扰,较ADC值更为准确。本研究结果发现,糖尿病患者双侧半卵圆中心ADC值均明显高于对照组,eADC值均明显低于对照组。推测糖尿病患者存在代谢异常,导致突触和神经元功能受损,突触数量减少,细胞内间隙扩大,水分子扩散能力增强。
在MRS检查中所显示的NAA峰是正常脑组织第一大峰,仅存在于神经元内,是神经元存活的标志。Cho可反映细胞膜的代谢状况和神经胶质细胞增殖情况;Cr值一般比较稳定,常作为其他代谢产物信号强度的参照物。本研究结果显示,糖尿病组左侧半卵圆中心Cho/Cr高于对照组,双侧半卵圆中心NAA/Cr、NAA/Cho均低于对照组,说明糖尿病患者双侧半卵圆中心均存在神经元缺失,神经细胞功能及代谢障碍。Sinha等[10]MRS分析显示,糖尿病患者右侧额叶和右侧顶-枕区NAA曲线下面积明显低于对照组。Lin等[11]研究发现,糖尿病患者豆状核NAA/Cr减小,Cho/Cr增大。Brundel等[12]研究发现,糖尿病患者双侧海马及顶叶白质等部位NAA/Cr下降。以上研究均表明,糖尿病患者部分脑区神经元功能受损。另外有研究显示,在糖尿病患者脑结构发生变化之前,可测得海马及额叶等特定部位代谢产物值变化,提示糖尿病早期存在部分神经元缺失和功能障碍[13]。徐丽娟等[14]研究发现,MRS对糖尿病酮症酸中毒早期患者出现的脑损害具有较高的诊断价值。因此,检测代谢物质在大脑内的含量变化可以提供常规MRI不能获得的病变脑区的生化信息,是常规成像的补充,有助于判断大脑损伤程度及治疗后的转归情况。本研究相关性分析发现,糖尿病组双侧半卵圆中心ADC值、eADC值与NAA/Cr、Cho/Cr、NAA/Cho均无显著相关性,表明MRS及DWI两种检查的相关指标在糖尿病患者脑损伤评估中并无相关性。
综上所述,MRS、DWI能够发现糖尿病患者脑部功能区的代谢状况及脑组织水分子改变,其相关参数改变可为糖尿病脑损伤诊断提供客观的量化依据。本研究在MRS的基础上进行改进,在DWI轴位图像上进行定位,使后处理可在同一扫描层面上进行;同时采用了多体素扫描,不仅提高了测量结果的准确性,并且可同步观察糖尿病患者双侧半卵圆中心ADC值、eADC值及脑内代谢产物变化。但本研究也存在一定的局限性:①样本量较小且手动勾画ROI,存在一定的误差;②测量部位只局限在半卵圆中心;③分析手段有限。随着MRI技术的不断发展,未来将测量多个部位的ADC值、eADC值及脑内代谢产物,以对糖尿病脑损伤进行更深入、全面研究。
[1] Wild S, Togile G, Green A, et al. Global prevalence of diabetes [J] . Diabetes Care, 2004,27(5):1047-1053.
[2] Ning G, Bloomgatden Z. Diabetes in China: prevalence, diagnosis, and control[J]. J Diabetes, 2013,5(1):372-372.
[3] Liu X, Xiao Q, Zhao K, et al. Ghrelin inhibits high glucose-induced PC12 cell apoptosis by regulating TLR4/NF-κB pathway[J]. Inflammation, 2013,36(6):1286-1294.
[4] Kamchatnov PR, Chugunov AV, Basse DA, et al. Peculiarities of the course of ischemic stroke in patients with diabetes mellitus type 2[J]. Zh Nevrol Psikhiatr Im S S Korsakova, 2009,109(10Suppl 2):15-18.
[5] Cougnard-Grégoire A, Delyfer MN, Korobelnik JF, et al. Elevated high-density lipoprotein cholesterol and age-related macular degeneration: the Alienor study[J]. PLoS One, 2014,9(3):e90973.
[6] Ittner LM, Gatz J. Amyloid-β and tau--a toxic pas de deux in Alzheimer′s disease[J]. Nat Rev Neurosci, 2011,12(2):65-72.
[7] Okada K, Kotani K, Yagyu H, et al. Effects of treatment with liraglutide on oxidative stress and cardiac natriuretic peptide levels in patients with type 2 diabetes mellitus [J]. Endocrine, 2014,47(3):962-964.
[8] 陈志晔,李金锋,孙杰,等.2型糖尿病患者大脑皮层变薄及胰岛素治疗恢复观察[J].中华医学杂志,2013,9(3):1313-1317.
[9] 王倩,徐基磐,伍建林,等.扩散张量成量成像评价2型糖尿病兔模型认知功能相关脑区白质微结构变化[J].中国医学影像技术,2013,29(9):1423-1426.
[10] Sinha S, Ekka M, Sharma U, et al. Assessment of changes in brain metabolites in Indian patients with type-2 diabetes mellitus using proton magnetic resonance spectroscopy[J]. BMC Res Notes, 2014,17(7):41.
[11] Lin Y, Zhou J, Sha L, et al. Metabolite differences in the lenticular nucleus in type 2 diabetes mellitus shown by proton MR spectroscopy[J]. AJNR Am J Neuroradiol,2013,34(9):1692-1696.
[12] Brundel M, Kappelle LJ, Biessels GJ. Brain imaging in type 2 diabetes[J]. Eur Neuropsychopharmacol, 2014,24(12):1967-1981.
[13] 李渊灵,王悦,徐晓云,等.2型糖尿病患者记忆功能及相关脑区代谢的改变[J].临床神经病学杂志,2013,26(3):173-176.
[14] 徐丽娟,杨义.功能磁共振成像在糖尿病脑部代谢异常中的应用研究[J].糖尿病新世界,2015,68(9):130-131.
赵云(E-mail: Zhaoyun@ctgu.edu.cn)
10.3969/j.issn.1002-266X.2017.44.027
R587.1
B
1002-266X(2017)44-0083-03
2017-03-13)
