非小细胞肺癌组织miR-564表达变化及其与患者临床病理参数和预后的关系
2017-12-11杨颖谕张李红罗贤勇张建坤李生强庞国莲钱玉莲
杨颖谕,张李红,罗贤勇,张建坤,李生强,庞国莲,钱玉莲
(曲靖市第一人民医院,云南曲靖655000)
非小细胞肺癌组织miR-564表达变化及其与患者临床病理参数和预后的关系
杨颖谕,张李红,罗贤勇,张建坤,李生强,庞国莲,钱玉莲
(曲靖市第一人民医院,云南曲靖655000)
目的探讨微小RNA-564(miR-564)在非小细胞肺癌(NSCLC)发生、发展中的作用。方法选择NSCLC患者43例,取手术切除的癌组织及其癌旁正常组织,采用qRT-PCR法检测两种组织中miR-564表达,并分析miR-564表达与患者临床病理参数和预后的关系。结果NSCLC组织miR-564相对表达量为12.43±3.17,癌旁正常组织为21.76±4.49,二者比较P<0.01。以NSCLC组织miR-564相对表达量的平均值为截断值,将患者分为miR-564低表达者21例、miR-564高表达者22例。miR-564表达与患者TNM分期、淋巴结转移有关(P均<0.05),与性别、年龄、吸烟、组织类型、组织分化程度无关(P均>0.05)。miR-564高表达者总生存期为(40±28)个月、无病生存期为(42±25)个月,miR-564低表达者分别为(38±25)、(40±23)个月;二者比较P均<0.05。结论NSCLC组织miR-564表达下调,其表达变化与肿瘤进展和患者预后有关。
非小细胞肺癌;微小RNA-564;细胞增殖
非小细胞肺癌(NSCLC)是肺癌最常见的组织学类型,占肺癌总数的80%~85%[1]。尽管各种新兴技术不断用于治疗NSCLC,但患者5年生存率仍然不超过15%[2]。刘月姣等[3]研究认为,肿瘤侵袭和转移与NSCLC患者预后差密切相关。因此,探寻敏感特异的肿瘤分子生物学标志物对NSCLC早期诊断和预后评估意义重大。微小RNA(miRNA)是一类长度为21~25个核苷酸的内源性非编码小分子单链RNA,广泛存在于多种生物体内。既往研究证实,某些miRNA在人类恶性肿瘤组织中异常表达,并通过调控一系列基因表达发挥癌基因或抑癌基因作用。miR-564是近年新发现的一种miRNA,有研究发现,在胃癌细胞中miR-564通过与其靶基因结合,发挥类似抑癌基因作用[4]。但目前关于miR-564表达与NSCLC的关系鲜见报道。本研究观察了NSCLC组织miR-564表达变化,并分析其与患者临床病理参数及预后的关系。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2011年6月~2012年8月曲靖市第一人民医院收治的初诊NSCLC患者43例。所有患者符合美国癌症联合委员会和国际抗癌联盟2010年制定的NSCLC诊断与分期标准[5],并经术后病理检查明确诊断。排除术前接受放疗、化疗或其他抗癌治疗者,合并间质性肺炎等其他肺部疾病者,妊娠期或哺乳期患者。其中,男28例、女15例,年龄(57±13)岁,有吸烟史25例;组织类型:鳞癌19例、腺癌24例,TNM分期:Ⅰ、Ⅱ期21例,Ⅲ、Ⅳ期22例;组织分化程度:低、中分化25例,高分化18例;有淋巴结转移16例,无淋巴结转移27例。本研究经曲靖市第一人民医院医学伦理委员会批准,患者均知情同意。
1.2 miR-564表达检测 采用qRT-PCR法。取手术切除的NSCLC组织及其配对的癌旁正常组织(距癌组织边缘>3 cm,并经病理检查确认),采用TRIzol法提取各组织总RNA,采用Nanodrop2000超微量分光光度计鉴定总RNA的浓度和纯度合格。根据miR-564的反转录引物5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGCA-TT-3′进行反转录,取反转录产物进行PCR扩增。所有引物由上海英骏生物技术有限公司设计合成。引物序列:miR-564上游引物:5′-AAGGGGGCTATGGAAAGGCAA-3′,下游引物: 5′-AATCCACGATGAA-GGGATGCT-3′;内参U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATT-TGC-3′。PCR反应体系共20 μL:5×loading buffer 5 μL、MgCl21 μL、dNTP 0.5 μL、上下游引物各1 μL、模板2 μL、Tag酶0.125 μL,灭菌水补至20 μL。PCR反应条件:95 ℃预变性30 s,95 ℃变性10 s、60 ℃延伸40 s,共35个循环,最后74 ℃延伸5 min。以U6为内参,采用2-ΔΔCt法计算miR-564相对表达量。实验重复3次,取平均值。比较NSCLC组织及癌旁正常组织miR-564相对表达量。以NSCLC组织miR-564相对表达量的平均值为截断值,将NSCLC患者分为miR-564低表达者和高表达者,分析NSCLC组织miR-564表达与患者临床病理参数的关系。
1.3 随访方法 通过电话、信件或门诊等方式进行随访,随访截至2017年2月18日,失访12例。统计NSCLC患者总生存期(OS)、无病生存期(DFS)。DFS是指从随机化临床试验开始至疾病复发或因任何原因导致死亡的时间。OS是指从随机化临床试验开始至任何原因引起患者死亡的时间。
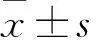
2 结果
2.1 NSCLC组织及癌旁正常组织miR-564表达比较 NSCLC组织miR-564相对表达量为12.43±3.17,癌旁正常组织为21.76±4.49;二者比较P<0.01。
2.2 NSCLC组织miR-564表达与患者临床病理参数的关系 miR-564低表达者21例,高表达者22例。NSCLC组织miR-564表达与患者临床病理参数的关系见表1。
2.3 NSCLC组织miR-564表达与患者预后的关系 NSCLC患者miR-564高表达者OS为(40±28)个月、DFS为(42±25)个月,miR-564低表达者分别为(38±25)、(40±23)个月;二者比较P均<0.05。见图1。
3 讨论
研究发现,miRNA主要通过与其靶基因mRNA的3′-UTR端互补结合降解mRNA或抑制mRNA翻译,从而阻遏基因表达,参与机体的多种生物学行为,如早期发育、细胞增殖、细胞凋亡等[6,7]。miRNA表达异常与恶性肿瘤关系密切,如miR-16在肺癌细胞中表达下调,通过将细胞阻滞于G0/G1期而发挥类似抑癌基因作用[8];miR-21在NSCLC细胞中表达上调,并能促进肿瘤细胞侵袭和迁移,具有癌基因作用[9]。与其他类型肿瘤生物学标志物比较,miRNA具有稳定性好、敏感性和特异性均较高等优点,故其在肿瘤的早期诊断、病情预测、预后评估等方面具有潜在的临床应用价值。

表1 NSCLC组织miR-564表达与患者临床病理参数的关系

注:A为NSCLC组织不同miR-564表达者OS比较;B为NSCLC组织不同miR-564表达者DFS比较。
图1NSCLC组织miR-564表达与患者预后的关系
miR-564是近年新发现的一种miRNA,正常情况下主要表达于内皮细胞。近年研究发现,miR-564在恶性肿瘤的发生、进展中扮演重要角色。现已证实,miR-564在乳腺癌、胃癌、结肠癌等组织中表达下调,并与肿瘤细胞的侵袭和迁移密切相关[10~13],具有类似抑癌基因的作用。推测miR-564有可能成为某些恶性肿瘤早期诊断和预后评估的分子生物学标志。目前关于miR-564的作用机制尚不完全清楚。Jiang等[14]研究发现,miR-564能抑制表皮生长因子受体(EGFR)和基质金属蛋白酶9(MMP-9)表达,继而抑制胶质母细胞瘤细胞增殖、侵袭和迁移,其作用机制可能与阻断TGF-β1信号通路有关。Rokah等[15]研究发现,慢性髓系白血病患者外周血miR-564低表达,其表达变化与病情进展密切相关;雷帕霉素靶蛋白、血管内皮生长因子、EGFR等可能均参与了miR-564介导的生物学过程。
本研究结果显示,NSCLC组织miR-564相对表达量明显低于癌旁正常组织,提示在NSCLC中miR-564可能具有抑癌基因作用。Mutlu等[11]研究发现,乳腺癌组织miR-564表达明显低于正常乳腺组织,并与血管浸润、临床分期、淋巴结转移、生存期和复发时间密切相关。本研究结果显示,miR-564低表达与NSCLC患者TNM分期、淋巴结转移有关,miR-564表达越低,TNM分期越高,淋巴结转移风险越大,与Chacolla-Huaringa等[16]研究结论基本一致。朱鹏冲等[17]研究认为,组织分化程度、TNM分期、淋巴结转移是预测NSCLC患者预后的独立因素,推测miR-564亦可能与NSCLC患者预后有关。为证实上述推测,本研究对NSCLC患者进行远期随访,结果发现NSCLC患者miR-564高表达者OS、DFS均较miR-564低表达者明显延长,说明miR-564表达变化与NSCLC患者预后有关。
综上所述,NSCLC组织miR-564表达下调,其表达变化与肿瘤进展和患者预后有关;miR-564有可能成为NSCLC早期诊断和预后评估的分子生物学标志之一。
[1] Grilley-Olson JE, Hayes DN, Moore DT, et al. Validation of interobserver agreement in lung cancer assessment: hematoxylin-eosin diagnostic reproducibility for non-small cell lung cancer: The 2004 World Health Organization classification and therapeutically relevant subsets[J]. Arch Pathol Lab Med, 2013,137(1):32-40.
[2] Jiang ZQ, Yang K, Komaki R, et al. Long-term clinical outcome of intensity-modulated radiotherapy for inoperable non-small cell lung cancer: The MD Anderson experience[J]. Int J Radiat Oncol Biol Phys, 2012,83(1):332-339.
[3] 刘月姣,李晓敏,武静,等.ⅢA(N2)期NSCLC术后预后因素分析[J].中华放射肿瘤学杂志,2016,25(10):1057-1061.
[4] Ohgino K, Soejima K, Yasuda H, et al. Expression of fibroblast growth factor 9 is associated with poor prognosis in patients with resected non-small cell lung cancer[J]. Lung Cancer, 2014,83(1):90-96.
[5] 刘裔莎,魏兵,杨雯娟,等.美国癌症联合会乳腺癌分期(第七版)简介[J].中华病理学杂志,2010,39(11):787-790.
[6] 范博,张亮,马驰,等.微小RNA与肿瘤发生的关系[J].中华肿瘤杂志,2012,34(6):401-404.
[7] 谢小缺,王华,顾康生.胃癌中长链非编码RNA和微小RNA的相关研究进展[J].安徽医科大学学报,2017,52(2):301-303.
[8] Ke Y, Zhao W, Xiong J, et al. Downregulation of miR-16 promotes growth and motility by targeting HDGF in non-small cell lung cancer cells[J]. FEBS Lett, 2013,587(18):3153-3157.
[9] Li B, Ren S, Li X, et al. MiR-21 overexpression is associated with acquired resistance of EGFR-TKI in non-small cell lung cancer[J]. Lung Cancer, 2014,83(2):146-153.
[10] Yang B, Jia L, Guo Q, et al. MiR-564 functions as a tumor suppressor in human lung cancer by targeting ZIC3[J]. Biochem Biophys Res Commun, 2015,467(4):690-696.
[11] Mutlu M, Saatci Ö, Ansari SA, et al. miR-564 acts as a dual inhibitor of PI3K and MAPK signaling networks and inhibits proliferation and invasion in breast cancer[J]. Sci Rep, 2016(6):32541.
[12] Guo Y, Qi Y, Guo A, et al. miR-564 is downregulated in gastric carcinoma and targets E2F3[J]. Oncol Lett, 2017,13(6):4155-4160.
[13] Chu S, Wang H, Yu M. A putative molecular network associated with colon cancer metastasis constructed from microarray data[J]. World J Surg Oncol, 2017,15(1):115.
[14] Jiang C, Shen F, Du J, et al. MicroRNA-564 is downregulated in glioblastoma and inhibited proliferation and invasion of glioblastoma cells by targeting TGF-β1[J]. Oncotarget, 2016,7(35):56200-56208.
[15] Rokah OH, Granot G, Ovcharenko A, et al. Downregulation of miR-31, miR-155, and miR-564 in chronic myeloid leukemia cells[J]. PLoS One, 2012,7(4):e35501.
[16] Chacolla-Huaringa R, Moreno-Cuevas J, Trevino V, et al. Entrainment of breast cell lines results in rhythmic fluctuations of MicroRNAs[J]. Int J Mol Sci, 2017,18(7):E1499.
[17] 朱鹏冲,孙志钢,肖伟,等.非小细胞肺癌患者手术后预后与信号转导和转录激活因子3的关系[J].中华实验外科杂志,2016,33(8):1910-1912.
张建坤(E-mail: zhangjianknu@163.com)
10.3969/j.issn.1002-266X.2017.44.025
R734.2
B
1002-266X(2017)44-0078-03
2017-08-08)
