肾癌组织miR-222、miR-122表达变化及其临床意义
2017-12-11蔡成宽支运来王鲲鹏涂传全杨文发孙方浒
蔡成宽,支运来,王鲲鹏,涂传全,杨文发,孙方浒
(连云港市第一人民医院,江苏连云港222002)
肾癌组织miR-222、miR-122表达变化及其临床意义
蔡成宽,支运来,王鲲鹏,涂传全,杨文发,孙方浒
(连云港市第一人民医院,江苏连云港222002)
目的探讨微小RNA-222(miR-222)、miR-122在肾癌发生、发展中的作用。方法选择肾癌患者72例,收集其术中切除的肾癌组织及其配对癌旁正常组织标本。采用实时荧光定量PCR法检测肾癌组织及其配对癌旁正常组织miR-222、miR-122表达,分析肾癌组织miR-222、miR-122表达与患者临床病理参数的关系及二者的相关性。结果肾癌组织及癌旁正常组织miR-222相对表达量分别为2.38±0.64、1.12±0.55,miR-122相对表达量分别为2.86±0.39、0.98±0.43;肾癌组织miR-222、miR-122相对表达量均高于癌旁正常组织(P均<0.01)。肾癌组织miR-222、miR-122表达与患者性别、年龄、病理类型、肿瘤直径均无关(P均>0.05),与患者病理分级、TNM分期、浸润深度、淋巴结转移均有关(P均<0.01)。肾癌组织miR-222、miR-122相对表达量呈正相关(r=0.517,P<0.05)。结论肾癌组织miR-222、miR-122表达均升高,二者可能协同促进肾癌的发生、发展;癌组织miR-222、miR-122表达变化有助于病情评估。
肾癌;微小RNA-222;微小RNA-122; 疾病进展
肾癌发病率在泌尿系统恶性肿瘤中仅次于膀胱癌,约占成人恶性肿瘤的2%[1,2]。肾癌的发病机制尚不完全清楚,目前临床上也无早期诊断肾癌以及评估病情严重程度的特异性指标。微小RNA(miRNA)是内源性非编码RNA分子,长度为19~25个核苷酸,通过与mRNA的3′-UTR区结合而降解靶mRNA或者抑制翻译过程,进而介导并调控基因表达,参与细胞增殖、分化及凋亡过程[3,4]。miR-222、miR-122是参与调控恶性肿瘤发生、发展过程的重要miRNA,在乳腺癌[5]、胃癌[6]、肝癌[7]等恶性肿瘤组织或者细胞中均呈异常高表达,但是其在肾癌组织中的表达变化鲜见报道。本研究观察了miR-222、miR-122在肾癌组织中的表达变化,并分析其与肾癌患者临床病理参数的关系,探讨其在肾癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择2014年1月~2016年12月于我院拟行手术治疗的肾癌患者72例,男45例,女27例;年龄38~79岁,平均62.7岁;均经术后病理检查证实诊断。组织类型:透明细胞癌58例,乳头状癌14例;肿瘤直径:<2.5 cm 37例,≥2.5 cm 37例;病理分级:G1级(高分化)31例,G2级(中分化)22例,G3级(低分化)19例;TNM分期[8]:Ⅰ、Ⅱ期39例,Ⅲ、Ⅳ期33例;浸润深度:T1、T2期20例,T3、T4期52例;淋巴结转移29例,无淋巴结转移43例。患者的临床资料均保存完整,手术前均未接受放、化疗以及其他可能影响本研究结果的抗肿瘤治疗方案。排除合并其他类型恶性肿瘤患者。收集患者术中切除的肾癌组织及其配对癌旁正常组织(距离癌组织边缘>5 cm)各72例份,迅速置于液氮中进行冷冻并保存于-80 ℃冰箱中。本研究通过医院伦理委员会审核,患者及家属均知情同意。
1.2 肾癌组织及其配对癌旁正常组织miR-222、miR-122表达检测 采用实时荧光定量PCR法。将保存于液氮中的肾癌组织以及癌旁组织标本在液氮中进行研磨,按照TRIzol试剂盒说明提取总RNA,紫外分光光度仪检测RNA吸光度(OD)值,OD260/OD280>1.8说明提取得到的总RNA纯度较好。1%琼脂糖变性凝胶电泳检测RNA完整性较好,按照All-in-oneTMmiRNA RT-qPCR detection Kit试剂盒上说明书反转录成cDNA。miR-222引物序列:上游引物: 5′-GTTCGTGGGAGCTACATCTGGC-3′,下游引物:5′-GCAGGGTCCGAGGTATTC-3′,引物长度200 bp;miR-122引物序列:上游引物:5′-CAAGCGTTGGAGTGTGACA-3′,下游引物:5′-CGTCCTACCATTCTCCAGC-3′,引物长度180 bp;内参U6引物序列:上游引物:5′-ATGGTTCGTGGGTGAGGTAGTAGGTTGT-3′,下游引物5′-GCAGGGTCCGAGGTATTC-3′ ,引物长度200 bp。PCR反应体系20 μL:2×All-in-one qPCR Mix 10 μL,(2 μmol/L)All-in-one miRNA qPCR Primer 2 μL,PCR通用引物2 μL,cNDA(按照1∶5稀释)2 μL,50×ROX参比染料0.4 μL,补充无RNA酶的超纯水至20 μL。PCR反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s,共40循环。采用2-ΔΔCt法计算miR-222、miR-122相对表达量。
1.3 肾癌组织miR-222、miR-122表达与患者临床病理参数的关系 收集患者的临床资料,分析肾癌组织miR-222、miR-122表达与患者临床病理参数的关系。采用Pearson积矩相关法分析miR-222与miR-122表达的关系。
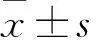
2 结果
2.1 肾癌组织及癌旁正常组织miR-222、miR-122表达比较 肾癌组织及癌旁正常组织miR-222相对表达量分别为2.38±0.64、1.12±0.55,miR-122相对表达量分别为2.86±0.39、0.98±0.43;肾癌组织miR-222、miR-122相对表达量均高于癌旁正常组织(P均<0.01)。
2.2 肾癌组织miR-222、miR-122表达与患者临床病理参数的关系 肾癌组织miR-222、miR-122表达与患者性别、年龄、病理类型、肿瘤直径均无关(P均>0.05),与患者病理分级、TNM分期、浸润深度、淋巴结转移均有关(P均<0.01)。见表1。
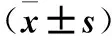
表1 肾癌组织miR-222、miR-122表达与患者临床病理参数的关系
2.3 肾癌组织miR-222、miR-122的关系 肾癌组织miR-222、miR-122相对表达量呈正相关(r=0.517,P<0.05)。
3 讨论
随着医学技术的快速发展,从分子水平上研究肾癌的发病机制已逐渐成为研究热点。miRNA是一类内源性非编码小分子RNA,可促进靶基因mRNA的降解或者抑制翻译过程,进而调控细胞内靶基因蛋白表达[9]。研究发现,miRNA不仅参与了细胞的分化、增殖、代谢和凋亡等系列过程,在恶性肿瘤的发生、发展过程中也有重要调控作用[10]。 研究发现,在易发生移位、缺失或者断裂区域等脆弱位点,有超过50%的肿瘤相关miRNA基因通过介导致癌基因或抑癌基因,参与恶性肿瘤的侵袭、转移等过程[11~13]。miR-222基因位于X染色体p11.3区约1 kb的区域内,在多种恶性肿瘤组织中呈异常表达[14]。Yang等[15]研究发现,miR-222可靶向抑制p27基因表达,进而通过阻断肝癌细胞周期而抑制其增殖。Li等[6]研究显示,miR-222在由幽门螺杆菌所致的胃癌黏膜中表达上调。Zhang等[16]研究表明,miR-222高表达提示膀胱癌患者预后不良。miR-122是肝脏特异性miRNA,位于人类18号染色体的q21.31区。研究表明,miR-122在非酒精性脂肪肝病、肝炎相关损伤以及肝脏恶性肿瘤等疾病中呈高表达[17]。Xing等[18]研究显示,miR-122高表达提示肝癌患者预后较差。有研究显示,miR-222和miR-221可介导PTEN的表达而调控胃癌肿瘤细胞的生长、侵袭,并且其表达上调可促进胃癌细胞的增殖[19]。本研究结果显示,肾癌组织miR-222、miR-122表达均高于癌旁组织,提示miR-222、miR-122高表达可能参与了肾癌的发生过程。本研究结果显示,分化程度低、临床分期晚、肿瘤浸润深以及出现淋巴结转移者癌组织miR-222、miR-122表达明显上调,提示miR-222、miR-122参与了肾癌的进展过程。本研究Pearson积矩相关分析结果显示,miR-222与miR-122呈正相关关系,提示miR-222表达水平上调可能促进miR-221的高表达,两者相互作用进而促进肾癌细胞生长并抑制其凋亡,最终参与肾癌细胞的发生、发展过程,但是其具体机制仍需进一步探讨。
综上所述,miR-222、miR-122均可促进肾癌的发生、发展,二者可能具有协同作用;癌组织miR-222、miR-122表达变化有助于肾癌的病情评估。
[1] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[2] 曲桂霞,扈青云,辛华,等.肾癌组织中MMP-26的表达与其分化程度的相关性分析[J].肿瘤药学,2014,4(2):258-261.
[3] Oliveto S, Mancino M, Manfrini N, et al. Role of microRNAs in translation regulation and cancer[J]. World J Biol Chem, 2017,8(1):45-56.
[4] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009,136(2):215-233.
[5] Zhong S, Li W, Chen Z, et al. MiR-222 and miR-29a contribute to the drug-resistance of breast cancer cells[J]. Gene, 2013,531(1):8-14.
[6] Li N, Tang B, Zhu ED, et al. Increased miR-222 in H. pylori-associated gastric cancer correlated with tumor progression by promoting cancer cell proliferation and targeting RECK[J]. FEBS Lett, 2012,586(6):722-728.
[7] Luna JM, Barajas JM, Teng KY, et al. Argonaute CLIP defines a deregulated miR-122-Bound transcriptome that correlates with patient survival in human liver cancer[J]. Mol Cell, 2017,67(3):400-410.
[8] Tang X, Lan Z, Chen Y, et al. The 7th AJCC/UICC TNM staging system may be not suitable in predicting prognosis of synchronous multiple gastric carcinoma patients with D2 gastrectomy[J]. Tumour Biol, 2015,36(5):3653-3659.
[9] Nishida N, Arizumi T, Hagiwara S, et al. MicroRNAs for the prediction of early response to sorafenib treatment in human hepatocellular carcinoma[J]. Liver Cancer, 2017,6(2):113-125.
[10] Pronina IV, Klimov EA, Burdennyy AM, et al. Methylation of the genes for the microRNAs miR-129-2 and miR-9-1, changes in their expression, and activation of their potential target genes in clear cell renal cell carcinoma[J]. Mol Biol (Mosk), 2017,51(1):73-84.
[11] Zhang Y, Tang W, Peng L, et al. Identification and validation of microRNAs as endogenous controls for quantitative polymerase chain reaction in plasma for stable coronary artery disease[J]. Cardiol J, 2016,23(6):694-703.
[12] Huang T, Wang-Johanning F, Zhou F, et al. MicroRNAs serve as a bridge between oxidative stress and gastric cancer(Review)[J]. Int J Oncol, 2016,49(5):1791-1800.
[13] 周宝永,陈独群,余祖虎,等.miR-222在肾癌中的表达及临床意义研究[J].中国煤炭工业医学杂志,2014,17(2):517-521.
[14] Jikuzono T, Kawamoto M, Yoshitake H, et al. The miR-221/222 cluster, miR-10b and miR-92a are highly upregulated in metastatic minimally invasive follicular thyroid carcinoma[J]. Int J Oncol, 2013,42(6):1858-1868.
[15] Yang YF, Wang F, Xiao JJ, et al. MiR-222 overexpression promotes proliferation of human hepatocellular carcinoma HepG2 cells by downregulating p27[J]. Int J Clin Exp Med, 2014,7(48):893-902.
[16] Zhang DQ, Zhou CK, Jiang XW, et al. Increased expression of miR-222 is associated with poor prognosis in bladder cancer[J]. World J Surg Oncol, 2014,12(9):241.
[17] Akuta N, Kawamura Y, Suzuki F, et al. Impact of circulating miR-122 for histological features and hepatocellular carcinoma of nonalcoholic fatty liver disease in Japan[J]. Hepatol Int, 2016,10(4):647-56.
[18] Xing TJ, Jiang DF, Huang JX, et al. Expression and clinical significance of miR-122 and miR-29 in hepatitis B virus-related liver disease[J]. Genet Mol Res, 2014,13(3):7912-7918.
[19] 金晶,闫竞一,薛向阳,等.miR-221和miR-222在胃癌中的表达及临床意义[J].肿瘤学杂志,2011,17(4):245-248.
江苏省科技计划发展项目(BK2014187)。
孙方浒(E-mail: sunfanghu_5123@yeah.net)
10.3969/j.issn.1002-266X.2017.44.020
R737.11
B
1002-266X(2017)44-0063-03
2017-03-19)
