急性缺血性脑卒中患者血清PARK7、D-D、LPA水平变化及意义
2017-12-11李在坡李娇娇李娟赵绍林蔡增林
李在坡,李娇娇,李娟,赵绍林,蔡增林
(连云港市第一人民医院,江苏连云港222002)
急性缺血性脑卒中患者血清PARK7、D-D、LPA水平变化及意义
李在坡,李娇娇,李娟,赵绍林,蔡增林
(连云港市第一人民医院,江苏连云港222002)
目的观察急性缺血性脑卒中(AIS)患者血清人帕金森蛋白7(PARK7)、D-二聚体(D-D)、溶血磷脂酸(LPA)水平变化,并探讨其临床意义。方法选择AIS患者89例为观察组,体检健康者80例为对照组。观察组不稳定斑块(UP)32例,稳定斑块(SP)38例,无斑块(NP)19例;神经功能缺损程度轻度28例,中度41例,重度20例。采用ELISA法检测两组血清PARK7、D-D、LPA。结果观察组血清PARK7、D-D、LPA水平均高于对照组(P均<0.05)。观察组UP、SP患者血清PARK7、D-D、LPA水平均高于NP患者(P均<0.05),UP患者均高于SP患者(P均<0.05)。观察组重度神经功能缺损患者血清PARK7、D-D、LPA水平均高于中度及轻度患者(P均<0.05),中度患者均高于轻度患者(P均<0.05)。结论AIS患者血清PARK7、D-D、LPA水平均升高,三项指标检测有助于判断AIS患者的斑块情况及神经功能缺损情况。
急性脑卒中;人帕金森蛋白7;D-二聚体;溶血磷脂酸;神经功能缺损
急性缺血性脑卒中(AIS)具有高发病率、高病死率、高致残率的特点[1]。目前临床对AIS患者的病情判断依赖CT和MRI等影像学检查手段,具有一定的主观性,且CT和MRI检测存在一定放射性,故单纯依靠影像学检查手段判断AIS患者病情有一定的局限性。寻找能有效反映患者病情的血清标志物是AIS诊断相关研究的重点[2]。目前已经证实,血清人帕金森蛋白7(PARK7)、D-二聚体(D-D)、溶血磷脂酸(LPA)与脑血管损伤存在密切联系[3,4],但其在AIS患者血清中的表达变化尚不清楚。本研究观察了AIS患者血清PARK7、D-D、LPA水平变化,并探讨其与患者斑块情况及神经功能缺损情况的关系。
1 资料与方法
1.1 临床资料 选择2016年2月~2017年5月我院收治的AIS患者89例作为观察组。纳入标准:①均满足我国第四次脑血管病会议对AIS的有关诊断标准[5];②均为初次发病;③由头颅CT或MRI等影像学检查确诊;④年龄≥40岁。排除标准:①存在其他类别的颅内疾病者;②有高血压或糖尿病等代谢性疾病者;③存在急性感染或血液疾病者;④合并恶性肿瘤者;⑤入组前已接受抗凝或抗血栓治疗者。其中男43例、女46例,年龄41~77(54.82±1.23)岁,病程1~5(2.31±0.13)d;动脉斑块情况:不稳定斑块(UP)32例,稳定斑块(SP)38例,无斑块(NP)19例;神经功能缺损程度:轻度(NIHSS评分0~15分)28例,中度(NIHSS评分16~30分)41例,重度(NIHSS评分31~42分)20例。另选同期体检健康者90例作为对照组,男45例、女45例,年龄40~75(54.74±1.36)岁。两组性别、年龄均具有可比性。本研究通过医院伦理委员会批准,患者及其家属均签署知情同意书。
1.2 血清PARK7、LPA、D-D 水平检测 采用ELISA法。观察组入院次日晨间抽取肘静脉血5 mL,对照组在体检当日抽取晨间静脉血5 mL,3 000 r/min离心15 min后提取血清。采用ELISA法检测血清PARK7、LPA及D-D。PARK7检测试剂盒购于深圳奥萨医药有限公司,LPA和D-D检测试剂盒均购于上海时代生物科技有限公司,严格根据试剂盒说明书步骤操作。分析比较观察组不同动脉斑块情况及神经功能缺损程度患者的血清PARK7、LPA、D-D水平。
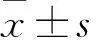
2 结果
2.1 两组血清PARK7、D-D、LPA水平比较 观察组血清PARK7、D-D、LPA水平均高于对照组(P均<0.05)。见表1。
2.2 观察组不同动脉斑块情况患者血清PARK7、D-D、LPA水平比较 观察组UP、SP患者血清PARK7、D-D、LPA水平均高于NP患者,UP患者均高于SP患者(P均<0.05)。见表2。
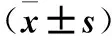
表1 两组血清PARK7、D-D、LPA水平比较
注:与对照组比较,*P<0.05。
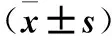
表2 观察组不同动脉斑块情况患者血清PARK7、D-D、LPA水平比较
注:与NP患者比较,*P<0.05;与SP患者比较,△P<0.05。
2.3 观察组不同神经功能缺损程度患者血清PARK7、D-D、LPA水平比较 观察组重度神经功能缺损患者血清PARK7、D-D、LPA水平均高于中度及轻度患者,中度患者均高于轻度患者(P均<0.05)。见表3。
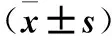
表3 观察组不同神经功能缺损程度患者血清PARK7、D-D、LPA水平比较
注:与轻度患者比较,*P<0.05;与中度患者比较,△P<0.05。
3 讨论
AIS的发病机制十分复杂,与多种因素密切相关,目前已经确定高血压、心血管类疾病、糖尿病以及血脂异常等均可作为该病的危险因素[7]。同时有报道指出,粥样硬化斑块与AIS发病密切相关,且炎性反应以及纤溶系统异常等同样发挥着关键作用[8]。此外,血液黏滞度改变亦会影响脑卒中发病以及疾病进展。
D-D为交联纤维蛋白发生特异性反应时的降解产物,其有利于纤溶功能亢进和加重机体高凝程度,因此能够促使动脉内粥样硬化斑块大量形成。AIS患者发病后会出现明显高凝低溶情况,其血脑屏障受到破坏,使得脑组织分泌物生成增多并进入血液循环,引发纤溶功能亢进,造成D-D水平显著上升。LPA是由活化状态血小板生成,有助于血小板聚集和激活启动可溶性类型纤维蛋白原。LPA为一种溶血磷脂,能够借助G蛋白偶联受体对靶细胞产生影响,具备广泛的生物效应。当血小板被凝血酶活化时,会在血液凝集初期生成LPA,造成其血清水平升高。PARK7为帕金森疾病早期发作时常染色体一项隐性遗传基因,初期被定性为癌蛋白。但经研究发现,PARK7具备分子伴侣以及抗氧化应激能力;其本身对神经可发挥保护作用,并可借助氧化应激而发生活化,当PARK7功能紊乱时,可引发卒中以及神经退行性病变[9]。同时,有研究指出,PARK7和脑卒中之间存在密切相关性,并且表现为较高的敏感性以及特异性[10]。PARK7可以被当做氧化还原反应十分敏感的一个分子伴侣,充当氧化应激反应的传感器,对神经元进行保护,防止其受到氧化应激伤害以及发生细胞死亡。在脑卒中发病时,PARK7在患者卒中区域呈丰富性表达,所以血清中PARK7水平情况有助于对脑卒中发病情况进行评估,是一项高可靠性标志物。本研究结果显示,观察组血清PARK7、D-D、LPA水平均明显高于对照组,与黄宏亮等[11]报道相符,提示AIS患者血清PARK7、D-D及LPA水平明显上升。原因可能是PARK7、D-D及LPA均参了AIS的发病及病情进展过程。具体而言,AIS的重要病因是动脉粥样硬化,并且氧化应激以及炎性反应等均参与整个疾病发生和进展。
本研究结果显示,UP和SP患者血清PARK7、D-D、LPA水平均高于NP患者,而UP患者高于SP患者,提示随着斑块情况的恶化,AIS患者的血清PARK7、D-D及LPA水平明显上升。原因可能是PARK7、D-D及LPA通过一系列生化反应直接或间接促使AIS患者的斑块形成,而PARK7可能通过氧化应激反应参与到此过程中。临床认为D-D以炎性细胞因子形式来促进动脉粥样硬化斑块产生,而动脉粥样硬化同时又是脑卒中发病的重要病理基础,因此D-D水平情况和脑卒中发生发展密切相关。LPA主要来源为血小板,同时还可以对血小板活化以及聚集等活动产生促进作用,进而促使血栓或斑块的形成[12]。本研究发现,中度和重度神经功能缺损患者血清PARK7、D-D及LPA水平均高于轻度患者,而重度患者又高于中度患者,提示伴随AIS患者神经功能缺损症状的逐渐加重,其血清PARK7、D-D及LPA水平也表现出了明显上升的趋势。原因主要是神经功能缺损能反映AIS患者的病情情况,又与其斑块的形成联系紧密,因此三项指标均会表现出协同性上升[13~16]。因此,临床上可对上述指标进行相应监测,对掌握AIS患者的斑块情况及神经功能缺损也有一定的应用价值。
综上所述,AIS患者血清PARK7、D-D、LPA水平升高,三项指标检测有助于判断AIS患者的斑块情况及神经功能缺损情况。
[1] 魏琰,张维文,王晓莉,等.无症状性脑梗死患者首发症状性急性脑卒中的临床特征及相关危险因素[J].脑与神经疾病杂志,2016,24(11):681-684.
[2] 许光银.缺血性脑卒中患者血浆LPA和LP-PLA2检测的临床意义[J].中华全科医学,2012,10(12):1943-1944.
[3] Kocak S, Ertekin B, Girisgin AS, et al. Lipoprotein-AISsociated phospholipAISe-A 2 activity and its diagnostic potential in patients with acute coronary syndrome and acute ischemic stroke[J]. Turk J Emerg Med, 2016,17(2):56-60.
[4] 李大伟,陈维.老年急性脑梗死患者血浆溶血磷脂酸水平的变化[J].中国老年学杂志, 2011,31(9):1672-1673.
[5] 李晓霞,白洁.D二聚体及血清脂蛋白(a)在急性缺血性脑卒中患者中的变化[J].血栓与止血学,2016,22(6):683-684.
[6] Kent ST, Rosenson RS, Avery CL, et al. PCSK9 loss-of-function variants, low-density lipoprotein cholesterol, and risk of coronary heart diseAISe and stroke: data from 9 studies of blacks and whites[J]. Circ Cardiov AISc Genet, 2017,10(4):1632-1633.
[7] He T, Wang J, Deng WS, et al. Association between Lipoprotein LipAISe Polymorphism and the Risk of Stroke: A Meta-analysis[J]. J Stroke Cerebrov AISc Dis, 2017,4(17):30282-30283.
[8] 沈珺,吴丹红,黄菲菲,等.急性脑卒中患者血清溶血磷脂酸和同型半胱氨酸水平变化及其与预后的关系[J].疑难病杂志,2016,15(10):1016-1019.
[9] 崔桂萍,刘萍.脑卒中患者血清PARK7水平变化及意义[J].山东医药,2013,53(24):12-13.
[10] Han X, Gao Y, Ma B, et al. The clinical relevance of serum NDKA, NMDA, PARK7, and UFDP levels with phlegm-heat syndrome and treatment efficacy evaluation of traditional chinese medicine in acute ischemic stroke[J]. Evid Based Complement Alternat Med, 2015(1):270498-270499.
[11] 黄宏亮,杨莉莉,黄崴,等.脑卒中患者血清PARK7、LPA和D-D水平与颈动脉粥样硬化及神经缺损程度的关系[J].疑难病杂志,2017,16(8):776-777.
[12] 牛德旺,齐进兴,邓建中,等.急性脑卒中溶栓与非溶栓治疗前后LPA、TNF、GMP140与IL-2水平和预后的相关性分析[J].中国实用神经疾病杂志,2013,16(12):30-31.
[13] 黄海华.急性缺血性脑卒中患者血清Lp(a)、D-D、CRP及FG的水平变化及相关性研究[J].海南医学院学报,2013,19(5):600-601.
[14] 许光银.缺血性脑卒中患者血浆LPA和LP-PLA2水平检测及意义[J].山东医药,2012,52(35):73-75.
[15] 李妙嫦,黄燕.不同类型急性脑卒中患者血清LPA表达及意义[J].临床医学工程,2012,19(8):1306-1307.
[16] Hijioka M, Inden M, Yanagisawa D, et al. DJ-1/PARK7: a new therapeutic target for neurodegenerative disorders[J]. Biol Pharm Bull, 2017,40(5):548-552.
江苏省自然科学基金资助项目(BK20151419)。
10.3969/j.issn.1002-266X.2017.44.018
R743.3
B
1002-266X(2017)44-0058-03
2017-09-19)
