纳米银对人冠状动脉内皮细胞凋亡的影响及其机制
2017-12-11孔立茶刘少云杨雪佳崔慎情孔继昌
孔立茶,刘少云,杨雪佳,崔慎情,孔继昌
(华北石油管理局总医院,河北任丘062552)
纳米银对人冠状动脉内皮细胞凋亡的影响及其机制
孔立茶,刘少云,杨雪佳,崔慎情,孔继昌
(华北石油管理局总医院,河北任丘062552)
目的探讨纳米银对人冠状动脉内皮细胞(HCAEC)凋亡的影响及其可能的机制。方法取生长状态良好并处于对数生长期的HCAEC,分别加入浓度为0、2.5、5、10、20、40、80 μg/mL的纳米银溶液,作用24 h。采用MTT法检测HCAEC凋亡率,ELISA法检测培养液上清血红素氧合酶1(HO-1)、血小板内皮细胞黏附分子1(PECAM-1)表达,火焰原子吸收光谱法检测细胞内、外银含量。结果加入2.5、5、10、20、40、80 μg/mL纳米银溶液的HCAEC凋亡率分别为8.51%、21.03%、42.38%、64.62%、78.35%、74.83%。随着加入纳米银溶液浓度升高,HCAEC培养液上清HO-1表达逐渐升高,各浓度间比较P均<0.05;加入40、80 μg/mL纳米银溶液的HCAEC培养液上清HO-1表达比较P>0.05。HCAEC加入10、20、40、80 μg/mL纳米银溶液后细胞培养液上清PECAM-1表达均高于0、2.5、5 μg/mL纳米银溶液,且加入40、80 μg/mL纳米银溶液后PECAM-1表达升高更明显(P均<0.05)。加入2.5、5、10、20 μg/mL纳米银溶液的HCAEC细胞内银含量低于细胞外(P均<0.01),加入40、80 μg/mL纳米银溶液的HCAEC细胞内、外银含量比较差异均无统计学意义(P均>0.05)。结论纳米银可促进HCAEC凋亡,其细胞毒性作用呈浓度依赖性;通过上调HO-1、PECAM-1表达造成细胞损伤可能是其作用机制。
纳米银;人冠状动脉内皮细胞;细胞凋亡;血红素氧合酶1;血小板内皮细胞黏附分子1
纳米银具有广谱抗菌性,目前多种纳米银材料被应用于众多医疗设备和产品中[1,2]。研究发现,纳米银通过皮肤或血液接触进入人体内,经由血液系统或淋巴系统循环分布到肺、肝脏、肾脏和大脑等器官,并开始逐渐积累[3],不仅能够造成细胞形态改变、细胞活力下降、线粒体损伤和细胞凋亡,还能引起细胞DNA 损伤、染色体畸变和细胞周期抑制等[4~6];此外还可引发心血管效应,甚至促发动脉粥样硬化[7]。动脉血管内皮细胞的结构及功能受损在心血管疾病的发生、发展中发挥重要作用,但目前关于纳米银对动脉血管内皮细胞影响的报道较少。2016年7月~2017年1月,本研究观察了纳米银对人冠状动脉内皮细胞(HCAEC)的细胞毒性作用,现将结果报告如下。
1 材料与方法
1.1 材料 细胞:HCAEC购自中科院上海细胞库。主要试剂:纳米银溶液(粒径1~30 nm)购自韩国Nanux公司;RPMI 1640培养液购自美国Hyclone公司;FBS、双抗和0.25%胰酶消化液购自美国Gibco公司;MTT、DMSO购自美国Sigma公司;血红素氧合酶1(HO-1)、血小板内皮细胞黏附分子1(PECAM-1)ELISA试剂盒购自美国BD公司;细胞培养耗材均购自德国Eppendorf公司。
1.2 细胞培养及分组处理 将HCAEC置于含10% FBS、青霉素(100 U/mL)和链霉素(0.1 mg/mL)的RPMI 1640培养液中,于37 ℃、5% CO2培养箱中培养。取生长状态良好并处于对数生长期的HCAEC,分别加入0(即不加入纳米银溶液)、2.5、5、10、20、40、80 μg/mL的纳米银溶液,作用24 h。
1.3 细胞凋亡率检测 采用MTT法。细胞处理24 h,弃去培养液,重新加入180 μL培养液及20 μL MTT,轻轻混合后,常规培养4 h。每孔加入150 μL DMSO,振荡10 min,使甲臜充分溶解。使用酶标仪检测490 nm处的吸光度(OD)值,计算细胞凋亡率。细胞凋亡率(%)=[(OD对照-OD空白)-(OD实验-OD空白)]/(OD对照-OD空白)×100%。
1.4 培养液上清HO-1、PECAM-1表达检测 采用ELISA法。细胞处理24 h,吸取培养液上清,采用ELISA法检测HO-1、PECAM-1表达,具体操作严格按照试剂盒说明书进行。实验重复3次,取平均值。
1.5 细胞内、外银含量检测 采用火焰原子吸收光谱法。细胞处理24 h,吸取培养液上清,保存于离心管中。将剩余细胞及培养液使用PBS缓冲液清洗4~5次,将清洗后的细胞转移到离心管中,加入低渗液,将细胞吹打均匀,置于冰水中,用超声破碎仪将细胞进行超声破碎。采用火焰原子吸收分光光度计检测超声破碎后细胞悬液及培养液上清中的银含量,即为细胞内、外银含量。实验重复3次,取平均值。
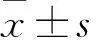
2 结果
2.1 细胞凋亡率 加入2.5、5、10、20、40、80 μg/mL纳米银溶液的HCAEC凋亡率分别为8.51%、21.03%、42.38%、64.62%、78.35%、74.83%。
2.2 培养液上清HO-1、PECAM-1表达 随着加入纳米银溶液浓度的升高,HCAEC培养液上清HO-1表达逐渐升高,各浓度间比较P均<0.05;加入40、80 μg/mL纳米银溶液的HCAEC培养液上清HO-1表达比较P>0.05。加入10、20、40、80 μg/mL纳米银溶液的HCAEC培养液上清PECAM-1表达均高于加入0、2.5、5 μg/mL纳米银溶液的HCAEC,且加入40、80 μg/mL纳米银溶液的HCAEC培养液上清PECAM-1表达升高更明显(P均<0.05)。见表1。
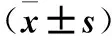
表1 加入不同浓度纳米银溶液的HCAEC培养液上清HO-1、PECAM-1表达比较
注:与0 μg/mL比较,*P<0.05;与2.5 μg/mL比较,#P<0.05;与5 μg/mL比较,△P<0.05;与10 μg/mL比较,▽P<0.05;与20 μg/mL比较,▲P<0.05。
2.3 细胞内、外银含量 随着加入纳米银溶液浓度的升高,HCAEC细胞内外银含量均逐渐升高。加入2.5、5、10、20 μg/mL纳米银溶液的HCAEC细胞内银含量低于细胞外(P均<0.01),加入40、80 μg/mL纳米银溶液的HCAEC细胞内、外银含量比较差异均无统计学意义(P均>0.05)。见表2。
3 讨论
研究证实,纳米银在不同的哺乳动物细胞系中均能诱导细胞毒性反应[8~11];能对中国仓鼠肺成纤维细胞产生明显的细胞毒性及遗传毒性,促进细胞凋亡[12]。Chairuangkitti等[8]体外研究发现,纳米银颗粒对人肺腺癌A549细胞的毒性作用与活性氧的产生有关。Sambale等[13]研究表明,纳米银能够影响人肺腺癌A549细胞形态,并促进其凋亡,但诱导细胞死亡的作用并不是由银离子直接导致的。研究发现,纳米银可通过诱导肝癌HepG2细胞产生ROS,导致线粒体受损,激发凋亡因子受体信号,引起一系列Caspase级联反应,最终导致细胞凋亡[14,15];纳米银还能诱导心血管系统炎症,甚至促发动脉粥样硬化(AS)[7]。AS是一种慢性进行性炎性疾病,其发生的主要病理机制为血管内皮细胞损伤及功能发生障碍。本研究结果显示,纳米银溶液能促进HCAEC细胞凋亡,且细胞毒性作用呈浓度依赖性,与上述研究结论一致。
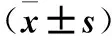
表2 加入不同浓度纳米银溶液的HCAEC细胞内、外银含量比较
注:与0 μg/mL比较,*P<0.05;与2.5 μg/mL比较,#P<0.05;与5 μg/mL比较,△P<0.05;与10 μg/mL比较,▽P<0.05;与20 μg/mL比较,▲P<0.05;与40 μg/mL比较,▼P<0.05。
HO-1是诱导型血红素氧合酶,一般情况下在血管内皮细胞中的表达较低,但在应激、缺氧或缺血等情况下会诱导其过表达,其表达升高具有抑制炎性反应、防止血管硬化、抗AS斑块形成的作用[16~18]。免疫球蛋白超家族的PECAM-1是与AS发生密切相关的一类细胞黏附因子,内皮细胞表面的PECAM-1能够参与维持内皮细胞完整性,还能介导炎性因子、参与细胞内信号转导[19,20]。当AS发生时血管内皮细胞凋亡数量增多,细胞HO-1、PECAM-1表达均显著升高[21]。本研究结果显示,随着纳米银溶液浓度升高,细胞培养液上清HO-1、PECAM-1表达均呈升高趋势;提示纳米银能够通过上调HO-1、PECAM-1表达造成血管内皮细胞损伤,间接参与AS的发生。本研究结果显示,纳米银溶液干预后HCAEC细胞内银含量高于细胞外,细胞内银含量随着加入纳米银溶液浓度的升高而逐渐升高,当加入纳米银溶液的浓度达到40、80 μg/mL时,HCAEC细胞内、外银含量比较差异均无统计学意义;说明当纳米银溶液浓度达到40 μg/mL时,纳米银开始大量进入细胞内并对其造成损害。
综上所述,纳米银可促进HCAEC凋亡,其细胞毒性作用呈浓度依赖性;通过上调HO-1、PECAM-1表达造成细胞损伤可能是其作用机制。纳米银可能通过促进血管内皮细胞损伤及诱导HCAEC凋亡而参与AS的发生,其具体作用机制还需要深入研究和探讨。
[1] Chaloupka K, Malam Y, Seifalian AM. Nanosilver as a new generation of nanoproduct in biomedical applications[J]. Trends Biotechnol, 2010,28(11):580-588.
[2] Lem KW, Choudhury A, Lakhani AA, et al. Use of nanosilver in consumer products[J]. Recent Pat Nanotechnol, 2012,6(1):60-72.
[3] Sintubin L, Verstraete W, Boon N. Biologically produced nanosilver: current state and future perspectives[J]. Biotechnol Bioeng, 2012,109(10):2422-2436.
[4] Sumit A, Nikhil T, Arun B, et al. Silver nanoparticles protect human keratinocytes against UVB radiation-induced DNA damage and apoptosis: potential for prevention of skin carcinogenesis[J]. Nanomedicine, 2015,11(5):1265-1275.
[5] Kim SH, Ko JW, Koh SK, et al. Silver nanoparticles induce apoptotic cell death in cultured cerebral cortical neurons[J]. Mol Cell Toxicol, 2014,10(2):173-179.
[6] Zhang T, Wang L, Chen Q, et al. Cytotoxic potential of silver nanoparticles [J]. Yonsei Med J, 2014,55(2):283-291.
[7] Simkhovich BZ, Kleinman MT, Kloner RA. Air pollution and cardiovascular injury epidemiology, toxicology, and mechanisms[J]. J Am Coll Cardiol, 2008,52(9):719-726.
[8] Chairuangkitti P, Lawanprasert S, Roytrakul S, et al. Silver nanoparticles induce toxicity in A549 cells via ROS-dependent and ROS-independent pathways[J]. Toxicol In Vitro, 2013,27(1):330-338.
[9] Soto KF, Carrasco A, Powell TG, et al. Comparative in vitro cytotoxicity assessment of some manufactured nanoparticulate materials characterized by transmissionelectron microscopy[J]. J Nanoparticle Res, 2005,7(2):145-169.
[10] Braydich SL, Hussain SSchlager JJ, Hofmann MC. In vitro cytotoxicity of nanoparticles in mammalian germline stem cells[J]. Toxicol Sci, 2005,88(2):412-419.
[11] Hussain SM, Hess KL, Gearhart JM, et al. In vitro toxicity of nanoparticles in BRL 3A rat liver cells[J]. Toxicol In Vitro, 2005,19(7):975-983.
[12] 于永生,施畅,徐丽明,等.纳米银对中国仓鼠肺成纤维细胞的细胞毒性和遗传毒性[J].癌变畸变突变,2014,26(6):428-433.
[13] Sambale F, Wagner S, Stahl F, et al. Investigations of the toxic effect of silver nanoparticles on mammalian cell lines[J]. J Nanomaterials, 2015,2015(1):1-9.
[14] 巩凡,张帮勇,黄艳梅,等.纳米银在HepG2和L02细胞中的生物分布及凋亡作用研究[J].环境与健康杂志,2014,31(10):893-896.
[15] 黄艳梅,巩凡,张婷,等.纳米银对人肝癌细胞及正常肝细胞增殖与凋亡的影响[J].环境与健康杂志,2013,30(9):770-772.
[16] Qingwei JI, Bangwei WU, Zeng Q, et al. HO-1 attenuates atherosclerosis via regulating the imbalance of Th17/Treg in ApoE-/-mice[J]. J Clin Cardiol, 2016,2(1):1-4.
[17] Luo Y, Sun G, Dong X, et al. Isorhamnetin Attenuates atherosclerosis by inhibiting macrophage apoptosis via PI3K/AKT activation and HO-1 induction[J]. Plos One, 2015,10(3):120259.
[18] Pechlaner R, Willeit P, Summerer M, et al. Heme oxygenase-1 gene promoter microsatellite polymorphism is associated with progressive atherosclerosis and incident cardiovascular disease [J]. Arterioscler Thromb Vasc Biol, 2015,35(1):229-236.
[19] Chistiakov DA, Orekhov AN, Bobryshev YV. Endothelial PECAM-1 and its function in vascular physiology and atherogenic pathology[J]. Exp Mol Pathol, 2016,100(3):409-415.
[20] Popovic' D, Starcˇ evic' JN, Letonja M, et al. PECAM-1gene polymorphism (rs668) and subclinical markers of carotid atherosclerosis in patients with type 2 diabetes mellitus [J]. Balkan J Med Genet, 2016,19(1):63-70.
[21] Sei-ichiro T, Yuan Z and Bo Q. Heine oxygenase-l mediated cytoprotection against fiver ischemia and reperfusion injury: inhibition of type-I interferon signaling[J]. Transplantation, 2007,83(3):1628-1634.
刘少云(E-mail: livshaoyun@163.com)
10.3969/j.issn.1002-266X.2017.44.014
R543.3
A
1002-266X(2017)44-0048-03
2017-03-07)
