NF-κB信号通路抑制剂对P物质作用后脊髓星形胶质细胞GFAP、炎性因子表达的影响
2017-12-11习亮梁伟张永峰
习亮,梁伟,张永峰
(第四军医大学附属第一医院 西京医院,西安710032)
NF-κB信号通路抑制剂对P物质作用后脊髓星形胶质细胞GFAP、炎性因子表达的影响
习亮,梁伟,张永峰
(第四军医大学附属第一医院 西京医院,西安710032)
目的探讨NF-κB信号通路抑制剂对P物质(SP)作用后脊髓星形胶质细胞胶质纤维酸性蛋白(GFAP)、TNF-α、IL-1β及NO表达的影响。方法将脊髓星形胶质细胞随机分为对照组、SP组和抑制剂组。SP组用含有SP的细胞培养液培养,抑制剂组用含有SP及NF-κB抑制剂SN50的细胞培养液培养,调整SP终浓度为1×10-7mol/L、SN50终浓度为10 μmol/L;对照组仅加入细胞培养液培养。各组作用24 h,采用Western blotting法检测细胞核转录因子κB p65二聚体(NF-κB p65)表达,免疫荧光法检测细胞GFAP表达,ELISA法检测细胞培养液上清TNF-α、IL-1β表达,硝酸还原酶法检测细胞培养液上清NO表达。结果SP组和抑制剂组NF-κB p65相对表达量、GFAP表达均高于对照组,且SP组升高更明显(P均<0.05)。SP组和抑制剂组培养液上清TNF-α、IL-1β、NO表达均高于对照组,且SP组升高更明显(P均<0.05)。结论SP能够促进脊髓星形胶质细胞活化并分泌NO、TNF-α、IL-1β,NF-κB信号通路抑制剂SN50能够降低SP的上述作用。
脊髓星形胶质细胞;P物质;核转录因子κB;胶质纤维酸性蛋白;肿瘤坏死因子α;白细胞介素1β
神经胶质细胞是除神经元以外的第二大类神经细胞,脊髓星形胶质细胞是中枢神经系统中病理性疼痛传递和产生的参与者[1]。P物质(SP)具有调控脊髓星形胶质细胞功能的作用,慢性疼痛能够通过SP、炎症因子等传递至脊髓星形胶质细胞,从而影响细胞功能的发挥[2~4]。已有研究表明,SP能够活化脊髓星形胶质细胞[5]。NF-κB参与多种组织、器官炎症的发生过程,检测NF-κB p65二聚体水平可以间接反映NF-κB信号通路的状态[6]。2016年2月~2017年1月, 本研究观察了NF-κB信号通路抑制剂对SP作用后脊髓星形胶质细胞胶质纤维酸性蛋白(GFAP)及炎性因子分泌的影响。现报告如下。
1 材料与方法
1.1 材料 细胞:参照刘涛等[7]的方法于SPF乳鼠中分离、培养脊髓星形胶质细胞,细胞贴壁后经GFAP免疫荧光鉴定为脊髓星形胶质细胞。主要试剂:FBS购于杭州四季青生物工程材料有限公司,胰蛋白酶、PBS购于美国Sigma公司,NF-κB p65单克隆抗体购于美国Santa Cruz公司,甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自于上海威奥生物科技有限公司,NF-κB抑制剂SN50购于美国AnaSpec公司,NO检测试剂盒、二喹啉甲酸(BCA)检测试剂盒购于碧云天生物技术研究所,TNF-α、IL-1β检测试剂盒均购于上海弘顺生物科技有限公司。
1.2 细胞分组处理 取培养至第3代的脊髓星形胶质细胞随机分为对照组、SP组和抑制剂组。SP组用含有SP的细胞培养液培养,调整其终浓度为1×10-7mol/L;抑制剂组用含有SP及NF-κB抑制剂SN50的细胞培养液培养,分别调整其终浓度为1×10-7mol/L、10 μmol/L;对照组用不含有SP和NF-κB抑制剂SN50的细胞培养液培养。
1.3 细胞NF-κB p65表达检测 采用Western blotting法。将脊髓星形胶质细胞以2×106个/孔接种至6孔板中,参照1.2的方法进行分组处理。培养24 h,用PBS洗涤细胞2次,每孔加入200 μL细胞裂解液,冰上裂解10 min。用细胞刮刀收集细胞,超声粉碎5次,每次5 s;8 000 r/min离心5 min,吸取上清液,-70 ℃保存。采用BCA蛋白浓度检测试剂盒检测蛋白样品浓度,将蛋白样品与上样缓冲液以1∶1的比例混合后于100 ℃水中煮沸5 min。加入到凝胶电泳(10%分离胶、4%浓缩胶)上样孔中,每孔加入40 μg蛋白样品,80 V电压电泳30 min,120 V电压至结束。50 V电压在4 ℃条件下转膜12 h,5%脱脂奶粉在37 ℃条件下封闭90 min。加入一抗(1∶1 000),4 ℃孵育过夜;加入二抗(1∶2 000),37 ℃孵育90 min。采用图像分析软件分析目的蛋白及内参蛋白GAPDH条带灰度值,以目的蛋白与内参蛋白条带灰度值的比值计算NF-κB p65相对表达量,实验重复3次。
1.4 细胞GFAP表达检测 采用免疫荧光法。取1.2中培养24 h的各组细胞,0.1 mol/L PBS洗涤后,加入含5%乙酸的95%乙醇,-20 ℃固定20 min。0.1 mol/L PBS洗涤,加入Tris-HCL缓冲液37 ℃孵育15 min。加入100倍稀释的GFAP抗体,37 ℃孵育30 min,加入50倍稀释的GFAP二抗,37 ℃孵育60 min。0.1 mol/L PBS洗涤,50%甘油封片。以PBS代替GFAP抗体作为阴性对照,于200倍显微镜下采用ImageJ软件计算积分光密度(IOD)值,以此表示GFAP表达量,实验重复3次。
1.5 细胞培养液上清TNF-α、IL-1β表达检测 采用ELISA法。取1.2中培养24 h的各组细胞,收集培养液上清,按照ELISA检测试剂盒说明书检测培养液上清TNF-α、IL-1β表达,实验重复3次。
1.6 细胞培养液上清NO表达检测 采用硝酸还原酶法。取1.2中培养24 h的各组细胞,收集培养液上清,按照试剂盒说明书检测NO表达,实验重复3次。
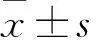
2 结果
2.1 各组NF-κB p65、GFAP表达比较 SP组和抑制剂组NF-κB p65相对表达量、GFAP表达均高于对照组,且SP组升高更明显(P均<0.05)。见表1。
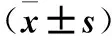
表1 各组NF-κB p65、GFAP表达比较
注:与对照组比较,*P<0.05;与SP组比较,#P<0.05。
2.2 各组培养液上清TNF-α、IL-1β及NO表达比较 SP组和抑制剂组培养液上清TNF-α、IL-1β、NO表达均高于对照组,且SP组升高更明显(P均<0.05)。见表2。
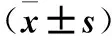
表2 各组培养液上清TNF-α、IL-1β及NO表达比较
注:与对照组比较,*P<0.05;与SP组比较,#P<0.05。
3 讨论
星形胶质细胞是中枢神经系统内分布最广的一种胶质细胞,存在于脑、脊髓等组织中,对神经元具有支持、营养、保护、修复等作用[8~11]。近年来研究表明,星形胶质细胞与中枢神经系统的痛觉传导有关。SP在中枢神经和周围神经中广泛存在,是一种神经递质,参与中枢疼痛感的传导,在多种慢性疼痛组织SP均升高。研究表明,一定浓度的SP能够诱发脊髓星形胶质细胞活化[12]。
NF-κB是一种存在于多种组织细胞中的核转录因子,在皮肤、肺、淋巴结、骨骼、胚胎组织中均有广泛表达[13]。NF-κB具有调控炎症因子和免疫相关基因表达的作用。正常情况下,NF-κB处于非活化状态,其在细胞质与NF-κB抑制蛋白结合,当受到病理因素作用后,细胞内NF-κB与NF-κB抑制蛋白解离,并调控相关基因的表达[14]。本研究结果显示,SP组和抑制剂组NF-κB p65相对表达量均高于对照组,且SP组升高更明显;说明SN50对SP作用后脊髓星形胶质细胞中的NF-κB信号通路有阻断作用,可降低细胞NF-κB p65表达。GFAP是星形胶质细胞的重要骨架蛋白,也是星形胶质细胞的特异性标志物,其表达上调标志着星形胶质细胞的活化程度升高[15]。本研究结果显示,SP组和抑制剂组GFAP表达均高于对照组,且SP组升高更明显;说明SP能够促进脊髓星形胶质细胞活化,而SN50可降低SP作用后引起的脊髓星形胶质细胞活化。
脊髓星形胶质细胞能够分泌炎症及疼痛因子,主要有NO、TNF-α、IL-1β等。IL-1β、TNF-α具有促进炎症发生的作用[16]。研究表明,TNF-α具有损伤神经元的作用,脊髓星形胶质细胞能够分泌TNF-α,促进NF-κB激活,引起细胞产生NO等氧自由基[17]。NO具有寿命短、活性高等特点,可参与免疫系统、血液系统、神经系统等多种病理及生理过程的发生。NO能够影响神经细胞的兴奋性,促进感觉传导[18,19],其表达升高能促进炎症和疼痛的发生[20]。本研究结果显示,SP组和抑制剂组培养液上清TNF-α、IL-1β、NO表达均高于对照组,且SP组升高更明显;说明SP能够促进脊髓星形胶质细胞分泌NO、TNF-α、IL-1β,而SN50具有拮抗SP促进脊髓星形胶质细胞分泌NO、TNF-α、IL-1β的作用。
综上所述,SP能够促进脊髓星形胶质细胞活化并分泌NO、TNF-α、IL-1β,NF-κB信号通路抑制剂SN50能够降低SP的上述作用。本研究为进一步探讨NF-κB信号通路在脊髓星形胶质细胞功能中的作用机制奠定了基础,为减轻中枢神经系统相关疾病导致的疼痛及炎症反应提供了新的思路。
[1] Garré JM, Yang G, Bukauskas FF, et al. FGF-1 triggers pannexin-1 hemichannel opening in spinal astrocytes of rodents and promotes inflammatory responses in acute spinal cord slices[J]. J Neurosci, 2016,36(17):4785-4801.
[2] Eguchi R, Akao S, Otsuguro K, et al. Different mechanisms of extracellular adenosine accumulation by reduction of the external Ca2+concentration and inhibition of adenosine metabolism in spinal astrocytes[J]. J Pharmacol Sci, 2015,128(1):47-53.
[3] Zhang FF, Morioka N, Kitamura T, et al. Proinflammatory cytokines downregulate connexin 43-gap junctions via the ubiquitin-proteasome system in rat spinal astrocytes[J]. Biochem Biophys Res Commun, 2015,464(4):1202-1208.
[4] Song Z, Xiong B, Guan X, et al. Minocycline attenuates bone cancer pain in rats by inhibiting NF-κB in spinal astrocytes[J]. Acta Pharmacol Sin, 2016,37(6):753-762.
[5] Liu J, Du L. PERK pathway is involved in oxygen-glucose-serum deprivation-induced NF-κB activation via ROS generation in spinal cord astrocytes[J]. Biochem Biophys Res Commun, 2015,467(2):197-203.
[6] Ohnou T, Yokai M, Kurihara T, et al. Pituitary adenylate cyclase-activating polypeptide type 1 receptor signaling evokes long-lasting nociceptive behaviors through the activation of spinal astrocytes in mice[J]. J Pharmacol Sci, 2016,130(4):194-203.
[7] 刘涛,曹富江,徐云强,等.腺病毒介导白细胞介素-6基因对脊髓星形胶质细胞生物学行为的影响[J].中华实验外科杂志,2015,32(004):850-853.
[8] Xia X, Ma Y, Yang L, et al. Impact of heat shock protein A 12B overexpression on spinal astrocyte survival against oxygen-glucose-serum deprivation/restoration in primary cultured astrocytes[J]. J Mol Neurosci, 2016,59(4):511-520.
[9] Nam Y, Kim JH, Kim JH, et al. Reversible Induction of pain hypersensitivity following optogenetic stimulation of spinal astrocytes[J]. Cell Rep, 2016,17(11):3049-3061.
[10] Qian B, Li F, Zhao LX, et al. Ligustilide ameliorates inflammatory pain and inhibits TLR4 upregulation in spinal astrocytes following complete freund′s adjuvant peripheral injection[J]. Cell Mol Neurobiol, 2016,36(1):143-149.
[11] Jiang BC, Cao DL, Zhang X, et al. CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5[J]. J Clin Invest, 2016,126(2):745-761.
[12] Shi P, Chen EY, Cs-Szabo G, et al. Biglycan inhibits capsaicin-induced substance p release by cultured dorsal root ganglion neurons[J]. Am J Phys Med Rehabil, 2016,95(9):656-662.
[13] 张佳,韩彬,柴文戍.血必净对内毒素诱导血管内皮细胞TLR4-NF-κB炎症信号通路表达的影响[J].辽宁医学院学报,2016,37(5):10-12.
[14] 马莉,沈燕.NF-κB P65 siRNA对IL-17诱导下MCP-1表达的影响作用[J].中国免疫学杂志,2015,31(10):1333-1336.
[15] 林永忠,孙长凯,吴旻,等.胰岛素对糖尿病大鼠认知功能及脑星形胶质细胞GFAP表达的影响[J].大连医科大学学报,2012,34(4):324-328.
[16] Li ZY, Zhang YP, Zhang J, et al. The possible involvement of JNK activation in the spinal dorsal horn in bortezomib-induced allodynia: the role of TNF-α and IL-1β[J]. J Anesth, 2016,30(1):55-63.
[17] Caiazzo M, Giannelli S, Valente P, et al.Direct conversion of fibroblasts into functional astrocytes by defined transcription factors [J]. Stem Cell Reports, 2015,4(1):25-36.
[18] 宋亚光,魏子淳,王宇,等.针灸预处理对成年和老年甲醛致痛大鼠脊髓NO分布和c-fos表达的影响[J].中国老年学杂志,2016,36(13):3101-3104.
[19] Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis[J]. Lancet Neurol, 2015,14(2):162-173.
[20] Diochot S, Alloui A, Rodrigues P, et al. Analgesic effects of mambalgin peptide inhibitors of acid-sensing ion channels in inflammatory and neuropathic pain[J]. Pain, 2016,157(3):552-559.
中国博士后科学基金资助项目(2013M532112)。
梁伟(E-mail: pdu_3466@163.com)
10.3969/j.issn.1002-266X.2017.44.013
R741
A
1002-266X(2017)44-0045-03
2017-03-15)
