厄贝沙坦对血管紧张素Ⅱ诱导宫颈癌HeLa细胞增殖的影响及其机制
2017-12-11樊霞朱红卫赵彦丽郝巧马梅娟
樊霞,朱红卫,赵彦丽,郝巧,马梅娟
(河北医科大学第四医院,石家庄 050011)
厄贝沙坦对血管紧张素Ⅱ诱导宫颈癌HeLa细胞增殖的影响及其机制
樊霞,朱红卫,赵彦丽,郝巧,马梅娟
(河北医科大学第四医院,石家庄 050011)
目的观察厄贝沙坦对血管紧张素Ⅱ诱导的宫颈癌HeLa细胞增殖的影响,并探讨其机制。方法将体外培养的人宫颈癌HeLa细胞分为厄贝沙坦组、血管紧张素Ⅱ组和对照组。厄贝沙坦组加入终浓度为10-7mol/L的血管紧张素Ⅱ和终浓度为10-5mol/L的厄贝沙坦,血管紧张素Ⅱ组加入终浓度为10-7mol/L的血管紧张素Ⅱ,对照组加入磷酸盐缓冲液。继续培养48 h收集各组细胞,采用MTT法检测各组细胞增殖情况(以OD520表示),采用免疫荧光法检测各组血管紧张素Ⅱ1型受体(AT1R)、血管内皮生长因子(VEGF)和基质金属蛋白酶2(MMP-2)蛋白表达量,采用实时荧光定量PCR法检测各组AT1R、VEGF、MMP-2 mRNA相对表达量。结果厄贝沙坦组、血管紧张素Ⅱ组、对照组OD520分别为5.51±1.13、7.83±1.58、4.30±0.82;血管紧张素Ⅱ组OD520高于对照组,厄贝沙坦组OD520低于血管紧张素Ⅱ组、高于对照组(P均<0.05)。血管紧张素Ⅱ组AT1R、VEGF、MMP-2蛋白表达量及mRNA相对表达量均高于对照组(P均<0.05);厄贝沙坦组AT1R、VEGF、MMP-2蛋白表达量及mRNA表达量均低于血管紧张素Ⅱ组、高于对照组(P均<0.05)。结论厄贝沙坦可抑制血管紧张素Ⅱ诱导后宫颈癌HeLa细胞的增殖能力;降低AT1R、VEGF、MMP-2表达可能是其作用机制。
宫颈癌;厄贝沙坦;血管紧张素Ⅱ;血管紧张素Ⅱ 1型受体;血管内皮生长因子;基质金属蛋白酶2
宫颈癌是女性最常见的恶性肿瘤之一,其发病率仅次于乳腺癌,近年来发病率逐年增加,且患者发病年龄呈现年轻化趋势[1]。目前治疗宫颈癌的新药多侧重于预防,虽然传统的放化疗可部分提高宫颈癌患者的生存率,改善患者预后,但仍然无法降低宫颈癌的复发、转移及耐药,亦无法降低宫颈癌患者的病死率[2,3]。肿瘤微血管的生成是肿瘤发生复发、转移和耐药的必要条件,通过抑制肿瘤的血管生成可以抑制肿瘤细胞的生长和转移[4~6]。文献报道,肿瘤微环境中血管紧张素Ⅱ表达异常升高,并通过调控多种信号通路及下游分子,促进血管内皮生长因子(VEGF)的表达,最终促进肿瘤细胞增殖[7~10]。厄贝沙坦是一种血管紧张素Ⅱ受体拮抗剂,目前主要用于治疗高血压,也可用于逆转左心室肥厚、治疗充血性心力衰竭和糖尿病肾病等[11]。笔者根据厄贝沙坦的作用机制推测厄贝沙坦可以抑制血管紧张素Ⅱ诱导的宫颈癌细胞增殖,但尚未见相关文献报道。2016年2~12月,本研究观察了厄贝沙坦对血管紧张素Ⅱ诱导的宫颈癌HeLa细胞株增殖的影响,并探讨血管紧张素Ⅱ1型受体(AT1R)、VEGF、基质金属蛋白酶2(MMP-2)在其中发挥的作用。
1 材料与方法
1.1 材料 宫颈癌HeLa细胞培养于含10%FBS的RPMI 1640培养基(美国Gibco公司)。兔抗人AT1R、VEGF、MMP-2和GAPDH抗体(美国CST公司),异硫氰酸荧光素标记的羊抗兔荧光二抗(武汉博士德生物工程有限公司),TRIzol试剂(美国Invitrogen公司),RNA抽提试剂盒(美国Applied Biosystems公司),TaqMan逆转录试剂盒 (英国Life Technologies公司),qSYBR-Green-containing PCR试剂盒(美国Qiagen公司),血管紧张素Ⅱ、厄贝沙坦(美国Sigma公司)。Thermo Multiskan Ascent酶标仪(型号413MBY042078,美国萨默飞世尔公司),倒置显微镜(日本Olympus公司)。
1.2 细胞分组处理 将体外培养的人宫颈癌HeLa细胞分为厄贝沙坦组、血管紧张素Ⅱ组和对照组。厄贝沙坦组细胞加入终浓度为10-7mol/L的血管紧张素Ⅱ和终浓度为10-5mol/L的厄贝沙坦,血管紧张素Ⅱ组加入终浓度为10-7mol/L的血管紧张素Ⅱ,对照组加入PBS。继续培养48 h,收集细胞进行后续实验。
1.3 细胞增殖情况观察 采用MTT法。收集各组细胞接种于96孔板,每孔加入MTT 10 μL,继续置于培养箱内培养6 h,每孔加入10%十二烷基磺酸钠100 μL,过夜。第二天取出细胞,振荡10 min,于酶标仪上检测520 nm处的吸光度值(OD520)。实验重复3 次,取平均值。
1.4 细胞AT1R、VEGF、MMP-2蛋白表达检测 采用免疫荧光法。收集各组细胞,加入4%多聚甲醛固定20 min,1%牛血清白蛋白封闭0.5 h,分别加入兔抗人AT1R、VEGF和MMP-2的一抗,4 ℃孵育过夜,经异硫氰酸荧光素标记的羊抗兔荧光二抗室温避光孵育1.5 h,荧光显微镜下拍片,采用显微镜自带ImagePlus7.0软件计算各组荧光强度,以此表示AT1R、VEGF、MMP-2蛋白表达量。
1.5 细胞AT1R、VEGF、MMP-2 mRNA表达检测 采用实时荧光定量PCR法。收集各组细胞,采用TRIzol提取总RNA,操作按试剂盒说明书进行。以上述提取的细胞总RNA为模板,按逆转录试剂盒说明书进行操作,逆转录生成cDNA。以cDNA为模板,按qSYBR-Green-containing PCR试剂盒说明书进行操作,在BioRad IQTM5 Multicolor实时荧光定量系统上检测各组Ct值。AT1R、VEGF、MMP-2引物采用Invitrogen公司生产的AT1R、VEGF、MMP-2探针,以GAPDH为内参照,采用2-ΔΔCt法计算AT1R、VEGF、MMP-2 mRNA相对表达量。
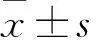
2 结果
2.1 各组细胞增殖情况比较 厄贝沙坦组、血管紧张素Ⅱ组、对照组OD520分别为5.51±1.13、7.83±1.58、4.30±0.82;血管紧张素Ⅱ组OD520高于对照组,厄贝沙坦组OD520低于血管紧张素Ⅱ组、高于对照组(P均<0.05)。
2.2 各组AT1R、VEGF、MMP-2蛋白表达量比较 见表1。
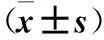
表1 各组AT1R、VEGF、MMP-2蛋白表达量比较
注:与对照组比较,*P<0.05;与血管紧张素Ⅱ组比较,#P<0.05。
2.3 各组AT1R、VEGF、MMP-2 mRNA相对表达量比较 见表2。
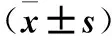
表2 各组AT1R、VEGF、MMP-2 mRNA相对表达量比较
注:与对照组比较,*P<0.05;与血管紧张素Ⅱ组比较,#P<0.05。
3 讨论
随着研究的深入和治疗手段不断完善,宫颈癌的诊断及治疗已取得极大进步,但其病死率并未从本质上得到改善[12]。肿瘤微血管的生成是肿瘤发生复发、转移和治疗耐药的根本原因,通过抑制肿瘤的血管生成可以有效抑制肿瘤细胞的生长和转移[13,14]。因此寻找可直接或间接抑制宫颈癌肿瘤微血管生成的药物是防治其复发转移的有效策略。
研究显示,血管紧张素Ⅱ可通过AT1R诱导心血管效应,而临床上AT1R抑制剂主要用于高血压的治疗[15],常用的AT1R抑制剂有缬沙坦、坎地沙坦和厄贝沙坦等,其中抗高血压效果最为显著、不良反应最小的是厄贝沙坦[16]。ATR1在多种恶性肿瘤中存在过表达现象,如子宫内膜腺癌[17]、甲状腺乳头状癌[18]和肾癌[19]等。本研究结果显示,血管紧张素Ⅱ组细胞增殖活性明显强于对照组,说明血管紧张素Ⅱ可以增强宫颈癌HeLa细胞增殖的能力。进一步研究发现,血管紧张素Ⅱ组AT1R、VEGF、MMP-2蛋白和mRNA表达均高于对照组,说明血管紧张素Ⅱ可能通过提高AT1R、VEGF、MMP-2蛋白和mRNA表达而促进宫颈癌细胞增殖。AT1R、VEGF、MMP-2三种蛋白变化趋势一致,说明三者协同参与了宫颈癌细胞的增殖调控过程。VEGF是肿瘤细胞分泌的重要的血管生成刺激因子,同时VEGF表达与多种恶性肿瘤的复发、转移或预后不良密切相关,其中就包括宫颈癌[20]。研究显示,血管紧张素Ⅱ可通过诱导VEGF的表达,并通过AT1R介导的多种信号通路来刺激和促进毛细血管的形成[21,22],该研究结果也可以用来解释为什么本研究中各组AT1R和VEGF的表达改变会保持一致。肿瘤侵袭和转移是一个涉及多基因和多步骤的复杂过程,其中肿瘤的基底膜被破坏、肿瘤细胞外基质被降解是肿瘤开始发生侵袭和转移的重要标志,而该过程依赖于多种蛋白酶系统的参与,基质金属蛋白酶家族(MMPs)就是其中最重要且庞大的一个细胞酶系,MMP-2也属于该家族。其中MMPs可通过降解细胞外基质中的不同成分,启动或促进肿瘤的侵袭和转移过程。有文献报道,AT1R可促进胃癌的恶性进展,而该过程可能与AT1R促进MMP-2和MMP-9表达上调,并促进血管生成有关[23]。宫颈癌细胞中AT1R与MMP-2表达之间可能也有某种调控关系,共同促进血管的新生。因此,AT1R、VEGF和MMP-2在肿瘤的血管生成中发挥重要作用[24,25]。
本研究结果显示,厄贝沙坦组细胞增殖活性明显低于血管紧张素Ⅱ组,说明厄贝沙坦可以抑制血管紧张素Ⅱ对宫颈癌细胞增殖的促进作用。进一步研究发现,厄贝沙坦组AT1R、VEGF、MMP-2蛋白和mRNA表达较血管紧张素Ⅱ组下降,这与厄贝沙坦的作用机制是相符合的。目前寻找抑制肿瘤血管生成的药物已成为新药研发或药物适应证拓展的一个重要策略,且已有许多此类抑制肿瘤血管生成的药物已被用于临床。本研究结果提示厄贝沙坦可能有治疗宫颈癌的潜力,但仍需要进一步研究证实。
[1] Shi JF, Canfell K, Lew JB, et al. The burden of cervical cancer in china synthesis of the evidence[J]. Br J cancer, 2012,130(3):641-652.
[2] Eskander RN, Tewari KS. Chemotherapy in the treatment of metastatic, persistent, and recurrent cervical cancer[J]. Curr Opin Obstet Gynecol, 2014,26(4):314-321.
[3] 刘焕芝.宫颈癌的治疗进展[J].中国当代医药,2010,17(25):19-20.
[4] 栾宁,王雪峰.VEGF-C与肿瘤转移的研究进展[J].现代肿瘤医学,2009,17(09):1805-1807.
[5] Pezzolo A, Parodi F, Corrias MV, et al. Tumor origin of endothelial cells in human neuroblastoma[J]. J Clin Oncol, 2007,25(4):376-383.
[6] Lowy CM, Oskarsson T. Tenascin C in metastasis: a view from the invasive front[J]. Cell Adh Migr, 2015,9(1-2):112-124.
[7] Meng YC, Ding ZY, Wang HQ, et al. Effect of microRNA-155 on angiogenesis after cerebral infarction of rats through AT1R/VEGFR2 pathway[J]. Asian Pac J Trop Med, 2015,8(10):829-835.
[8] Walter A, Etienne-Selloum N, Sarr M, et al. Angiotensin Ⅱ induces the vascular expression of VEGF and MMP-2 in vivo: preventive effect of red wine polyphenols[J]. J Vasc Res, 2008,45(5):386-394.
[9] Choke E, Cockerill GW, Dawson J, et al. Vascular endothelial growth factor enhances angiotensin Ⅱ-induced aneurysm formation in apolipoprotein E-deficient mice[J]. J Vasc Surg, 2010,52(1):159-166.
[10] Mansour MA, Al-Ismaeel H, Al-Rikabi AC, et al. Comparison of angiotensin converting enzyme inhibitors and angiotensin Ⅱ type 1 receptor blockade for the prevention of premalignant changes in the liver[J]. Life Sci, 2011,89(5-6):188-194.
[11] 常世忠,方薇,梅友健.厄贝沙坦临床应用研究[J].安徽医药,2003,7(6):463-464.
[12] Shostka KG, Pavlenko AN, Fokina AV, et al. Immediate and long-term results of treatment after pelvic exenteration for locally advanced cervical cancer[J]. Vopr Onkol, 2014,60(3):319-322.
[13] Liu WT, Jing YY, Yu GF, et al. Toll like receptor 4 facilitates invasion and migration as a cancer stem cell marker in hepatocellular carcinoma[J]. Cancer Lett, 2015,358(2):136-143.
[14] Feng LH, Dong H, Lau WY, et al. Novel microvascular invasion-based prognostic nomograms to predict survival outcomes in patients after R0 resection for hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2017,143(2):293-303.
[15] Miyajima A, Kosaka T, Asano T, et al. Angiotensin Ⅱ type Ⅰ antagonist prevents pulmonary metastasis of murine renal cancer by inhibiting tumor angiogenesis[J]. Cancer Res, 2002,62(15):4176-4179.
[16] Ismail B, deKemp RA, Hadizad T, et al. Decreased renal AT1 receptor binding in rats after subtotal nephrectomy: PET study with[(18)F]FPyKYNE-losartan[J]. EJNMMI Res, 2016,6(1):55.
[17] 赵万成,杨清,王玉.AngⅡ及AT1R在子宫内膜腺癌的表达及临床意义[J].现代妇产科进展,2011,20(2):109-112.
[18] 张志宇,张会娟,王俊宏.甲状腺乳头状癌组织中ANG-Ⅱ,AT1R,VEGF表达及意义[J].山东医药,2009,49(7):89-90.
[19] 郭刚,施国海,张帆,等.血管紧张素系统抑制剂与舒尼替尼治疗晚期肾癌患者疗效的相关性研究[J].临床泌尿外科杂志,2015,30(4):294-298.
[20] Rader JS, Sill MW, Beumer JH, et al. A stratified randomized double-blind phase Ⅱ trial of celecoxib for treating patients with cervical intraepithelial neoplasia: the potential predictive value of VEGF serum levels: an NRG Oncology/Gynecologic Oncology Group study[J]. Gynecol Oncol, 2017,145(2):291-297.
[21] Wang X, Bai YP, Hong D, et al. Ang Ⅱ induces capillary formation from endothelial cells via the AT1R-dependent inositol requiring enzyme 1 pathway[J]. Biochem Biophys Res Commun, 2013,434(3):552-558.
[22] Zhou L, Luo Y, Sato S, et al. Role of two types of angiotensin Ⅱ receptors in colorectal carcinoma progression[J]. Pathobiology, 2014,81(4):169-175.
[23] Huang W, Yu LF, Zhong J, et al. Angiotensin Ⅱ type 1 receptor expression in human gastric cancer and induces MMP2 and MMP9 expression in MKN-28 cells[J]. Dig Dis Sci, 2008,53(1):163-168.
[24] Gorman JL, Liu ST, Slopack D, et al. Angiotensin Ⅱ evokes angiogenic signals within skeletal muscle through co-ordinated effects on skeletal myocytes and endothelial cells[J]. PLoS One, 2014,9(1):85537.
[25] Tanaka N, Miyajima A, Kosaka T, et al. Cis-dichlorodiammineplatinum upregulates angiotensin Ⅱ type 1 receptors through reactive oxygen species generation and enhances VEGF production in bladder cancer[J]. Mol Cancer Ther, 2010,9(11):2982-2992.
河北省科技计划项目(162777266)。
10.3969/j.issn.1002-266X.2017.44.010
R737.3
A
1002-266X(2017)44-0036-03
2017-09-15)
