独活寄生汤含药血清对膝关节OA大鼠滑膜细胞TNF-α、IL-6、IL-8、IL-10表达的影响及其机制
2017-12-11杜津莉樊炜骏李建陈少青孙鹏
杜津莉,樊炜骏,李建,陈少青,孙鹏
(1天津中医药大学第一附属医院,天津300193;2内蒙古民族大学附属医院)
独活寄生汤含药血清对膝关节OA大鼠滑膜细胞TNF-α、IL-6、IL-8、IL-10表达的影响及其机制
杜津莉1,樊炜骏1,李建1,陈少青2,孙鹏1
(1天津中医药大学第一附属医院,天津300193;2内蒙古民族大学附属医院)
目的探讨独活寄生汤含药血清对膝关节骨关节炎(OA)大鼠滑膜细胞炎症因子表达的影响及其可能机制。方法采用Hulth法建立OA大鼠模型,分离膝关节滑膜细胞,采用酶原消化法进行培养,并将其分为模型组及低、中、高剂量组,以正常大鼠膝关节滑膜细胞为对照组。低、中、高剂量组分别加入经独活寄生汤中药0.85、1.7、3.4 mL/kg灌胃大鼠的含药血清,对照组与模型组加入等量20% FBS,培养48 h。采用ELISA法检测各组细胞TNF-α、IL-6、IL-8及IL-10表达,超高效液相色谱-高分辨质谱法检测各组细胞脂氧素A4表达,Western blotting法检测各组细胞抗c-Jun氨基末端激酶(JNK)、磷酸化JNK(p-JNK)、激活子蛋白1(AP-1)及磷酸化AP-1(p-AP-1)表达。结果对照组、高剂量组、中剂量组、低剂量组和模型组细胞TNF-α、IL-6、IL-8表达均依次升高,IL-10、脂氧素A4表达依次降低,组间两两比较P均<0.05。与对照组比较,模型组细胞AP-1、p-AP-1、JNK及p-JNK表达均升高(P均<0.05);与模型组比较,高、中、低剂量组细胞AP-1、p-AP-1、JNK及p-JNK表达均降低,且高剂量组降低更明显(P均<0.05)。结论独活寄生汤含药血清可降低膝关节OA大鼠滑膜细胞TNA-α、IL-6、IL-8、IL-10表达,并呈剂量依赖性;提高滑膜细胞脂氧素A4表达、抑制JNK、AP-1及其磷酸化通路可能是其作用机制。
骨关节炎;膝关节;独活寄生汤;滑膜细胞;脂氧素A4;炎症反应;大鼠
60岁以上男性骨关节炎(OA)发病率约为9.6%,女性发病率约为18%[1]。OA的病理表现为关节软骨变性及丢失,最易受累的关节为膝关节[2]。中医认为,膝关节OA属于“骨痹”、“膝痹”范畴,多为肝肾亏虚、外感寒湿所致[3]。独活寄生汤具有祛风湿、止痹痛、益肝肾、补气血之功效,既往关于独活寄生汤治疗膝关节OA的临床效果及其对关节软骨细胞作用的研究较多[4],但其对滑膜细胞的影响鲜见报道。2016年8~12月,本研究观察了独活寄生汤含药血清对膝关节OA大鼠滑膜细胞炎症因子表达的影响,现分析结果并探讨其可能的机制。
1 材料与方法
1.1 材料 实验动物:雄性Wistar大鼠60只,6周龄,体质量(180±5)g,由天津中医药大学医学动物实验中心提供,动物合格证号:SCXK(津)2009-002。主要试剂:抗激活子蛋白1(AP-1)、抗磷酸化AP-1(p-AP-1)、抗c-Jun氨基末端激酶(JNK)、抗磷酸化JNK(p-JNK)、抗β-肌动蛋白(β-actin)购于美国Abcam公司,TNF-α、IL-6、IL-8、IL-10 ELISA试剂盒购于中国欣博盛生物科技有限公司。主要仪器:5804R高速冷冻离心机购于德国Eppendorf公司,光学显微镜购于日本Olympus公司。
1.2 独活寄生汤含药血清制备 独活寄生汤方药组成:独活9 g,桑寄生6 g,当归6 g,茯苓6 g,党参6 g,熟地黄6 g,防风6 g,秦艽6 g,白芍6 g,川牛膝6 g,川芎6 g,制川乌6 g (先煎),细辛6 g,甘草6 g,由天津中医药大学附属医院中药制剂室浓缩煎制成浓度为1 g/mL的药液。选择雄性Wistar大鼠30只,随机分为三组,每组10只。按照人鼠体表面积比值进行换算[3],分别给予独活寄生汤中药0.85、1.7、3.4 mL/kg灌胃,1次/d,连续给药14天。末次给药2 h后处死,于无菌条件下采集腹主动脉血5 mL,静置2 h。4 ℃条件下2 000 r/min离心10 min,分离血清,分别记为低、中、高剂量含药血清。56 ℃水浴灭活,-80 ℃冰箱保存备用。
1.3 滑膜细胞提取及鉴定 随机选择雄性Wistar大鼠15只,采用Hulth法建立膝关节OA模型,方法如下:无菌条件下于大鼠膝关节内侧纵行切开约2 cm,眼科剪剪断内侧副韧带及前、后交叉韧带,仅保留关节软骨面;缝合切口后不固定伤肢,腹腔注射青霉素钠3×104U预防感染[5]。术后给予正常饮食,自由活动。造模4周处死,切取膝关节OA大鼠滑膜组织,清洗后用眼科无菌剪剪成约1 mm3小块。加入含10% FBS的Ⅱ型胶原酶约6 mL,消化3 h,吹打细胞悬浊液、离心;加入2 mL DMEM培养液,200目筛网过滤、离心。弃上清后加入4 mL DMEM培养液,吹打混匀细胞沉淀。选择正常雄性Wistar大鼠15只,参照上述方法分离滑膜细胞。取分离的膝关节OA大鼠及正常大鼠的滑膜细胞,培养48 h,光镜下观察细胞形态;4%多聚甲醛固定,PBS缓冲液冲洗,采用免疫组化法检测滑膜细胞标志性蛋白(波形蛋白)表达,所有操作严格参照说明书进行。结果显示,细胞以梭型为主,细胞波形蛋白表达呈阳性,符合滑膜细胞形态及特征。
1.4 细胞分组处理 取对数生长期的膝关节OA大鼠滑膜细胞接种于6孔板中,调整细胞密度为5×104个/孔,将细胞随机分为模型组及低、中、高剂量组。低、中、高剂量组细胞分别加入1.2中保存备用的低、中、高剂量含药血清1 mL,24 h更换一次同样的含药血清,共培养48 h。模型组加入等量20% FBS,培养48 h。取对数生长期的正常大鼠滑膜细胞作为对照组,接冲6孔板,调整细胞密度为5×104个/孔,加入等量20% FBS,培养48 h。
1.5 细胞TNF-α、IL-6、IL-8及IL-10表达检测 采用ELISA法。培养48 h,采用ELISA试剂盒检测各组细胞TNF-α、IL-6、IL-8及IL-10表达。所有操作严格参照说明书进行,试剂盒灵敏度均为1 pg/mL。实验重复3次,取平均值。
1.6 细胞脂氧素A4表达检测 采用超高效液相色谱-高分辨质谱法。培养48 h,各组细胞采用PBS缓冲液清洗2次,液氮铺满培养孔,待液氮蒸发后,每孔加入0.75 mL甲醇-水溶液(体积比4∶1)。用细胞刮刀刮下细胞,经三氯甲烷萃取溶液中的脂溶性成分,沉淀后上层用等体积乙腈沉淀蛋白,加入0.1%甲酸水溶液复溶,采用超高效液相色谱-高分辨质谱法进行分析。色谱柱柱温40 ℃,流动相:(A)含0.1%甲酸的水溶液;(B)甲醇流动相梯度组成:1~3 min,8%~85%流动相B;3~6 min,85%~100%流动相B;6~8 min,100%流动相B;8~9 min, 100%~8%流动相B;9~11 min,8%流动相B。流速0.5 mL/min;样品进样量10 μL。质谱分析条件:ESI离子源,采用正、负离子模式。正离子模式:毛细管电压2.6 kV,锥孔电压60 V,离子源、雾化温度分别为110、470 ℃,壳气流速900 L/h;负离子模式:毛细管电压2.6 kV,锥孔电压40 V,离子源、雾化温度分别为70、160 ℃,壳气流速550 L/h;亮氨酸脑啡肽做为质谱内标,采用甲酸钠校正质量轴。采用Masslynx V4.1软件进行峰提取、峰对齐及归一化处理,通过HMDB及METLIN等精确质量检索数据库[6]确定脂氧素A4相对分子质量。采用正交偏最小二乘判别法计算脂氧素A4表达,实验重复3次,取平均值。
1.7 细胞AP-1、p-AP-1、JNK及p-JNK表达检测 采用Western blotting法。作用48 h,取各组细胞,加入RIPA裂解液及蛋白酶抑制剂PMSF,提取蛋白质,测定浓度合格。取15 μL蛋白进行10% SDS-PAGE,常规转膜后脱脂奶粉封闭;加入抗AP-1、抗p-AP-1、抗JNK或抗p-JNK一抗(稀释比例分别为1∶1 000、1∶500、1∶500、1∶500),4 ℃孵育过夜,TBST洗脱5 min×3次;加入辣根过氧化酶标记的二抗,室温孵育2 h,TBST洗脱10 min×3次,ECL化学发光显像[7]。采用Image J软件分析条带灰度值,以目的蛋白与内参蛋白β-actin灰度值的比值计算目的蛋白的相对表达量。实验重复3次,取平均值。
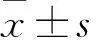
2 结果
2.1 各组细胞TNF-α、IL-6、IL-8及IL-10表达比较 见表1。
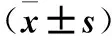
表1 各组细胞TNF-α、IL-6、IL-8及IL-10表达比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▽P<0.05。
2.2 各组细胞脂氧素A4表达比较 对照组、高剂量组、中剂量组、低剂量组和模型组细胞脂氧素A4表达分别为27.47±5.08、24.78±2.37、16.12±1.47、13.48±2.1、5.63±2.62,组间两两比较P均<0.05。
2.3 各组细胞AP-1、p-AP-1、JNK及p-JNK表达比较 见表2。
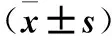
表2 各组细胞AP-1、p-AP-1、JNK及p-JNK相对表达量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,△P<0.05;与中剂量组比较,▽P<0.05。
3 讨论
既往研究认为,OA的主要发病机制为软骨降解及关节边缘骨赘形成[8]。近年来滑膜细胞在OA发病及进展中的作用逐渐受到重视[9]。滑膜细胞可通过自分泌和旁分泌的方式产生大量炎症因子,从而干扰软骨生成和加速软骨基质降解,进而诱发OA临床症状和疾病进展[10]。因此,抑制滑膜细胞炎症因子分泌可能成为治疗或辅助治疗OA的新方向。独活寄生汤由独活、桑寄生、杜仲、牛膝等15味中药组成,是《备急千金方》中治疗下肢痹痛的经典方剂。邝高艳等[11]采用独活寄生汤治疗OA患者838例,结果显示独活寄生汤治疗OA疗效肯定,且不良反应较少。另有研究报道,独活寄生汤可抑制关节液中IL-6、TNF-α、基质金属蛋白酶1(MMP-1)表达,减轻炎症反应对关节软骨的破坏[12]。
脂氧素A4是目前为止人类发现具有广泛抗炎作用的脂质类抗炎递质之一[13]。已有研究证实,脂氧素A4与关节炎的发生有着广泛而密切的联系[14]。Alexander等[15]研究证实,脂氧素A4可抑制JNK信号通路激活,进而抑制微血管的炎症渗出及炎性因子表达。Bitto等[16]研究证实,脂氧素A4可通过降低JNK及p-JNK的表达减少炎性因子TNF-α、IL-6生成,同时提高抗炎因子IL-10 表达。Wu等[17]研究发现,脂氧素A4可抑制JNK激活,进而降低AP-1表达并减少其向细胞核转移,从而降低IL-6、IL-8等炎性因子表达。TNF-α可通过降解软骨基质、提高其他炎性因子活性、促进骨膜细胞产生前列腺素E2等多个方面破坏膝关节软骨组织[18]。IL-6可抑制骨糖蛋白合成,并促进成纤维细胞和基质微分子的降解,从而加重软骨损伤[19]。IL-8是目前已知作用最强的中性粒细胞趋化因子,可由滑膜细胞本身分泌,促使炎症细胞向炎症部位募集,增强对关节软骨的损伤作用[20];抑制滑膜细胞中IL-8表达有可能成为延缓OA发病进程的关键因素。IL-10在OA的发病中具有双重作用,一方面当OA滑膜细胞具有炎症反应时,高表达的IL-10可抑制TNF-α、IL-6生成,另一方面IL-10可以抑制单核巨噬细胞释放免疫介质,从而保护OA软骨细胞[21]。
本研究结果显示,对照组、高剂量组、中剂量组、低剂量组和模型组细胞TNF-α、IL-6、IL-8表达均依次升高,IL-10表达均依次降低;说明独活寄生汤含药血清可抑膝关节OA大鼠滑膜细胞炎性因子分泌,并呈剂量依赖性。本研究模型组细胞AP-1、p-AP-1、JNK及p-JNK表达均高于对照组,脂氧素A4表达均低于对照组,说明脂氧素A4表达下降可能通过升高AP-1、JNK及其磷酸化水平而促进滑膜细胞分泌炎性因子,从而参与OA的发生与发展。本研究高、中、低剂量组细胞中AP-1、p-AP-1、JNK及p-JNK表达均低于模型组,脂氧素A4表达高于模型组,且高剂量组变化更明显,说明独活寄生汤含药血清可提高OA滑膜细胞脂氧素A4表达,降低JNK、AP-1及其磷酸化水平,并呈剂量依赖性。
综上所述,独活寄生汤含药血清可降低膝关节OA大鼠滑膜细胞炎症因子表达,并呈剂量依赖性;提高滑膜细胞脂氧素A4表达、抑制JNK、AP-1及其磷酸化通路可能是其作用机制。
[1] Woolf AD, Pfleger B. Burden of major musculoskeletal conditions[J]. Bull World Health Organ, 2003,81(9):646-656.
[2] 张磊,孙德昱.双醋瑞因联合独活寄生汤治疗中老年膝骨性关节炎[J].中国实验方剂学,2013,19(2):299-302.
[3] 兰平文,沈彬.TGF-β/BMP信号通路在骨关节炎软骨细胞退变中的作用机制[J].中华关节外科杂志(电子版),2015,9(5):644-647.
[4] 车萍,季旭明,梁粟,等.独活寄生汤对佐剂性关节炎大鼠的抗炎镇痛作用及血清中5-HTP, 5-HIAA的影响[J].中国实验方剂学杂志,2014,20(19):170-173.
[5] 袁琴,阚卫兵,宋鹏飞,等.补肾活血方对大鼠膝骨关节炎滑膜细胞β-catenin、MMP-7的影响[J].中国骨伤,2012,25(9):761-765.
[6] 王曦烨,单晓彤,王伊林,等.丹参多酚酸盐改善扩张性心肌病心肌功能的作用机制[J].高等学校化学学报,2016,37(5):844-851.
[7] 王伊林,赵雅君,杨洋,等.磷酸肌酸钠对慢病毒介导Calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
[8] Goncalves FB, Rocha FA, Albuquerque RP, et al. Reproducibility assessment of different descriptions of the kellgren and lawrence classification for osteoarthritis of the knee[J]. Rev Bras Ortop, 2016,510(6):687-691.
[9] 许传勇,宋鹏飞,阚卫兵,等.塞来昔布胶囊对大鼠膝骨性关节炎滑膜细胞β-catenin和基质金属蛋白酶-7的影响[J].广东医学,2013,34(5):678-681.
[10] 吴广文,陈俊,叶锦霞,等.透骨消通胶囊含药血清对膝骨关节炎滑膜细胞uPA系统及炎性因子的影响[J].中国组织工程研究,2015,19(16):6005-6009.
[11] 邝高艳,严可,柴爽,等.独活寄生汤加减治疗膝骨关节炎疗效及安全性的Meta分析[J].中医药导报,2016,22(17):59-62.
[12] 李军,王朝阳.独活寄生汤对兔膝骨性关节炎关节液肿瘤坏死因子-α、白介素-6和基质金属蛋白酶-1水平的影响[J].中国老年学杂志,2012,32(5):1002-1003.
[13] Romano M. Lipoxin and aspirin-triggered lipoxins[J]. Scientific World J, 2010,10(2):1048-1064.
[14] 程璐璐,陈朝辉,张慧,等.脂氧素与类风湿关节炎的相关性研究[J].中国免疫学杂志,2016,32(11):1721-1724.
[15] Alexander Q, Ereso MD, Victorino MD, et al. Lipoxin A4 attenuates microvascular fluid leak during inflammation[J]. J Surg Res, 2009,156(2):183-188.
[16] Bitto A, Minutoli L, Altavilla D, et al. Flavocoxid a dual inhibitor of COX-2 and 5-LOX of natural origin, attenuates the inflammatory response and protects mice from sepsis[J]. Critical Care, 2012,16(1):32.
[17] Wu SH, Liao PY, Chen ZQ, et al. Signal pathway involved in inhibition by lipoxin A4 of production of interleukins induced in endothelial cells by lipopolysaccharide[J]. Inflamm Res, 2008,57(9):430-437.
[18] 陈元良,张涛,钟海波.骨碎补总黄酮对骨性关节炎血清IL-1、IL-8及TNF-α表达的影响[J].陕西中医,2013,34(9):1251-1253.
[19] 张新玉,黄炳仓,无墅,等.影像学检查与细胞因子与膝骨关节炎患者病情活动的相关性研究[J].临床和实验医学杂志,2015,14(13):1082-1085.
[20] 罗心静,莫选荣,周玲玲.Hsp72对类风湿关节炎滑膜细胞IL-6、IL-8表达及NF-kB活化的影响[J].中国应用生理学杂志,2012,28(4):336-339.
[21] 潘建科,罗斌,郭达,等.龙鳖胶囊对膝骨关节炎大鼠IL-1β、IL-6、IL-10水平的影响[J].中华中医药杂志,2015,30(5):1675-1679.
EffectofDuhuoJishengdecoctiondrug-containingserumonexpressionofsynovialcellTNA-α,IL-6,IL-8,IL-10inkneeosteoarthritisrats
DUJinli1,FANWeijun,LIJian,CHENShaoqing,SUNPeng
(1TheFirstTeachingHospitalofTianjinUniversityofTraditionalChineseMedicine,Tianjin200193,China)
ObjectiveTo observe the effect of Duhuo Jisheng decoction drug-containing serum on the expression of inflammatory factors in synovial cells of knee osteoarthritis (OA) rats and to explore its possible mechanism.MethodsThe rat model of OA was established by Hulth method. The synovial cells of knee joint were cultured by enzymatic digestion. The synovial cells were divided into the model group and low-dose, medium-dose and high-dose groups. The normal rat synovial cells were used as the control group. The rats in the low-dose, medium-dose and high-dose groups were added with the serum containing Duhuo Jisheng decoction 0.85, 1.7 and 3.4 mL/kg by gavage, respectively, while rats in the control group and the model group were given the same amount of 20% fetal bovine serum, and then both of them were cultured for 48 h. The levels of TNF-α, IL-6, IL-8, and IL-10 were detected by ELISA. The expression of lipoxin A4 was detected by high performance liquid chromatography-high resolution mass spectrometry. Western blotting was used to detect the expression of Anti-c-Jun amino terminal kinase (JNK) , p-JNK, activator protein 1 (AP-1), and p-AP-1 expression.ResultsThe expression levels of TNF-α, IL-6, and IL-8 in the control group, high-dose group, medium-dose group, low-dose group, and model group gradually increased, the expression levels of IL-10 and lipoxin A4 gradually decreased, and significant difference was found between every two groups (allP<0.05). Compared with the control group, the expression levels of AP-1, p-AP-1, JNK, and p-JNK in the model group increased (allP<0.05). Compared with the model group, the expression levels of AP-1, p-AP-1, JNK, and p-JNK gradually decreased in the high-dose, medium-dose and low-dose groups, and the decrease was more significant in the high-dose group (allP<0.05).ConclusionDuhuo Jisheng decoction can reduce the expression of TNA-α, IL-6, IL-8, IL-10 in the synovial cells of knee OA rats in a dose-dependent manner by inhibiting JNK, AP-1 and its phosphorylation pathway and increasing the expression of lipoxin A4 in synovial cells.
osteoarthritis; knee; Duhuo Jisheng decoction; synovial cells; lipoxy A4; inflammatory response; rats
内蒙古自治区自然科学基金资助项目(2016MS08125)。
杜津莉(1980-),女,主治医师,研究方向为脊柱、关节疾病的发病机制及治疗。E-mail: zydujinli@126.com
陈少青(1980-),男,副主任医师,研究方向为脊柱、关节疾病的发病机制及治疗。E-mail: jxtgteam@163.com
10.3969/j.issn.1002-266X.2017.44.004
R684.3
A
1002-266X(2017)44-0014-04
2017-01-16)
