力达霉素对人宫颈癌Caski细胞增殖的影响及其机制
2017-12-11鲁华秦烨占景琼王艳林
鲁华,秦烨,占景琼,王艳林
(三峡大学肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌443002)
·论著·
力达霉素对人宫颈癌Caski细胞增殖的影响及其机制
鲁华,秦烨,占景琼,王艳林
(三峡大学肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌443002)
目的探讨力达霉素对人宫颈癌Caski细胞增殖的影响及其可能的机制。方法将对数生长期的人宫颈癌Caski细胞随机分为低、中、高浓度组及对照组,低、中、高浓度组均加入含力达霉素的RPMI 1640完全培养基100 μL,分别调整其终浓度为1、2.5、5 ng/mL,对照组仅加入等体积RPMI 1640完全培养基。作用24 h,采用MTT法检测细胞增殖能力(以吸光度值表示),计算细胞生存率;采用流式细胞术检测细胞周期及线粒体膜电位降低比例;透射电子显微镜下观察细胞形态学改变,计算细胞凋亡率及裂亡率。结果低、中、高浓度组细胞增殖能力及细胞生存率均低于对照组,且高浓度组降低更明显(P均<0.01)。对照组及中浓度组S期细胞比例均高于低、高浓度组(P均<0.05)。低、中、高浓度组G0/G1期细胞比例均低于对照组,G2/M期细胞比例均高于对照组,且中、高浓度组变化更明显(P均<0.05)。低、中、高浓度组及对照组细胞线粒体膜电位降低比例分别为(34.77±5.33)%、(37.87±5.73)%、(18.37±3.91)%、(4.17±0.65)%;低、中、高浓度组细胞线粒体膜电位降低比例均高于对照组,且低、中浓度组均高于高浓度组(P均<0.05)。透射电镜下可见对照组细胞形态正常,低、中、高浓度组存在多种形态的死亡细胞,包括凋亡、坏死、裂亡的细胞。对照组及高、低、中浓度组细胞凋亡率及裂亡率均依次升高,两组间比较P均<0.05。结论力达霉素可抑制人宫颈癌Caski细胞增殖,并呈浓度依赖性,其机制可能与诱导细胞凋亡或裂亡有关。
宫颈癌;力达霉素;人宫颈癌Caski细胞;细胞凋亡;细胞裂亡;线粒体膜电位
力达霉素是一种从链霉菌中分离的大分子肽类抗生素[1],对多种肿瘤(如肺癌、胰腺癌、肝癌等)具有强烈的细胞毒作用[2~6],其在细胞水平上的抗肿瘤活性显著高于临床上常用的抗肿瘤药物,如阿霉素、丝裂霉素C、甲氨蝶呤等。研究表明,力达霉素可抑制肺癌、结肠癌、乳腺癌、胃癌、肝癌等细胞移植后的裸鼠成瘤能力,并通过多种机制抑制肿瘤生长,且可能对肿瘤细胞的增殖具有特异性影响[2~5]。2015年3月~2016年6月,本研究观察了力达霉素对人宫颈癌Caski细胞增殖的影响,现分析结果并探讨其可能的机制。
1 材料与方法
1.1 材料 细胞:人宫颈癌Caski细胞购于武汉大学细胞典藏中心,由三峡大学肿瘤微环境与免疫治疗湖北省重点实验室传代保存。主要药物及试剂:力达霉素由中国医学科学院生物技术研究所甄永苏院士惠赠,MitoProbe TM JC-1流式细胞术检测试剂盒及RPMI 1640完全培养基均购于美国Invitrogen公司。主要仪器:全波长酶标仪购于美国Thermo Fisher公司;H-7500透射电子显微镜购于日本日立公司;超薄切片机购于德国莱卡公司;EPICSXL-4流式检测仪购于美国Beckman-coulter公司。
1.2 细胞培养与分组处理 取对数生长期的人宫颈癌Caski细胞,以3 000个/孔接种至96孔板,采用RPMI 1640完全培养基,于37 ℃、5% CO2培养箱中培养20 h。将人宫颈癌Caski细胞随机分为低、中、高浓度组及对照组,低、中、高浓度组均加入含力达霉素的RPMI 1640完全培养基100 μL,分别调整其终浓度为1、2.5、5 ng/mL,对照组仅加入等体积RPMI 1640完全培养基,37 ℃、5% CO2培养箱中培养。每组设置4个复孔。
1.3 细胞增殖情况检测 采用MTT法。取各组作用24 h细胞,每孔加入含0.5% MTT的RPMI 1640完全培养基(终浓度为250 μg/mL),继续培养4 h。弃上清,每孔加入250 μL二甲基亚砜,置摇床上低速振荡10 min,充分溶解结晶物。采用酶联免疫检测仪测量490 nm波长处的吸光度(OD)值,以此表示细胞增殖能力,并计算细胞生存率。细胞生存率=OD药物/OD对照×100%。
1.4 细胞周期检测 采用流式细胞术。收集各组作用24 h细胞,离心弃上清,预冷PBS冲洗2次,预冷70%乙醇4 ℃固定30 min。2 000 r/min离心5 min,弃上清,1 mL PBS冲洗1次。采用含0.2% TritonX-100和100 μg/mL RNase的PBS混合液500 μL重悬细胞,加入碘化丙啶(50 μg/ mL)避光孵育30 min,300目尼龙网进行过滤,上流式细胞仪检测细胞周期。
1.5 细胞凋亡情况检测 采用流式细胞术。收集各组作用24 h细胞,用预温至37 ℃的培养基1 mL重悬细胞,边振荡边加入2.5 mL荧光染料JC-1储存液(终浓度2.5 μg/mL),37 ℃避光保存10 min。加入2 mL PBS至细胞悬液中,2 000 r/min离心5 min,弃上清,0.3 mL PBS重悬细胞。上流式细胞仪检测细胞线粒体膜电位降低比例,以此反映细胞凋亡情况。
1.6 细胞形态学改变及死亡细胞分类 收集各组作用24 h细胞,2 000 r/min离心5 min,弃上清,戊二醛溶液固定,超薄切片机制片。以200目透射电镜铜网为载体,随机选取10目,采用透射电子显微镜在不同放大倍数下(×5 000、×6 000、×7 000)观察细胞形态学改变,计数凋亡及裂亡细胞,计算细胞凋亡率及裂亡率。
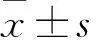
2 结果
2.1 各组细胞增殖情况比较 低、中、高浓度组细胞增殖能力及细胞生存率均低于对照组,且高浓度组降低更明显(P均<0.01)。见表1。
2.2 各组细胞周期比较 对照组及中浓度组S期细胞比例均高于低、高浓度组(P<0.05或<0.01)。低、中、高浓度组G0/G1期细胞比例均低于对照组,G2/M期细胞比例均高于对照组,且中、高浓度组变化更明显(P<0.05或<0.01)。见表2。
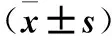
表1 各组细胞增殖情况比较
注:与对照组比较,*P<0.01;与高浓度组比较,#P< 0.01。
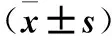
表2 各组细胞周期比较
注:与对照组比较,*P<0.05,#P<0.01;与低浓度组比较,△P<0.05,▽P<0.01;与中浓度组比较,▲P<0.05。
2.3 各组细胞凋亡情况比较 低、中、高浓度组及对照组细胞线粒体膜电位降低比例分别为(34.77±5.33)%、(37.87±5.73)%、(18.37±3.91)%、(4.17±0.65)%;低、中、高浓度组细胞线粒体膜电位降低的细胞比例均高于对照组,且低、中浓度组升高更明显(P均<0.05);低、中浓度组细胞线粒体膜电位降低的细胞比例比较差异无统计学意义(P>0.05)。
2.4 各组细胞形态学变化 对照组细胞膜完整,向外形成大量纤细突起的微绒毛;细胞质染色正常,可见线状、长杆状线粒体;细胞核常染色质(低电子密度)、异染色质(高电子密度)分布均匀。低、中、高浓度组存在多种形态的死亡细胞,包括凋亡、坏死、裂亡的细胞。死亡细胞的主要特点:①凋亡中期细胞体积变小,细胞核深染,异染色质边集,核膜和细胞质膜完整,细胞质内可见空泡形成,细胞膜上可见以发芽、起泡等方式形成的多个球形突起。凋亡晚期细胞体积进一步变小,细胞质少而深,细胞体周围可见多个球形突起脱落形成的一些大小不等的凋亡小体。②坏死早期细胞核染色质边集,核中部电子密度低;细胞质结构崩解,呈颗粒状;线粒体、内质网崩解形成空泡状结构,可见其中含有中等电子密度的无定形电子致密物。坏死晚期细胞膜破裂,细胞质逸出;细胞微绒毛消失,细胞质结构崩解,呈疏松颗粒状;细胞器崩解空泡形成,染色质变淡呈颗粒状凝集,只可见到细胞核轮廓。③裂亡早期细胞体积变大,细胞有丝分裂异常形成大小不等多个细胞核。裂亡晚期细胞体积进一步变大,细胞表面光滑,微绒毛消失,细胞质内充满线粒体,内质网肿胀崩解形成的空泡状结构;细胞核常染色质与异染色质差异消失,呈砂砾样改变。
2.5 各组细胞凋亡率及裂亡率比较 对照组及高、低、中浓度组细胞凋亡率依次升高,对照组及低、中、高浓度组细胞裂亡率依次升高,两组间比较P<0.05或<0.01。见表3。

表3 各组细胞凋亡率及裂亡率比较
注:与对照组比较,*P<0.05,#P<0.01;与低浓度组比较,△P<0.05,▽P<0.01;与中浓度组比较,▲P<0.05,▼P<0.01。
3 讨论
力达霉素是一种新型抗肿瘤药物,其对肝癌BEL-7402细胞DNA、RNA合成具有强烈的抑制作用[7],对结肠癌HCT-116细胞具有明显的细胞周期阻滞作用(阻滞于G2/M期)[8],并能显著诱导早幼粒白血病HL-60细胞、胰腺癌细胞、骨髓瘤U266及SKO-007细胞凋亡[9~11],引起肝癌BEL-7420细胞发生裂亡[12]。本研究结果显示,低、中、高浓度组细胞增殖能力及细胞生存率均低于对照组,且高浓度组降低更明显;说明低浓度力达霉素处理24 h即能显著抑制人宫颈癌Caski细胞增殖,且该作用具有浓度依赖性。
线粒体膜电位是指生物膜两侧离子浓度不同所产生的跨膜电位差,可反映线粒体功能的完整性,是评价线粒体功能的敏感指标[13]。细胞死亡方式有凋亡和裂亡等不同形式[14,15],细胞凋亡时线粒体损伤发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前[16]。在凋亡因子的刺激下,线粒体膜通透性转化孔增大,使内膜离子浓度梯度消失、呼吸链失偶联,导致跨膜电位降低或耗散,促进凋亡活性物质如Cytc等从线粒体基质中释放进入细胞质,激活Caspase级联反应,最终引发细胞凋亡[17]。因此,线粒体膜电位降低是细胞凋亡早期的一个标志性事件,线粒体膜电位降低细胞比例可反映细胞凋亡的程度[16]。本研究结果显示,低、中、高浓度组线粒体膜电位降低的细胞比例均高于对照组,提示不同浓度的力达霉素均可导致线粒体膜电位显著下降,并诱导细胞发生线粒体介导的凋亡。本研究中高浓度组细胞线粒体膜电位下降比例低于中、低浓度组,细胞线粒体膜电位下降比例并没有随力达霉素浓度的升高而升高,结合力达霉素对人宫颈癌Caski细胞的增殖抑制作用呈浓度依赖性这一结果,推测力达霉素除了诱导人宫颈癌Caski细胞凋亡外,还可能诱导Caski细胞发生其他类型的死亡。
1989年,Molz等[18]发现在一种对热敏感的酵母突变株中,细胞分裂时染色体分离发生异常。此后一些学者便把这种在DNA发生损害时,细胞无法进行完全分裂而导致出现四倍体或多倍体的现象称为细胞有丝分裂灾变,这种有别于典型细胞凋亡特征的细胞死亡方式也被称为裂亡[19]。裂亡的发生可能与细胞有丝分裂的异常,如中心体过度复制、多极性纺锤体形成、多核形成等有关[20],细胞周期检测表现为S期和G2/M期阻滞[21]。本研究结果显示,中、高浓度组G0/G1期细胞比例均低于对照组及低浓度组,G2/M期细胞比例均高于对照组及低浓度组,对照组及中浓度组S期细胞比例均高于低、高浓度组。说明力达霉素除了诱导人宫颈癌Caski细胞凋亡外,还可诱导细胞发生裂亡。
除了生化特征外,裂亡与凋亡细胞还具有各自不同的形态学特征。凋亡细胞染色质凝集、边缘化,细胞体皱缩、变圆,形成凋亡小体;裂亡的主要形态学特征包括有丝分裂异常,细胞体积变大,形成多核细胞。本研究透射电镜观察结果证实,力达霉素处理后的人宫颈癌Caski细胞形态学上发生上述凋亡、坏死及裂亡病理改变。本研究结果显示,对照组及高、低、中浓度组细胞凋亡率依次升高,对照组及低、中、高浓度组细胞裂亡率依次升高;说明力达霉素浓度为2.5 ng/mL时对细胞凋亡的诱导作用最强,浓度为5 ng/mL时对细胞裂亡的诱导作用最强。上述结果提示,不同浓度力达霉素诱导人宫颈癌Caski细胞死亡的模式也有所不同。
综上所述,力达霉素可抑制人宫颈癌Caski细胞增殖,并呈浓度依赖性;其机制可能与诱导人宫颈癌Caski细胞凋亡或裂亡有关。
[1] Hu JL, Xue YC, Xie MY, et al. A new macromolecular antitumor antibiotic, C1027. I. Discovery, taxonomy of producing organism, fermentation and biological activity[J]. J Antibiot, 1988,41(11):1575-1584.
[2] Liu F, Shang Y, Chen SZ. Chloroquine potentiates the anti-cancer effect of lidamycin on non-small cell lung cancer cells in vitro[J]. Acta Pharmacol Sin, 2014,35(5):645-652.
[3] Chen J, Wu S, Ou-Yang ZG, et al. Synergy of gemcitabine and lidamycin associated with NF-κBdownregulation in pancreatic carcinoma cells[J]. Acta Pharmacol Sin, 2008,29(5):614-619.
[4] Huang YH, Shang BY, Zhen YS. Antitumor efficacy of lidamycin on hepatoma and active moiety of its molecule[J]. World J Gastroenterol, 2005,11(26):3980-3984.
[5] Zhang SH, Chen J, Jiang M, et al. Lidamycin induces apoptosis of human gastric carcinoma BGC823 cells and inhibits xenograft growth in nude mice[J]. Acta Pharmacol Sin, 2008,43(6):601-604.
[6] 陈淑珍,甄永苏,邵荣光.力达霉素抗肿瘤作用及其分子机制研究新进展[J].中国抗生素杂志,2010,35(6):401-407,413.
[7] He QY, Jing B, Li Dd. Effects of lidamycin on genomic DNA in human heptatoma BEL-7402 cells[J]. Acta Pharmacol Sin, 2002,23(3):253-256.
[8] Pan Y, Ren K, He H, et al. Knockdown of Chk1 sensitizes human colon carcinoma HCT116 cells in a p53-dependent manner to lidamycin through abrogation of a G2/M checkpoint and induction of apoptosis[J]. Cancer Biol Ther, 2009,8(16):1559-1566.
[9] Chen J, Yan ZY, Li C, et al. Effects of lidamycin on proliferation and differentiation of HL-60 Cell[J]. J Chin Pharm Sci, 2010,45(23):819-1822.
[10] Chen J, Ou-Yang ZG, Zhang SH, et al. Down-regulation of the nuclear factor-κB by lidamycin in association with inducing apoptosis in human pancreatic cancer cells and inhibiting xenograft growth[J]. Oncol Rep, 2007,17(6):1445-1451.
[11] Zhen YZ, Ji CM, Hao XF, et al. Lidamycin enhances sensitivity of multiple myeloma to bortezomid by modulating expression of mitogen-activated protein kinases[J]. Cancer Res Prevent Treat, 2014,41(5):353-357.
[12] Vitale I, Galluzzi L, Castedo M, et al. Mitotic catastrophe: a mechanism for avoiding genomic instability[J]. Nat Rev Mol Cell Biol, 2011,12(6):384-391.
[13] 刘祯,李卫红,张杰,等.鱼藤酮对神经瘤细胞线粒体膜电位的影响[J].环境与职业医学,2003,20(2):73-74,77.
[14] 高瑞娟,赵春燕,李电东.有丝分裂与有丝分裂灾变[J].中国新药杂志,2014,24(8):2854-2859,2885.
[15] Jiang B, Li DD, Zhen YS. Induction of apoptosis by enediyne antitumor antibiotic C1027 in HL-60 human promyelocytic leukemia cells[J]. Biochem Biophys Res Com, 1995,208(1):238-244.
[16] Haeberlein SL. Mitochondrial function in apoptotic neuronal cell death[J]. Neurochem Res, 2004,29(3):521-530.
[17] Garrido C, Galluzzi L, Brunet M, et al. Mechanisms of cytochrome crelease from mitochondria[J]. Cell Death Differ, 2006,13(9):1423-1431.
[18] Molz L, Booher R, Young P, et al. cdc2 and the regulation of mitosis: six interacting mcs genes[J]. Genetics, 1989,5(4):365.
[19] Margottin-Goguet F, Hsu JY, Loktev A, et al. Prophase destruction of emi1 by the SCF βTrCP/Slimb, ubiquitin ligase activates the anaphase promoting complex to allow progression beyond prometaphase[J]. Dev Cell, 2003,4(6):813-826.
[20] Liang YX, Zhang W, Li DD, et al. Mitotic cell death in BEL-7402 cells induced by enediyne antibiotic lidamycin is associated with centrosome overduplication[J]. World J Gastroenterol, 2004,10(18):2632-2636.
[21] Ianzini F, Mackey MA. Spontaneous premature chromosome condensation and mitotic catastrophe following irradiation of HeLa S3 cells[J]. Int J Radiat Biol, 1997,72(4):409-421.
EffectoflidamycinonproliferationofhumancervicalcancerCaskicells
LUHua,QINYe,ZHANJingqiong,WANGYanlin
(ChinaThreeGorgesUniversity,HubeiKeyLaboratoryofTumorMicroenvironmentandImmunotherapy,Yichang443002,China)
ObjectiveTo investigate the effect of lidamycin on the proliferation of human cervical cancer Caski cells and its underlying molecular mechanisms.MethodsHuman cervical cancer Caski cells were randomly divided the experimental groups (including the low-dose, medium-dose and high-dose groups) which were separately treated with 1, 2.5 and 5 ng/mL lidamycin (100 μL) for 24 h, and the control group which was added with the same volume of RPMI-1640. MTT assay was used to detect the inhibition rate of proliferation. The cell cycle and mitochondrial membrane potential of CasKi cells were measured by flow cytometry. Transmission electronic microscope was used to observe the morphological changes of Caski cells. We calculated the apoptosis rate and mitotic catastrophe rate.ResultsThe proliferation rate and survival rate of the experimental groups were significantly lower than those of the control group, and the decrease in the high-dose group was more significant (allP<0.05). The percentage of cells in the S phase of the control group and the medium-dose group was higher than those in the low-dose and high-dose groups (allP<0.05). The percentage of cells in the G0/G1phase of the experimental groups was lower than that of the control group and the percentage of cells in the G2/M phase was higher than that of the control group, especially in the medium-dose and high-dose groups (allP<0.05). The ratios of mitochondrial membrane potential decrease in the low-dose, medium-dose and high-dose groups and control group were 34.77%±5.33%, 37.87%±5.73%, 18.37%±3.91%, and 4.17%±0.65%, respectively. The mitochondrial membrane potential decreased ratios of the experimental groups were higher than that in the control group, especially in the low-dose and medium-dose groups (allP<0.05). Transmission electronic microscopy showed that the control group had normal morphology while the experimental groups had many forms of death cells, including apoptosis, necrosis and mitotic catastrophe. The apoptosis rate and mitotic catastrophe rate of the experimental groups were both higher than those of control group (bothP<0.05).ConclusionLidamycin can significantly inhibit the proliferation of Caski cells with an dose-dependent manner by inducing the apoptosis and mitotic catastrophe of cells.
cervical carcinoma; lidamycin; human cervical cancer Caski cells; apoptosis; mitotic catastrophe; mitochondrial membrane potential
国家自然科学基金资助项目(81372265)。
鲁华(1978-),男,讲师,研究方向为肿瘤病理学。E-mail: 4554080@qq.com
王艳林(1954-),男,教授,研究方向为肿瘤分子生物学。E-mail: 2244524933@qq.com
10.3969/j.issn.1002-266X.2017.44.001
R737.33
A
1002-266X(2017)44-0001-04
2017-02-09)
