单次大剂量与多次小剂量放射线构建小鼠放射性唾液腺损伤模型效果比较
2017-12-11王涛刘东
王涛,刘东
(胜利油田中心医院,山东东营 257034)
单次大剂量与多次小剂量放射线构建小鼠放射性唾液腺损伤模型效果比较
王涛,刘东
(胜利油田中心医院,山东东营 257034)
目的探讨单次大剂量与多次小剂量放射线构建小鼠放射性唾液腺损伤模型的应用效果。方法选取C3H小鼠30只,随机分为空白对照组(空白组)、单次大剂量照射组(单放组)、多次小剂量照射组(多放组)各10只。空白组以0 Gy放射线照射,单放组以15 Gy放射线单次照射,多放组以每天5 Gy照射,连续5 d。分别于照射前及照射后1、5、10周测定各组唾液分泌率。照射后10周采集三组小鼠下颌下腺,分别测定腺泡细胞相对面积、细胞增殖率及毛细血管密度。结果与空白组比较,单放组、多放组唾液分泌率均下降,腺泡细胞相对面积减小,下颌下腺细胞增殖率降低,下颌下腺毛细血管密度减低,差异均有统计学意义(P均lt;0.05)。单放组与多放组以上观察指标比较差异无统计学意义(P均gt;0.05)。结论单次大剂量与多次小剂量放射线构建小鼠放射性唾液腺损伤模型的效果相当。
唾液腺;放射性损伤;单剂量放射;多剂量放射;小鼠
头颈部肿瘤是临床第六大常见恶性肿瘤,放射性治疗(放疗)是其最主要的治疗方法[1]。由于唾液腺组织尤其是腺泡细胞对放射线高度敏感,头颈部放疗在杀死肿瘤细胞的同时不可避免地造成唾液腺功能损伤,从而引起沟纹舌、猛性龋、口腔黏膜炎等并发症,严重影响患者的生活质量[2]。近年来,组织工程、基因治疗及干细胞治疗等方法被用来修复动物放射性唾液腺损伤,其中构建放射性唾液腺损伤动物模型是实验研究的关键环节。单次大剂量照射与多次小剂量照射是目前最常用的唾液腺损伤动物模型的构建方法,但究竟哪种方法更好尚存在争议。2017年2~6月,我们对两种方法构建的模型效果进行比较。现将结果报告如下。
1 材料与方法
1.1 材料 实验动物:8周龄C3H小鼠30只[北京维通利华实验动物技术有限公司,合格证号:SCXK(京)(2016)0017,许可证号:SCXK (京)2011-0011],体质量18~23 g。主要仪器及试剂:医用直线加速器(Varian Clinic Trilogy)、PAS染色试剂盒(美国Sigma公司)、PCNA染色试剂盒(美国Invitrogen公司)、CD31抗体(美国Ramp;D Systems公司)。
1.2 动物分组及照射方法 将30只小鼠随机分为空白对照组(空白组)、单次大剂量照射组(单放组)、多次小剂量照射组(多放组)各10只,小鼠腹腔注射苯巴比妥钠(5 mg/kg)麻醉后,头颈部充分暴露于放射野内,其余部位用铅板遮挡。单放组以15 Gy放射线单次照射;多放组以每天5 Gy照射,连续5 d;空白组直线加速器不运行(照射剂量为0 Gy),其他处理同照射组。照射后各组小鼠皮下注射生理盐水500 μL并保持正常体温直至苏醒。
1.3 唾液分泌率测定及唾液腺标本采集 照射前及照射后1、5、10周用苯巴比妥钠麻醉小鼠,皮下注射毛果芸香碱(2 mg/kg)。倾斜固定小鼠,将分血器一端置于小鼠口角,另一端置于预称重0.5 mL离心管中,收集唾液10 min,之后将离心管称重,计算小鼠唾液分泌量及唾液分泌率。10周后小鼠脱颈处死取下颌下腺,一部分浸入4%多聚甲醛溶液中固定,脱水石蜡包埋,另一部分OCT包埋后放入-80 ℃冰箱保存备用。
1.4 下颌下腺腺泡细胞相对面积及增殖率检测 将石蜡包埋的下颌下腺标本切片、常规脱腊水化,按试剂盒说明方法进行PAS染色。200倍光学显微镜下观察拍照,Image J软件计算下颌下腺腺泡细胞相对面积,即腺泡细胞占整个下颌下腺细胞面积的百分比。下颌下腺切片标本常规脱腊水化,热抗原修复后,行PCNA染色,免疫组化标记PCNA阳性细胞为下颌下腺细胞。400倍光学显微镜下观察拍照,Image J软件计算下颌下腺细胞增殖率。
1.5 下颌下腺组织毛细血管密度检测 7 μm下颌下腺冰冻切片于4%多聚甲醛固定10 min,10%正常驴血清封闭1 h,山羊来源抗小鼠CD31(1∶100)抗体4 ℃孵育过夜。PBS替代一抗作为空白对照,异硫氰酸荧光素标记的驴抗山羊IgG(1∶200)常温避光孵育1 h。PBS冲洗3次后,DAPI常温孵育2 min标记细胞核。甘油封片后,荧光显微镜观察照相。免疫荧光标定血管内皮细胞标志物CD31,从而显示下颌下腺毛细血管密度。

2 结果
2.1 三组唾液分泌率比较 三组照射前唾液分泌率比较无统计学差异(P均gt;0.05)。照射后1周单放组、多放组唾液分泌率均下降至空白组的50%,照射后5、10周两组唾液分泌率持续下降,与空白组比较有统计学差异(P均lt;0.05)。但单放组与多放组各时点唾液分泌率比较无统计学差异(P均gt;0.05)。见表1。
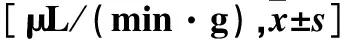
表1 三组照射前后唾液分泌率比较
注:与空白组相比,*Plt;0.05。
2.2 三组下颌下腺组织结构及腺泡细胞相对面积比较 PAS染色显示,空白组小鼠下颌下腺组织致密清晰,腺泡及导管细胞排列规则,胞质丰富,腺泡细胞相对面积为71%±9%。单放组、多放组小鼠下颌下腺组织结构疏松,间质纤维化明显并见炎症细胞浸润,腺泡细胞萎缩;两组腺泡细胞相对面积分别为34%±4%、30%±5%。与空白组比较,单放组与多放组腺泡细胞相对面积均减小(P均lt;0.05);单放组、多放组腺泡细胞相对面积比较无统计学差异(Pgt;0.05)。
2.3 三组下颌下腺细胞增殖率比较 空白组、单放组、多放组下颌下腺细胞增殖率分别为11%±1.4%、4%±0.9%、5%±1.8%。单放组、多放组下颌下腺细胞增殖率均低于空白组(P均lt;0.05),单放组、多放组下颌下腺细胞增殖率无统计学差异(Pgt;0.05)。
2.4 三组下颌下腺毛细血管密度比较 与空白组比较,单放组、多放组小鼠下颌下腺血管系统破坏明显,毛细血管密度减低。
3 讨论
放射性唾液腺损伤是头颈部肿瘤患者放疗后最常见的并发症之一,其损伤机制一直是临床研究的热点。目前,临床对放射性唾液腺损伤患者的治疗主要是唾液替代疗法和保守治疗,但治疗效果有限,尚未找到从根本上治疗此类疾病的方法[3]。虽然临床已采用多种技术保护唾液腺,如使用调强放疗、通过手术方法将唾液腺移植出放射损伤区域外等[4~6],但调强放疗后仍有40%的患者唾液腺受损。而唾液腺移植主要用于保护下颌下腺,不能用于腮腺的保护。近年来,基因治疗、组织工程及干细胞治疗成为放射后唾液腺功能修复的研究热点[7~9],其中体外单细胞培养和动物模型是进行以上研究的常用方法。体外单细胞培养具有方便、经济、快捷等优点,但单层细胞培养失去了细胞外基质及三维细胞结构,不能模拟体内复杂的病理生理变化;另外,人工环境中培养单细胞易引起细胞表型的改变[10]。而动物模型虽然实验周期长、费用高,但能最大程度地再现人体复杂的疾病发展过程,所以一直是实验研究最主要的手段之一。
目前,构建放射性唾液腺损伤的动物模型主要有局部单次大剂量照射和多次小剂量照射两种方法。单次大剂量照射方案具有方便、快捷的优点,故被多数研究者采用。但临床患者的放疗多采用对肿瘤周围正常组织损伤较小的多次小剂量照射方案。因此,近年来有学者在构建动物模型时将放射剂量分割成与临床相关的小剂量。然而,多次小剂量方案需较多的时间和人力,并且要反复麻醉动物,易造成动物麻醉意外死亡,对操作技术的要求更严格。因此,单次大剂量照射和多次小剂量照射构建唾液腺损伤动物模型的效果如何需进一步研究证实。本研究结果显示,无论单次大剂量还是多次小剂量放射线照射均能造成小鼠唾液分泌减低、腺泡细胞萎缩、组织细胞增殖率下降及腺体毛细血管密度减低等症状,均能较好反映放疗患者唾液腺损伤的病理生理变化。另外,两种照射方法均未造成小鼠全身症状。但考虑到单次大剂量照射方案具有方便、快捷的优势,建议在今后实验中如果动物能耐受,选择单次大剂量局部照射的方案构建放射性唾液腺损伤动物模型更佳。
[1] Lombaert IM, Brunsting JF, Wierenga PK, et al. Rescue of salivary gland function after stem cell transplantation in irradiated glands[J]. PLoS One, 2008,3(4):e2063.
[2] 张少梅,欧忠辉,邹敬才,等.干细胞修复放射性唾液腺损伤的研究进展[J].牙体牙髓牙周病学杂志,2015,17(6):384-387.
[3] Tran SD, Liu Y, Xia D, et al. Paracrine effects of bone marrow soup restore organfunction, regeneration, and repair in salivary glands damaged by irradiation[J]. PLoS One, 2013,8(4):e61632.
[4] Vergeer MR, Doornaert PA, Rietveld DH, et al. Intensity-modulated radiotherapy reduces radiation-induced morbidity and improves health-related quality of life: results of a nonrandomized prospective study using a standardized follow-up program[J]. Int J Radiat Oncol Biol Phys, 2009,74(1):1-8.
[5] Sood AJ, Fox NF, O′Connell BP, et al. Salivary gland transfer to prevent radiation-induced xerostomia: a systematic review and meta-analysis[J]. Oral Oncol, 2014,50(2):77-83.
[6] Seikaly H, Jha N, McGaw T, et al. Submandibular gland transfer: a new method of preventing radiation-induced xerostomia[J]. Laryngoscope, 2001,111(2):347-352.
[7] Zheng C, Cotrim AP, Rowzee A, et al. Prevention of radiation-induced salivary hypofunction following hKGF gene delivery to murine submandibular glands[J]. Clin Cancer Res, 2011,17(9):2842-2851.
[8] Aframian DJ, Palmon A. Current status of the development of an artificial salivary gland[J]. Tissue Eng Part B Rev, 2008,14(2):187-198.
[9] Sumita Y, Liu Y, Khalili S, et al. Bone marrow-derived cells rescue salivary gland function in mice with head and neck irradiation[J]. Int J Biochem Cell Biol, 2011,43(1):80-87.
[10] Su X, Fang D, Liu Y, et al. Three-dimensional organotypic culture of human salivary glands: the slice culture model[J]. Oral Dis, 2016,22(7):639-648.
10.3969/j.issn.1002-266X.2017.41.014
R781.7
A
1002-266X(2017)41-0044-03
刘东(E-mail:18905460909@163.com)
2017-08-16)
