荷载CSCs抗原的DC疫苗联合小剂量TP治疗乳腺癌小鼠效果观察
2017-12-11陈心梁慧玲伍龙徐细明张一桥陈能冯翎
陈心,梁慧玲,伍龙,徐细明,张一桥,陈能,冯翎
(武汉大学人民医院,武汉430060)
荷载CSCs抗原的DC疫苗联合小剂量TP治疗乳腺癌小鼠效果观察
陈心,梁慧玲,伍龙,徐细明,张一桥,陈能,冯翎
(武汉大学人民医院,武汉430060)
目的研究荷载肿瘤干细胞(CSCs)抗原的树突状细胞疫苗联合小剂量TP(紫杉醇+顺铂)治疗小鼠乳腺癌的疗效。方法利用ALDEFLUOR染料从小鼠乳腺癌细胞系4T1中分选出ALDH high肿瘤干细胞,将CSCs制备成细胞裂解液加载在DC细胞上制备成CSCs-DC疫苗。利用小鼠乳腺癌细胞系4T1接种Balb/c小鼠建立小鼠乳腺癌模型,随机分成磷酸盐缓冲液组(PBS组)、紫杉醇+顺铂组(TP组)、CSCs-DC疫苗组(CSCs-DC组)、CSCs-DC疫苗联合TP组(CSCs-DC+TP组),PBS组腹腔注射0.1 mL的PBS;TP组腹腔注射紫杉醇20 mg/kg,顺铂5 mg/kg;CSCs-DC组皮下注射CSCs-DC疫苗;CSCs-DC+TP组皮下注射CSCs-DC疫苗,腹腔注射紫杉醇20 mg/kg,顺铂5 mg/kg。观测各组肿瘤大小和小鼠生存期,实验终点取小鼠脾脏,体外培养激活后利用LDH细胞毒性实验测定细胞毒性T淋巴细胞(CTL)活性,ELISA法测定B细胞分泌IgG水平。结果CSCs-DC+TP组肿瘤体积小于PBS组、TP组及CSCs-DC组(P均lt;0.05)。小鼠生存期CSCs-DC+TP组最长,生存时间为(62.00±2.65)d,CSCs-DC组次之,生存时间为(52.00±1.00)d,TP组和PBS组生存时间分别为(46.00±2.00)、(35.00±1.00)d。CSCs-DC+TP组小鼠脾脏中CTL活性和B细胞分泌IgG水平最高,CSCs-DC组次之,TP组较CSCs-DC组和CSCs-DC+TP组低,但较PBS组高,差异有统计学意义(P均lt;0.01)。结论CSCs-DC疫苗联合小剂量TP治疗乳腺癌小鼠较CSCs-DC疫苗和TP单用效果好。
乳腺肿瘤;肿瘤干细胞;疫苗;紫杉醇;顺铂;小鼠
乳腺癌是危害我国女性健康的最主要恶性肿瘤之一,近年来发病率呈上升趋势。根据全国肿瘤登记中心发布的最新数据显示,目前我国每年女性乳腺癌发病约24.9万,位居女性发病首位,城市地区发病相对较高,平均29例女性会有1例患乳腺癌;每年死亡病例约6.0万,位居女性死亡第6位[1]。肿瘤干细胞(CSCs)是肿瘤细胞中一小群具有自我更新能力并能产生异质性肿瘤细胞的细胞群体,具有很强的成瘤性和侵袭迁移潜能[2],CSCs能长期处于休眠状态而对传统的放化疗不敏感,是肿瘤增殖、复发转移并最终导致患者死亡的关键因素。2015年11月~2016年11月,我们制备CSCs-DC疫苗并将其联合小剂量TP治疗乳腺癌小鼠。现将结果报告如下。
1 材料与方法
1.1 材料 Balb/c小鼠[动物合格证号:SCXK(鄂)2014-0004,使用许可证号:SYXK(鄂)2015-0027],雌性,8周,购自武汉大学实验动物中心,SPF级条件下饲养,符合伦理委员会认可。ALDEFLUOR干细胞试剂盒购自美国Stem Cell公司,紫杉醇购自江苏扬子江药业,顺铂购自齐鲁制药有限公司,纯化抗小鼠CD3和CD28、抗小鼠CD40、白细胞介素2和粒-巨噬细胞集落刺激因子(GM-CSF)购自Ebioscience公司,IgG ELISA试剂盒购自赛默飞公司,LDH释放试剂盒购自普洛麦格生物技术有限公司,RPMI1640培养液、胎牛血清(FBS)、0.25%胰酶消化液和青霉素/链霉素购自GIBCO公司。小鼠乳腺癌细胞系4T1购自武汉大学生命科学研究院细胞库,细胞于含10%胎牛血清的1640培养基中生长,置于37 ℃、5% CO2、95%湿度条件下传代培养。
1.2 CSCs的分选和抗原的获得 采用ALDEFLUORTM试剂盒分选CSCs:收集对数生长期4T1细胞, 制备成单细胞悬液,计数细胞并用ALDEFLUOR缓冲液重悬细胞,使其终浓度为1×106/mL,加入ALDEFLUOR染料,7-AAD和DEAB作为对照组,水浴孵育后行流式分选ALDHhigh-CSCs细胞,将分选收集的ALDHhigh 4T1(CSCs)细胞置于液氮中浸泡5 min,而后37 ℃水浴中放置5 min,如此反复3次;获得CSCs裂解液(CSCs抗原)。
1.3 CSCs-DC疫苗的制备 无菌条件下,取8周龄雌性Balb/c小鼠股骨和胫骨骨髓,于1640培养基和GM-CSF环境下培养10 d,收获成熟DC细胞,将方法1.2中收集的裂解液以1∶3的比例加入DC细胞中,培养过夜,获得加载CSCs抗原的DC疫苗。
1.4 小鼠乳腺癌模型的建立与分组 将正常Balb/c小鼠随机分成4组,每组3只。将对数生长期的4T1细胞调整细胞浓度至5×107/mL,接种0.1 mL于每只小鼠右侧乳垫下,每日观察肿瘤形成情况。扪及肿瘤直径为6~9 mm时随机分为4组,磷酸盐缓冲液组 (PBS组):PBS 0.1 mL腹腔注射,第1、7、14天;紫杉醇+顺铂组(TP组):紫杉醇 20 mg/kg,腹腔注射,第1、7、14天;顺铂 5 mg/kg,腹腔注射,第1、7天;CSCs-DC疫苗组(CSCs-DC组): CSCs-DC疫苗,皮下注射,第1、7天;CSCs-DC疫苗联合TP组(CSCs-DC+TP组):CSCs-DC疫苗,皮下注射,第1、7天,紫杉醇 20 mg/kg,腹腔注射,第1、7、14天;顺铂5 mg/kg,腹腔注射,第1、7天。
1.5 肿瘤大小和小鼠生存期观测 药物处理后每日规定时间进行观察,自用药当天开始,每 3 天测 1次肿瘤长、短径,直至实验结束,并计算肿瘤体积。成瘤后测量肿瘤最长径(a)及与之垂直的横径(b),根据公式V=1/2ab2计算瘤体积,绘制移植瘤生长曲线。记录小鼠生存时间,绘制生存曲线。
1.6 细胞毒效应实验 实验结束时收集各组小鼠脾脏,T细胞被anti-CD3/ anti-CD28 激活和IL-2扩增为细胞毒性T淋巴细胞(CTL),靶细胞为分选的ALDH+ SCC7细胞,利用LDH释放试剂盒检测CTL细胞对靶细胞的杀伤作用。将效应细胞和靶细胞在圆底96孔板中共同孵育6 h,转移上清至一个新的96孔平底酶分析板,加入底物,终止反应后1 h内用酶标仪在492 nm处检测OD值。根据以下公式计算CTL活性。CTL活性(%)=(实验孔OD值-效应细胞自发OD值-靶细胞自发OD值)/(靶细胞最大OD值-靶细胞自发OD值)×100%。
1.7 活化B细胞培养液上清中IgG含量检测 采用ELISA法。实验结束时收集各组小鼠脾脏,B细胞被LPS和anti-CD40激活,包被缓冲液稀释亲和素纯化抗体,每孔加入100 μL,4 ℃过夜包被酶标板。洗板3 次。加ELISA封闭液,每孔200 μL,室温封闭1 h。封闭结束后,弃去封闭液,洗板,加入待测样品(以标准品制作标准曲线)100 μL,室温孵育1 h。洗板,每孔加入HRP标记的检测抗体100 μL,室温孵育1 h。洗板,每孔加入TMB 底物溶液100 μL,室温避光显色30 min,每孔加入2 mol/L H2SO450 μL终止反应。用酶标仪检测450 nm处OD值。绘制标准曲线,通过标准曲线计算样品浓度。

2 结果
2.1 各组肿瘤生长情况比较 从用药开始,各组小鼠肿瘤生长平缓,体积比较差异无统计学意义(P均gt;0.05)。随后,各组肿瘤生长出现差异,TP组、CSCs-DC组和CSCs-DC+TP组生长曲线平缓,但未停滞;而PBS组生长较快,曲线陡直。第27天,PBS组与TP组、CSCs-DC组、CSCs-DC+TP组肿瘤体积出现统计学差异,TP组、CSCs-DC组和CSCs-DC+TP组肿瘤体积小于PBS组,差异有统计学意义(P均lt;0.05)。第42天,TP组与CSCs-DC组、CSCs-DC+TP组分别比较,肿瘤体积出现统计学差异,CSCs-DC组和CSCs-DC+TP组肿瘤体积均小于TP组,差异有统计学意义(P均lt;0.05)。第51天,CSCs-DC组和CSCs-DC+TP组肿瘤体积出现统计学差异,CSCs-DC+TP组肿瘤体积小于CSCs-DC组,差异有统计学意义(Plt;0.05)。根据肿瘤生长体积与时间关系绘制肿瘤生长曲线见图 1。
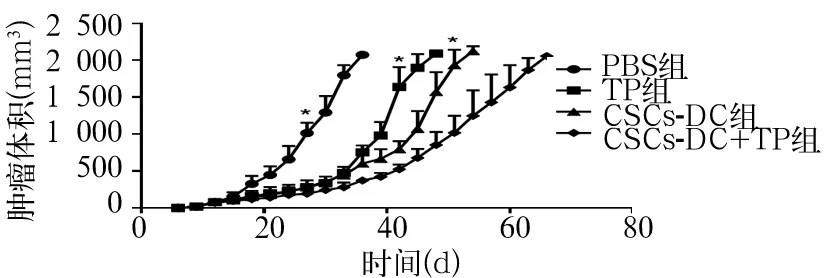
图1 四组肿瘤生长曲线
2.2 各组荷瘤鼠生存期比较 CSCs-DC+TP组、TP组、CSCs-DC组、 PBS组生存期分别为(62.00±2.65)、(46.00±2.00)、(52.00±1.00)、(35.00±1.00)d,CSCs-DC+TP组较PBS组、TP组和CSCs-DC组生存期延长(P均lt;0.01)。以生存时间为横轴,生存率为纵轴,用 GraphPad Prism统计软件绘制的生存曲线见图2。
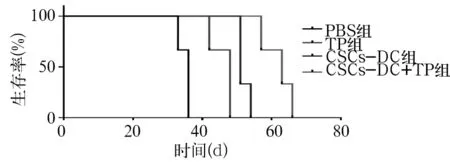
图2 荷瘤鼠生存曲线
2.3 各组CTL活性比较 CSCs-DC+TP组、TP组、CSCs-DC组、PBS组CTL活性分别为28.67%±1.98%、10.12%±1.05%、19.85%±1.68%、6.45%±1.09%,四组间比较,P均lt;0.05。
2.4 各组IgG抗体水平比较 CSCs-DC+TP组、TP组、CSCs-DC组、PBS组IgG抗体水平分别为(215.2±19.67)、(95.42±11.69)、(161.9±7.96)、(55.66±8.67)ng/mL,四组间比较,P均lt;0.05。
3 讨论
乳腺癌是临床最常见的恶性肿瘤之一,肿瘤复发和转移是患者死亡的主要原因。肿瘤干细胞是肿瘤增殖、复发转移的关键[3],靶向杀伤CSCs是成功控制肿瘤的关键[4]。正确识别、分离和鉴定肿瘤干细胞是靶向杀伤肿瘤干细胞的基础,利用特异性肿瘤干细胞表面标志物通过流式细胞仪等技术对肿瘤干细胞进行分选,是当前肿瘤干细胞分选鉴定的主要手段。CD24、CD44、B38.1和ESA是乳腺癌干细胞常用的表面分子标志物[5]。近年来,乙醛脱氢酶(ALDH)被作为一种新的干细胞标志物用于鉴定和分离肿瘤干细胞。ALDH是催化细胞内乙醛氧化为乙酸的细胞溶质酶,参与多种组织的分化与基因表达;亦是组织中正常干细胞与肿瘤干细胞生长、分化的必需物质,可作为正常干细胞与CSCs的标志物之一。
利用Aldefluor试剂通过流式细胞术分选出高ALDH活性的细胞是一种简单、可靠的分离肿瘤干细胞方法[6]。分离出的肿瘤干细胞具有活性,可用于后续的体内、体外试验研究。ALDH作为肿瘤干细胞标志物已被用于肺癌、前列腺癌、头颈部鳞状细胞癌和乳腺癌。研究发现乳腺癌组织中的ALDH+细胞能形成小球并能自我更新,在异体抑制中具有更强的成瘤性,对常规的阿霉素、环磷酰胺及紫杉醇化疗药物耐药,具有肿瘤干细胞的特性[7]。ALDH与乳腺癌的预后呈负相关,ALDH+患者较ALDH-患者死亡相对危险度为1.76[8]。
乳腺癌干细胞对传统的放疗和化疗存在抵抗现象。研究[9]发现放疗会增加乳腺癌鼠模型中CSCs的比例,同样,化疗可使乳腺癌干细胞富集的现象在体内实验中亦被观察到[10]。此外,有研究[11]发现乳腺癌患者在接收新辅助化疗后,肿瘤中CSCs比例增加。因而,免疫治疗尤其是针对乳腺癌干细胞的免疫治疗将有望成为未来治疗肿瘤的重要手段[12]。
树突状细胞(DC)作为专职抗原呈递细胞,因其抗原呈递功能及免疫佐剂作用,可诱导出高效而特异的抗肿瘤免疫作用[13]。能刺激初始型T 细胞活化和增殖,是特异性免疫应答的始动者。DC 还能诱导机体的体液免疫,激活NK、NK-T 细胞,参与非特异性免疫。本研究即是通过Aldefluor染料分离出CSCs,通过冻融法获得CSCs抗原并将特异性的抗原加载在DC细胞上启动特异性的免疫应答。但CSCs-DC疫苗的效果有限,我们观察到随着观测时间的延长,即使给予CSCs-DC疫苗的治疗,最终肿瘤仍会在小鼠体内复发。考虑原因在于疫苗的疗效与免疫细胞的能力和肿瘤微环境密切相关,包括DCs对肿瘤抗原的递呈能力;T、B细胞向肿瘤组织迁徙能力及肿瘤微环境中T、B细胞的功能等。肿瘤微环境由肿瘤细胞、间质细胞、微血管、肿瘤浸润细胞及肿瘤细胞或基质细胞分泌的多种细胞因子等共同组成,包括DCs、肿瘤相关巨噬细胞(TAM)、调节性T细胞(Treg)、髓源抑制性细胞(MDSCs)、转化生长因子-β1、白细胞介素10、血管内皮生长因子、前列腺素E2等。这些不同类型的细胞受到癌细胞的募集,形成一个适合癌细胞生长而使其他免疫细胞活性受到抑制的肿瘤微环境[14],这种肿瘤微环境不但影响DCs分化成熟,下调DCs表面共刺激分子和黏附分子的表达,使DCs不能发挥有效的抗原提呈,而且抑制了T、B细胞活性,从而使我们设计的CSCs-DC疫苗在攻击CSCs时作用有限。
常规化疗在杀伤肿瘤细胞的同时亦削弱了机体的免疫功能,然而小剂量的节拍化疗能降低荷瘤小鼠体内的Treg细胞数量,改善T细胞和NK细胞功能,从而起到增强免疫功能的作用。本研究结果发现,CSCs-DC+TP组肿瘤生长较CSCs-DC组和TP组受到明显抑制,生存期延长,CTL活性增强,B细胞分泌抗体水平提高,说明小剂量的TP化疗能通过强化T、B细胞功能,增强CSCs-DC疫苗的疗效。
综上所述,CSCs-DC疫苗联合小剂量TP治疗乳腺癌荷瘤小鼠,能抑制肿瘤生长,延长小鼠的生存时间,与治疗诱发肿瘤免疫应答有关,此为乳腺癌的治疗提供了新思路。
[1] 陈万青,郑荣寿.中国女性乳腺癌发病死亡和生存状况[J].中国肿瘤临床,2015,42(13):668-674.
[2] 陆翰杰,秦艳茹.肿瘤干细胞在肿瘤侵袭转移中的作用机制及功能相关信号通路研究进展[J].山东医药,2016,56(7):94-96.
[3] Shima H, Yamada A, Ishikawa T, et al. Are breast cancer stem cells the key to resolving clinical issues in breast cancer therapy[J]. Gland Surg, 2017,6(1):82-88.
[4] Pan Q, Li Q, Liu S, et al. Concise review: Targeting cancer stem cells using immunologic approaches[J]. Stem Cells, 2015,33(7):2085-2092.
[5] Chekhun VF, Lukianova NY, Chekhun SV, et al. Association of CD44+CD24-/low with markers of aggressiveness and plasticity of cell lines and tumors of patients with breast cancer[J]. Exp Oncol, 2017,39(3):203-211.
[6] Leng Z, Yang Z, Li L, et al. A reliable method for the sorting and identification of ALDHhigh cancer stem cells by flow cytometry[J]. Exp Ther Med, 2017,14(4):2801-2808.
[7] Tao H, Lu L, Xia Y, et al. Antitumor effector B cells directly kill tumor cells via the Fas/FasL pathway and are regulated by IL-10[J]. Eur J Immunol, 2015,45(4):999-1009.
[8] Charafejauffret E, Ginestier C, Iovino F, et al. Aldehyde dehydrogenase 1-positive cancer stem cells mediate metastasis and poor clinical outcome in inflammatory breast cancer[J]. Clin Cancer Res, 2010,16(1):45-55.
[9] Menaa C, Li JJ. The role of radiotherapy-resistant stem cells in breast cancer recurrence[J]. Breast Cancer Manag, 2013,2(2):89-92.
[10] Arumugam P, Song JM. Quantitative evaluation of ABC transporter-mediated drug resistance based on the determination of the anticancer activity of camptothecin against breast cancer stem cells using TIRF[J]. Integr Biol (Camb), 2016,8(6):704-711.
[11] Zhong Y, Shen S, Zhou Y, et al. ALDH1 is a better clinical indicator for relapse of invasive ductal breast cancer than the CD44+/CD24-phenotype[J]. Med Oncol, 2014,31(3):864.
[12] Chen Q, Cui XX, Liang PF, et al. Immunotherapy with dendritic cells and cytokine-induced killer cells for MDA-MB-231 breast cancer stem cells in nude mice[J]. Am J Transl Res, 2016,8(7):2947-2955.
[13] 徐彬,马俊杰,王小龙,等.树突状细胞自体回输联合 TA 方案化疗治疗乳腺癌22例临床观察[J].山东医药,2014,54(35):74-76.
[14] Schatton T, Schutte U, Frank NY, et al. Modulation of T-cell activation by malignant melanoma initiating cells[J]. Cancer Res, 2010,70(2):697-708.
EfficacyofCSCsantigens-loadeddendriticcellvaccinecombinedwithlow-doseTPintreatmentofbreastcancerinmice
CHENXin,LIANGHuiling,WULong,XUXiming,ZHANGYiqiao,CHENNeng,FENGLing
(RenminHospitalofWuhanUniversity,Wuhan430060,China)
ObjectiveTo study the therapeutic effect and mechanism of cancer stem cells (CSCs) antigens-loaded dendritic cell (DC) vaccine combined with low-does TP (paclitaxel and cisplatin) in treatment of breast cancer in mice.MethodsWe sorted out the CSCs from breast cancer cell lines (4T1) by using ALDEFLUOR. Bone marrow-derived DCs were pulsed with CSCs lysate to generate CSCs-DC vaccine. The Balb/c mice were inoculated with the heterogeneous 4T1 tumor cells by subcutaneous injection to make the mouse breast cancer models. The models were then divided into four groups: PBS group which was administrated PBS, TP group which was injected with 20 mg/kg paclitaxel and 5 mg/kg cisplatin intraperitoneally, CSCs-DC vaccine group (CSCs-DC group) which was administrated CSCs-DC vaccine by subcutaneous injection, and the CSCs-DC vaccine + TP group (CSCs-DC+TP group) which was administrated CSCs-DC vaccine by subcutaneous injection and was injected with 20 mg/kg paclitaxel and 5 mg/kg cisplatin intraperitoneally. Tumor volumes were measured and survival was monitored. At the end of the experiment, the spleens in mice were harvested, the cytotoxic lymphocyte (CTL) activity was measured by using LDH cytotoxicity assay, and IgG levels secreted by B cells was measured by ELISA.ResultsThe tumor size in the CSCs-DC+TP group was less than that of the PBS group, the TP group and the CSCs-DC group (Plt;0.05). The average survival time of the CSCs-DC+TP group was (62.00±2.65) d and was the longest, the average survival time of CSCs-DC group was (52.00±1.00) d, the average survival time of TP group and PBS group were (46.00 ±2.00) d and (35.00 ±1.00) d, respectively. The CTL activity and IgG levels secreted by B cells in the CSCs-DC+TP group were the highest, the CSCs-DC group was the second, TP group was lower than the CSCs-DC group and the CSCs-DC+TP group, but was higher than the PBS group, and the difference was statistically significant (Plt;0.01).ConclusionThe therapeutic effect of CSCs-DC vaccine combined with low-dose TP in the treatment of the mouse breast cancer is better than CSCs-DC vaccine and TP alone.
breast neoplasms; cancer stem cells; vccine; paclitaxel; cisplatin
10.3969/j.issn.1002-266X.2017.41.005
R737.9
A
1002-266X(2017)41-0016-04
国家自然科学基金资助项目(81302133);中央高校基本科研业务费专项基金资助项目(2042014kf0149);湖北省自然科学基金资助项目(2012FKC143)。
陈心(1981-),女,博士,主治医师,主要研究方向为肿瘤干细胞的研究与应用。E-mail:whdxchenxin@163.com
2017-05-10)
