TFPI-2基因CpG岛甲基化与非小细胞肺癌浸润、转移的关系
2017-12-11鲍俊英徐家行梁江水纪涛殷桂林董永强
鲍俊英,徐家行,梁江水,纪涛,殷桂林,董永强
(1华中科技大学同济医学院附属武汉市中心医院,武汉430010;2郴州市第一人民医院;3中国人民解放军武汉总医院)
TFPI-2基因CpG岛甲基化与非小细胞肺癌浸润、转移的关系
鲍俊英1,徐家行1,梁江水2,纪涛3,殷桂林3,董永强3
(1华中科技大学同济医学院附属武汉市中心医院,武汉430010;2郴州市第一人民医院;3中国人民解放军武汉总医院)
目的探讨TFPI-2基因CpG岛甲基化状态与非小细胞肺癌浸润、转移的关系。方法收集60例份非小细胞肺癌组织及相应癌旁组织和10例份正常肺组织,采用MS-PCR法检测其中组织途径抑制因子2(TFPI-2)基因CpG岛甲基化状态,分析TFPI-2基因CpG岛甲基化状态与非小细胞肺癌患者临床病理特征的关系。结果TFPI-2基因在肺癌组织、癌旁组织的阳性率分别为38.3%、6.7%,二者比较,P=0.009。TFPI-2基因CpG岛甲基化状态与非小细胞肺癌患者临床分期、淋巴结转移有关(P=0.002)。结论TFPI-2基因GpG岛甲基化与非小细胞肺癌浸润、转移有关。
非小细胞肺癌;组织途径抑制因子2;DNA甲基化
肺癌的发病率逐年增高,总体五年生存率约17%,其主要原因为肺癌转移所致[1]。组织因子途径抑制物2(TFPI-2)在对细胞外基质结构完整性的维持及肿瘤细胞侵袭和转移调控方面发挥重要作用,具有抑制肿瘤及其血管生成、诱导细胞凋亡等多种生物学功能,故TFPI-2基因被认为是一种潜在的抑癌基因。近年研究[2,3]发现,在肝癌、神经胶质瘤、结肠癌、胰腺癌等恶性肿瘤中,TFPI-2基因CpG岛甲基化使TFPI-2表达出现下降或缺失,此与肿瘤的生长和发展有关。TFPI-2基因启动子区域CpG岛异常甲基化及表达情况与非小细胞肺癌的关系国内外研究较少。本研究通过检测60例患者非小细胞肺癌组织及相应癌旁组织和10例正常肺组织中的TFPI-2基因CpG岛甲基化状态,分析TFPI-2基因CpG岛甲基化状态与非小细胞肺癌发生发展的关系。
1 资料与方法
1.1 临床资料 收集2011年11月~2012年11月中国人民解放军武汉总医院(原广州军区武汉总医院)心胸外科60例非小细胞肺癌患者手术标本,其中包括肺癌组织及距癌组织边缘5 cm处癌旁组织各60例份,其中男35例、女25例,年龄36~76(60.75±9.61)岁。患者术前肺部均行多层螺旋CT扫描,术前影像学检查均未发现患者有肺癌远处转移,术前患者均未接受过化学药物疗法、放射性治疗及靶向药物治疗等抗肿瘤治疗。参加实验的患者均提前告知,术前均签署知情同意书,本实验经中国人民解放军武汉总医院伦理委员会审核并通过。参照国际肺癌研究协会 (IASLC) 2009年修订发布的非小细胞肺癌TNM分期标准:Ⅰ期33例(55.0%)、Ⅱ期12例(20.0%)、Ⅲ期15例(25.0%)。术后病理类型:腺癌38例(63.3%),鳞癌18例(30.0%),腺鳞癌4例(6.7%)。组织分化程度:高等分化4例(6.7%)、中等分化41例(68.3%)、低等及未分化15例(25.0%)。淋巴结转移情况:无淋巴结转移39例(65.0%),有淋巴结转移21例(35.0%)。另外实验中取10例排除肺癌患者的正常肺组织,所有标本切取后置于液氮罐中冷冻储存。
1.2 TFPI-2基因CpG岛甲基化检测 取冻存的癌组织25 mg剪碎后加入液氮研磨至粉状,将其处理为细胞悬液,离心后予以RNaseA及蛋白酶K溶液降解多次离心固定后经重亚硫酸盐处理DNA。采用MS-PCR法,引物采用Primer Premier5.0生物软件设计。甲基化正向引物:5′-TTTATGTTTTTAAGAGGTGGATTTC-3′,反向引物:5′-AACTTTCTCCTATAATCCAAACGAA-3′;非甲基化正向引物:5′-TTATGTTTTTAAGAGGTGGATTTTG-3′,反向引物:5′-CAAACTTTCTCCTATAATCCAAACAA-3′。PCR扩增:PCR 反应总体系为25 μL,PCR buffer 2.0 μL,2.5 mmol/L dNTPMixture 1.6 μL,正向引物0.2 μL,反向引物0.2 μL,Taq 酶0.1 μL,修饰后的DNA模板2.0 μL,三蒸水13.9 μL补足总体积。反应条件:94 ℃,4 min;94 ℃,30 s;56 ℃,30 s;72 ℃,45 s;35个循环;72 ℃,5 min,最后在凝胶成像系统中成像并摄像。实验结果分为完全甲基化、不完全甲基化及非甲基化[4]。其中完全甲基化是指经甲基化特异性的引物扩增出条带,而非甲基化特异性的引物未扩增出条带,表明TFPI-2基因CpG岛发生了完全甲基化。而不全甲基化是指甲基化和非甲基化特异性的引物均扩增出条带,其出现的原因可能是因为肿瘤细胞的一个等位基因发生了甲基化而另一个未发生甲基化造成的,这种情况亦被定义为甲基化阳性。而非甲基化则是指甲基化和非甲基化特异性的引物均未能扩增出条带,表明TFPI-2基因CpG岛未发生甲基化。
1.3 统计学方法 采用SPSS13.0统计软件。率的比较采用χ2检验,评价TFPI-2基因甲基化与非小细胞肺癌患者临床病理特征的关系。Plt;0.05为差异有统计学意义。
2 结果
2.1 TFPI-2基因CpG岛甲基化状态 TFPI-2基因在60例非小细胞肺癌组织中的甲基化(包括完全和不完全甲基化)阳性率达到38.3%(23/60),在相应癌旁组织中的甲基化阳性率达到6.7%(4/60),TFPI-2基因在非小细胞肺癌组织及癌旁组织的甲基化阳性率比较,P=0.009。正常肺组织中无一例发生甲基化。典型的MS-PCR结果见图1。
2.2 TFPI-2基因甲基化与非小细胞肺癌患者临床病理特征的关系 见表1。
3 讨论
DNA甲基化是指在DNA甲基转移酶催化作用下,DNA的C、G二核苷酸的胞嘧啶选择性地结合一个甲基团,形成5-甲基胞嘧啶[5]。DNA甲基化是一种表观遗传学的修饰过程,可通过某些基因甲基化程度的改变而造成基因功能的失活,从而导致某些恶性肿瘤的发生和进展[6]。CpG岛甲基化在肿瘤的早期阶段、癌前阶段已存在,其可能参与细胞周期的调控、DNA修复、细胞凋亡及肿瘤的浸润和转移等多个环节[7]。
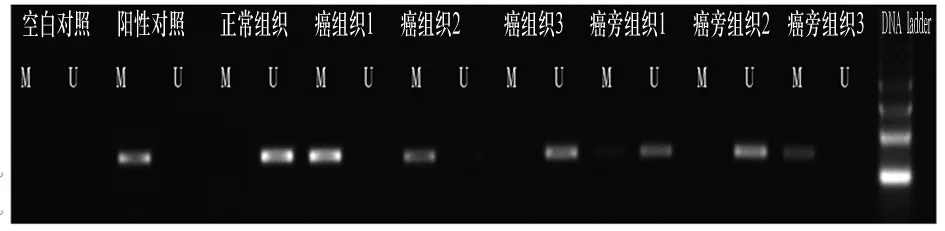
注: M:甲基化,U:非甲基化。
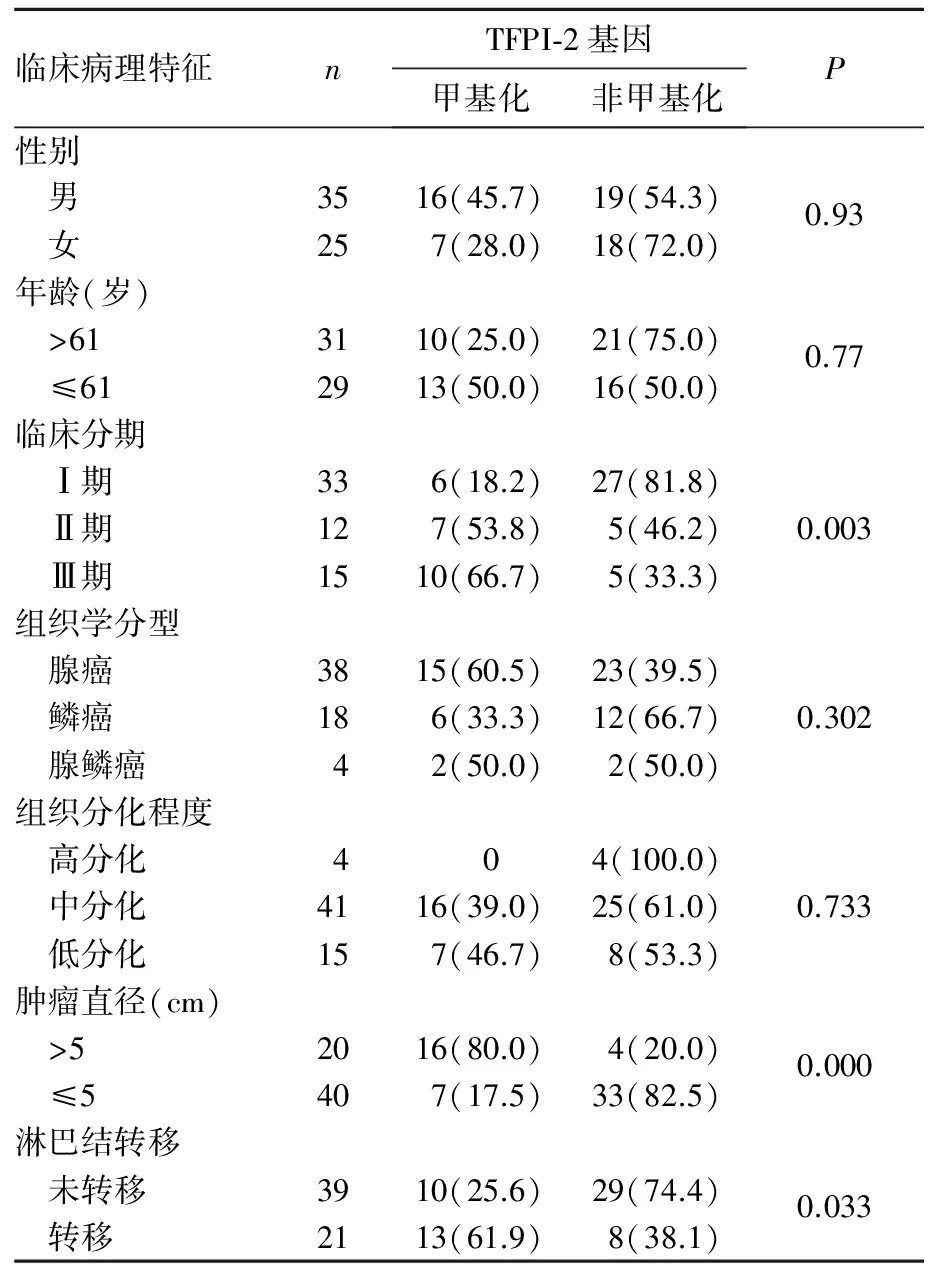
图1 TFPI-2基因在非小细胞肺癌组织、癌旁组织的甲基化状态
人类TFPI-2基因位于染色体7q22,基因全长约7 kb,其基因链中含有一个220 bp的CpG岛,跨距外显子1和外显子3的转录起始位点,G+C 的含量约占比为77%[8]。TFPI-2亦称胎盘蛋白-5,是一种含有kunits型结构的丝氨酸蛋白酶抑制物超家族成员,参与维护细胞外基质(ECM)结构的完整性及控制肿瘤侵袭和转移等,通过抑制肿瘤组织中血管生成从而抑制肿瘤组织生长,并具有抑制细胞增殖、诱导细胞凋亡等多种生物特性[9]。研究表明在多种人类肿瘤中,TFPI-2基因启动子CpG岛甲基化可致TFPI-2基因沉默。近年来多项研究发现,在肝癌、神经胶质瘤、结肠癌、胰腺癌等恶性肿瘤中,TFPI-2基因CpG岛甲基化使得TFPI-2表达出现下降或缺失,这与肿瘤的生长和发展有关。
TFPI-2抑制肿瘤浸润及转移的机制可能有[10,11]:①TFPI-2通过抑制MMPs在内的多种蛋白酶的活性,阻断ECM的重塑,维持ECM结构的完整性,从而抑制肿瘤浸润及转移。②TFPI-2通过上调TNF-R、Fas-R的表达,促进Caspase-3及Caspase-9相互作用,从而在肿瘤细胞凋亡过程中启动促进作用;TFPI-2抑制ECM中纤溶酶及MMPs等活性,保护FasL配体细胞外结构域的完整性,并与VEGF相互作用,使得促凋亡蛋白Bax的表达增高,使得凋亡蛋白Bcl-2表达降低,诱导肿瘤细胞的凋亡从而发挥其抗肿瘤效应。③TFPI-2通过拮抗组织因子,从而阻断血管生成;TFPI-2通过抑制血管内皮细胞的迁移和管道形成,配偶和肿瘤血管生成拟态,从而抑制肿瘤新生血管的形成。
本研究结果显示,60例患者中非小细胞肺癌组织的TFPI-2基因甲基化阳性率明显高于癌旁组织,而同期检测的10例正常肺组织中TFPI-2基因无一例出现甲基化。表明在正常组织、癌旁组织及肺癌组织中TFPI-2基因甲基化率依次增高。推断TFPI-2基因CpG岛甲基化程度越高,肿瘤发生浸润的可能性越大。同时发现,Ⅰ、Ⅱ期非小细胞肺癌组织中TFPI-2表达阳性率高于Ⅲ期,差异有统计学意义。TFPI-2基因CpG岛的异常甲基化导致了TFPI-2基因表达下降,并可能与非小细胞肺癌发生和转移有关。进一步分析发现,非小细胞肺癌患者的临床分期、肿瘤直径及淋巴结转移与TFPI-2基因甲基化呈正相关,原因可能是TFPI-2基因启动子区异常甲基化,致抑癌基因失活,使其抑制肿瘤发生发展、浸润转移的作用明显下降。但不同病理类型非小细胞肺癌,如腺癌、鳞癌及腺鳞癌,其TFPI-2基因CpG岛甲基化率无统计学差异。主要原因与非小细胞肺癌中不同病理类型肿瘤中细胞生物学特征相似有关。以上结论表明TFPI-2基因CpG岛甲基化与非小细胞肺癌的发生及浸润、转移有关,但因本实验收集样本量较小,致肿瘤组织分化程度高低及肿瘤组织学类型与TFPI-2基因甲基化阳性率无统计学差异,此种现象的原因可能与本组实验中收集的腺癌和中等分化程度的非小细胞肺癌偏多有关。
[1] 解宝泉,张志艳,王袁,等.血清CEA、CYFRA2 1-1及SCCA检测对肺癌患者预后的评估价值[J].山东医药,2017,57(5):54-55.
[2] Wu D, Xiong L, Wu S, et al. TFPI-2 methylation predicts poor prognosis in non-small cell lung cancer[J]. Lung Cancer, 2012,76(1):106-111.
[3] Gessler F, Voss V, Seifert V, et al. Knockdown of TFPI-2 promotesmigration and invasion of glioma cells[J]. Neurosci Lett, 2011,497(1):49-54.
[4] 郑浩,汤志刚.5-Aza-CdR对胰腺癌细胞系Panc-1中TFPI-2基因甲基化水平及表达的影响[J].肿瘤防治研究,2012,39(2):233-236.
[5] Hashimoto H, Vertino PM, Cheng X. Molecular coupling of D N Amethylation and histone methylation [J]. Epigenomics, 2016,2(5):657-669.
[6] Lakka SS, Konduri SD, Mohanam S, et al. In vitro modulation of human lung cancer cell line invasiveness by antisense cDNA of tissue factor pathway inhibitor-2[J]. Clin Exp Metastasis, 2000,18(3):239-244.
[7] Vaitkiene P, Skiriute D, Skauminas K, et al. Associations Between TFPI-2 Methylation and Poor Prognosis in Glioblastomas[J]. Medicina, 2012,48(7):345-349.
[8] Dong YQ, Liang JS, Zhu SB, et al. Effect of 5-aza-2′-deoxycytidine on the cell proliferation of non-small cell lung cancer cell line A549 cells and expression of TFPI-2 gene[J]. Asian Pac J Cancer Prev, 2013,14(7):4421-4426.
[9] 梁江水,董永强,殷桂林,等.5-Aza-CdR对非小细胞肺癌细胞株A549细胞TFPI-2基因甲基化水平及表达的影响[J].实用医学杂志,2013,29(21):3475-3478.
[10] Qiao Z, Yao Z, Shi ZW, et al. Reduced expression of tissue factor pathway inhibitor-2 contributes to apoptosis and angiogenesis in cervical cancer[J]. J Exp Clin Cancer Res, 2012,319(1):1.
[11] Takada H, Wakabayashi N, Dohi O, et al. Tissue factor pathway inhibitor 2 (TFPI2) is frequently silenced by aberrant promoter hypermethylation in gastric cancer[J]. Cancer Genet Cytogenet, 2010,197(1):16-24.
10.3969/j.issn.1002-266X.2017.41.028
R734.2
B
1002-266X(2017)41-0082-03
董永强(E-mail:xin15ge@163.com)
2017-08-01)
