脉冲电场处理油菜籽对菜籽油品质的影响
2017-12-11王丽娟钱建亚
张 良, 王丽娟,钱建亚
(扬州大学 食品科学与工程学院,江苏 扬州 225127)
脉冲电场处理油菜籽对菜籽油品质的影响
张 良, 王丽娟,钱建亚
(扬州大学 食品科学与工程学院,江苏 扬州 225127)
脉冲电场;油菜籽;菜籽油;品质
油菜是一种历史悠久、全世界范围种植的含油种子作物。在所有油料作物的油脂中,菜籽油中酚类物质含量最高,并含有丰富的植物甾醇[1]。菜籽油的萃取方法包括压榨法和溶剂浸提法。压榨法效率较低,饼粕中残油量大[2],为了提高得率,可采用清洗、破裂、粉碎、脱壳和热炒等预处理工序[3]。溶剂浸提法出油率高,但原料中存在的具有生物活性的非极性成分不能被有机溶剂溶解并浸提出。低温制油是油脂工业的追求,因为低温可降低蛋白质变性程度,使蛋白质得到更好的应用。
脉冲电场 (PEF) 处理是一种非热加工技术,20世纪90年代起成为食品领域的研究热点,但是研究仅局限于液态食品 (果汁、鸡蛋和牛奶等),主要用于杀菌和钝酶方面。我们的前期研究证明PEF可以直接用于对固体物料进行处理以获得所希望的效果[4],采用PEF处理油菜籽颗粒可以提高出油率[5]。本研究旨在评价脉冲电场处理后所得菜籽油的主要功能性成分和理化性质等品质指标。
1 材料与方法
1.1 试验材料
双低油菜籽:秦优7号,产于江苏盐城;大豆油 (含TBHQ):益海嘉里江苏泰州分公司;DPPH、α-生育酚 (99.9%)和γ-生育酚 (gt;95%) 标准品:Sigma公司;抗坏血酸 (VC) 和BHA:天津市致远化学试剂有限公司。其他试剂均为分析纯。
HD35-5脉冲电源;Trace DSQ II气相色谱-质谱联用仪:美国Thermo公司;LC-20A液相色谱仪 (配有UV-VIS检测器SPD-20A):日本岛津公司;UV-2401PC紫外可见分光光度计:日本 Shimadzu 公司;WSL罗维朋比色计。
1.2 试验方法
1.2.1 油样制备
依据文献[5]脉冲电场最佳条件,设定脉冲电压35 kV、物料停留时间 185 s、脉冲频率806 Hz、脉冲宽度8 μs,对50 g含水量约50%的油菜籽进行处理,40℃烘干,粉碎,以油菜籽粉与溶剂比1∶5加入异丙醇,75℃浸提两次,每次2 h,合并萃取液,蒸发脱溶,油置于4℃保存。相同条件下以未经PEF处理的油菜籽所萃取的油为对照组。
1.2.2 理化品质分析
酸值测定:根据GB/T 5530—2005进行;过氧化值测定:根据GB/T 5538—2005进行;p-茴香胺值测定:根据GB/T 24304—2009进行;碘值测定:根据GB/T 5532—2008进行;皂化值测定:根据GB/T 5534—2008进行;透明度、气味测定:根据GB/T 5525—2008进行;色泽测定:根据GB/T 22460—2008进行;加热试验:根据GB/T 5531—2008进行。
1.2.3 营养品质分析
总酚含量测定:参照文献[1,6]的方法。稍作修改。准确取1.00 g菜籽油于10 mL离心管中,分别加入1.5 mL正己烷和80%甲醇水溶液,涡旋混合6 min,5 000 r/min离心10 min,向下层溶液中加入1.5 mL 80%甲醇水溶液重复萃取,合并上层萃取液,4℃保存备用。将0.6 mL的萃取液移入10 mL比色管,缓慢加入5 mL蒸馏水和0.5 mL福林酚显色剂,8 min后,加入2 mL饱和碳酸钠溶液,加蒸馏水至刻度,混匀,暗反应30 min,用甲醇溶液作空白,以波长765 nm处测得OD值(y)对标准单宁酸质量浓度(x)作图得标准曲线y=0.077 7x+0.020 3 (R2= 0.994 8)。
生育酚含量测定:参照GB/T 26635—2011。以标准物质质量浓度 (x) 对色谱峰面积(y)作图得到标准曲线:α-生育酚:y=3 468.2x+63 450(r=0.999 3);γ-生育酚:y=4 923.6x-6 762(r=0.999 3)。
1.2.4 油脂体外抗氧化能力测定

将PEF组和对照组菜籽油分别以质量分数1%、5%、10%加入10 g大豆油中,以不添加菜籽油的大豆油作为空白,以添加0.01% BHA的大豆油作为阳性对照,充分混匀后封口,置于50℃恒温箱内,每隔2 d取样测定过氧化值(POV)。
1.2.5 油脂贮藏稳定性测定
分别将PEF组和对照组菜籽油放入白色玻璃烧杯中,在室温自然光条件下放置。每隔2 d测定透明度、气味和颜色。每隔5 d测定油脂酸值、过氧化值及p-茴香胺值。
1.2.6 统计分析方法
釆用Excel 2007和SPSS22.0软件作图和进行统计分析,Plt;0.01表示差异极显著,Plt;0.05表示差异显著,Pgt;0.05表示差异不显著。
2 结果与讨论
2.1 PEF处理对菜籽油理化性质的影响(见表1)

表1 PEF处理对菜籽油理化性质影响
注:**表示差异极显著。
从表1可以看出,PEF组的油脂酸值(KOH)为1.44 mg/g,极显著高于对照组的酸值(KOH)0.77 mg/g(Plt;0.01),与Guderjan等[8]的结果相似。酸值的增加可能是由脉冲电场冲击酯链裂解引起的。PEF组过氧化值 (3.18 mmol/kg) 极显著高于对照组的(2.05 mmol/kg)(Plt;0.01),与文献[9-10]报道结果相似。原因可能是PEF对物料持续作用,使得不饱和脂肪氧化生成过氧化物。PEF组p-茴香胺值(0.89) 极显著高于对照组的(0.63)(Plt;0.01)。这是由于PEF处理时,初级氧化物不断氧化裂解,产生小分子挥发性醛等物质,加速了二级氧化产物的生成速率[9]。PEF组碘值(I)(921.8 g/kg)极显著低于对照组的(982.4 g/kg)(Plt;0.01)。皂化值无显著差异(Pgt;0.05)。PEF组和对照组油脂色泽均符合四级菜籽油国家标准。加热有絮状物出现,油脂色泽变深,需进行脱胶处理。
2.2 PEF处理对菜籽油营养品质的影响
2.2.1 PEF处理对总酚含量的影响
油菜籽经PEF处理使菜籽油中的总酚 (以单宁酸计) 含量从(337.7±1.8) mg/kg极显著增加到(464.1±5.8) mg/kg,与Guderjan等[8]的结果相似,认为PEF处理能显著增加菜籽油中的生育酚、多酚、植物甾醇等抗氧化物质。
2.2.2 PEF处理对生育酚含量的影响(见表2)
表2PEF处理对生育酚含量的影响mg/kg

组别α-生育酚γ-生育酚对照组163.2±5.5∗∗414.6±0.4∗∗PEF组190.8±2.0∗∗476.4±16.3∗∗
菜籽油中的生育酚以α-、γ-生育酚为主,δ-生育酚含量极少,无β-生育酚检出。从表2可以看出,与对照组相比油菜籽经PEF处理后,菜籽油中α-、γ-生育酚含量均极显著增加(Plt;0.01),其中α-生育酚增加了16.9%,γ-生育酚增加了14.9%。Azadmard-damirchi等[11]发现微波预处理使菜籽油中生育酚含量提高了55%。值得注意的是,α-生育酚是油脂回色的主要因素,Zhang等[12]发现在油脂回色中,α-生育酚比γ-生育酚表现出更强的相关性。
2.3 PEF处理对菜籽油体外抗氧化能力的影响
2.3.1 PEF处理对菜籽油清除DPPH·能力的影响(见图1)
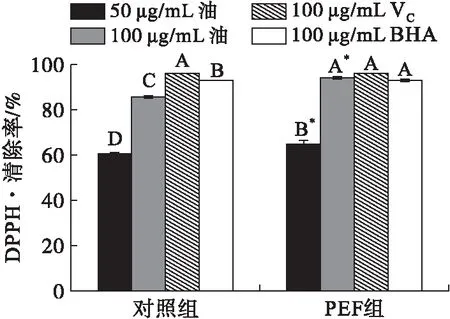
注:不同大写字母表示组内比较差异极显著;*表示组间比较差异显著。下同。
图1PEF处理对菜籽油清除DPPH·能力的影响
由图1可知,PEF组油样对DPPH·清除率显著高于对照组的。随着菜籽油质量浓度的增加,对DPPH·清除率极显著增加,当菜籽油质量浓度达到100 μg/mL时,PEF组的菜籽油对DPPH·清除率与100 μg/mL VC、100 μg/mL BHA的相当,可能是因为菜籽油中含有较多的抗氧化成分如多酚类化合物和生育酚的原因。
2.3.2 PEF处理对菜籽油清除·OH能力的影响(见图2)
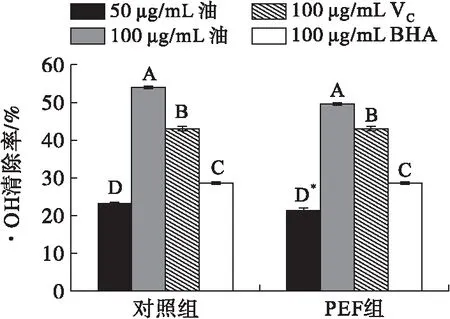
图2 PEF处理对菜籽油清除·OH能力的影响
由图2可知,·OH的清除率随菜籽油质量浓度的增加而增大,增加效果极显著。当菜籽油质量浓度达到100 μg/mL时对·OH自由基清除率极显著高于100 μg/mL VC和100 μg/mL BHA。PEF处理前后的菜籽油对·OH均具有较高的清除率,但菜籽油质量浓度为50 μg/mL时,PEF组显著低于对照组。
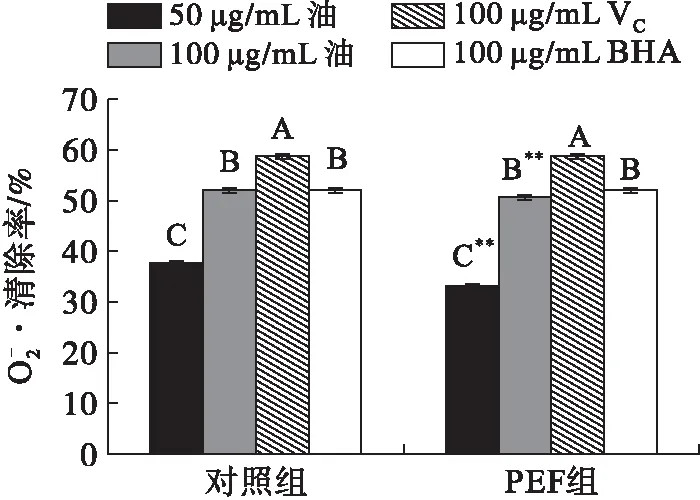
注:不同大写字母表示组内比较差异极显著,**表示组间比较差异极显著。


2.3.4 菜籽油对大豆油贮藏稳定性的影响 (见表3)
油脂在贮藏过程中,不饱和脂肪酸容易发生氧化和分解,在降低油脂营养价值的同时,伴随着有害物质的产生,并引起过氧化值的升高。常用过氧化值作为食用油氧化劣变水平的度量标准。
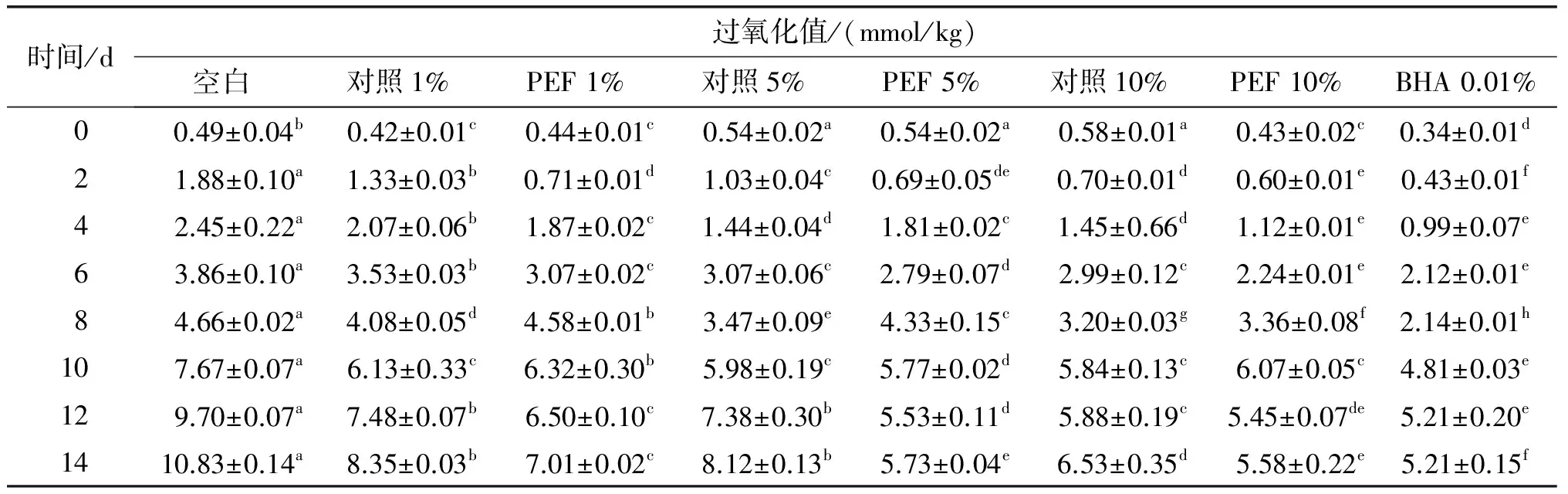
表3 菜籽油对大豆油贮藏稳定性的影响
注:用LSD法进行多重比较,同一行中标注不同小写字母代表差异显著;标注同一小写字母代表无显著性差异。
从表3可以看出,随着贮藏时间的延长,大豆油(空白)过氧化值不断增加。加入1%、5%和10%的PEF处理前后的菜籽油均可延缓大豆油过氧化值的升高。空白组在10 d时过氧化值达到7.67 mmol/kg,超过7.5 mmol/kg的国家标准限值;1%、5%对照组过氧化值在12 d接近限值,分别为7.48、7.38 mmol/kg,14 d时超出限值,分别达到8.35、8.12 mmol/kg;添加PEF处理后的菜籽油在14 d贮藏试验中,大豆油的过氧化值保持在国家标准限值内。方差分析显示,菜籽油对大豆油的抗氧化效果显著。PEF组菜籽油的添加量达到10%时,4、6 d和12 d的抗氧化效果与0.01% BHA相当;14 d时,5%和10% PEF组的菜籽油添加效果相当,无显著差异。
2.4 PEF处理对菜籽油贮藏性质的影响
2.4.1 PEF处理对油脂透明度、气味的影响
透明度是植物油脂的重要质量指标,是对油脂中是否含有过量的水分和磷脂等非油脂成分的初步判断,以此可推断油脂的纯净程度。在10 d的观察期内,所有测试样品均表现出透明无浑浊,具有菜籽油固有的气味,无异味。
2.4.2 PEF处理对油脂色泽影响(见表4)
从表4可以看出,在贮藏0、2 d,PEF组油脂黄色值(Y)和红色值(R)均显著、极显著(Plt;0.05) 大于对照组。随着贮藏时间延长,各组Y值和R值都有不同幅度增长,PEF组变化显著。原因可能是不饱和脂肪酸在PEF作用下发生氧化聚合反应[13],此外非油成分天然色素、生育酚和植物甾醇等的氧化也会加深油脂颜色。相关研究表明生育酚的氧化是油脂变色的主要影响因素[14]。

表4 PEF处理菜籽油贮藏过程中色泽的变化
注:表中同一列数字上的不同大写字母表示组内比较差异极显著;*和**分别表示组间比较差异显著或极显著。
2.4.3 PEF处理对油脂酸值的影响(见图4)

图4 PEF处理对菜籽油酸值的影响
由图4可知,随着贮藏时间延长,PEF组酸值的变化比对照组的缓慢,且贮藏前期变化较小,后期变化较大。贮藏40 d时对照组酸值高于PEF组。贮藏60 d时PEF组的酸值(KOH)是3.90 mg/g,而对照组的酸值(KOH)已经达到4.62 mg/g,不符合国家标准的要求 (≤4 mg/g)。
2.4.4 PEF处理对油脂过氧化值的影响(见图5)
由图5可知,随着贮藏时间的延长过氧化值增加,0~20 d时过氧化值变化速度相对缓慢,40 d后过氧化值变化较快。随着贮藏时间的延长,PEF组的过氧化值的变化速度相对于对照组的缓慢,45 d后对照组的过氧化值高于PEF组的。

图5 PEF处理对菜籽油过氧化值的影响
2.4.5 PEF处理对油脂p-茴香胺值的影响(见图6)
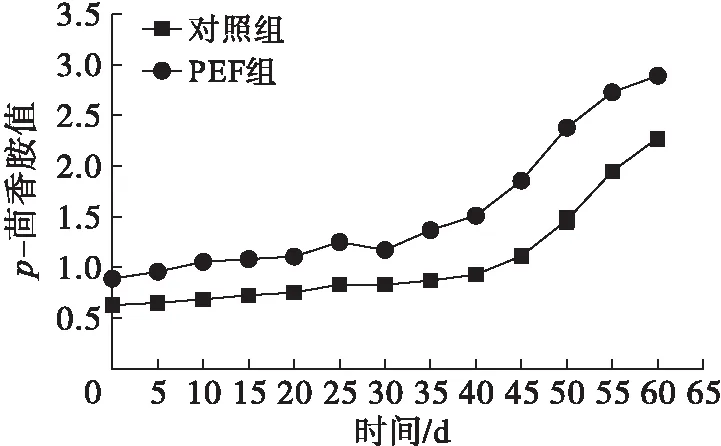
图6 PEF处理对菜籽油p-茴香胺值的影响
p-茴香胺值是通过检测油脂中2-直链烯醛的含量来评估油脂二级氧化产物含量变化的。由图6可知,贮藏40 d前各组p-茴香胺值无显著变化,40 d后迅速增加,且PEF组的p-茴香胺值高于对照组的。Cao等[15]认为油脂氧化的机理与油脂二级氧化产物的生成速度有关,油脂中的过氧化物极不稳定,会进一步分解为小分子的醛、酮和醌。PEF的作用机理需作进一步的研究。
3 结 论

[1] KOSKI A, PSOMIADOU E, TSIMIDOU M, et al. Oxidative stability and minor constituents of virgin olive oil and cold-pressed rapeseed oil [J]. Eur Food Res Technol, 2002, 214(4): 294-298.
[2] ANDERSON D. A primer on oils processing technology [M]. New York: John Wiley amp; Sons Inc., 1996: 1-60.
[3] GALLOWAY G P. Cleaning, cracking, dehulling, decorticating and flaking of oil bearing materials [J]. J Am Oil Chem Soc, 1976, 53(6): 271-274.
[4] QIAN J Y, GU Y P, JIANG W, et al. Inactivating effect of pulsed electric field on lipase in brown rice[J]. Innov Food Sci Emerg Technol, 2014, 22(4): 89-94.
[5] 王丽娟, 钱建亚. 脉冲电场处理双低油菜籽提高出油率及对主要脂肪酸的影响[J]. 中国油脂, 2016, 41(10): 6-10.
[6] KAUR C, KAPOOR H C. Anti-oxidant activity and total phenolic content of some Asian vegetables [J]. Int J Food Sci Technol, 2002, 37(2): 153-161.
[7] 孔浩, 张继. 杏仁油及葡萄籽油清除自由基能力研究[J]. 甘肃科技, 2008, 24(6): 57-58.
[8] GUDERJAN M, ELEZ -MARTNEZ P, KNORR D. Application of pulsed electric fields at oil yield and content of functional food ingredients at the production of rapeseed oil [J].Innov Food Sci Emerg Technol, 2007, 8(1): 55-62.
[9] ZENG X A, HAN Z, ZI Z H. Effects of pulsed electric field treatments on quality of peanut oil [J]. Food Control, 2009, 21 (5): 611-614.
[10] 资智洪, 曾新安. 高强脉冲电场作用下水中溶解氧的变化反应[J]. 高电压技术, 2008, 34 (4): 695-699.
[11] AZADMARD-DAMIRCHI S, HABIBI-NODE F, HESARI J, et al. Effect of pretreatment with microwaves on oxidative stability and nutraceuticals content of oil from rapeseed [J]. Food Chem, 2010, 121(4): 1211-1215.
[12] ZHANG Y, XU X, JIANG Y, et al. Effect of tocopherols and phytosterol on color reversion of MCT [J]. Food Sci Technol Res, 2013, 19(6): 1127-1131.
[13] MALLIKA MANRAL M C, PANDEY K, JAYATHILAKAN K, et al. Effect of fish (Catlacatla) frying on the quality characteristics of sunflower oil [J]. Food Chem, 2008, 106(2): 634-639.
[14] 张余权. 植物油储存过程中回色机理研究[D]. 江苏 无锡: 江南大学, 2015.
[15] CAO J, DENG L, ZHU X M, et al. Novel approach to evaluate the oxidation state of vegetable oils using characteristic oxidation indicators [J]. J Agric Food Chem, 2014, 62(52): 12545-12552.
Effectofpulsedelectricfieldonqualityofcanolaoilbytreatingoilseedgrain
ZHANG Liang, WANG Lijuan, QIAN Jianya
(School of Food Science and Engineering, Yangzhou University, Yangzhou 225127, Jiangsu, China)
pulsed electric field; oilseed grain; canola oil; quality
TS225.14;S565.4
A
1003-7969(2017)11-0033-05
2017-02-14;
2017-07-27
国家自然科学基金项目(31571765)
张 良 (1989), 女, 讲师,硕士生导师,博士,研究方向为食品科学与工程 (E-mail) zhangliang@yzu.edu.cn。
钱建亚,教授,博士生导师,博士(E-mail) jyqian@yzu.edu.cn。
