提高微绿球藻的生物量和油脂含量的研究
2017-12-11郭晓烨邱昌扬何勇锦王明兹陈必链福建师范大学生命科学学院福州3507福建师范大学工业微生物教育部工程研究中心福州3507
郭晓烨,邱昌扬,何勇锦,陈 涵,王明兹,2,陈必链,2(.福建师范大学 生命科学学院,福州 3507; 2.福建师范大学 工业微生物教育部工程研究中心,福州 3507)
提高微绿球藻的生物量和油脂含量的研究
郭晓烨1,邱昌扬1,何勇锦1,陈 涵1,王明兹1,2,陈必链1,2
(1.福建师范大学 生命科学学院,福州 350117; 2.福建师范大学 工业微生物教育部工程研究中心,福州 350117)
研究光照强度和硝酸钾质量浓度对微绿球藻生物量和油脂含量的影响,通过两步培养法培养微绿球藻提高其生物量和油脂含量。结果表明:在硝酸钾质量浓度100 mg/L条件下,当光照强度为1 940~2 060 lx时,培养12 d,微绿球藻的生物量和油脂含量最高,分别为0.68 g/L和16.28%;低光照强度(1 940~2 060 lx)下,在不添加硝酸钾时,微绿球藻的生物量最低,为0.39 g/L,油脂含量最高,为22.62%;随着硝酸钾质量浓度的增加,微绿球藻的生物量逐渐增加,而油脂含量逐渐下降;两步培养法可以促进微绿球藻的油脂合成,油脂含量和油脂产量分别达到30.50%和0.15 g/L。
微绿球藻;两步培养;油脂;生物量
微绿球藻是海洋经济型产油微藻,具有油脂含量高、易培养、细胞壁薄、营养丰富等特点[1-2]。因此,利用富油微绿球藻开发生物柴油,具有广阔的发展前景。提高微绿球藻的油脂含量和生物量的研究,主要是通过调控氮、磷、金属离子、光照和培养模式等途径。研究表明,在氮缺乏条件下,会促进微绿球藻细胞的油脂合成,但会影响微藻的生长。窦晓等[3]研究了N/P比和氮盐浓度对眼点拟微绿球藻培养密度和油脂含量的影响,当培养基中NaNO3质量浓度为0.225 g/L、N/P比为4∶1时,生物量和油脂含量均最大,分别为2.53 g/L和41.20%。杜晓凤等[4]通过正交实验设计优化气升式反应器培养微绿球藻产油条件,结果表明,在光照强度为5 000 lx、光周期L∶D为10∶14、温度24℃条件下缺氮培养,微绿球藻的油脂含量最高,为46.72%。
在实际生产中,微藻的生长与产油主要呈非生长相关型,即在极端条件(缺营养物质和/或强光)下有利于油脂积累[5]。为了提高微藻生物量和油脂产量,获得适合微藻生物量与细胞油脂含量的平衡条件,是开发第三代微藻生物质能源的关键技术点。两步培养法可实现该平衡[6],即第一步提高生物量:在低光照强度下,在含氮的培养基中培养微藻到稳定期;第二步积累油脂:离心收获藻泥,再将其转于缺氮培养基中,并置高光照强度下培养,胁迫其积累油脂。Mujtaba等[7]利用两步培养法通过含氮培养基培养使小球藻生物量达1.87 g/L,再将其转于缺氮条件培养积累油脂,使油脂含量从14.50%提高到24.60%(干重)。本课题组的李小妹等[8]采用两步培养法培养栅藻,生物量可达0.96 g/L,油脂含量可达23.35%,生物量和油脂含量分别比常规单步法培养(10 d)提高了35.74%和近1倍;而采用两步缺氮法培养,油脂含量可达50%左右,最高可达53%[9]。本文研究光照强度和硝酸钾质量浓度对微绿球藻的生物量和油脂含量的影响,然后研究两步培养法对微绿球藻合成油脂的影响,以期为微绿球藻的工业化应用提供基础数据。
1 材料与方法
1.1 实验材料
1.1.1 藻种
微绿球藻Nannochlorisoculata,保藏于本实验室。
1.1.2 培养基
采用MAV配方,组成成分为:KNO3100 mg/L,KH2PO410 mg/L,FeSO4·7H2O 2.5 mg/L,MgSO40.25 mg/L,Na2EDTA 10 mg/L,维生素B125×10-7mg/L,维生素B16×10-3mg/L,海水1 L,pH 7.0,121℃灭菌20 min。其中,FeSO4·7H2O和维生素通过0.22 μm过滤除菌。
含100 mg/L KNO3的MAV培养基标记为MAV(+N),缺KNO3的MAV培养基标记为MAV(-N)。
1.2 实验方法
1.2.1 光照强度和硝酸钾质量浓度对微绿球藻生物量和油脂含量的影响
以20%的接种量接种于内装MAV(+N)培养液120 mL的500 mL三角瓶中,设定4个光照强度范围(1 230~1 320 lx、1 940~2 060 lx、2 440~2 720 lx和3 000~3 250 lx)和4个硝酸钾质量浓度水平(0、50、100、150 mg/L),130 r/min的摇床培养,培养温度为(25±1)℃,培养12 d,测定生物量和油脂含量。
1.2.2 两步培养法
第一步(高氮培养):将微绿球藻接种于MAV(+N)培养基中,在低光照强度(1 940~2 060 lx)下摇床培养至稳定期(12 d)。第二步(缺氮培养):将藻液于5 000 r/min离心10 min,弃去上清液,用培养基MAV(-N)洗藻泥,将藻泥接种于MAV(-N)培养基中,于高光照强度(7 500 lx)下摇床培养8 d。
1.2.3 两步缺氮培养法
第一步(缺氮培养):将微绿球藻培养至生长对数期后,接种于MAV(-N)培养基中,于低光照强度(1 940~2 060 lx)下摇床培养至稳定期(12 d)。第二步(缺氮培养):将藻液于5 000 r/min离心10 min,弃去上清液,用培养基MAV(-N)洗藻泥,将藻泥接种于MAV(-N)培养基中,于高光照强度(7 500 lx)下摇床培养8 d。
1.2.4 生物量测定
取一定量藻液,于4℃下16 000 r/min离心5 min,弃去上清液,蒸馏水洗涤2次,将藻泥置于80℃烘干至恒重,称重。
1.2.5 油脂含量测定
参考Bligh等[10]方法。将150 mL藻液于10 000 r/min离心10 min后,弃去上清液,蒸馏水洗涤2次,冷冻干燥后,收集藻粉。称取50~100 mg冻干藻粉于10 mL具盖螺口离心管中,加入5 mL 5% KOH溶液,间歇振荡混匀20 min,70℃水浴加热5 min,5 000 r/min离心10 min,去除含叶绿素的上清液,重复1次。加2 mL 4 mol/L盐酸溶液,充分混匀,室温下静置30 min,沸水浴加热5 min,-20℃重复速冻5次。加入3 mL氯仿-甲醇(体积比2∶1),间歇振荡混匀20 min,5 000 r/min离心10 min后,取氯仿层,重复3次。收集氯仿层于10 mL离心管中,加入等体积的5% NaCl溶液,充分混匀,5 000 r/min离心10 min后,收集氯仿层,真空去除氯仿,至恒重。油脂含量=油脂质量/冻干藻粉质量×100%。
1.2.6 培养液中硝酸钾质量浓度的测定[11]
硝酸钾标准曲线的制作:取6支试管,配制不同质量浓度的硝酸钾溶液。每支试管中依次加入0.1 mL 8 g/L氨基磺酸、0.4 mL 1 mol/L盐酸和8.5 mL蒸馏水,至溶液共10 mL,于220 nm和275 nm波长下分别测吸光值A。以硝酸钾质量浓度为纵坐标,以吸光值(A220-2A275)为横坐标,绘制标准曲线,得到标准曲线方程为:y=17.185(A220-2A275)-0.070 5,R2=0.999 69。
培养液中硝酸钾质量浓度的测定:取1.0 mL微绿球藻培养液,1 000 r/min离心5 min后,取上清培养基,加入0.1 mL 8 g/L氨基磺酸、0.4 mL 1 mol/L 盐酸和8.5 mL蒸馏水。以新鲜海水为对照组,在220 nm和275 nm波长下,测吸光值。根据标准曲线方程,计算样品中硝酸钾的质量浓度。
1.2.7 数据处理
每组实验数据设3个平行,采用Micro Excel 2010和Origin 8.5软件处理数据,结果用“平均值±标准偏差”表示。
2 结果与讨论
2.1 光照强度对微绿球藻生物量和油脂含量的影响
在硝酸钾质量浓度为100 mg/L的条件下,考察不同光照强度对微绿球藻生物量和油脂含量的影响,结果见图1。
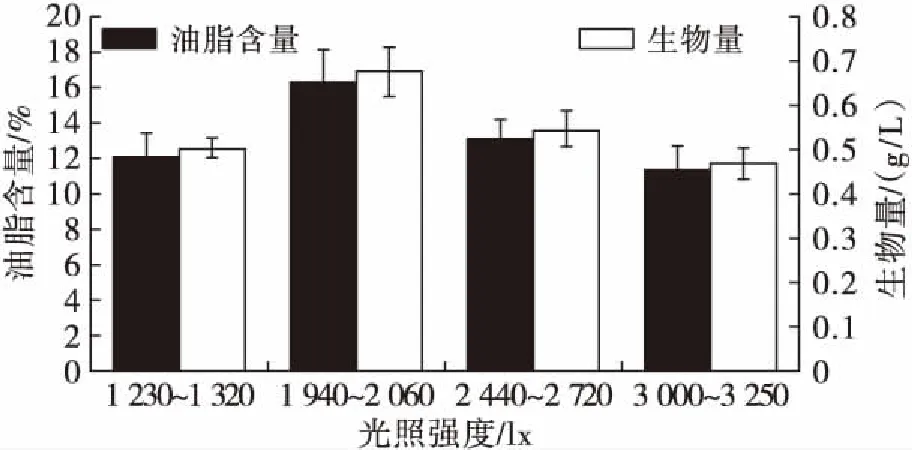
图1 光照强度对微绿球藻生物量和油脂含量的影响
由图1可知,当光照强度处于1 940~2 060 lx时,微绿球藻的生物量和油脂含量都最高,分别为0.68 g/L和16.28%。当光照强度低于1 940 lx或高于2 060 lx时,微绿球藻的生物量和油脂含量较低。Li等[12]研究发现,光照强度会影响新颖拟绿球藻(Pseudochlorococcumsp.)合成淀粉的关键酶腺苷二磷酸焦磷酸化酶(ADPase)的活性,导致微藻的生化组分存在较大差异性。Jia等[13]系统分析微绿球藻光固碳与油脂积累的分子机制,结果也发现光照强度和缺氮调控对微藻的糖类、糖脂、中性脂、磷脂合成有密切关系。Li[12]、Jia[13]等的结果表明,在适合的光照强度范围,微藻机体光合作用代谢与细胞膜上蛋白质、单糖和生物膜磷脂的合成处于相对稳定状态,这可提高微藻的CO2固定速率,为微藻的生长繁殖提供充足的碳源。因此,选择1 940~2 060 lx作为培养微绿球藻的最适光照强度。
2.2 硝酸钾质量浓度对微绿球藻生物量和油脂含量的影响
硝酸钾是MAV培养基中含量最高的营养料,其中氮元素是构成微藻细胞蛋白质、叶绿素的重要元素。适量的初始硝酸钾质量浓度有利于微藻的生长和油脂的合成。低光照强度 (1 940~2 060 lx) 下考察硝酸钾质量浓度对微绿球藻生物量和油脂含量的影响,结果见图2。
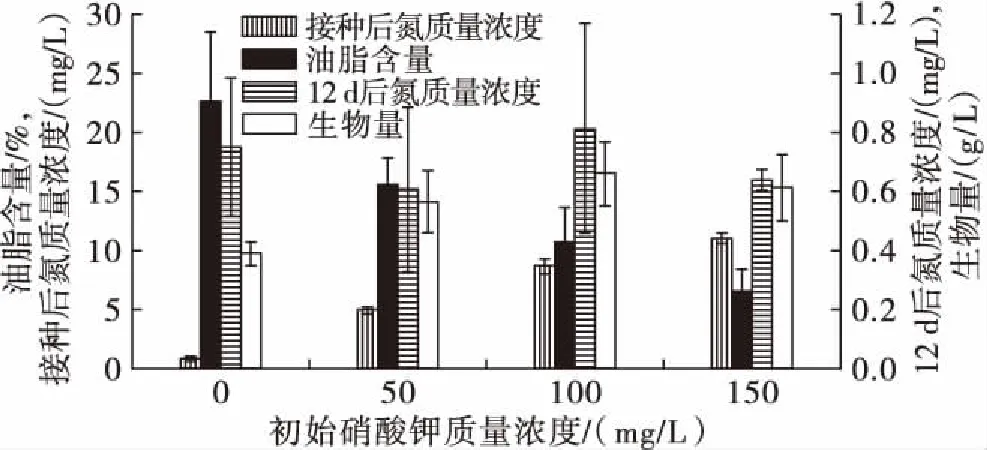
图2 不同硝酸钾质量浓度对微绿球藻生物量和油脂含量的影响
由图2可知,培养结束后,培养液中氮质量浓度都很低(lt;1 mg/L)。在不添加硝酸钾时,微绿球藻的生物量最低(0.39 g/L),但油脂含量最高(22.62%);随着硝酸钾质量浓度的增加(0~100 mg/L),微绿球藻的生物量也逐渐增加(0.39~0.66 g/L);但微绿球藻细胞的油脂含量呈下降趋势(22.62%~10.72%)。这与之前关于栅藻的研究结果是一致的,在氮充足条件下,有利于微藻的生长;在缺氮条件下,促进微藻油脂的大量合成[14-15]。Guschina等[14]指出培养基中氮元素含量会影响真核微藻光合作用中的PSⅡ表观吸收元件,包括光合代谢的酶(如ADPase)和色素的合成。Dean等[15]也证实了Guschina等[14]的观点。但过高的硝酸钾质量浓度(150 mg/L)不利微藻的生长和代谢活动。这说明了微绿球藻生长和代谢活动对培养基中硝酸钾质量浓度有一定的选择性。因此,在氮充足条件(100 mg/L)下,有利于微藻的生长和糖类(如淀粉)的合成;在缺氮条件下,微藻机体的碳流量发生改变,即合成蛋白质和/或糖类的碳流量向合成油脂转移,最终提高油脂含量。
为了获得较高的生物量和油脂含量,寻找微藻生长与油脂合成的最佳调控点,两步培养法可以克服图2中微藻生长和油脂合成的问题。因此,在缺氮条件下,有必要进一步探索微绿球藻的油脂合成调控条件。
2.3 缺氮条件下光照强度对微绿球藻生物量和油脂含量的影响
关于栅藻等其他藻种的研究表明,在缺氮条件下,高光照强度有利于微藻细胞的生长和油脂的合成。因此,在MAV(-N)培养基中,选择4个光照强度培养12 d,测定其生物量及油脂含量,结果见图3。

图3 缺氮条件下光照强度对微绿球藻生物量和油脂含量的影响
由图3可知,在7 000~7 500 lx光照强度下,微绿球藻的油脂含量(13.94%)最高,生物量(0.33 g/L)高于6 000 lx以下组和8 000~8 500 lx组,但低于硝酸钾质量浓度为100 mg/L MAV(+N)培养基的生物量(0.66 g/L)。这进一步证实了氮充足和缺氮条件下,微藻的代谢活动,尤其是生长繁殖代谢影响较大。此外,在缺氮条件下,光照强度会影响微藻的生长和油脂合成。这可能是因为在缺氮下过高或过低的光照强度影响微藻的光合作用,导致固碳率降低和机体碳流量方向的转移,影响微藻的生长和油脂合成[12-15]。为了降低能耗,选择7 000~7 500 lx为微绿球藻在缺氮条件下的最适光照强度。
2.4 不同培养方法促进微绿球藻合成油脂
通过不同培养方法,即高氮培养(硝酸钾质量浓度为100 mg/L,光照强度为1 940~2 060 lx)、两步培养法和两步缺氮培养法,研究微绿球藻的生物量、油脂含量和油脂产量的变化,结果见图4。
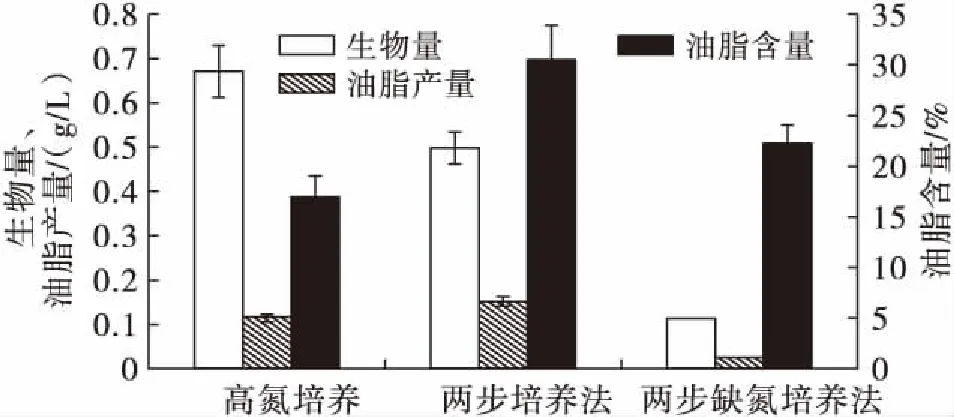
图4 不同培养方法对微绿球藻生物量、油脂含量和油脂产量的影响
由图4可知,在1 940~2 060 lx光照强度下,采用MAV(+N)培养基培养12 d后,微绿球藻的生物量(0.67 g/L)比两步培养法的生物量(0.50 g/L)高。但在高氮培养下的微绿球藻的油脂含量(16.92%)和油脂产量(0.11 g/L)显著低于两步培养法的油脂含量(30.50%)和油脂产量(0.15 g/L)。在缺氮培养条件下,培养基中营养元素的不均衡,导致微藻的生长繁殖活动受到影响,最终导致微绿球藻的生物量下降。但两步培养法有利于微藻油脂的合成,其油脂含量为30.50%,约是MAV(+N)培养基培养下的油脂含量的1.8倍。其他研究[13-14]也得出类似的结果,这说明两步培养法有利于微藻保持较高的生物量、油脂含量和油脂产量。
但值得注意的是两步缺氮培养法培养的微绿球藻的生物量、油脂含量和油脂产量都显著降低,分别为0.11 g/L、22.31%和0.03 g/L。同时,两步缺氮培养法的藻粉呈浅黄色。结果表明,长期处于缺氮条件的微绿球藻细胞已经极大地影响机体的正常代谢活动。这与本实验室利用栅藻为藻种所报道的结果不一致[9],主要原因可能是两者缺氮的控制方法不同。在栅藻两步缺氮培养法中,将培养至对数期的栅藻以20%接种量接种于完全缺氮培养基中,此时培养基中的硝酸钾质量浓度为0.30 g/L,而将对数期的栅藻培养至稳定期所需要的硝酸钾质量浓度也为0.30 g/L,因此在第一步缺氮培养过程中,先消耗培养基中剩余的氮源,从而将对数期的栅藻培养至稳定期以增加其生物量,这为第二步完全的缺氮培养提供了生物量的保证[9]。而本实验中,将培养至对数期的微绿球藻以20%的接种量接种于培养基中,此时并没有刻意去控制培养基中的硝酸钾质量浓度正好满足藻生长需求,有可能此时培养基中的硝酸钾质量浓度不足以提供将微绿球藻培养至稳定期,从而不利于第二步缺氮培养中生物量和油脂的积累。
3 结 论
在硝酸钾质量浓度为100 mg/L、光照强度为1 940~2 060 lx时,培养12 d,微绿球藻的生物量和油脂含量都最高,分别为0.68 g/L和16.28%。硝酸钾质量浓度显著影响微绿球藻的生长和油脂积累。低光照强度(1 940~2 060 lx)下,在不添加硝酸钾时,微绿球藻的生物量最低(0.39 g/L),但油脂含量最高(22.62%);随着硝酸钾质量浓度的增加,微绿球藻的生物量逐渐增加,最高可达0.66 g/L;而微绿球藻细胞的油脂含量呈下降趋势。在缺氮条件下,光照强度会影响微绿球藻的生长和油脂合成。通过两步培养法,可以促进微绿球藻的油脂合成,油脂含量比高氮培养提高了0.8倍,油脂产量提高了36.36%。因此,为克服微绿球藻培养过程中生物量与油脂含量的矛盾关系,可通过两步培养法实现微绿球藻的生物量和油脂含量最大化。
[1] 陆向红,贾俊乾,张秋红,等. 响应面法优化眼点拟微绿球藻酶法提油工艺研究[J]. 中国油脂,2015,40(9):13-17.
[2] 孟迎迎,陆洪斌,刘娇,等. 石墨化碳对微藻油脂及微藻生物柴油的脱色研究[J]. 中国油脂,2016,41(10):53-57.
[3] 窦晓, 陆向红,卢美贞,等. N/P比及氮盐浓度对眼点拟微绿球藻培养密度和油脂含量的影响[J].太阳能学报, 2014, 35 (8):1536-1540.
[4] 杜晓凤, 邹宁,孙东红,等.微绿球藻富集油脂的培养条件优化[J].中国油脂,2012,37(12): 66-69.
[5] 姜进举, 苗凤萍,冯大伟,等.微藻生物柴油技术的研究现状及展望[J].中国生物工程杂志, 2010, 30 (2): 134-137.
[6] 黄冠华,陈峰,魏东.两步培养法提高蛋白核小球藻的油脂含量[J].华南理工大学学报(自然科学版), 2008, 36 (12):97-101.
[7] MUJTABA G, CHO W, LEE C G,et al.Lipid production byChlorellavulgarisafter a shift from nutrient-rich to nitrogen starvation conditions[J]. Bioresour Technol, 2012,123:279-283.
[8] 李小妹, 廖兴辉,王明兹,等.两步培养法提高栅藻的生物量及油脂含量[J].中国油脂, 2014,39(5): 53-56.
[9] LI X M, WANG M Z, LIAO X H,et al. Two stages of N-deficient cultivation enhance the lipid content of microalgaScenedesmussp.[J]. J Am Oil Chem Soc, 2015,92(4):503-512.
[10] BLIGH E G, DYER W J. A rapid method of total lipid extraction and purification[J]. Can J Biochem Physiol, 1959,37(8):911-917.
[11] BESCHKOV V, VELIZAROV S, AGATHOS S N,et al. Bacterial denitrification of waste water stimulated by constant electric field[J]. Biochem Eng J, 2004, 17 (2):141-145.
[12] LI Y T, HAN D X, SOMMERFELD M,et al. Photosynthetic carbon partitioning and lipid production in the oleaginous microalgaPseudochlorococcumsp. (Chlorophyceae) under nitrogen-limited conditions[J]. Bioresour Technol, 2011,102 (1):123-129.
[13] JIA J, HAN D X,GERKEN G G,et al. Molecular mechanisms for photosynthetic carbon partitioning into storage neutral lipids inNannochloropsisoceanicaunder nitrogen-depletion conditions[J]. Algal Res, 2015,7:66-77.
[14] GUSCHINA L A, HARWOOD J L. Lipids and lipid metabolism in eukaryotic algae[J]. Progr Lipid Res, 2006, 45(2):160-186.
[15] DEAN A P, SIGEE D C, ESTRADA B,et al. Using FTIR spectroscopy for rapid determination of lipid accumulation in response to nitrogen limitation in freshwater microalgae[J]. Bioresour Technol, 2010, 101 (12):4499-4507.
ImprovementofbiomassandoilcontentofNannochlorisoculata
GUO Xiaoye1, QIU Changyang1, HE Yongjin1, CHEN Han1,WANG Mingzi1,2, CHEN Bilian1,2
(1.College of Life Sciences, Fujian Normal University, Fuzhou 350117, China; 2.Engineering Research Center of Industrial Microbiology of Ministry of Education, Fujian Normal University, Fuzhou 350117, China)
The effects of light intensity and mass concentration of potassium nitrate on the biomass and oil content ofNannochlorisoculatawere investigated, and the microalgae was cultivated by two-stage cultivation method to enhance the biomass and oil content. The results showed thatNannochlorisoculataachieved the highest biomass of 0.68 g/L and oil content of 16.28% in the light intensity of 1 940-2 060 lx and mass concentration of potassium nitrate 100 mg/L for 12 d of cultivation. The lowest biomass and highest oil content ofNannochlorisoculatain the nitrogen-deficient medium were 0.39 g/L and 22.62%, respectively at low light intensity (1 940-2 060 lx). An increase in the mass concentration of potassium nitrate resulted in an increase in the biomass and a decrease in the oil content ofNannochlorisoculata. Two-step cultivation method promoted the oil synthesis ofNannochlorisoculata, and the oil content and oil yield were 30.50% and 0.15 g/L, respectively.
Nannochlorisoculata; two-step cultivation; oil; biomass
2017-02-19;
2017-08-09
福建省科技厅农业引导性项目(2015N0007);福州市科技局市校科技合作项目(2016-G-73);福建省大学生创新创业训练计划项目
郭晓烨(1994),女,在读本科,专业为生物工程(E-mail)gxy015@163.com。
陈必链,教授(E-mail)chenbil@fjnu.edu.cn。
生物工程
TQ645;S968.4
A
1003-7969(2017)10-0121-05
