农业用硝酸钾危险类别浅析
2014-10-17张罡
张罡
(岳阳市钾盐科学研究所,湖南岳阳 414000)
硝酸钾(KNO3)是一种重要的无机化工原料,分子量为101.1,自然界中单体存在的形式少见,常与钠硝石、泻利盐、钙硝石和石膏共生。硝酸钾为白色粉末或无色透明的斜方、菱形结晶。它有两种晶型,在25℃时生成无水硝酸钾的斜方形结晶,高于127.7℃时转变为菱面体结晶。硝酸钾相对密度为2.109,熔点为334℃,易溶于水、液氨和甘油。不溶于无水乙醇和乙醚,25℃时在无水甲醇中的溶解度为0.34%。25℃时,硝酸钾溶解热焓(水中无限稀释)为 34.9 kJ/mol,比热容为 96.36 J/(mol·K),生成热焓为-492.8 kJ/mol,熔化热焓为10 kJ/mol。硝酸钾在空气中不易潮解,仅微吸湿,不易结块,在水中不形成水合物,冰盐点为-2.85℃,含硝酸钾9.66%(质量分数)。在101.33 kPa下,77.0%(质量分数)硝酸钾饱和溶液沸点为 115.6 ℃[1-3]。
中国硝酸钾生产的历史悠久。20世纪90年代以前,中国只有单一的工业硝酸钾生产,产品主要用于烟花爆竹、黑色火药、导火索、医药、化学反应催化剂、氧化剂、玻璃澄清剂、陶瓷彩釉剂、选矿剂、金属热处理剂等。由于硝酸钾属于氧化剂,国际上认定硝酸钾为危险品5.1范畴。目前,工业硝酸钾执行国家标准GB 1918—2011《工业硝酸钾》。
从1999年开始,中国开始生产农业用硝酸钾,通常用硝酸、硝酸铵、硝酸钠等硝酸盐与氯化钾转化法制取,主要用作氮钾复合肥,执行国家标准GB/T 20784—2006《农业用硝酸钾 {新定价}》。
自从农业用硝酸钾出现以来,由于对其危险类别没有明确认定,因此就农业用硝酸钾是否属于危险品曾引发过争论。笔者依据超过20 a硝酸钾生产实践经验,就农业用硝酸钾的危险类别做了探讨。
1 农业用硝酸钾与工业硝酸钾的区别[4-6]
表1为GB 1918—2011中对工业硝酸钾的指标要求。表2为GB/T 20784—2006对农业用硝酸钾产品的指标要求。由表1、表2数据对比可以明显看出,农业用硝酸钾与工业硝酸钾是不同的2个产品。工业硝酸钾纯度为99.0%~99.7%,接近纯化学概念硝酸钾,具有纯硝酸钾的理化性质。由于硝酸钾为氧化剂,所以纯化学概念的硝酸钾与工业硝酸钾均列入GB 12268—2005《危险货物品名表》。
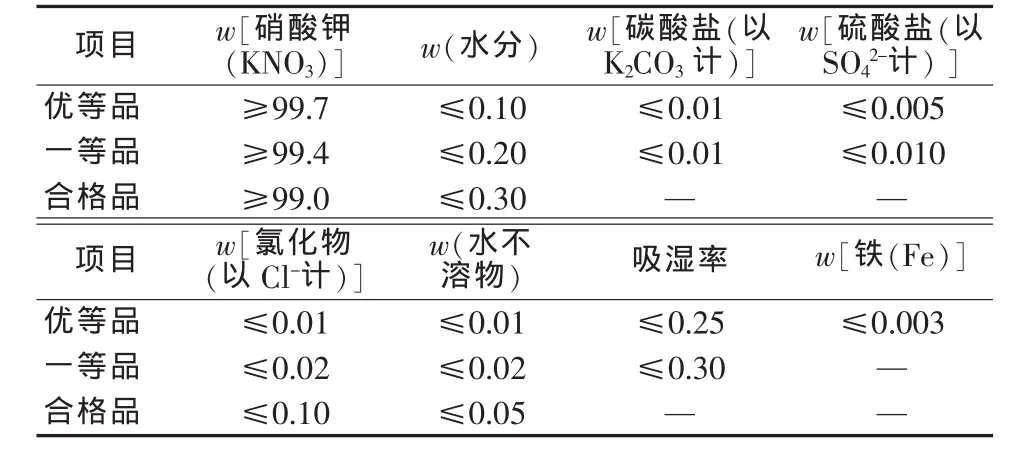
表1 GB 1918—2011中工业硝酸钾的指标要求 %

表2 GB/T 20784—2006对农业用硝酸钾产品的要求 %
农业用硝酸钾与工业硝酸钾不同,它实际上含有钙、镁、硫酸盐、氯化物及水分等杂质,总含量达6%(质量分数)甚至更高,农业用硝酸钾的组成十分复杂,它不是以单体硝酸钾形式存在,而是以多种复盐、固溶体形式存在。目前,中国农业用硝酸钾基本采用硝酸铵与氯化钾转化法制得,其产品中就存在硝酸铵钾与氯化铵钾、硫酸钾镁、氯化钾镁等复盐,因此和工业硝酸钾及化学概念上的硝酸钾在成分方面以及理化性质上存在明显差异。
2 农业用硝酸钾的特性
2.1 无可燃性[1,7-8]
纯硝酸钾本身是不燃物质,其熔点为334℃,熔融的纯硝酸钾在530℃左右还是稳定的,在650~750℃时分解生成雾状亚硝酸钾和氧气,在750℃以上反应生成的亚硝酸钾进一步分解成氮氧化物。通常情况下工业硝酸钾在400℃左右时分解放出氧,并转变成亚硝酸钾,继续加热则生成氧化钾。目前,国内外尚未见硝酸钾燃烧或火灾事故的报道,可以推定纯硝酸钾本身没有爆炸危险性。
笔者于2013年6月曾让一家农用硝酸钾生产企业送样给青岛东标检测服务有限公司,委托其对农用硝酸钾进行可燃性 (燃点)检验,检验方法为ASTMD92-2010用克利福兰得开杯法测定闪点和起火点的实验方法。检验结果表明,农用硝酸钾在燃点大于1000℃时仍不能燃烧。
此外,山西文通钾盐集团等多家生产企业采用溶熔造粒法对农用硝酸钾进行造粒,造粒过程中需要将农用硝酸钾加热到300℃以上,使其变成熔融状态。在此过程中农用硝酸钾依然非常稳定,不会燃烧与爆炸。
通过实验和工业实例证明,农业用硝酸钾属于不燃物质,没有可燃危险性。
2.2 无反应爆炸危险性[1,7-8]
纯硝酸钾在高温下非常稳定,虽然在650~750℃和750℃以上会发生分解反应,但不会发生链式爆炸反应:

但单体硝酸钾作为氧化剂,它与有机物(如葡萄糖)接触能发生反应:

硝酸钾与碳粉及硫黄共热时,能发出强光和燃烧:

可见,单体硝酸钾与其他还原剂物质能发生燃烧爆炸反应。
农业用硝酸钾是多组分复盐与固溶体,它与其他还原剂物质也能发生化学反应,但不会发生爆炸。爆炸是一个非常快速的链式反应,农业用硝酸钾不会发生爆炸的主要原因:1)农业用硝酸钾中大量钙镁水分等杂质本身没有爆炸性,属于惰性物质,它们阻止或延缓链式反应的快速进行,从而达到阻爆的效果;2)农业用硝酸钾基本为颗粒状,由晶体组成,结构致密,孔隙不发育,颗粒结构致密程度的增加,使得反应产生的气体的扩散混合受到根本限制,减缓了临近农业硝酸钾的化学反应速度,从而抑制了爆炸的进行。因此,不能采用农业用硝酸钾制造炸药、烟花鞭炮等。
目前,关于硝酸钾不能被撞击的观点是错误的,既使是工业硝酸钾也完全可以撞击,其生产过程中就必须经过粉碎工序,中国许多厂家仍然使用粉碎机将硝酸钾粉碎,还有一些农业硝酸钾企业也会使用挤压造粒机对农业硝酸钾造粒。农业用硝酸钾不会因撞击爆炸,其主要原因:1)硝酸钾通常情况下要在400℃以上的高温条件下才开始发生分解反应,既使硝酸钾在高速强力撞击作用下经受强烈压缩,该过程在时间上极其短促,因而可认为来不及进行热量交换,即为绝热压缩过程。晶体间气体受绝热压缩,迅速达到很高温度,形成热核,而热核温度很难达到硝酸钾分解反应所需反应温度;2)硝酸钾由晶体组成,结构致密,孔隙不发育,颗粒结构致密程度的增加,使得其对摩擦撞击作用引起的相对位移变小,在压力的作用下,位移速度差变小,局部温度上升变慢,降低了形成灼热核的可能性。因此,撞击不会使农业硝酸钾发生爆炸。
由此可知,农业用硝酸钾具有安全稳定的性能,它既不可能发生反应爆炸,也不会因撞击爆炸。既使碳粉或硫黄混入农业用硝酸钾后共热,其反应也十分缓慢,不会引起爆炸。虽然农业用硝酸钾作为一种改性硝酸钾,是一种高效氮钾复合肥,但它不能代替工业硝酸钾使用。
2.3 对人体与环境的影响[7-9]
农业用硝酸钾所含化学成分虽然十分复杂,但其所含硝酸钾、及钙、镁、硫酸盐、氯化物及水分等杂质都没有毒性。农业用硝酸钾对呼吸道、眼及皮肤有刺激性。人体吸入高浓度硝酸钾粉尘可能引起肺水肿,大量吸入可引起高铁血红蛋白血症,影响血液携氧能力,出现头痛、头晕、紫绀、恶心、呕吐。皮肤反复接触硝酸钾会引起皮肤干燥、皲裂和皮疹。农业用硝酸钾及其他硝酸钾生产中,接触粉尘硝酸钾的工人只要佩戴防尘面具、手套,可有效避免硝酸钾对人体的不良影响。
农业用硝酸钾对环境的影响也微乎其微。它的养分全部为水溶性,植物容易吸收,不会在土壤中形成盐类积累,导致土壤盐渍板结,或因盐类在作物根部积聚而引起作物病变,是理想的绿色化肥。
此外,硝酸钾在医药工业中用于生产青霉素钾盐、利福平等药物;在食品工业可用作发色剂、防腐剂。这些都说明硝酸钾是无腐蚀性与毒性的,对人体与环境没有危险性。
3 正确认识农业用硝酸钾安全性能
由于国内外硝酸铵爆炸事故时有发生,受其影响,硝酸钾在一些人的印象中都和易燃易爆挂钩,实际上硝酸钾本身没有易燃易爆的危险性,国内外也从末发生过硝酸钾燃烧爆炸事故。因此,应实事求是正视硝酸钾的安全性和应用价值。
中国将农用硝酸钾登记列为化肥新品种,迄今为止尚未见到关于农用硝酸钾燃烧爆炸事故的报道,从实践应用的角度也证明了农用硝酸钾的安全可靠性能。
中国目前有部分农用硝酸钾企业执行的是非危险品政策,特别是运输方面,铁路公路大都采用化肥优惠运价,而没有像工业硝酸钾那样在生产储运过程中执行甲类危险品的标准。事实上,囯外特别是欧洲对其运输和仓储政策较为宽松,比如轮船运载硝酸钾可以与货物混装。但也有一些地区政府部门仍然将农用硝酸钾列入甲类危险品的标准,农用硝酸钾在运输中受到的种种限制和苛刻条件,导致其成本大大提高,如运费比普通化肥高1倍以上,令农民负担加重。这不仅是对农用硝酸钾危险性的错误认识,而且与中国的惠农政策背道而驰。
农用硝酸钾是一种高效氮钾复合肥,被称为第三代钾肥,发展农用硝酸钾对发展中国高效农业具有重要意义。对农用硝酸钾生产发展应制定宽松的政策,当务之际,有关部门应从实际出发,将农用硝酸钾进行正确的危险类别分类。
4 结束语
按照GB 6944—2005《危险货物分类和品名编号》对危险货物的定义:指具有爆炸、易燃、毒害、感染、腐蚀、放射性等危险特性,在运输、储存、生产、经营、使用和处置中,容易造成人身伤亡、财产损毁或环境污染而需要特别防护的物质和物品。农业硝酸钾是多组分复盐与固溶体,它和工业硝酸钾组成成分完全不同,农业用硝酸钾理化性质与工业硝酸钾也有较大区别。检测和实践表明,农业用硝酸钾无毒无腐蚀性,没有可燃危险性,没有反应爆炸危险性,国内外也从未发生过农业用硝酸钾燃烧爆炸事故。因此,应正确认识农业用硝酸钾的安全性能和潜在价值,将农业用硝酸钾定性为非危险品,以充分发挥其应有的价值。
[1]张罡,夏重阳,何斌鸿,等.我国硝酸钾市场竞争力分析[J].化学工业,2007,25(9):16-18.
[2]张罡.我国农用硝酸钾市场前景与发展对策[J].化肥设计2002,40(5):48-50.
[3]史建斌,于湖.浅谈硝酸钾的结晶[J].无机盐工业,2000,32(3):26-27.
[4]刘荣海,陈网桦,胡毅亭.安全原理与危险化学品测评技术[M].北京:化学工业出版社,2004.
[5]中国农业科学院土壤肥料研究所.中国肥料[M].上海:科学技术出版社,1994:219.
