丹皮酚在肝癌前病变模型大鼠体内的组织分布研究△
2017-12-11宋艺君杨史军王湘张东星李京涛蔡大勇王玥琦
宋艺君,杨史军,王湘,张东星,李京涛,蔡大勇,王玥琦
(1.陕西中医药大学,陕西 咸阳 712046;2.北京中医药大学,北京 100029;3.中国医学科学院 药用植物研究所,北京 100193)
丹皮酚在肝癌前病变模型大鼠体内的组织分布研究△
宋艺君1*,杨史军3,王湘2,张东星2,李京涛1,蔡大勇3,王玥琦2
(1.陕西中医药大学,陕西 咸阳 712046;2.北京中医药大学,北京 100029;3.中国医学科学院 药用植物研究所,北京 100193)
目的建立用超高效液相色谱(UPLC)测定肝癌前病变模型大鼠组织中丹皮酚的分析方法,研究丹皮酚在大鼠体内的组织分布特征。方法采用UPLC测定大鼠组织中丹皮酚的浓度。结果丹皮酚在对照组大鼠各组织中的分布顺序依次为肾>胃>小肠>脑>肝>脾>心>肺,在模型组大鼠各组织中的分布顺序依次为肝>肾>脾>肠>胃>心>脑>肺,且其在模型组各组织的AUCall均大于在对照组各组织的AUCall。结论相对于对照组,丹皮酚在模型动物组织内含量增高。
丹皮酚;肝癌前病变;组织分布
丹皮酚是毛茛科植物牡丹的根皮、萝摩科植物徐长卿的干燥根和根茎的主要有效成分[1],又是毛莨科植物芍药的根的有效成分。研究表明丹皮酚具有抗肿瘤、抗菌、增强免疫力、降压、促进微循环等药理作用[2]。
肝癌前病变是指在慢性肝病中出现的肝细胞不典型增生、腺瘤样增生、肝细胞再生结节、肝细胞小管状化生和卵圆细胞增生,其发展为肝癌的几率高,尤其是肝硬化病灶中出现的异型增生病灶或结节、异型增生的细胞[3]。肝癌前病变是肝细胞癌变进展中启动、促进和演变过程的中间阶段,它是阻断癌变的理想靶点。因而阻止或延缓肝癌前病变的发生发展,对于预防肝脏癌症的发生,具有重要的现实意义。
本文在前期实验的基础上[4],建立肝癌前病变大鼠模型,研究丹皮酚在肝癌前病变模型大鼠体内的组织分布规律,进一步探索丹皮酚在模型大鼠体内的靶器官、主要消除途径等,为其临床用药提供指导。
1 材料与仪器
1.1动物
SPF级雄性Wistar大鼠,体质量(220±20)g,购于北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2008-0013。
1.2 药物与试剂
丹皮酚原料药(广西亿康药业股份有限公司,批号:101021);丹皮酚对照品(中国食品药品检定研究院,批号:0708-9704);二-乙基亚硝胺(DEN)(Sigma公司,批号:1000928405);甲醇(色谱级,美国Fisher Scientific公司);水为娃哈哈纯净水;其余试剂均为分析纯。
1.3 主要仪器
Acquity超高效液相色谱仪、PDA 检测器(美国Waters公司);AL104-IC电子分析天平(上海梅特勒-托利多仪器有限公司);QL901涡旋混合器(海门市麒麟医用仪器厂);H-1850R台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
2 方法
2.1 分组与造模
SPF级雄性Wistar大鼠70只,按照体重均衡随机分为2组,对照组(d000)和模型组(d112)。适应性饲养1周后,模型组腹腔注射DEN 50 mg·kg-1复制模型,每周2次,连续16周,对照组给予等体积0.9%氯化钠溶液。
2.2 丹皮酚混悬液制备
取一定量丹皮酚,加入0.5% CMCNa溶液,超声使其溶解得到38.88 mg·mL-1的丹皮酚混悬液。
2.3 给药与取样
大鼠于造模16周时,禁食不禁水12 h后,按照194.4 mg·kg-1(前期试验筛选的剂量)的剂量灌胃丹皮酚混悬液,于给药后0.5、2、10、20、45、90、120 min将大鼠立即解剖并采集肝、心、脾、肺、肾、脑、胃、小肠组织,用0.9%氯化钠溶液洗去表面浮血,滤纸吸干水分后,各组织精密称重。将各组织加入2倍量0.9%氯化钠溶液,用电动匀浆机制备匀浆,-20 ℃冷冻保存,备用。
2.4 肝脏组织大体形态观察
在16周末对所有大鼠取材,做肝脏大体标本肉眼观察,并拍照存档。
2.5 组织分布研究
2.5.1 色谱条件 Waters Acquity C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相:甲醇-水(70∶30);流速:0.3 mL·min-1;检测波长:274 nm;柱温:25 ℃;进样量:2.1 μL。
2.5.2 对照品溶液制备 精密称取丹皮酚对照品12.37 mg于2 mL的容量瓶中,用流动相制成6.185 mg·mL-1的丹皮酚储备液,4 ℃冰箱保存备用。
2.5.3 样品预处理 精密吸取25 μL组织匀浆,置于EP管内,先加入稀盐酸2 μL,涡旋10 s,再加入3倍体积量的乙酸乙酯萃取,涡旋30 s,并12 000 r·min-1离心8 min,取上清液置于另外一个EP管,同法再萃取1次,合并2次上清液自然挥干,残渣用流动相70 μL溶解,涡旋30 s,12 000 r·min-1离心8 min,取上液清55 μL置于EP管,-4 ℃冰箱放置30 min,12 000 r·min-1离心8 min,再取上清液40 μL置于进样瓶中,UPLC自动进样。
2.6 方法学验证
2.6.1 专属性试验 大鼠各空白组织和灌胃丹皮酚后的各组织样品,按2.5.3项下方法处理,分别进样分析得到色谱图,直接进样丹皮酚对照品溶液得到色谱图,通过3种色谱图比较丹皮酚峰位置是否存在干扰。
2.6.2 标准曲线制备 在空白组织匀浆中加入适量丹皮酚对照品溶液,分别制成质量浓度为412.33、103.08、25.77、6.44、1.61、0.40、0.10、0.025 mg·L-1的含丹皮酚组织样品,按2.5.3项下方法处理,进样分析(各个组织处理相同)。以丹皮酚峰面积Y对丹皮酚质量浓度X(mg·L-1)进行线性回归,建立回归方程。
2.6.3 精密度试验 按照标准曲线项下操作,分别制备质量浓度为103.08、6.44、0.40 mg·L-1的含丹皮酚组织样品,按2.5.3项下方法平行操作,进样分析。每个质量浓度于日内平行测定5份样品,考察日内精密度;每个质量浓度每日各平行测定5份样品,连续5天,考察日间精密度。
2.6.4 绝对回收率试验 取空白组织匀浆3份,每份30 μL(各个组织处理相同),分别加入3个质量浓度的丹皮酚对照品溶液10 μL,配置成含丹皮酚103.08、6.44、0.40 mg·L-1的含药组织样品,按2.5.3项下方法处理,进样分析记录色谱峰面积,每个浓度平行操作5份。根据上述标准曲线计算丹皮酚质量浓度,并以丹皮酚测得量与加入量之比计算绝对回收率。
2.6.5 相对回收率试验 取空白组织匀浆3份,每份30 μL(各个组织处理相同),分别加入3个质量浓度的丹皮酚对照品溶液10 μL,配置成含丹皮酚103.08、6.44、0.40 mg·L-1的含药组织样品,按2.5.3项下方法处理,得到丹皮酚色谱峰面积A1;用水代替空白组织样品,按照上述方法操作,进样测定,得到丹皮酚色谱峰面积A2,每个质量浓度平行操作5份。按公式(1)计算相对回收率。
相对回收率(%)=A1/A2×100%
(1)
2.6.6 稳定性试验 按照标准曲线项下操作,分别制备丹皮酚质量浓度为103.08、6.44、0.40 mg·L-1的标准空白组织样品各5份,按2.5.3项下方法处理,室温保存,于0、2、4、8、10 h分别进样分析,记录丹皮酚峰面积,计算丹皮酚质量浓度。
2.7 统计学方法
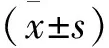
3 结果
3.1 肝脏组织大体形态观察
对照组:大鼠肝脏大小正常,质地光滑柔软,颜色淡红,切面鲜红,无显著病变;模型组:大鼠肝脏明显肿大,表面逐渐粗糙,质地变硬,边缘变钝,颜色变浅,包膜变厚,出现数量不等,大小不一的黄褐色细颗粒状结节,切面明显见黄色脂肪变,部分肝小叶有明显的胆汁淤积,个别肝小叶与腹腔其他脏器粘连。见图1。
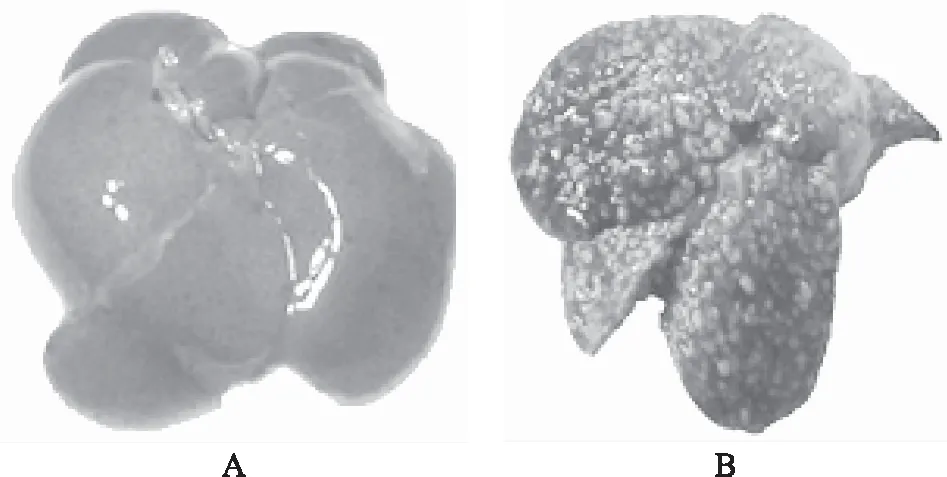
注:A.对照组;B.模型组。图1 各组肝脏大体标本肉眼观察图
3.2 分析方法验证
3.2.1 专属性 在上述色谱条件下,丹皮酚的保留时间约为1.23 min,理论塔板数大于4000。结果表明,空白组织的内源性物质不干扰丹皮酚的测定,见图2。
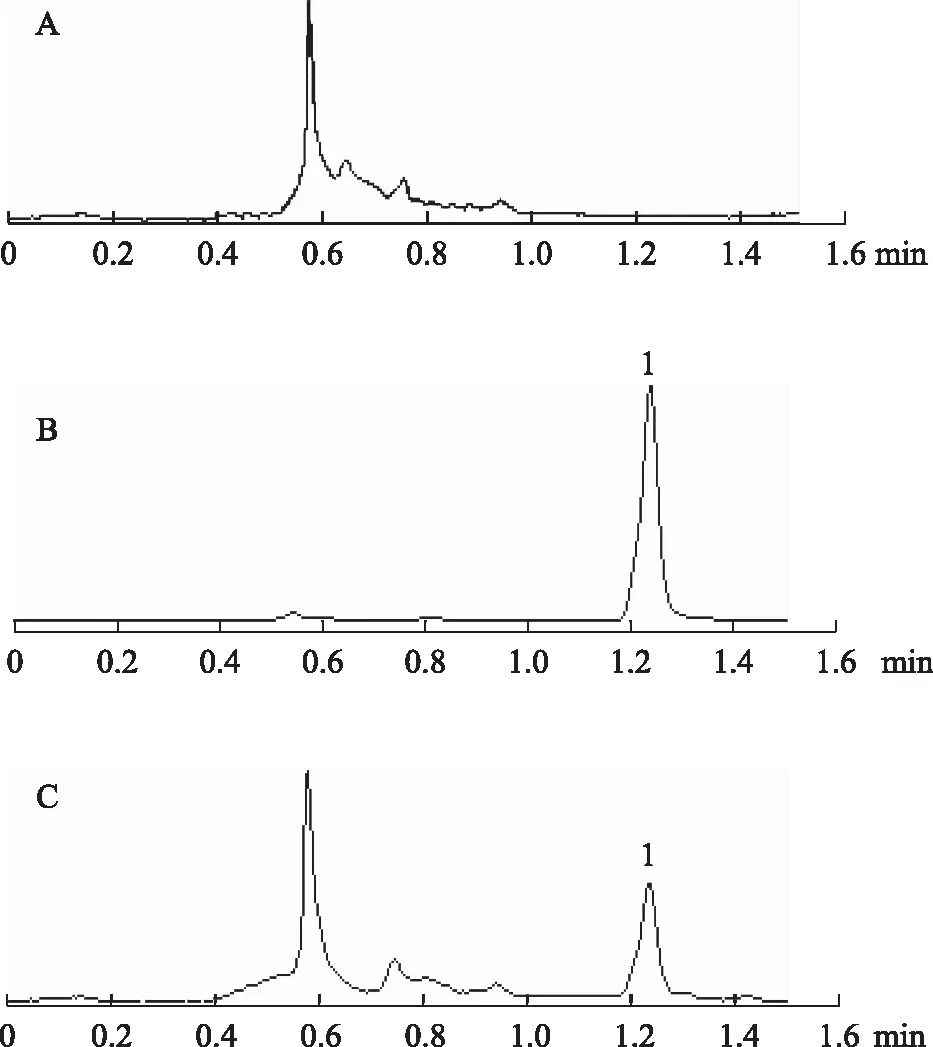
注:A.空白组织样品;B.丹皮酚对照品;C.给药后组织样品;1.丹皮酚。图2 丹皮酚UPLC图
3.2.2 标准曲线 以丹皮酚峰面积Y对丹皮酚质量浓度X(mg·L-1)进行线性回归,丹皮酚在0.025~412.33 mg·L-1线性关系良好,回归方程见表1。
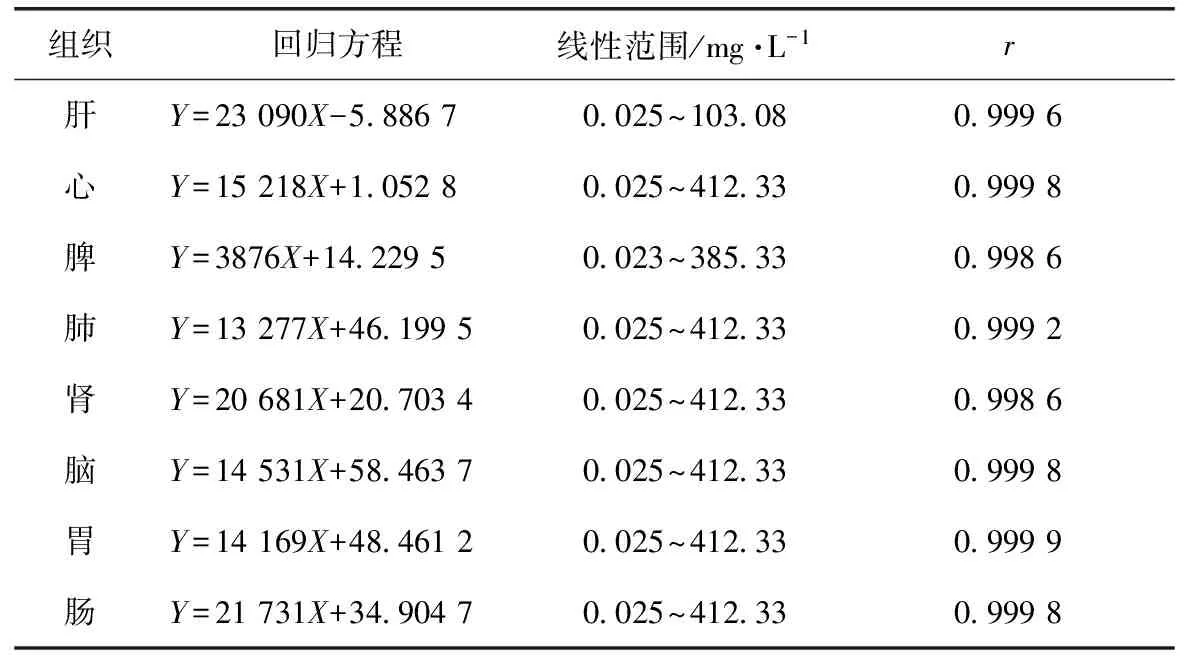
表1 丹皮酚在大鼠各组织的回归方程及线性范围(n=5)
3.2.3 精密度 结果表明丹皮酚各个含药组织高、中、低质量浓度日内精密度,日间精密度RSD均小于10%,符合试验要求。
3.2.4 回收率 丹皮酚各个含药组织低、中、高质量浓度的回收率结果见表2。结果显示,丹皮酚各组织3种质量浓度下的平均回收率在82%~98%,RSD≤8%,符合试验要求。
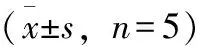
表2 各组织中丹皮酚回收率试验结果
3.2.5 稳定性 结果表明丹皮酚经过处理后室温放置10 h均稳定,RSD均小于10%。
3.3 组织样品中丹皮酚的质量浓度
按照2.5.3项下方法操作,UPLC测定大鼠各组织样品中丹皮酚的响应值,代入相应的回归方程计算各时间点组织样品中丹皮酚的质量浓度(μg·mL-1),丹皮酚在对照组和模型组的平均组织浓度-时间曲线见图3。
注:A.对照组;B.模型组。图3 丹皮酚在对照组和模型组各个组织的组织浓度-时间曲线
3.4 丹皮酚在各组大鼠体内的药动学参数
药动学数据用WinNonlin药动学软件处理,丹皮酚在大鼠体内的组织浓度-时间过程符合非房室模型,主要药动学参数见表3,结果显示:相对于对照组,模型组肝、心、脾、肺、肾、脑、胃、小肠的药时曲线下面积(AUC)均增加;相对于对照组,模型组肝、心、脾、肺、肾、脑、胃、小肠的最大浓度(Cmax)均增加;相对于对照组,模型组肝、心、脾、肾、小肠、脑、胃的清除率(CL)均减少,肺的CL增加;相对于对照组,模型组肝、心、脾、肺、肾、脑、小肠的表观分布容积(V)均减少,胃的V增加;相对于对照组,模型组肝、心、肾、胃的平均滞留时间(MRT)增加,脾、肺、脑、小肠的MRT降低。丹皮酚在对照组各个组织中的分布顺序依次为肾>胃>小肠>脑>肝>脾>心>肺,在模型组各个组织中的分布顺序依次为肝>肾>脾>小肠>胃>心>脑>肺。
表3 大鼠灌胃给予丹皮酚在大鼠组织的药动学参数
注:相同器官的d112与d000组比较,*P<0.05,**P<0.01。
4 讨论
通过大鼠肝脏的大体形态观察,对照组大鼠肝脏光滑柔软,颜色淡红,无病变。模型组大鼠肝脏颜色暗红,明显肿大,无光泽,可见增生结节形成。
目前国内外关于丹皮酚组织分布的研究较少,陈群等[5]利用GC-MS测定比较了丹皮酚单用和丹皮酚与冰片合用在脑中的浓度,结果丹皮酚单用时不易透过血脑屏障,在脑中的浓度较低,合用后,由于冰片能促进血脑屏障的开放,丹皮酚在脑中的浓度增加。丹皮酚单用时在脑中的达峰时间为10 min,与本实验存在一定的差异,其原因可能是实验动物之间的种族差异引起的。Li等[6]研究了丹皮酚灌胃给药后在大鼠体内的组织分布情况,结果显示,丹皮酚在体内可以快速分布和消除,肝和肾是主要的分布器官,可以透过血脑屏障。肝脏在2 min达到最大浓度,心、脾、肺、肾、脑均在20 min达到最大浓度,随后快速消除,丹皮酚在大鼠各个组织没有长时间的积累。李清侠等[7]研究了丹皮酚在小鼠体内的药动学和组织分布情况,结果显示小鼠一次性灌胃丹皮酚(65 mg·kg-1)后,体内药动学呈单室模型,其主要分布在肝,其次是脾、小肠上端、肾、结肠、心、肺。
本实验丹皮酚灌胃给药0.5 min后可在各组织中检测到,表明丹皮酚口服后迅速、广泛地分布于各组织器官,这可能与丹皮酚的高脂溶性有关。灌胃后胃肠道浓度偏高的情形可能是给药途径所致。
大鼠灌胃丹皮酚后,比较丹皮酚在各个组织中不同时间点的分布情况,丹皮酚在对照组各个组织中的AUC分布特征为肾>胃>小肠>脑>肝>脾>心>肺,在模型组各个组织中的AUC分布特征为肝>肾>脾>小肠>胃>心>脑>肺。丹皮酚在肝、肾中AUC较高,肝、肾为血流量丰富的组织,为丹皮酚对肝炎、肝癌[8-9]具有预防保护作用提供依据,说明丹皮酚组织分布情况与其药效密切相关;肾中AUC也高,追溯其原因可能也与丹皮酚主要以肾排泄[10]为主相关,Li等[6]在肾中发现丹皮酚的代谢产物,亦说明丹皮酚从肾脏排泄,和本文结果一致。丹皮酚进入体内后在肝、肾分布量较大,为进一步研究牡丹皮归肝、肾、心经的中医药学理论提供了部分实验依据。在大脑中AUC较低,Tmax大约40 min,反映了丹皮酚不易透过血脑屏障,这与文献报道的一致[11]。
文献查阅结果显示,中药在生物体不同的机能状态下,其药理作用和体内过程可能不同[12]。在本实验中,模型组各组织中丹皮酚含量高于对照组,可能是因为模型组大鼠有肝硬化,伴随肝脏各种代谢酶活性降低,因此对药物代谢能力降低,从而导致各组织中丹皮酚含量升高[13]。研究丹皮酚在病理情况下体内行为特征与在正常动物体内特征的差异,对其临床用药具有指导意义。
综上所述,本研究对丹皮酚在对照组和模型组大鼠进行了组织分布研究,实验结果表明,相对于对照组,丹皮酚在模型组具有更好的肝靶向组织分布作用。后续本研究将进一步深化,从分子通路层面探索丹皮酚预防肝癌的机制。
[1] 杨秀伟.中药成分的吸收分布、代谢、排泄、毒性与药效:上册[M].北京:中国医药科技出版社,2006.
[2] 吕成明,刘海燕.丹皮酚的药理作用研究进展[J].医药导报,2005,24(2):142-143.
[3] 谢晶日,任公平,李明,等.中医药防治肝癌前病变机制研究概况[J].中国医药导报,2008,5(8):25-26.
[4] 宋艺君,刘晓婷,冯丽莉,等.二乙基亚硝胺诱发肝癌前病变大鼠模型的建立[J].世界华人消化杂志,2012,20(27):2562-2569.
[5] 陈群,李士敏.冰片对丹皮酚药代动力学及透血脑屏障的影响[D].杭州:浙江大学,2005.
[6] Li H,Wang S W,Yang Q,et al.LC Tissue Distribution Study of Pae in Rats after Oral Administration[J].Chromatographia,2011,73:495-500.
[7] 李清侠,赵春阳,莫家钰,等.丹皮酚对小鼠体内药动学及组织分布情况的研究[J].海峡药学,2011,23(7):45-47.
[8] Hu S L,Shen G,Zhao W G,et al.Pae,the main active principles of Paeonia moutan,ameliorates alcoholic steatohepatitis in mice[J].Journal of Ethnopharmacology,2010,128:100-106.
[9] Sun G P,Wang H,Xu S P,et al.Anti-tumor effects of paeonol in a HepA-hepatoma bearing mouse model via induction of tumor cell apoptosis and stimμLation of IL-2 and TNF-α production[J].European Journal of Pharmacology,2008,584:246-252.
[10] T Yasuda,R Kon,T Nakazawa,et al.Metabolism of Pae in Rats[J].Nat Prod,1999,62:1142-1144.
[11] 陈群,李士敏.丹皮酚在小鼠血浆和脑组织中的分布研究[J].中国药房,2009,20(21):1620-1621.
[12] 徐晓玉.中药药理学[M].北京:中国中医药出版社,2010.
[13] 訾慧,李可强,郑洪新.补肾壮骨滴丸中淫羊藿苷在骨质疏松模型与正常大鼠体内组织分布比较[J].中华中医药学刊,2015,33(12):2856-2859.
TissueDistributionStudyofPaeonol(Pae)inHepaticPrecancerousLesionModelRats
SONGYijun1*,YANGShijun3,WANGXiang2,ZHANGDongxing2,LIJingtao1,CAIDayong3,WANGYueqi2
(1.ShaanxiUniversityofChineseMedicine,Xianyang712046,China;2.BeijingUniversityofChineseMedicine,Beijing100029,China;3.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,Beijing100193,China)
Objective:To establish an analytical method for determination of Pae in tissues of hepatic precancerous lesion model rats by UPLC,and study the tissue distribution of Pae in rats.MethodsThe concentration of Pae in rats tissues were determined by UPLC.ResultsIn control group,kidney had the highest tissue concentration of Pae,followed by stomach,small intestine,brain,liver,spleen,heart,lung;in model group,liver had the highest tissue concentration of Pae,followed by kidney,spleen,small intestine,stomach,heart,brain,lung.And its AUCallin model group was larger than that in control group.ConclusionCompared with the control group,the content of Pae in model group increased.
Paeonol;hepatic precancerous lesion;tissue distribution
国家自然科学基金项目(81603612);陕西中医药大学科研基金项目(2015PY12)
*
宋艺君,博士,讲师,研究方向:中医药预防肝癌研究;E-mail:songyijun200506@126.com
10.13313/j.issn.1673-4890.2017.11.014
2017-03-09)
