外源茉莉素调控植物中萜类化合物生物合成的研究进展△
2017-12-09石宏武罗祖良崔晟榕马小军
石宏武,罗祖良,崔晟榕,马小军,2*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100)
·综述·
外源茉莉素调控植物中萜类化合物生物合成的研究进展△
石宏武1,罗祖良1,崔晟榕1,马小军1,2*
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.中国医学科学院 药用植物研究所 云南分所,云南 景洪 666100)
萜类化合物是植物中的一类重要的次生代谢产物,在医药、工业和农业生产上扮演着重要的角色。由于一些重要的萜类具有复杂的化学结构以及在植物中的低含量,使其不能低成本地大量生产。因此,利用植物中普遍存在的茉莉素调控机制和外源介导相关转录因子,调控萜类生物合成途径关键酶基因表达,以达到提高目标萜类化合物含量,这已成为研究热点。本文综述了萜类化合物的生物合成途径、响应茉莉素信号且与次生代谢有关的转录因子以及应用茉莉素调控萜类化合物合成的研究进展,探讨了茉莉素调控萜类合成中所面临的问题,并对茉莉素调控萜类生物合成的潜在经济价值进行了展望。
茉莉素;萜类化合物;转录因子;调控;综述
萜类(terpenoids)化合物是植物中以异戊二烯单位构成的一类重要的次生代谢产物,主要有半萜、单萜、倍半萜、二萜、三萜等,其也是天然药物活性成分的主要来源,具有增强植物抗病能力、帮助植物抵御天敌、维系植物与其他物种的互惠关系以及化感等作用[1]。近年来,由于萜类化合物在医药、工业和农业上的广泛应用,使其具有可观的经济价值。然而在萜类化合物的生产中发现,一些具有重要价值的萜类化合物的化学结构复杂且在植物中含量较低,开发成本较高。植物组织细胞培养和微生物发酵生物合成虽然能够大幅度提高萜类产量,但在植物组织细胞管理或构建合适的发酵菌株上,前期投入成本高。因此利用植物自身的代谢通路,通过植物激素调控萜类快速合成和大量积累,不失为一种经济可行的方法。
植物激素是植物体内产生的一类调控植物生长发育、代谢、环境应答等生理过程的重要代谢产物。随着分子生物学的不断完善以及植物激素检测技术体系的日趋成熟,对筛选激素受体和激素信号转导的研究就显得更加经济、易操作。茉莉素(jasmonates)作为近几十年来新发现的一类植物激素,已经在调控植物生长和次生代谢上广泛应用,且在调控萜类次生代谢产物积累上获得了重大进展。本文主要从萜类化合物在体内合成途径入手,综述了茉莉素调控植物萜类合成途径关键酶表达,以提高其含量的研究状况,以及茉莉素在调控过程中涉及的一些转录因子,以期获得对茉莉素调控萜类生物合成的新认识。
1 植物萜类化合物的合成途径
萜类化合物主要是通过两个途径合成:位于胞质和内质网中的甲羟戊酸(MVA)途径以及位于质体中的脱氧木酮糖-5-磷酸途径(DOXP)或甲基赤藓醇-4-磷酸途径(MEP)。
这两个途径可分为3个阶段:焦磷酸异戊烯酯(IPP)及其双键异构体γ,γ-二甲基烯丙酯(DMAPP)的生成阶段、萜类直接前体的合成阶段和萜类的合成及修饰阶段[2]。在第一阶段,MVA途径是起始于乙酰CoA,依次在乙酰乙酰CoA硫解酶(AACT)、3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)、羟甲基戊二酰CoA还原酶(HMGR)等酶的催化下形成甲羟戊酸(MVA),然后再依次通过甲羟戊酸激酶(MK)、甲羟戊酸磷酸激酶(PMK)和甲羟戊酸焦磷酸脱羧酶(MVD)等作用下形成IPP。MEP途径则是以丙酮酸和磷酸甘油醛为前体化合物,经过1-脱氧-D-木酮糖-5-磷酸合酶(DXS)聚合成1-脱氧-D-木酮糖-5-磷酸,随后经过1-脱氧-D-木酮糖-5-磷酸还原酶(DXR)、2-甲基-D-赤藓醇-4-磷酸胱氨酰转移酶(MCT)等酶的催化下形成IPP和DMAPP[3]。两种途径产生的IPP可以越过质体膜互为利用[4]。在第二阶段,由MVA和MEP途径合成的IPP在IPP异构酶催化下形成具有活性的异构体DMAPP,在异戊烯转移酶的作用下形成焦磷酸香叶酯(GPP),衍生为单萜类化合物,或在继续与IPP分子缩合衍生成焦磷酸金合欢酯(FPP)、焦磷酸香叶基香叶酯(GGPP)和焦磷酸香叶基金合欢酯(GFPP)等萜类前体化合物[5]。第三阶段,在形成的萜类前体化合物的基础上,经过环化,形成相应的萜类和甾醇类化合物,见图1。
2 茉莉素及与其响应的转录因子
茉莉素是新纳入到植物内源激素的一类具有环戊酮结构的化合物,由亚麻酸经脂肪氧合酶途径合成,主要包括茉莉酸异亮氨酸(jasmonic acid-isoleucine,JA-Ile)、茉莉酸(jasmonic acid,JA)和茉莉酸甲酯(methyl-jasmonic acid,MeJA)等。其中,虽然在植物体内具有生物活性的为JA-Ile,但是由于MeJA具有挥发性、不易被离子化、易透过细胞等特点而被选为外源使用[6]。茉莉素在植物生长发育过程中发挥着广泛的生物学功能,如调控植物组织器官生长发育[7]、介导植物对病虫害和病原菌的抗性反应[8]、诱导衰老和调节次生代谢[9]等。
茉莉素的信号转导途径研究表明,26S泛素蛋白酶体介导了茉莉素反应。茉莉素受体COI1(coronatime insensitive 1)通过与ASK(Arabidopsis SKP)、Cullin、F-box和Rbx1(ring box-1,Rbx1)相互作用形成多亚基泛素连接酶复合体SCFCOI1[10]。当植物体内活性的茉莉素信号分子处于低水平时,抑制因子JAZ蛋白(jasmonate ZIM-domain protein)通过与各转录因子(transcription factor,TF)相互作用,抑制茉莉素信号传导。当植物受到外源刺激,或自身生长发育促使茉莉素信号分子大量积累时,多亚基泛素连接酶复合体SCFCOI1中的COI1受体结合茉莉素信号分子,进而引导SCFCOI1与JAZ蛋白相结合,使得JAZ蛋白泛素化,泛素化的JAZ蛋白经过26S蛋白酶体被降解,被JAZ抑制的TF释放,从而结合相应基因上游的顺势作用元件,促进/抑制其表达而产生茉莉素样效应[11]。
从茉莉素信号转导途径可以看出,茉莉素产生的生物学功能主要是通过介导释放TF来调控基因表达而实现的,如调控植物雄蕊晚发育的MYB21和MYB24[11],调控根发育的MYC2[12]以及调控植物抗虫反应的MYC2、MYC3和MYC4[13]等。表1总结了茉莉素诱导产生次生代谢产物对应介导的几类TF,主要属于AP2/ERF(APETALA2/Ethylene-Response Factors)、bHLH(basic Helix-Loop-Helix)、MYB和WRKY四个家族,涉及长春花、拟南芥、烟草、黄花蒿、红豆杉、人参、西洋参、三七、日本黄连等植物。这些TF上调或下调关键合酶的基因表达,调控生物合成途径的代谢走向。因此,通过外源施加激素介导转录因子,调控基因的表达,从而生产大量的目标次生代谢产物,这可为医药、化工生产上的原料来源提供重要的补充。
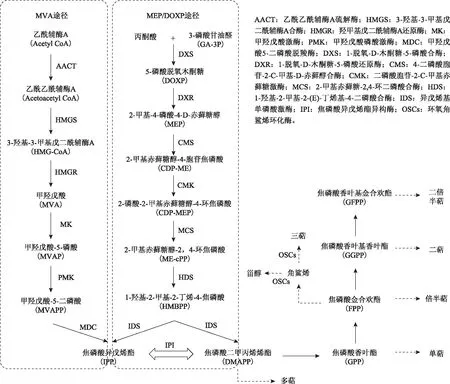
图1 萜类化合物的生物合成途径
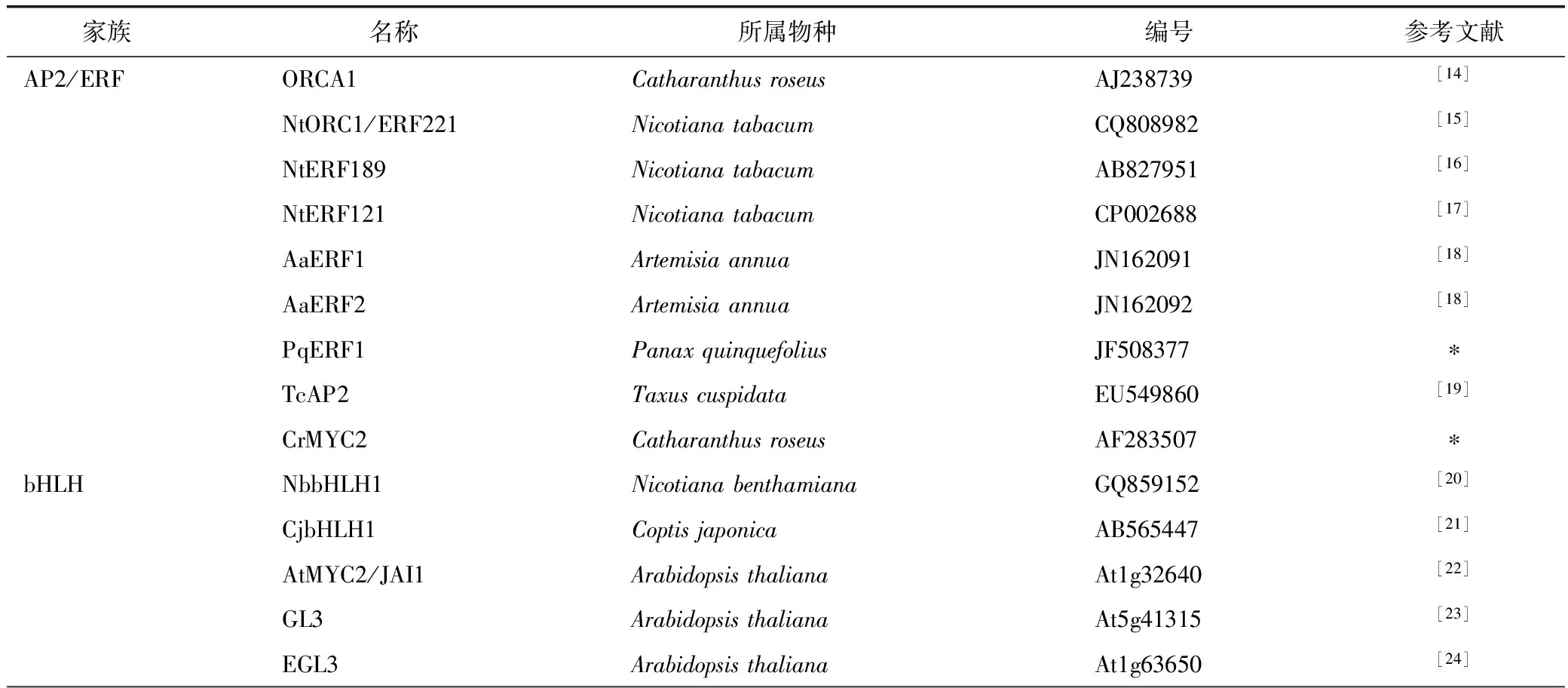
表1 文献中一些与调控次生代谢有关的应答JA的转录因子
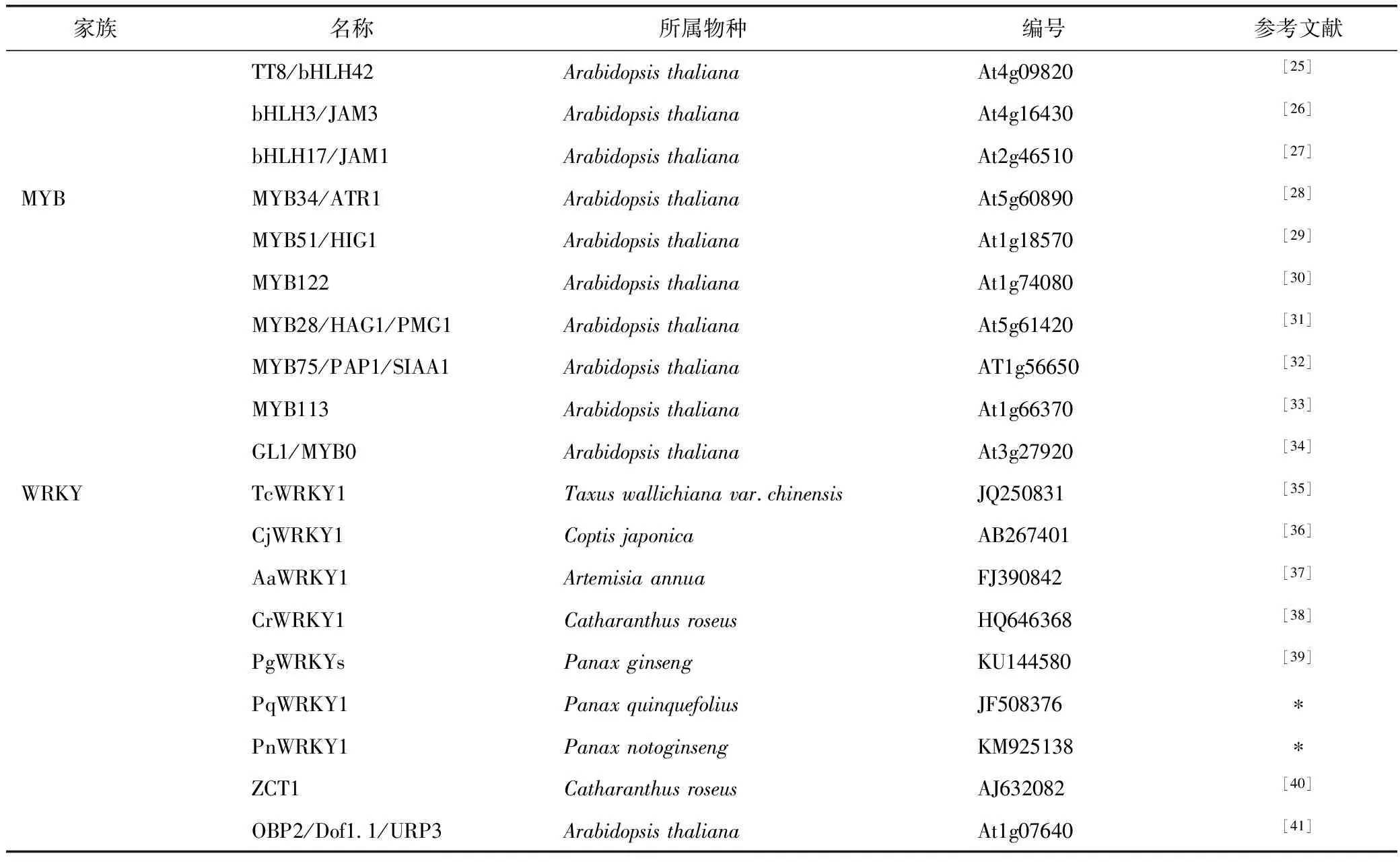
表1(续)
注:*表示直接提交至NCBI。
3 茉莉素调节萜类化合物合成的研究
萜类化合物在植物中直接提取的产率低,化学合成途径复杂,特别是手性化合物的合成等问题大大限制了其生产应用,通过外源植物激素茉莉素调控关键合成酶基因的表达来提高萜类产量,在很大程度上有望改善这一不利局面。通过对植物不同时期的转录组数据分析和生物学验证,进而对萜类化合物代谢途径关键酶基因序列进行分析,获得转录调控关键基因的顺式作用元件,分析可能存在的TF作用的顺式作用元件,再通过酵母单杂交试验筛选介导调控的TF,从而达到促进/抑制基因表达的作用。另外,植物激素的调控不仅可以增加萜类产量,还可提高植物组织器官的利用率。其中,茉莉酸甲酯已经广泛地用于调控植物萜类化合物的合成,与之响应的转录因子在阳春砂、青蒿素、红豆杉、罗汉果、三七和苦玄参等大多数植物中皆存在。
3.1 调控阳春砂挥发性萜类生物合成的研究
阳春砂(AomomumvillosumLour.)属于姜科豆蔻属植物,味辛,性温,归脾、胃经,具有化湿开胃、温脾止泻、理气安胎的功能。其中主要含有乙酸龙脑酯、樟脑、龙脑、蒎烯、柠檬烯和芳樟醇等挥发性单萜类化合物。阳春砂主产于广东、广西、福建、云南等地,由于生长地理环境要求高,导致其产量低,质量参差不齐[42],而茉莉素能有效地改善阳春砂的质量。
利用不同浓度的茉莉酸甲酯处理阳春砂的果实和叶片,检测发现,在600 μmol·L-1MeJA处理果实24 h后,果皮和种子团中大部分挥发性萜类化合物的积累明显增加,处理果或叶对果皮和种子团中不同挥发性萜类化合物含量的影响存在差异。此外,通过转录组测序和KEGG代谢通路分析发现,与挥发性萜类化合物密切相关的Unigene有208个,响应JA信号重要的MYC类(bHLH家族)TF的Unigene有22个[43]。该研究通过转录组数据分析获得的多个与挥发性萜类化合物的候选基因以及JA处理阳春砂的试验数据,为深入开展挖掘JA调控挥发性萜类生物合成奠定了重要基础。
3.2 调控青蒿素生物合成的研究
青蒿素属于过氧化物倍半萜,是从黄花蒿ArtemisiaannuaL.中分离到的一种抗疟疾的有效成分。由于其在一定时期内具有的重大战略意义,基于前期大量的生物或化学合成的研究基础,通过外源茉莉素来调控黄花蒿中青蒿素的合成,从而提高原材料质量的研究也已经取得了很大的进展。
Wang等[44]利用300 μmol·L-1MeJA处理黄花蒿植株8 d后,黄花蒿中青蒿素含量提高了49%,青蒿素前体化合物青蒿酸和双氢青蒿酸分别提高了80%和28%,并通过偏最小二乘近红外光谱分析(OSC-PLS)方法检测到其他6种倍半萜和3种三萜含量均增高。Maes等[45]筛选到茉莉素介导青蒿素生物合成的174个基因,其中包括形成焦磷酸金合欢酯过程的DXS和FDS基因以及后期修饰成青蒿素的CYP71AV1基因。在茉莉素介导青蒿素合成的过程中,编码AP2/ERF家族的TF的主要两种基因分别为AaERF1和AaERF2,并且EMSAs和酵母单杂交试验证明,AaERF1和AaERF2能够结合到编码紫穗槐-4,11-二烯合酶基因(ADS)和CYP71AV1基因的启动子序列,稳定过表达这两个基因都能使青蒿素含量提高[18]。此外,AaWRKY1通过结合ADS基因上的W-box,促进其表达[37],而bHLH家族中的AaMYC2主要是结合启动子中的G-box或G-box-like motifs作用元件来调控基因表达[46]。因此,茉莉素可以通过介导转录因子AaMYC2、AaWRKY1、AaERF1和AaERF2来调控青蒿素的生物合成,这些探索为以后黄花蒿的高质量种植、采收提供了理论依据。
3.3 调控紫杉醇生物合成的研究
紫杉醇属于二萜类化合物,临床上用于治疗卵巢癌、乳腺癌及非小细胞肺癌等。紫杉醇最早从太平洋红豆杉(Taxusbrevifolia)的树皮中分离到,但含量极低。由于紫杉醇原料药长期处于供不应求状态,因此开展快速生物合成紫杉醇的研究尤为重要。通过最具有诱导活力的一类茉莉素MeJA调控红豆杉中紫杉烷型化合物的合成关键酶基因的表达,使代谢支路有利于紫杉醇的合成。
Nims等[47]用MeJA处理红豆杉,7 d后与未检测到目标化合物的对照组相比,实验组的紫杉醇和三尖杉宁碱含量达到了3.3 mg·L-1和2.2 mg·L-1,10-脱乙酰巴卡丁III和浆果赤霉素III含量达到3.3 mg·L-1和1.2 mg·L-1,并且在MJ诱导6 h后,合成起始途径的酶基因GGPPS、TASY和T5αH均上调并持续至24 h。该实验通过反转录PCR(RT-PCR)分析了紫杉烷化合物合成路径中各基因的表达情况,为紫杉醇的靶向代谢工程奠定了基础。研究发现,MeJA能够诱导大幅度提高紫杉醇合成途径关健酶紫杉二烯合成酶和GGPPS酶的活力[48],从而间接提高紫杉醇产量。此外,通过对MeJA诱导后的产物比较发现,JA对C-13位紫杉烷衍生物的诱导作用强于C-14位[49]。在JA诱导紫杉醇积累过程中,从红豆杉(Taxuswallichianavar.chinensis)中筛选到WRKY家族TcWRKY1。体外研究发现,TcWRKY1蛋白特定地作用于编码10-脱乙酰巴卡丁III-10β-O-乙酰转移酶(DBAT)基因上的启动子中两个W-box元件,调控该关键酶基因的表达[50]。这些筛选到的TF或调控通路研究为今后靶向生物合成紫杉醇或提高红豆杉采收时有效成分含量等工作提供了有利的依据。
3.4 调控罗汉果中葫芦二烯醇生物合成的研究
葫芦二烯醇是从罗汉果、栝楼、西葫芦等中分离到的葫芦烷型四环三萜类化合物,研究发现,其具有抗炎、抗肿瘤活性,也是葫芦素类化合物生物合成的关键中间体[51]。在罗汉果(Siraitiagrosvenorii)中,以葫芦二烯醇为母核结构的罗汉果甜苷基于其惊人的甜度和低热量等优点,在甜味剂开发上具有很大的市场潜力。利用茉莉素刺激罗汉果以增高葫芦二烯醇和甜苷含量的研究取得了不错效果。
利用Solexa高通量测序技术对罗汉果果实的转录组及不同时期的表达谱进行分析,已经得到了大量的罗汉果基因信息,并验证了以葫芦二烯醇为中间产物,合成罗汉果甜苷途径的相关基因的表达[52]。Zhang等[53]对罗汉果果实转录组数据中注释为转录因子的所有非重复Unigene进行分析,发现其中数目最多的3类转录因子家族为bHLH、WRKY和MYB,数量分别为79、57和50。此外,通过MeJA喷施罗汉果幼果,发现葫芦二烯醇含量较对照组增加了22%,RT-PCR检测基因表达,发现葫芦二烯醇合成途径中11个基因的表达受MeJA影响。同时,在对葫芦二烯醇合酶基因SgCS启动子进行克隆,获得了1459 bp的基因序列,顺式作用元件分析发现,这段序列中具有核心启动子元件TATA-box和CAAT-box,其中有3个响应JA的顺式作用调控元件。这些研究证明,通过JA调控罗汉果中葫芦二烯醇生物的合成是可行的。这些转录因子作用的顺式作用元件数据为筛选具体的转录因子蛋白奠定了基础,也为研究罗汉果中葫芦烷型三萜化合物合成途径的激素分子调控机制开辟了新途径。
3.5 调控其他萜类化合物生物合成的研究
茉莉素除了调控上述萜类化合物的生物合成外,还能对其他萜类的合成产生诱导作用。甲基茉莉酸处理人参发现,人参皂苷合成途径中的关键酶基因SS和SE的表达量明显提升[54]。在苦玄参(PicriafeltearraeLour.)上喷施MeJA能提高苦玄参苷IA和IB含量[55]。埃及黑种草(NigellasativaL.)在MeJA作用后,常春藤皂苷和刺楸皂苷含量相对于对照组提高了12倍[56]。此外,JA还能调控西洋参、三七、柴胡等药材中合成萜类皂苷的相关基因的表达[57-58]。在三萜化合物生物合成途径中,角鲨烯在2,3-氧化鲨烯合酶(SQE)作用下形成2,3-氧化鲨烯,2,3-氧化鲨烯的环化处于萜类和甾醇合成途径的分支点。研究发现,JA能有效地增强萜类环化酶的活性,抑制甾醇支路环化酶基因的表达[59]。
4 总结与展望
茉莉素调控植物中萜类化合物的积累,能够有效地提高经济作物的质量,此外,在激素处理后的植物中,以往废弃的植物组织也会得到很好的利用。相比萜类化合物的全合成或是异源生物合成的高成本投入问题,茉莉素信号调控途径在植物界广泛存在且经济有效,这使其调控萜类合成成为一个研究的热点。加上我国是一个种植大国,高产量的萜类植物将保证了其生产中的原材料供给。以往研究中,是将代谢途径中某个基因过表达以获得相应产物,与此方法相比,茉莉素以经济易操作的方式在植物整个次生代谢系统上调节多个酶基因的表达水平,是一种更全面的调控目标次生代谢产物合成的有效可行的方法。
茉莉素作为调控萜类化合物的植物激素之一,深入研究阐明其调控植物次生代谢的传导通路以及相关的转录因子,无论是在实际生产种植还是基础研究上,都具有重大意义。尽管茉莉素信号转导机制的研究已有初步成果,仍有很多茉莉素调控植物生长和抗性的分子机制还不清楚,不同物种中对茉莉素响应的转录因子也可能受到其他激素的影响,其他植物激素与茉莉素产生的拮抗或协同作用的分子机制的研究还不是很透彻,相关的具有重要价值的转录因子还需要不断筛选补充。由于在调控萜类化合物合成中,茉莉素是外源施加的植物激素,对植物生长或是作物质量上的负面影响还不得而知。因此,还需要大量的科学实验研究来更详细地阐明茉莉素作用的分子机制,对茉莉素单一响应或产生同类效应的转录因子仍需要不断筛选研究。
近些年来对萜类化合物的深入研究,使其在医药、农业、化工生产上占有越来越重要的地位。茉莉素调控植物萜类化合物的生物合成将会解决萜类生产的原料供给问题,这也大大提高了植物的有效利用率。虽然目前茉莉素的分子作用机制尚未成熟,但是从调控的实质性结果上我们已经看到希望,加上如今各个学科迅猛发展以及其交叉互补的优势,相信更为全面的分子作用机理很快将会被阐明,茉莉素在调控萜类生物合成上的潜在经济价值也会被充分挖掘。
[1] 付佳,王洋,阎秀峰.萜类化合物的生理生态功能及经济价值[J].东北林业大学学报,2003,31(6):59-62.
[2] 罗祖良,张凯伦,马小军,等.三萜皂苷的合成生物学研究进展[J].中草药,2016,47(10):1806-1814.
[3] 刘春生.药用植物学[M].北京:中国中医药出版社,2016.
[4] Laule O,Fürholz A,Chang H S,et al.Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis inArabidopsisthaliana[J].P Natl Acad Sci USA,2003,100(11):6866-6871.
[5] 吴立军.天然药物化学[M].北京:人民卫生出版社,2011.
[6] Zhou M,Memelink J.Jasmonate-responsive transcription factors regulating plant secondary metabolism [J].Biotechnol Adv,2016,34(4):441-449.
[7] Xie D X,Feys B F,James S,et al.COI1:AnArabidopsisGene Required for Jasmonate-Regulated Defense and Fertility[J].Science,1998,280(5366):1091-1094.
[8] Koo A J K,Howe G A.The wound hormone jasmonate[J].Phytochemistry,2009,70(13/14):1571-1580.
[9] Falcone Ferreyra M L,Rius S,Emiliani J,et al.Cloning and characterization of a UV-B-inducible maize flavonol synthase[J].Plant J,2010,62(1):77-91.
[10] Santner A,Estelle M.Recent advances and emerging trends in plant hormone signalling[J].Nature,2009,459(7250):1071-1078.
[11] Song S,Qi T,Huang H,et al.The jasmonate-ZIM domain proteins interact with the R2R3-MYB transcription factors MYB21 and MYB24 to affect jasmonate-regulated stamen development inArabidopsis[J].Plant Cell,2011,23(3):1000-1013.
[12] Dombrecht B,Gang P X,Sprague S J,et al.MYC2 differentially modulates diverse jasmonate-dependent functions inArabidopsis[J].Plant Cell,2007,19(7):2225-2245.
[13] Ryu C M,Farag M A,Hu C H,et al.Bacterial volatiles induce systemic resistance inArabidopsis[J].Plant Physiol,2004,134(3):1017-1026.
[14] Menke F L H,Champion A,Kijne J W,et al.A novel jasmonate-and elicitor-responsive element in the periwinkle secondary metabolite biosynthetic gene Str interacts with a jasmonate-and elicitor-inducible AP2‐domain transcription factor,ORCA2[J].Embo J,1999,18(16):4455-4463.
[15] Inze D G.Genes and uses thereof to modulate secondary metabolite biosynthesis:US,EP1606300 A2[P].2003-11-27.
[16] Shoji T,Kajikawa M,Hashimoto T.Clustered transcription factor genes regulate nicotine biosynthesis in tobacco[J].Plant Cell,2010,22(10):3390-3409.
[17] Tabata S,Kaneko T,Nakamura Y,et al.Sequence and analysis of chromosome 5 of the plantArabidopsisthaliana[J].Nature,2000,408(6814):823-826.
[18] Yu Z X,Li J X,Yang C Q,et al.The jasmonate-responsive AP2/ERF transcription factors AaERF1 and AaERF2 positively regulate artemisinin biosynthesis inArtemisiaannuaL[J].Mol Plant,2012,5(2):353-365.
[19] Dai Y,Qin Q,Dai D,et al.Isolation and characterization of a novel cDNA encoding methyl jasmonate-responsive transcription factor TcAP2 fromTaxuscuspidata[J].Biotechnol Lett,2009,31(11):1801-1809.
[20] Todd A T,Liu E,Polvi S L,et al.A functional genomics screen identifies diverse transcription factors that regulate alkaloid biosynthesis inNicotianabenthamiana[J].Plant J,2010,62(4):589-600.
[21] Yamada Y,Kokabu Y,Chaki K,et al.Isoquinoline alkaloid biosynthesis is regulated by a unique bHLH-type transcription factor inCoptisjaponica[J].Plant Cell Physiol,2011,52(7):1131-1141.
[22] Yastreb T O,Kolupaev Y E,Lugovaya A A,et al.Content of osmolytes and flavonoids under salt stress inArabidopsisthalianaPlants defective in jasmonate signaling[J].Appl Biochem and Micro,2016,52(2):210-215.
[23] Sun L,Zhang A,Zhou Z,et al.GLABROUS INFLORESCENCE STEMS3(GIS3)regulates trichome initiation and development inArabidopsis[J].New Phytol,2015,206(1):220-230.
[24] Qi T,Huang H,Wu D,et al.ArabidopsisDELLA and JAZ proteins bind the WD-repeat/bHLH/MYB complex to modulate gibberellin and jasmonate signaling synergy[J].Plant Cell,2014,26(3):1118-1133.
[25] Xu W,Grain D,Le G J,et al.Regulation of flavonoid biosynthesis involves an unexpected complex transcriptional regulation of TT8 expression,inArabidopsis[J].New Phytol,2013,198(1):59-70.
[26] Sasakisekimoto Y,Saito H,Masuda S,et al.Comprehensive analysis of protein interactions between JAZ proteins and bHLH transcription factors that negatively regulate jasmonate signaling[J].Plant Signal Behav,2014,8(12):28-38.
[27] Nakata M,Ohme-Takagi M.Two bHLH-type transcription factors,JA-ASSOCIATED MYC2-LIKE2 and JAM3,are transcriptional repressors and affect male fertility[J].Plant Signal Behav,2013,8(12):e26473.
[28] Schweizer F,Fernándezcalvo P,Zander M,et al.Arabidopsisbasic helix-loop-helix transcription factors MYC2,MYC3,and MYC4 regulate glucosinolate biosynthesis,insect performance,and feeding behavior[J].Plant Cell,2013,25(8):3117.
[29] Benstein R M,Ludewig K,Wulfert S,et al.Arabidopsisphosphoglycerate dehydrogenase1 of the phosphoserine pathway is essential for development and required for ammonium assimilation and tryptophan biosynthesis[J].Plant Cell,2013,25(12):5011-5029.
[30] Frerigmann H,Gigolashvili T,et al.MYB34,MYB51,and MYB122 Distinctly regulate indolic glucosinolate biosynthesis inArabidopsisthaliana[J].Mol plant,2014,7(5):814-828.
[31] Ding Y,Liu N,Virlouvet L,et al.Four distinct types of dehydration stress memory genes inArabidopsisthaliana[J].BMC Plant Biol,2013,13(1):229.
[32] Li S,Zachgo S.TCP3 interacts with R2R3-MYB proteins,promotes flavonoid biosynthesis and negatively regulates the auxin response inArabidopsisthaliana[J].Plant J,2013,76(6):901-913.
[33] Chen Y H,Yang X Y,He K,et al.The MYB transcription factor superfamily ofArabidopsis:expression analysis and phylogenetic comparison with the rice MYB family[J].Plant Mol Biol,2006,60(1):107-124.
[34] Bloomer R H,Juenger T E,Symonds V V.Natural variation in GL1 and its effects on trichome density inArabidopsisthaliana[J].Mol Ecol,2012,21(14):3501-3515.
[35] Li S,Zhang P,Zhang M,et al.Functional analysis of a WRKY transcription factor involved in transcriptional activation of the DBAT gene inTaxuschinensis[J].Plant Biol,2013,15(1):19-26.
[36] Kato N,Dubouzet E,Kokabu Y,et al.Identification of a WRKY protein as a transcriptional regulator of benzylisoquinoline alkaloid biosynthesis inCoptisjaponica[J].Plant Cell Physiol,2007,48(1):8-18.
[37] Ma D,Pu G,Lei C,et al.Isolation and characterization of AaWRKY1,anArtemisiaannuatranscription factor that regulates the amorpha-4,11-diene synthase gene,a key gene of artemisinin biosynthesis[J].Plant Cell Physiol,2009,50(12):2146-2161.
[38] Suttipanta N,Yuan L.The transcription factor CrWRKY1 positively regulates the terpenoid indole alkaloid biosynthesis inCatharanthusroseus[J].Plant Physiol,2011,157(4):2081-2093.
[39] Xiu H,Nuruzzaman M,Guo X,et al.Molecular cloning and expression analysis of eight PgWRKY genes inPanaxginsengresponsive to salt and hormones[J].Int J Mol Sci,2016,17(3):319.
[40] Pauw B,Hilliou F A,Martin V S,et al.Zinc finger proteins act as transcriptional repressors of alkaloid biosynthesis genes inCatharanthusroseus[J].J Biol Chem,2004,279(51):52940-52948.
[41] Nakano T,Suzuki K,Ohtsuki N,et al.Identification of genes of the plant-specific transcription-factor families cooperatively regulated by ethylene and jasmonate inArabidopsisthaliana[J].J Plant Res,2006,119(4):407-413.
[42] 李学兰,李荣英,马治安,等.景洪市砂仁现状调查(二)—种植地环境条件对砂仁产量的影响[J].云南热作科技,2002,25(4):31-33.
[43] 王焕,杨锦芬,邓可,等.茉莉酸甲酯影响阳春砂挥发性萜类代谢和基因转录[J].世界科学技术-中医药现代化,2014,7(16):1528-1536.
[44] Wang H,Ma C,Li Z,et al.Effects of exogenous methyl jasmonate on artemisinin biosynthesis and secondary metabolites inArtemisiaannuaL.[J].Ind Crop Prod,2010,31(2):214-218.
[45] Maes L,Van Nieuwerburgh F C W,Zhang Y,et al.Dissection of the phytohormonal regulation of trichome formation and biosynthesis of the antimalarial compound artemisinin inArtemisiaannuaplants[J].New Phytol,2011,189(1):176-189.
[46] Shen Q,Lu X,Yan T,et al.The jasmonate-responsive AaMYC2 transcription factor positively regulates artemisinin biosynthesis inArtemisiaannua[J].New Phytol,2016,210(4):1269-1281.
[47] Nims E,Dubois C P,Roberts S C,et al.Expression profiling of genes involved in paclitaxel biosynthesis for targeted metabolic engineering[J].Metab Eng,2006,8(5):385-394.
[48] Laskaris G,Bounkhay M,Theodoridis G,et al.Induction of geranylgeranyl diphosphate synthase activity and taxane accumulation inTaxusbaccatacell cultures after elicitation by methyl jasmonate[J].Plant Sci,1999,147(1):1-8.
[49] Ketchum R E,Rithner C D,Qiu D,et al.Taxus metabolomics:methyl jasmonate preferentially induces production of taxoids oxygenated at C-13 inTaxusmediacell cultures[J].Phytochemistry,2003,62(6):901-909.
[50] Li S,Zhang P,Zhang M,et al.Functional analysis of a WRKY transcription factor involved in transcriptional activation of the DBAT gene inTaxuschinensis[J].Plant Biol,2013,15(1):19-26.
[51] 罗祖良,张凯伦,马小军,等.葫芦二烯醇及其生物合成的研究进展[J].药物生物技术,2016,23(2):179-182.
[52] Itkin M,Davidovich-Rikanati R,Cohen S,et al.The biosynthetic pathway of the nonsugar,high-intensity sweetener mogroside V fromSiraitiagrosvenorii[J].P Natl Acad Sci USA,2016,113(47):e7619-e7628.
[53] Zhang K,Luo Z,Guo Y,et al.Methyl jasmonate-induced accumulation of metabolites and transcriptional responses involved in triterpene biosynthesis inSiraitiagrosvenoriifruit at different growing stages[J].Acta Soc Bot Pol,2016,85(3):3503.
[54] Choi D W,Jung J D,Ha Y I,et al.Analysis of transcripts in methyl jasmonate-treated ginseng hairy roots to identify genes involved in the biosynthesis of ginsenosides and other secondary metabolites[J].Plant Cell Rep,2005,23(8):557-566.
[55] 谢阳姣,何志鹏,林伟.茉莉酸甲酯对苦玄参生长及苦玄参苷积累的影响研究[J].作物杂志,2013(2):80-84.
[56] Scholz M,Lipinski M,Leupold M,et al.Methyl jasmonate induced accumulation of kalopanaxsaponin I inNigellasativa[J].Phytochemistry,2009,70(4):517-522.
[57] 赵寿经,侯艳,贾冬梅,等.西洋参发根的诱导及不同外源物质对发根生长和皂苷含量的影响[J].天然产物研究与开发,2010,1(22):98-103.
[58] 战晴晴,金钺,魏建和,等.北柴胡不定根培养及茉莉酸甲酯处理对柴胡皂苷含量的影响[J].生物技术通讯,2011,1(22):57-60.
[59] 田娇,刘园,房敏峰.外源茉莉酸类激素对药用植物次生代谢的影响研究[J].天然产物研究与开发,2015,27(1):185-190.
ResearchProgressofExogenousJasmonatesRegulatingTerpenoidsBiosynthesisinPlants
SHIHongwu1,LUOZuliang1,CUIShengrong1,MAXiaojun1,2*
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Beijing100193,China;2.YunnanBranchofInstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,Jinghong666100,China)
Terpenoid is one of the important plant secondary metabolites in the plants,which exerts a significant part in the production of medicine,industry and agriculture.Mass production is steadily growing while the enhancement of production of target products is still a tough matter as the complexity of some important terpenoids chemical construction and low content in plants.Therefore,it has been a research focus that improving the target terpenoid content by jasmonates found in the majority of pants mediate correlative transcription factors to regulate the key enzyme genes expression in terpenoid biosynthetic pathway.In this paper,research progress on terpenoid biosynthetic pathway,some secondary metabolism transcription factors that response of jasmonates signal and application of jasmonates regulation on terpenoid biosynthetic is reviewed,the dilemmas faced by the jasmonates regulation on terpenoid biosynthetic are discussed and the great potential economic value of jasmonates regulate terpenoid biosynthetic is predicted.
Jasmonates;terpenoid;transcription factors;regulation;Review
国家自然科学基金(81373914,81573521);北京市自然科学基金(5172028)
*
马小军,研究员,研究方向:分子生物学;E-mail:mayixuan10@163.com
10.13313/j.issn.1673-4890.2017.11.030
2017-03-22)
