腹腔镜下射频消融术治疗原发性肝癌的效果探讨
2017-12-07冉江林袁春旺尹小勇
冉江林,袁春旺,尹小勇
(1.广元市第四人民医院,四川 广元,628000;2.首都医科大学附属北京佑安医院)
腹腔镜下射频消融术治疗原发性肝癌的效果探讨
冉江林1,袁春旺2,尹小勇1
(1.广元市第四人民医院,四川 广元,628000;2.首都医科大学附属北京佑安医院)
目的探讨腹腔镜下射频消融术(laparoscopic radiofrequency ablation,LRFA)治疗原发性肝癌的临床效果及对患者血清甲胎蛋白(alpha-fetoprotein,AFP)、干扰素-γ(interferon-γ,IFN-γ)及细胞免疫水平的影响。方法选取2011年1月至2013年1月治疗的60例原发性肝癌患者,其中30例行LRFA(LRFA组),30例行传统手术(传统组),对比两组临床效果。结果术后复查,LRFA组肿瘤完全坏死率86.67%、肿瘤不完全坏死率10.00%、肿瘤部分坏死率3.33%,传统组术后复查,均成功切除病灶。治疗前、治疗后2周、治疗后4周,两组患者血清AFP水平差异无统计学意义(P>0.05);治疗后2周、治疗后4周,LRFA组血清IFN-γ、CD3+、CD4+、CD4+/CD8+水平高于传统组(P<0.05);LRFA组2年生存率(50.00%)高于传统组的23.33%(P<0.05)。结论LRFA治疗原发性肝癌的临床疗效与传统手术相当,并能改善患者的早期免疫学指标。
肝肿瘤;腹腔镜检查;射频消融术;甲胎蛋白类;干扰素γ;免疫,细胞
原发性肝癌是我国高发肿瘤之一,具有一定的地域特征,东南沿海地区发病率显著高于内陆地区,患者集中于40~50岁,且以男性人群为主[1]。半数以上患者最早出现的症状为肝区疼痛,疼痛多呈胀痛、刺痛及持续性钝痛等,随着疾病进展,患者会合并消瘦、乏力、腹胀、黄疸、贫血、下肢水肿、肝肿大等症状,疾病晚期会出现脑、肺、骨转移,危及生命[2]。射频消融术是借助射频电流促使局部组织凝固坏死,实现肿瘤细胞灭杀、心律失常阻断等目标的医学技术。射频消融术具有微创特征,对于无法手术根除的原发性肝癌患者具有重要价值[3]。为探究腹腔镜下射频消融术(laparoscopic radiofrequency ablation,LRFA)治疗原发性肝癌的临床效果及对患者血清甲胎蛋白(alpha-fetoprotein,AFP)、干扰素-γ(interferon-γ,IFN-γ)、细胞免疫水平的影响,笔者进行了本研究,现将体会报道如下。
1 资料与方法
1.1 临床资料 选取2011年1月至2013年1月我院治疗的60例原发性肝癌患者,其中30例行LRFA(LRFA组),30例行传统手术(传统组),两组患者年龄、性别等临床资料差异均无统计学意义(P>0.05),见表1。
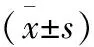
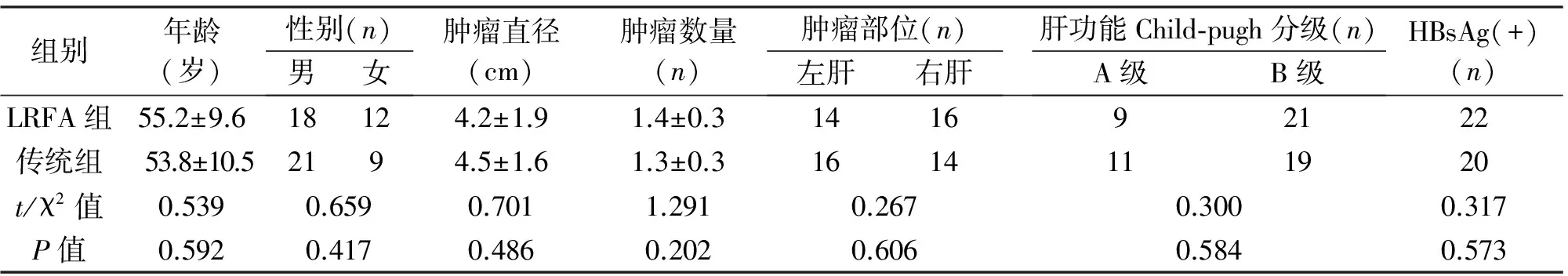
组别年龄(岁)性别(n)男女肿瘤直径(cm)肿瘤数量(n)肿瘤部位(n)左肝右肝肝功能Child⁃pugh分级(n)A级B级HBsAg(+)(n)LRFA组55.2±9.618124.2±1.91.4±0.3141692122传统组53.8±10.52194.5±1.61.3±0.31614111920t/χ2值0.5390.6590.7011.2910.2670.3000.317P值0.5920.4170.4860.2020.6060.5840.573
1.2 纳入与排除标准
1.2.1 纳入标准[4](1)肝癌患者的诊断标准依据人民卫生出版社第八版《外科学》中的标准;(2)年龄≤79岁;(3)治疗前经CT、MRI检查及肝细胞穿刺检查证实为肝癌,且为原发性,肝癌均为块状型、结节型,肝癌病灶数量<3枚;(4)手术实施前获得患者的知情同意。
1.2.2 排除标准[5](1)转移性肝癌;(2)患者已形成下腔静脉或门静脉癌栓;(3)已发生远处转移,患者的预计生存时间<3个月;(4)未能接受术后随访的患者。
1.3 治疗方法 LRFA组:选用WE7568多极射频消融治疗仪,功率为200 W,频率为290 kHz。全麻后建立气腹,脐下切口置入30°腹腔镜,剑突下穿刺1枚Trocar,检测肿瘤病灶情况,结合影像学结果进针,当电极进入肿瘤中心位置后,根据病灶体积,将消融针设置合适直径,于计算机控制下进行消融,消融时间与肿瘤大小相关,通常30~50 mm的肿瘤,消融时间为10~25 min;直径≥5.0 cm,则行多位置叠加消融。传统组:行传统开腹手术。
1.4 观察指标及疗效评价 LRFA组临床疗效评价[6]:治疗结束后1~1.5个月行CT、数字减影血管造影检查,观察病灶坏死情况,如病变区域无强化,数字减影血管造影未见肿瘤染色,则为完全坏死;若干病变部位仍存在强化信号,排除异常灌注、肿瘤周围的炎症反应后,根据强化信号范围划分为:90%~99%为不完全坏死,50%~89%为部分坏死。选用酶联免疫法检测并比较两组患者治疗前、治疗后2周、治疗后4周患者的血清AFP、IFN-γ水平;选用分选型流式细胞仪检测外周血中T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平,操作根据说明书进行。随访并记录两组患者1、2、3年生存率。
2 结 果
2.1 两组患者肿瘤病灶坏死情况分析 LRFA组肿瘤完全坏死率为86.67%(26/30)、肿瘤不完全坏死率为10.00%(3/30)、肿瘤部分坏死率为3.33%(1/30),传统组术后复查,均成功切除病灶。
2.2 两组患者血清AFP、IFN-γ水平的比较 治疗前、治疗后2周、治疗后4周,两组患者血清AFP水平差异无统计学意义(P>0.05);治疗后2周、治疗后4周,LRFA组血清IFN-γ水平高于传统组(P<0.05);见表2。
2.3 两组患者T淋巴细胞亚群的比较 治疗前,两组患者T淋巴细胞亚群差异无统计学意义(P>0.05);治疗后2周、4周,LRFA组CD3+、CD4+、CD4+/CD8+水平高于传统组(P<0.05);见表3。
2.4 两组患者预后的比较 LRFA组2年生存率(50.00%)高于传统组(23.33%),差异有统计学意义(P<0.05);见表4。
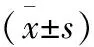
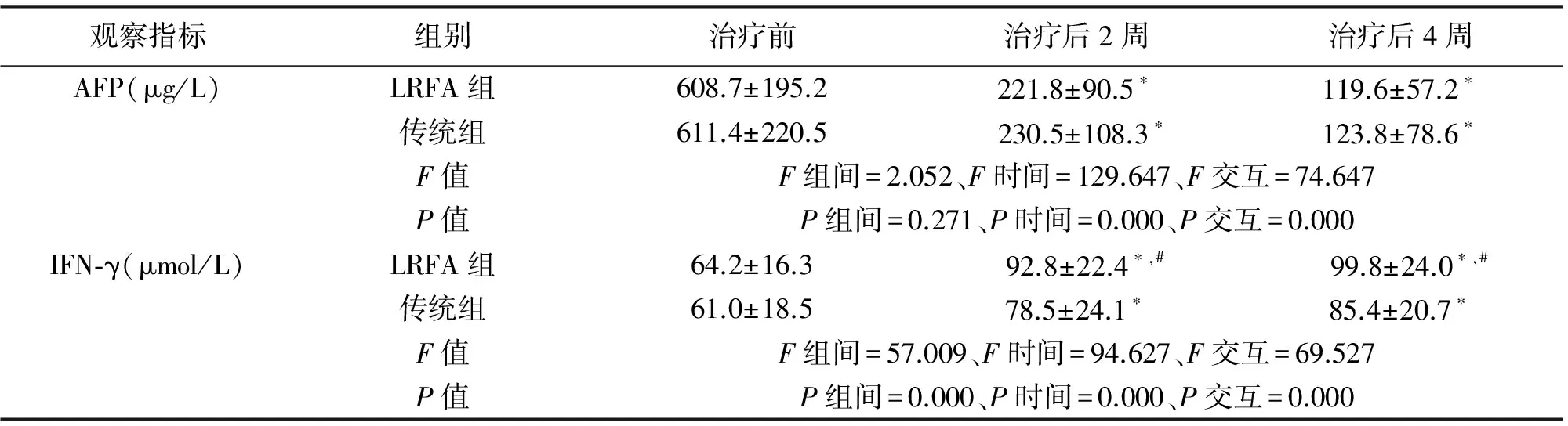
观察指标组别治疗前治疗后2周治疗后4周AFP(μg/L)LRFA组608.7±195.2221.8±90.5∗119.6±57.2∗传统组611.4±220.5230.5±108.3∗123.8±78.6∗F值F组间=2.052、F时间=129.647、F交互=74.647P值P组间=0.271、P时间=0.000、P交互=0.000IFN⁃γ(μmol/L)LRFA组64.2±16.392.8±22.4∗,#99.8±24.0∗,#传统组61.0±18.578.5±24.1∗85.4±20.7∗F值F组间=57.009、F时间=94.627、F交互=69.527P值P组间=0.000、P时间=0.000、P交互=0.000
*P<0.05 vs.治疗前;#P<0.05 vs.传统组
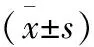
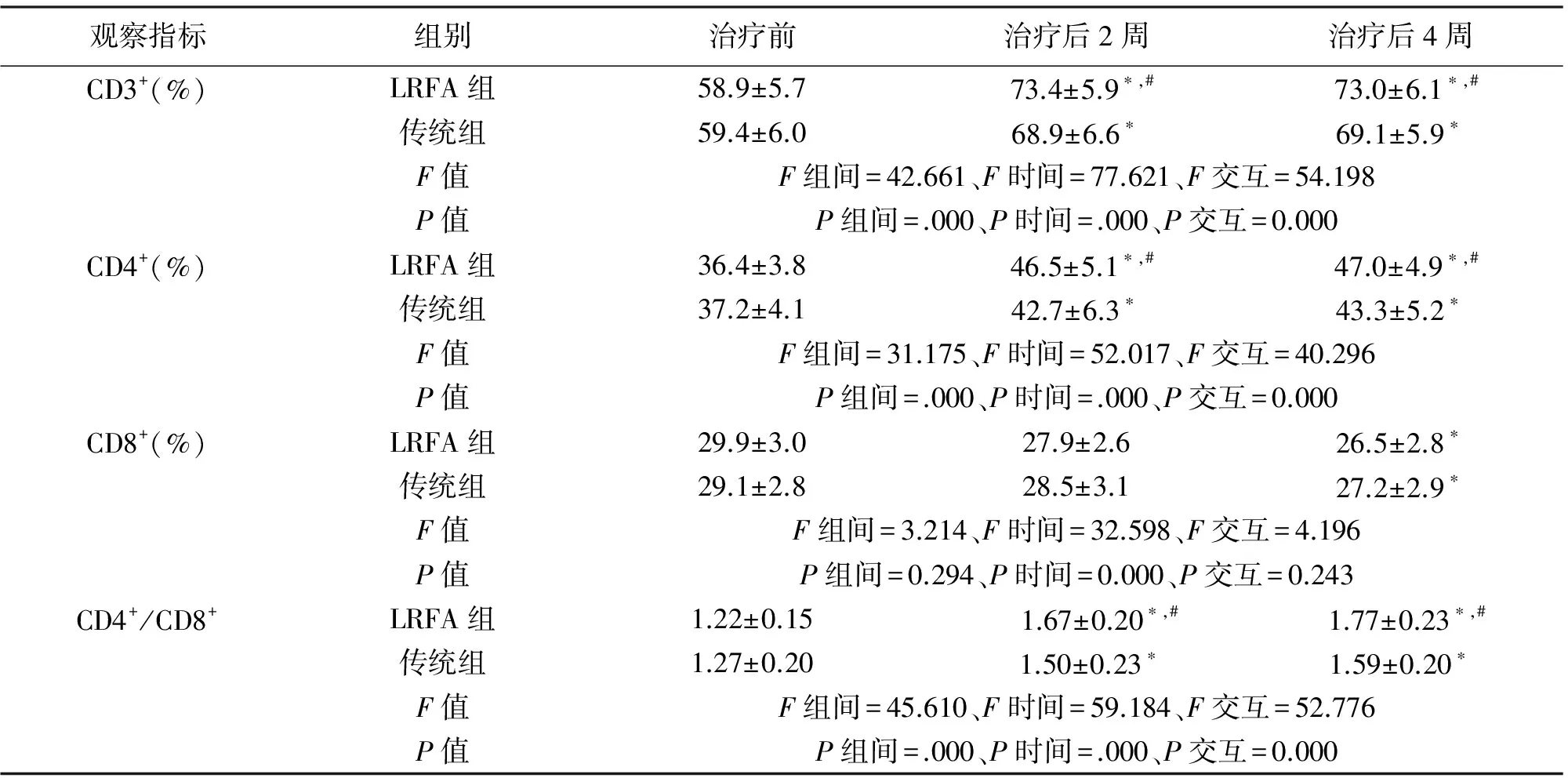
观察指标组别治疗前治疗后2周治疗后4周CD3+(%)LRFA组58.9±5.773.4±5.9∗,#73.0±6.1∗,#传统组59.4±6.068.9±6.6∗69.1±5.9∗F值F组间=42.661、F时间=77.621、F交互=54.198P值P组间=.000、P时间=.000、P交互=0.000CD4+(%)LRFA组36.4±3.846.5±5.1∗,#47.0±4.9∗,#传统组37.2±4.142.7±6.3∗43.3±5.2∗F值F组间=31.175、F时间=52.017、F交互=40.296P值P组间=.000、P时间=.000、P交互=0.000CD8+(%)LRFA组29.9±3.027.9±2.626.5±2.8∗传统组29.1±2.828.5±3.127.2±2.9∗F值F组间=3.214、F时间=32.598、F交互=4.196P值P组间=0.294、P时间=0.000、P交互=0.243CD4+/CD8+LRFA组1.22±0.15 1.67±0.20∗,#1.77±0.23∗,#传统组1.27±0.20 1.50±0.23∗1.59±0.20∗F值F组间=45.610、F时间=59.184、F交互=52.776P值P组间=.000、P时间=.000、P交互=0.000
*P<0.05 vs.治疗前;#P<0.05 vs.传统组
表4 两组患者预后的比较[n(%)]
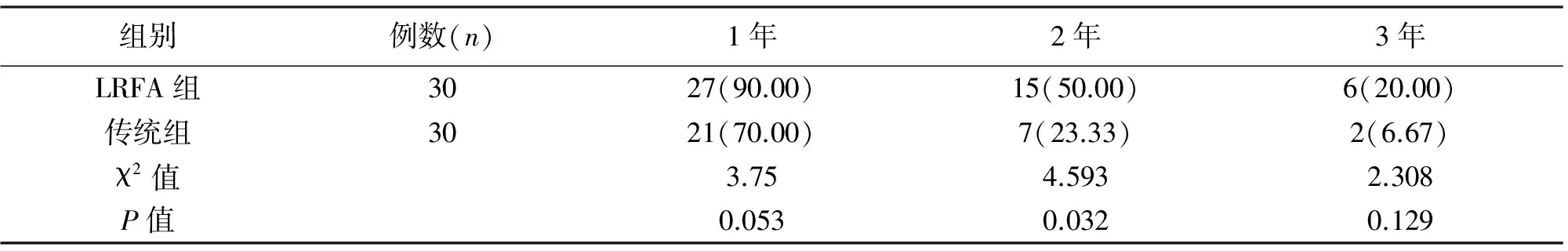
组别例数(n)1年2年3年LRFA组3027(90.00)15(50.00)6(20.00)传统组3021(70.00)7(23.33)2(6.67)χ2值3.754.5932.308P值0.0530.0320.129
3 讨 论
对比其他术式,LRFA具有以下优势:(1)手术可在腹腔镜直视下进行,视野宽阔,术中可通过韧带、组织游离等操作充分暴露病灶,以减少消融术对病灶周围组织的损伤;(2)腹腔镜直视下,穿刺位点精确,可对病灶进行精准定位、损毁,有效减少了正常肝组织的损伤,避免术后肝功能衰竭[7];(3)全麻操作可有效降低术中疼痛感及机体应激反应;(4)腹腔镜下可对穿刺出血进行细致检查,保证术中出血的有效清除,降低腹腔感染率;(5)手术损伤小,可用于凝血功能障碍或糖尿病患者[8]。本研究中,LRFA组肿瘤完全坏死率为86.67%、肿瘤不完全坏死率为10.00%、肿瘤部分坏死率为3.33%;传统组术后复查,均成功切除病灶;表明LRFA的手术疗效与传统术式相似。LRFA具有明显微创特征,术中腹腔镜下清晰视野可有效提高病灶消融损毁率,使患者在低损伤的情况下获得与传统术式相似的手术疗效。
临床研究表明,手术及其他治疗方式均无法完全清除癌细胞,仅降低患者肿瘤负荷。因此,治疗后肝癌患者体内癌细胞是否形成新病灶,这与患者机体抗肿瘤免疫能力密切相关[9]。机体抗肿瘤免疫能力是癌细胞灭杀能力的重要影响因子,对癌症复发、转移及患者预后具有重要作用[10]。T淋巴细胞是人体内的主要抗肿瘤免疫物质,CD3+是总T淋巴细胞,具有两个亚群,即CD4+、CD8+[11]。其中CD4+具有辅助剂诱导功能,是免疫应答的主要参与因子,可通过释放IL-2、IFN-γ等因子激活NK细胞、巨噬细胞参与抗肿瘤免疫;CD8+则具有细胞毒功能,可通过合成抑制性T细胞因子形成特异性免疫。CD4+/CD8+比值则是反应人体免疫功能的重要指标,比值越高提示机体免疫能力越强,越低则提示机体处于免疫抑制状态[12]。本研究中,LRFA组CD3+、CD4+、CD4+/CD8+水平高于传统组,表明LRFA组患者机体免疫功能显著强于传统组,分析可能与LRFA的低损伤有关,患者健康肝区及周围组织损伤较小,其免疫能力损伤也相对较小。
AFP是酸性糖蛋白的一种,主要存在于胎儿早期肝脏及卵黄囊内,并于胎儿出生后逐步消失[13]。AFP在正常人群中含量较低,当其高表达时,提示患者可能伴原发性肝癌,是临床常用的肝癌手术切除疗效判定指标[14]。IFN-γ是Ⅱ型干扰素家族成员之一,只由T细胞及NK细胞合成,具有抗病毒、免疫调节剂抗肿瘤等功能[15]。本研究中LRFA组血清IFN-γ水平高于传统组,表明LRFA组患者机体抗肿瘤能力强于传统组。
本研究统计分析了LRFA治疗原发性肝癌的临床疗效,并采用酶联免疫法检测分析患者AFP、IFN-γ、CD3+、CD4+、CD8+、CD4+/CD8+水平,证实LRFA的微创及免疫学优势,研究具有可信性。但需要注意的是,并不是所有的患者都适合LRFA,机体状态较差、无法耐受麻醉、心肺功能严重障碍、全身多处转移等患者,为LRFA的禁忌证。
综上所述,LRFA治疗原发性肝癌的临床效果与开放手术相当,能早期改善患者的免疫水平。
[1] 张俊霞,张丹,李丽芳,等.重组人干扰素联合薄芝糖肽治疗高甲胎蛋白慢性乙型肝炎的临床观察[J].中国药房,2015,1(9):1173-1175.
[2] 林元佳,韦艾凌,张永琴,等.射频消融术联合癌痛消颗粒改善中晚期原发性肝癌患者生存质量的临床疗效分析[J].时珍国医国药,2015,15(4):909-910.
[3] 宋培军,刘会春,周磊,等.原发性肝癌患者血清IGF-Ⅱ、TGF-β1及IL-10的检测及意义[J].实用医学杂志,2015,31(24):4040-4042.
[4] 苏惠婷,李冰,曹炬,等.CXCL13、IL-31在原发性肝癌患者血清中的表达及临床意义[J].中国免疫学杂志,2016,32(11):1682-1688.
[5] 刘扬,王跃如,丁光辉,等.甲胎蛋白特异性肝癌疫苗体外杀伤HepG2肝癌细胞的分子机制[J].中华肝胆外科杂志,2016,22(1):52-55.
[6] 钟国成,吴超群,陈青,等.高强度聚焦超声治疗肝癌的免疫学效应及影像学评估[J].中华物理医学与康复杂志,2014,36(9):709-713.
[7] 李成德,蔡健梅,吴小文,等.乙型肝炎患者血清B7-H3和IFN-γ的水平及临床意义[J].细胞与分子免疫学杂志,2015,31(11):1533-1536.
[8] 刘扬,王跃如,王龙,等.甲胎蛋白特异性肝癌疫苗体内杀伤肝癌细胞[J].中华实验外科杂志,2014,31(1):77-80.
[9] Correa-Gallego C,Fong Y,Gonen M,et al.A retrospective comparison of microwave ablation vs.radiofrequency ablation for colorectal cancer hepatic metastases[J].Ann Surg Oncol,2014,21(13):4278-4283.
[10] 钱跹,吕磊,战旗,等.液相色谱-串联质谱法测定原发性肝癌患者血清中7种甾类激素[J].第二军医大学学报,2016,37(7):810-814.
[11] 林满洲,周华东,陈念平,等.BCLC-B期肝癌患者经皮射频消融生存期相关单因素分析[J].中国普通外科杂志,2014,23(7):989-993.
[12] Lorber G,Glamore M,Doshi M,et al.Long-term oncologic outcomes following radiofrequency ablation with real-time temperature monitoring for T1a renal cell cancer[J].Urol Oncol,2014,32(7):1017-1023.
[13] 占美晓,李勇,胡宝山,等.甲胎蛋白阴性肝癌射频消融治疗前血清中转移相关miRNA的临床价值[J].介入放射学杂志,2014,23(7):601-605.
[14] 张前进,胡伯年,裴俊烽,等.腹腔镜下射频消融术在肝癌患者中的临床应用价值及其对血清血管内皮生长因子和基质金属蛋白酶-2的影响[J].中国内镜杂志,2016,22(9):10-14.
[15] 陈仲武,林征宇,陈一平,等.TACE联合MRI引导下射频消融术治疗原发性肝癌[J].中国介入影像与治疗学,2014,11(10):635-638.
(英文编辑:夏平钿)
Effectoflaparoscopicradiofrequencyablationonprimaryhepaticcarcinoma
RANJiang-lin1,YUANChun-wang2,YINXiao-yong1
1.DepartmentofGeneralSurgery,theFourthPeople'sHospitalofGuangyuan,Guangyuan628000,China;2.BeijingYouAnHospital,CapitalMedicalUniversity
Objective:To investigate the clinical effect of laparoscopic radiofrequency ablation (LRFA) in the treatment of patients with primary liver cancer and its effect on the levels of serum alpha-fetoprotein (AFP),interferon-γ (IFN-γ) and cellular immunity.MethodsClinical data of 60 patients with primary liver cancer from Jan.2011 to Jan.2013 were retrospectively studied.Among them,30 patients underwent LRFA (LRFA group) and 30 patients underwent traditional surgical treatment (traditional group).The clinical effect of the two methods was compared.ResultsIn the LRFA group,the tumor complete necrosis rate was 86.67%,the tumor incomplete necrosis rate was 10.00% and the tumor part necrosis rate was 3.33%.In the traditional group all patients’ lesion was completely excised.There was no significant difference in serum AFP between the two groups before,2 weeks after and 4 weeks after the treatment (P>0.05).2 weeks and 4 weeks after treatment,the levels of serum IFN-γ,CD3+,CD4+,CD4+/CD8+in LRFA group were higher than those in the traditional group (P<0.05).The 2-year survival rate of the LRFA group was higher than that of the traditional group (50.00% vs.23.33%,P<0.05).ConclusionsThe clinical effect of LRFA is similar to that of traditional surgery in treatment of primary liver cancer,while LRFA can improve the early level of immunology.
Liver neoplasms;Laparoscopy;Radiofrequency ablation;Alpha-fetoproteins;Interferon-gamma;Immunity,cellular
1009-6612(2017)10-0770-04
10.13499/j.cnki.fqjwkzz.2017.10.770
冉江林(1972—)男,四川省广元市第四人民医院普通外科医师,主要从事普通外科的研究。
R735.7
A
2017-03-20)
